Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.17 no.4 Bogotá Oct./Dec. 2013
ORIGINAL
Costos en pacientes con infección por Acinetobacter baumannii en Colombia
a Facultad de Medicina, Doctorado Interfacultades en Salud Pública, Universidad Nacional de Colombia, Bogotá, Colombia
b Fundación para el Desarrollo y Apoyo en Salud Internacional (FUDASAI), Bogotá, Colombia
c Grupo de Investigación en economía de la Salud, Universidad de Cartagena, Cartagena de Indias, Colombia
d Leslie Dan Faculty of Pharmacy, University of Toronto, Toronto, Ontario, Canadá
e School of Pharmacy, Temple University, Philadelphia, PA, Estados Unidos de América
Recibido el 16 de mayo de 2013; aceptado el 3 de diciembre de 2013
Resumen
Objetivo: Determinar el impacto económico como resultado de la adquisición de una infección por A. baumannii en Colombia.
Métodos: Se consideró la información de un estudio previo de cohorte prospectivo, multicéntrico. Se incluyeron 165 pacientes ingresados en las Unidades de Cuidados Intensivos (UCIs) participantes entre abril de 2006 y abril de 2010. Se cuantificaron los costos directos e indirectos de la atención desde la perspectiva de la sociedad utilizando la técnica de microcosteo, y se realizaron modelos uni y multivariados.
Resultados: La mayoría de los pacientes eran menores de 65 años de edad (75%), hombres (64%) y una tercera parte (32%) estaban infectados por un A. baumannii resistente (resistencia a 5 o más familias de antimicrobianos). El costo total hospitalario en la población de pacientes del estudio fue de US $ 10.180 (Costos directos US $ 10.105 SD ± 6.671 y costos indirectos US $ 75 ± 106 por paciente). El costo de los antimicrobianos fue de US $ 3.497 ± 3.510 por paciente.
Conclusiones: Los pacientes con A. baumannii que fueron ingresados en la UCI son altamente costosos para el sistema de salud Colombiano. Aunque el costo principal estuvo asociado directamente a la atención en salud, cada paciente y su familia también asumieron costos, que se estimaron aproximadamente en 30% del salario mensual mínimo legal vigente para el año 2012.
© 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados.
PALABRAS CLAVE
Acinetobacter ; Costo; Colombia
Healthcare costs in Colombian patients infected with Acinetobacter baumannii
Abstract
Objective: The purpose of the study was to determine the healthcare costs among patients infected with A. baumannii in intensive care units (ICUs) in Colombia.
Methods: We reviewed information from a previous prospective, observational, and multicenter study that included 165 patients admitted to Critical Care Units (ICUs) between April 2006 and April 2010. Direct and indirect health care costs were estimated from the societal perspective using micro-costing, and uni- and multivariate models were constructed.
Results: The majority of patients (64%) were male; most (75%) were under 65 years of age, and 32% were infected with a pathogen resistant to 5 or more antimicrobial families. Overall, the healthcare cost in our sample was US $10,180 (The total direct cost (SD) was US $10,105±$6671 and the indirect cost was US $75±$106 per patient). The antimicrobia cost was US $3,497±$3,510 per patient and indirect costs represented <1% of the total cost.
Conclusions: High costs were observed in patients with A. baumannii who were admitted to the ICU. The main cost was the direct cost of care, but patients and their families assumed out-of-pocket costs as a consequence of the infection that represented nearly 30% of the legal minimum wage for Colombia in 2012.
© 2013 ACIN. Published by Elsevier España, S.L. All rights reserved.
KEYWORDS
Acinetobacter ; Cost; Colombia
Introducción
El Acinetobacter baumannii es un bacilo gram negativo responsable de un número importante de infecciones especialmente en Unidades de Cuidados Intensivos (UCIs) en el mundo 1-3. La resistencia a algunos antibióticos marcadores como los carbapenémicos se ha incrementado de 9% en 1995 a 40% en 2004 en hospitales de Estados Unidos 4, y esta resistencia es aún mayor en hospitales en Latino América, presentándose entre el 50% y el 70% 2,5. En Colombia se observa una resistencia aproximada de 40% 1.
Debido a la fácil propagación del A. baumannii entre los pacientes, principalmente aquellos críticamente enfermos 6, su difícil control debido a su capacidad de supervivencia prolongada 7, y su forma de transmisión por contacto directo así como la creciente probabilidad de propagación a través de otros medios como el aire 8 y reservorios no humanos 9, la susceptibilidad cada vez menor a una gran gama de antimicrobianos 2 y la posibilidad de adquirir una de estas bacterias, es un problema que debe ser considerado en la actualidad como de salud pública 3. La información sobre el impacto financiero de la adquisición de una infección por A. baumannii actualmente es limitada pero se estima que oscila entre US $ 5.600 y US $ 30.000 por caso registrado en los países desarrollados 8,10,11, y en nuestro medio hasta el momento no se han publicado estudios económicos que evidencien los costos asociados a esa infección. El objetivo del presente estudio fue determinar el impacto económico como consecuencia de la adquisición de una infección por A. baumannii en Colombia.
Materiales y métodos
Esta investigación fue aprobada por el Comité de Ética e Investigación de la Universidad Nacional de Colombia y las 3 Instituciones Prestadoras de Servicios (IPS) participantes. Estas instituciones fueron escogidas por tener una alta tasa de infecciones por A. baumannii en Colombia, pertenecer al sector tanto público como privado y tener disponibilidad y aprobación para el desarrollo de la presente investigación.
Diseño metodológico
El presente estudio se realizó a partir de la información de un estudio de cohorte prospectivo realizado previamente, en el que se incluyeron todos los pacientes admitidos entre abril de 2006 y abril de 2010 en las UCIs de las instituciones participantes y que presentaban diagnóstico de Infecciones Asociadas al Cuidado en Salud (IACS), con aislamiento de A. baumannii y más de 48 horas de hospitalización en las UCIs. Los establecimientos de salud que participaron fueron 2 del sector público con 306 camas en promedio de hospitalización y 13 camas disponibles para la UCI y una institución privada con 275 camas, de hospitalización y 10 en la UCI 3.
Se examinaron las IACS identificadas con mayor frecuencia en las UCIs, siendo estas: Infección de Sitio Operatorio (ISO), Infección Urinaria Asociada a Catéter Urinario (ITU), Neumonía Asociada a Ventilación mecánica en paciente adulto (NAV), Infección del Torrente Sanguíneo Asociada a Catéter venoso central (ITSCAT), Neumonía Asociada al Cuidado de Salud (NACS) e infección de piel y Tejidos Blandos (TBLAN).
Recolección de datos y microbiología
En el estudio de cohorte la información sobre identificación bacteriana y resistencia de A. baumannii fue obtenida de los cultivos realizados a los pacientes. En las instituciones participantes se utilizaron sistemas automatizados para la identificación microbiológica. La cepa control utilizada de A. baumannii fue ATCC BAA-747. Las especies fueron identificadas por medio del Sistema Vitek (bioMérieux Vitek) y MicroScan (MicroScan Siemens). Los aislamientos clasificados como intermedios o resistentes a los antibióticos también fueron considerados no susceptibles a los agentes.
Las pruebas de sensibilidad a los antimicrobianos se realizaron de acuerdo con los métodos recomendados por el Instituto de Estándares Clínicos y de Laboratorio (CLSI, sigla en inglés) y el Comité Nacional de Estándares de Laboratorio Clínico (NCCLS, sigla en inglés) 10.
Los laboratorios participantes cuentan con controles de calidad externos e internos que garantizan la confiabilidad de los resultados.
Análisis de costos
Se realizó un estudio de costo de la enfermedad usando una aproximación desde la incidencia de la misma, con base en la información de la cohorte de pacientes que ingresaron a las UCIs en el tiempo de estudio y que presentaron diagnóstico de IACS; haciendo seguimiento con intervalos de dos días hasta su egreso de la UCI. La técnica utilizada en el análisis se basó en la exhaustividad del micro costeo, incluyendo todos los eventos que representan costos relevantes para la perspectiva de la sociedad (costos directos e indirectos) pero con exclusión de costos intangibles 12,13.
El costo unitario se obtuvo usando como aproximación el promedio de las tarifas de los recursos en el mercado reportadas por los hospitales. El costo total de los recursos directos de la atención médica para cada paciente se determinó multiplicando el número de unidades consumidas por el costo unitario. La estimación de las pérdidas de capacidad laboral se realizó con base en la información suministrada por los pacientes mediante la técnica de capital humano 12. La valoración del transporte para asistir al hospital se realizó con la información reportada por los pacientes o sus familias. Como el estudio se llevó a cabo durante 4 años, se ajustaron los costos al año 2012 utilizando el Índice de Precios al Consumidor (IPC) para Colombia 14, estimando inicialmente los costos en pesos colombianos y luego se convirtieron a dólares estadounidenses 13.
Se calculó el promedio y la desviación estándar (DS) para cada una de las variables de desenlace y posteriormente se construyó un modelo univariado, comparando pacientes con edades menores y mayores a 65 años, género (masculino/ femenino), valor dado para el Apache II (según tres categorías menor de 10 puntos, 10-20 puntos y mayor de 20), sitio de la infección (considerando 6 categorías: ISO, ITU, NAV, ITSCAT, NACS y TBLAN), número de diagnósticos (mayor o igual de 5 y menor a 5) y comorbilidades (Diabetes, Hipertensión, Enfermedad Pulmonar Obstructiva Crónica, Neoplasia, Insuficiencia renal, y ninguna).
También fue considerada la ventilación mecánica (clasificada en 3 categorías: entre 1 y 10 días, más de 10 días y ninguna), se consideró el número de resistencia a medicamentos (entre 1 y 5 o más), la presencia o la ausencia de multirresistencia [MDR] (considerada como resistencia a dos o más familias de antimicrobianos utilizados para tratar infecciones por el microorganismo estudiado), el uso apropiado o no de tratamiento, los días de hospitalización (considerados en menor o igual a 14 días y más de 14 días), el número de diagnósticos (según número total de comorbilidades y complicaciones en el día que la infección por A. baumannii fue diagnosticada).
El tratamiento antimicrobiano se consideró adecuado si el paciente recibió al menos un antibiótico al que el A. baumannii era susceptible in vitro, y este fármaco había sido administrado dentro de las 72 horas desde el momento en que los cultivos fueron tomados. El modelo multivariado se construyó utilizando un procedimiento de selección que, en primer lugar, consideró las variables con p < 0,20 en el análisis univariado como candidatos para el modelo multivariado, y luego, se mantuvieron las variables con p < 0,05 en el modelo final.
Se estimaron los costos basados en el promedio de los efectos marginales de un modelo lineal generalizado con log link y distribución gamma. Se utilizó bootstrap para construir intervalos de confianza al 95% y valores de p. Se realizó un modelo multivariado separado que incluyó MDR, sitio de la infección y puntuación de APACHE II. Todos los análisis estadísticos se realizaron utilizando SAS versión 9.2 (SAS Institute, Cary, NC).
Resultados
En el estudio de cohorte se analizaron 165 pacientes pertenecientes a tres UCIs que presentaron infección por A. baumannii , con predominio de pacientes menores de 65 años (75%), mayor proporción de población masculina (64%), y presencia de infección por un patógeno resistente (resistencia a 5 o más familias de antimicrobianos) en 32%.
Los tipos más comunes de las infecciones fueron la infección del sitio quirúrgico (24,2%) y la neumonía asociada a ventilación mecánica (20,6%).
En general, el costo total hospitalario en esta población de pacientes fue de US $ 10.180. (Costo directo US $ 10.105 SD ± 6.671 y los costos indirectos US $ 75 ± 106 por paciente). El costo hospitalario como consecuencia de la infección fue de US $ 4.823 ± 3.271 por individuo, los medicamentos antimicrobianos costaron en promedio US $ 3.497 ± 3.510 por paciente y los costos indirectos representaron menos del 1% del costo total (tabla 1).
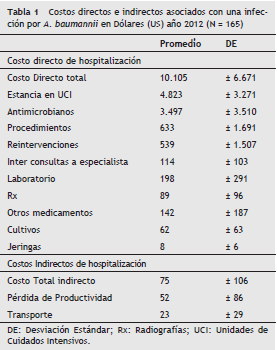
Las variables, con una fuerte asociación positiva con el costo, fueron la MDR con una diferencia en costos de US $ 5.555 comparados con que no tenían esta característica p < 0,005. Las variables que no se asociaron con el costo fueron la edad (p = 0,15), el género (p = 0,12), la puntuación APACHE II (p = 0,22), número de diagnósticos (p = 0,18), comorbilidades (p = 0,40), ventilación mecánica (p = 0,12), tratamiento antimicrobiano apropiado (p = 0,60) y días de estancia en UCI posterior al diagnóstico (p = 0,70) (tabla 2).
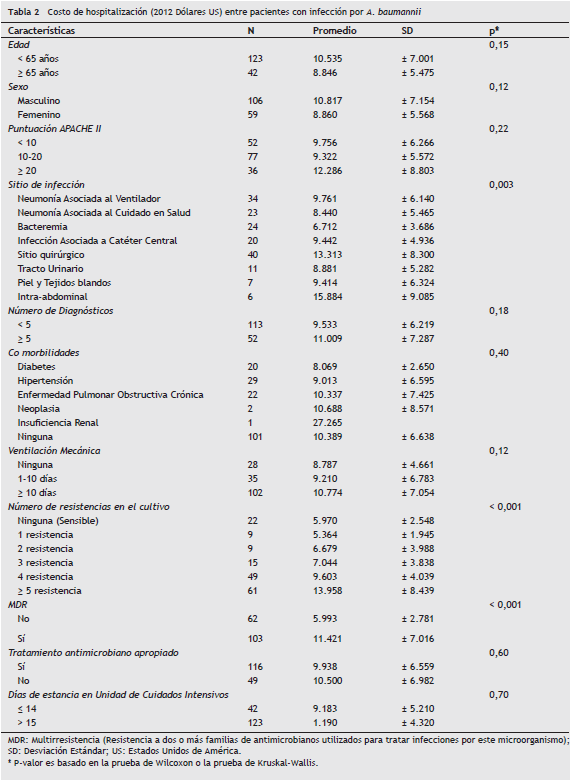
Las variables sin significación estadística fueron eliminadas al realizar la regresión lineal para costos; sin embargo, aunque el APACHE II no mostró significación en el análisis univariado, se decidió ingresar esta variable en el análisis multivariado debido a la estrecha relación con el resultado investigado.
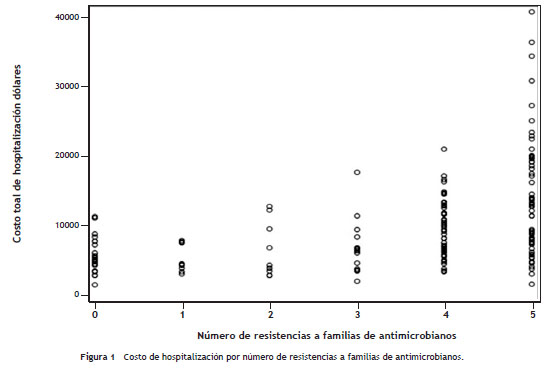
Las variables usadas para el modelo multivariado final para predecir el costo total de la atención en salud se presentan en la tabla 3; las variables independientes que se correlacionaron con el costo total fueron infección de sitio quirúrgico con US $ 9.420 más costosa que los otros tipos de infección, la presencia de 4, 5 o más resistencias en el cultivo microbiológico con sobrecosto entre US $ 9.193 y US 13.253 respectivamente comparados con la presencia de 3 o menos resistencias (fig. 1), y la presencia de MDR con un costo de US 11.128 p < 0,005.

Discusión
En los resultados del presente estudio se evidencia que el costo total encontrado para los pacientes es de US $ 10.180 por paciente. El componente más importante de este costo es el directo, que es responsable por el 99% del total. El 52% se explica por los costos de hotelería o estancia, y el 36%, por el costo de los medicamentos, donde los antibióticos representan el 95%, y sobre el costo total la tercera parte.
Las IACS se han asociado con una serie de consecuencias negativas para los pacientes, incluyendo aumento de estancia hospitalaria, morbilidad, mortalidad y costos hospitalarios 3,6,10,11,15,16. Las infecciones asociadas a patógenos resistentes pueden magnificar este efecto 15,17-19. En el estudio de cohorte realizado, el 87% de los 165 pacientes tenían una IACS causada por un A. baumannii resistente, y más de la mitad de estos (72%) fueron infectados con un patógeno multirresistente. Estos hallazgos de MDR son un poco más altos a los reportados por otros autores que en promedio sitúan la presencia de MDR entre el 15 y 16% 15,20.
La carga financiera adicional de resistencia a los antimicrobianos para las organizaciones de atención de la salud ha sido un área de intenso estudio en los últimos dos decenios. Los estudios se han centrado en el impacto sobre los costos asociados con bacterias resistentes a los antibióticos en gram negativos y en gram positivos, pero estos tienden a incluir múltiples patógenos microbianos a la vez 21-23. Igualmente, solo se encuentran estudios de casos y controles, o serie de casos que cuentan con un número reducido de pacientes, y donde solo se analizan los costos directos de la atención 21,24.
El costo puede depender también del germen 25-29 por lo que la forma correcta de llevar a cabo tales análisis sería no solo por sitio de infección, sino también por el microorganismo. En el presente estudio se utilizó el Acinetobacter baumannii , dado que produce alta morbilidad y mortalidad en las UCIs de Colombia 1-3,30.
El impacto de la resistencia sobre los costos depende de la prevalencia del microorganismo, dado que la distribución de los mismos varía de una institución a otra y hay una falta de normalización en la definición de la resistencia, por tanto la comparación del impacto de la resistencia entre los estudios resulta un poco difícil. En el presente estudio la resistencia definida es bastante similar a la de otros, pero tiene en cuenta los antibióticos presentes en el formulario de medicamentos del país autorizado durante el tiempo de seguimiento a la cohorte de pacientes. Dado que la utilización de los antibióticos varía entre los hospitales, y, tanto los patrones como el uso de antibióticos afectan la resistencia, se presentan diferencias en los costos y las tasas de resistencia, entre los hospitales y otros establecimientos sanitarios. Por lo tanto, las definiciones pertinentes de la resistencia varían a nivel local. No obstante, las definiciones comunes para su uso en el campo de la investigación son necesarias a fin de evaluar con precisión las consecuencias de infecciones hospitalarias por bacterias resistentes a los antibióticos.
Existe en la literatura algunos estudios que evidencian el costo de las infecciones por A. baumannii , siendo aproximadamente entre US $ 4.865 y US $ 12.000 por paciente, esta diferencia en costos es atribuible a la necesidad de internar o no a los pacientes en la UCIs 6,10, lo cual también se evidenció en los resultados del presente estudio.
Se podría argumentar que el costo del día/cama por IACS es el mismo tanto si la cama está ocupada por un paciente con IACS como si la usa un paciente por otra causa. Sin embargo, teniendo en cuenta las particularidades de las IACS, habría que evaluar los recursos que el hospital dedica al tratamiento de una enfermedad iatrogénica adquirida en su propio medio y, en gran parte, prevenible, frente a la necesidad de tratar a otros pacientes con patologías graves no adquiridas en el hospital, y que ameriten el uso de los recursos asignados a la UCI. La reducción del porcentaje de camas ocupadas por pacientes con IACS que se lograría con la aplicación de medidas de control, se reflejaría en una disminución del costo de tratar esas infecciones. El razonamiento económico de esta afirmación se puede resumir en dos premisas: i) las IACS usan los escasos recursos en salud, al prolongar la estancia hospitalaria, y ii) las medidas eficaces de control de las IACS liberan recursos y permiten asignarlos a otros usos.
Se necesitan estudios adicionales que desvelen la problemática de los costos por IACS utilizando otros microorganismos, otros servicios hospitalarios con el fin de tener mayor entendimiento del efecto de este tipo de infecciones en el contexto de la salud pública. El presente resultado proporciona información que puede ser útil en la planificación, justificación de los gastos y medidas encaminadas a la prevención de infecciones hospitalarias con Acinetobacter baumannii , resistentes a los antibióticos.
Dentro de las limitaciones presentadas en el estudio, es necesario tener en cuenta que se utilizó una perspectiva de la sociedad, incluyendo los costos indirectos de productividad del paciente, sin incluir los costos de productividad post-egreso del paciente, de familiares y acompañantes, así como tampoco se incluyeron años de vida perdidos en caso de muerte, lo cual puede subestimar tanto los costos indirectos como los costos totales y el impacto de la infección estudiada. Sin embargo en el presente estudio con el acercamiento que se da a los costos indirectos se evidencia un alto costo de la infección, que podría ser superior si se tuviera en cuenta otros costos indirectos.
Otra limitación presentada es que no se realizó comparación entre los costos asociados a mayor o menor mortalidad presentada, lo cual podría sugerir otros resultados, pero en el presente estudio no se consideró como un objetivo y sería importante en posteriores investigaciones.
Así mismo se considera como limitación que, al ser un análisis de cuatro años, se pudo haber generado cambios en la forma de la recuperación de la información y la facturación hacia los pacientes. Sin embargo, las personas encargadas de la recolección de la información fueron entrenadas por el investigador principal y, en la mayoría de los casos, dicho investigador lideró la recolección de la información, con lo cual se controló este sesgo.
Por otro lado ,se ajustó los resultados del análisis multivariado según múltiples factores de riesgo conocidos que pueden afectar, sin embargo , como ocurre con cualquier estudio observacional, la causalidad inferida no es absoluta debido a los posibles factores no medibles que pueden variar entre los pacientes, entre los hospitales, las características del patógeno, y los diferentes mecanismos de resistencia del A. baumannii 4,31,32, además, no se realizó análisis de biología molecular para caracterizar los diferentes mecanismos de resistencia.
En conclusión, se observó un alto costo en pacientes con A. baumannii que fueron ingresados en las UCIs, donde el principal costo es el directo de la atención, sin embargo cada paciente y sus familias tuvieron que asumir un costo que es aproximadamente el 30% del salario mensual mínimo legal vigente para el año 2012. Por tanto sería importante contar con una política nacional de vigilancia y control de las IACS, con el fin de generar e implementar prácticas basadas en la evidencia científica disponible con el fin de disminuir la transmisión de estos patógenos, controlando de esta forma el excesivo costo en salud para la sociedad.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Nos gustaría dar las gracias a la Dra. Narda Olarte, Jefe Alberto Valderrama y Jefe Karlo Reyes del Hospital El Tunal, el Dr. Fabio Barrera, Jefe Ana Gilma, Sánchez de Parada, el Dr. Blanca Arango y el Dr. Luz Dary Teherán del Hospital Occidente de Kennedy, el Dr. Edgar Ruiz Luengas, Dr. Fabio Corredor, Dr. Diego Villarraga, Dr. Norma Montoya y el Dr. Martha Salinas de la Clínica del Occidente; y el Dr. Julio Cesar Castillo Inocencio y la Dra. Liliana Raquel Lemos Luengas de FUDASAI.
* Autor para correspondencia.
Correo electrónico: elkin799@yahoo.com (E.V. Lemos).
0123-9392/$ - see front matter © 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados.
Bibliografía
1. Villegas MV, Kattan JN, Correa A, Lolans K, Guzman AM, Woodford N, et al. Dissemination of Acinetobacter baumannii clones with OXA-23 Carbapenemase in Colombian hospitals. Antimicrob Agents Chemother. 2007;51:2001-4. [ Links ]
2. Bertrand X, Dowzicky MJ. Antimicrobial susceptibility among gram-negative isolates collected from intensive care units in North America, Europe, the Asia-Pacific Rim, Latin America, the Middle East, and Africa between 2004 and 2009 as part of the Tigecycline Evaluation and Surveillance Trial. Clin Ther. 2012;34:124-37. [ Links ]
3. Lemos EV, De la Hoz Restrepo F, Alvis N, Quevedo E, Canon O, Leon Y. Acinetobacter baumannii - related mortality in intensive care units in Colombia. Rev Panam Salud Publica. 2011;30:287-94. [ Links ]
4. Munoz-Price LS, Weinstein RA. Acinetobacter infection. N Engl J Med. 2008;358):1271-81. [ Links ]
5. Gales AC, Castanheira M, Jones RN, Sader HS. Antimicrobial resistance among Gram-negative bacilli isolated from Latin America: results from SENTRY Antimicrobial Surveillance Program (Latin America, 2008-2010). Diagn Microbiol Infect Dis. 2012;73:354-60. [ Links ]
6. Lee NY, Lee HC, Ko NY, Chang CM, Shih HI, Wu CJ, et al. Clinical and economic impact of multidrug resistance in nosocomial Acinetobacter baumannii bacteremia. Infect Control Hosp Epidemiol. 2007;28:713-9. [ Links ]
7. Lambiase A, Piazza O, Rossano F, Del Pezzo M, Tufano R, Catania MR. Persistence of carbapenem-resistant Acinetobacter baumannii strains in an Italian intensive care unit during a forty-six month study period. New Microbiol. 2012;35:199-206. [ Links ]
8. Young L, Sabel A, Price C. Epidemiologic, clinical, and economic evaluation of an outbreak of clonal multidrug-resistant Acinetobacter baumannii infection in a surgical intensive care unit. Infect Control Hosp Epidemiol. 2007;28:1247-54. [ Links ]
9. Endimiani A, Hujer KM, Hujer AM, Bertschy I, Rossano A, Koch C, et al. Acinetobacter baumannii isolates from pets and horses in Switzerland: molecular characterization and clinical data. J Antimicrob Chemother. 2011;66:2248-54. [ Links ]
10. Wilson S, Knipe C, Zieguer M, et al. Direct costs of multidrug- resistant Acinetobacter baumannii in the burn unit of a public teaching hospital. Am J Infect Control. 2004;32:342-4. [ Links ]
11. The Brooklyn antibiotic Resistance Task Force. The cost of antibiotic resistance: effect of resistance Among Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumanii,and Pseudomonas aeruginosa on length of Hospital stay. Infect Control Hosp Epidemiol. 2002;23:106-8. [ Links ]
12. Drummond M, O´Brien B. Métodos para la evaluación económica de los programas de asistencia sanitaria. Madrid: Ediciones Díaz de santos; 2001. ISBN: 84-7478-502-0. [ Links ]
13. Shi L, Hodges M, Drummond M, Ahn J, Li SC, Hu S, et al. Good research practices for measuring drug costs in cost effectiveness analyses: an international perspective: the ISPOR Drug Cost Task Force report Part VI. Value Health. 2010;13:28-33. [ Links ]
14. The World Bank. Colombia, World Development Indicators. 2012 consultado 1 Feb 2012. Disponible en: http://data.Worldbank.org/country/Colombia [ Links ]
15. Mauldin PD, Salgado CD, Hansen IS, Durup DT, Bosso JA. Attributable hospital cost and length of stay associated with health care-associated infections caused by antibiotic-resistant gram-negative bacteria. Antimicrob Agents Chemother. 2010;54:109-15. [ Links ]
16. Evans HL, Lefrak SN, Lyman J, Smith RL, Chong TW, McElearney ST, et al. Cost of gram-negative resistance. Crit. Care Med. 2007;35:89-95. [ Links ]
17. Shorr AF. Review of studies on the impact on gram-negative bacterial resistance on outcomes in the intensive care unit. Crit Care Med. 2009;37:1463-9. [ Links ]
18. Metan G, Alp E, Aygen B, Sumerkan B. Carbapenem-resistant Acinetobacter baumannii : an emerging threat for patients with post-neurosurgical meningitis. Int J Antimicrob Agents. 2007;29:112-3. [ Links ]
19. Sheng WH, Liao CH, Lauderdale TL, Ko WC, Chen YS, Liu JW, et al. A multicenter study of risk factors and outcome of hospitalized patients with infections due to carbapenem-resistant Acinetobacter baumannii. Int J Infect Dis. 2010;14:e764-9. [ Links ]
20. Hidron AI, Edwards JR, Patel J, Horan TC, Sievert DM, Pollock DA, et al. NHSN annual update: antimicrobial-resistant pathogens associated with healthcare-associated infections: annual summary of data reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2006-2007. Infect Control Hosp Epidemiol. 2008;29:996-1011. [ Links ]
21. Carmeli YG, Eliopoulos E, Mozaffari E, Samore M. Health and economic outcomes of vancomycin-resistant enterococci. Arch Intern Med. 2002;162:2223-8. [ Links ]
22. Carmeli Y, Troillet N, Karchmer AW, Samore MH. Health and economic outcomes of antibiotic resistance in Pseudomonas aeruginosa . Arch Intern Med. 1999;159:1127-32. [ Links ]
23. Lautenbach E, Weiner MG, Nachamkin I, Bilker WB, Sheridan A, Fishman NO. Imipenem resistance among Pseudomonas aeruginosa isolates: risk factors for infection and impact of resistance on clinical and economic outcomes. Infect Control Hosp Epidemiol. 2006;27:893-900. [ Links ]
24. Gaynes R, Edwards JR. Overview of healthcare associated infections caused by gram-negative bacilli. Clin Infect Dis. 2005;41:848-54. [ Links ]
25. Cosgrove SE, Qi Y, Kaye KS, Harbarth SA, Karchmer W, Carmeli Y. The impact of methicillin resistance in Staphylococcus aureus bacteremia on patient outcomes: mortality, length of stay, and hospital charges. Infect Control Hosp Epidemiol. 2000;26:166-74. [ Links ]
26. Cosgrove SE, Kaye KS, Eliopoulous GM, Carmeli Y. Health and economic outcomes of the emergence of third-generation cephalosporin resistance in Enterobacter species. Arch Intern Med. 2002;162:185-90. [ Links ]
27. Engemann JJ, Carmeli Y, Cosgrove SE, Fowler VG, Bronstein MZ, Trivette SL, et al. Adverse clinical and economic outcomes attributable to methicillin resistance among patients with Staphylococcus aureus surgical site infection. Clin Infect Dis. 2003;36:592-8. [ Links ]
28. Cosgrove SE, Carmelli Y. The impact of antimicrobial resistance on health and economic outcomes. Clin Infect Dis. 2003;36:1433-7. [ Links ]
29. Cosgrove SE. The relationship between antimicrobial resistance and patient outcomes: mortality, length of hospital stay, and health care costs. Clin Infect Dis. 2006;42(Suppl. 2):S82-S89. [ Links ]
30. Briceno DF, Correa A, Valencia C, Torres JA, Pacheco R, Montealegre MC, et al. Antimicrobial resistance of Gram negative bacilli isolated from tertiary-care hospitals in Colombia. Biomedica. 2010;30:371-81. [ Links ]
31. Kim YJ, Kim SI, Kim YR, Hong KW, Wie SH, Park YJ, et al. Carbapenem- resistant Acinetobacter baumannii: diversity of resistant mechanisms and risk factors for infection. Epidemiol Infect. 2012;140:137-45. [ Links ]
32. Poirel L, Nordmann P. Carbapenem resistance in Acinetobacter baumannii: mechanisms and epidemiology. Clin Microbiol Infect. 2006;12:826-36. [ Links ]













