Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.17 no.4 Bogotá Oct./Dec. 2013
REVISIÓN
Infección por Brucella canis en humanos: propuesta de un modelo teórico de infección a través de la ruta oral
Miryan Margot Sánchez-Jiménez a, *, Carlos Andrés Giraldo-Echeverri b y Martha Olivera-Angel b
a Doctorado Colciencias 2010, Grupo Vericel, Facultad de Ciencias Agrarias. Universidad de Antioquia, Medellín, Antioquia, Colombia
b Grupo Vericel-Biogénesis, Escuela de Medicina Veterinaria, Facultad de Ciencias Agrarias, Universidad de Antioquia, Medellín, Antioquia, Colombia
Recibido el 24 de junio de 2013; aceptado el 19 de noviembre de 2013
Resumen La infección por Brucella canis en los humanos se ha reconocido recientemente como una zoonosis, pero frecuentemente es sub reportada debido a que los síntomas pueden confundirse con los de un resfriado común u otras infecciones causadas por otros patógenos. Los caninos son los hospederos primarios de Brucella canis ; el incremento en la tendencia de tener perros como mascotas podría también aumentar la posibilidad de transmisión de la infección a los humanos por el estrecho contacto entre la mascota infectada y su propietario. En Colombia, hay reportes de aislamientos de B. canis de caninos de criaderos y de un humano en contacto con perros infectados, al igual que reportes de caninos seropositivos a la infección. Sin embargo, no hay mucha información disponible sobre los mecanismos de interacción hospedero-patógeno que conduzcan al establecimiento de la infección por Brucella canis en perros y en humanos esta información es todavía menor. En esta revisión se propone un modelo para la infección humana con Brucella canis a través de la ruta oral utilizando la información disponible para otras especies de Brucella que infectan al humano, incluyendo B. abortu s y B. melitensis , que difieren de B. canis en la composición estructural de su lipopolisacárido. También se hipotetiza el mecanismo de infección celular que es usado por B. canis para invadir y establecer la infección en células no fagocíticas y fagocíticas.
© 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados
PALABRAS CLAVE
Brucella canis ; Zoonosis;
Brucella canis infection in humans: Proposal of a theoretical model of infection through the oral route
Abstract Brucella canis infection in humans has recently been recognized as a zoonosis, but it is frequently under reported because the flu-like symptoms are often confused with the presence of other disease-causing pathogens. Dogs are the primary hosts for Brucella canis ; the increasing trend to adopt dogs as pets also enhances the likelihood of transmission of Brucella canis infection through contact between infected dogs and owners. In Colombia, there are reports of isolates of B. canis from kennel dogs and also from one human being along with seropositive results from dogs and humans. However, the mechanism of hostpathogen interactions leading to the infection of Brucella canis in dogs is still unknown and even less is known about human infections. This review proposes a model for human infection with Brucella canis through the oral route. We use the information available for other human-infecting Brucella species, including B. abortu s and B. melitensis, which differ from B. canis in the structural composition of the lipopolysaccharide molecule. The mechanism of cellular infection used by B. canis to invade and establish infection in nonphagocytic and phagocytic cells is also hypothesized.
© 2013 ACIN. Published by Elsevier España, S.L. All rights reserved.
KEYWORDS
Brucella canis; Zoonoses; Infection
Introducción
El género Brucella está conformado actualmente por diez especies, de las cuales seis se consideran con potencial zoonótico para el humano: B. melitensis, B. abortus, B. suis, B. canis, B. ceti y B. pinnipedialis 1. Desde el punto de vista estructural, este género se puede clasificar, con base en la composición del lipopolisacárido (LPS), en dos grupos: cepas lisas, cuyo LPS está formado por el lípido A, el núcleo del oligosacárido y el antígeno O (Polisacárido O, o cadena lateral O) como es el caso de Brucella melitensis , B. abortus y B. suis ; o cepas rugosas, las cuales tienen el lípido A, el núcleo del oligosacárido y una cadena O muy corta o ausente, como es el caso de B. canis y de B. ovis , respectivamente 2 .
Esta clasificación es muy importante, ya que las características de patogenicidad en humanos varían de acuerdo a ella, sin embargo, los mecanismos completos de infección, invasión y diseminación se desconocen. Se proponen en esta revisión los mecanismos conocidos en B. canis y se contrastan con los ya determinados en otras especies de Brucella .
Brucelosis canina en humanos
La brucelosis canina es una zoonosis, cuyos hospederos primarios son los cánidos, en quienes causa problemas reproductivos como aborto e infertilidad, problemas óseos como disco-espondilitis, problemas oculares como uveítis, entre otros 3. En Medellín, desde 2009 se reportaron casos de infección por Brucella canis en caninos de criaderos 4,5, en caninos de albergues 6 y en mascotas 7. En humanos se estableció como factor de riesgo para la infección por Brucella canis a partir de caninos de criaderos, la exposición sin elementos de protección personal a material biológico, como abortos y secreciones, de perros infectados con la bacteria 8.
En humanos, la infección se produce por contacto con secreciones provenientes de caninos infectados o por accidentes de laboratorio 9. La enfermedad puede ser asintomática y crónica, al igual que la infección producida por B. abortus ; pueden pasar meses, e incluso años, antes de presentarse sintomatología 10. A nivel mundial se han documentado, desde 1968, cada vez más casos de infección humana por esta bacteria, con un incremento en los últimos años de casos reportados en personas con inmunidad competente 11,12, así como inmunosuprimidas 13,14.
Es poco lo que se conoce sobre el proceso de infección por B. canis en humanos, por lo cual este artículo pretende, basado en el conocimiento que se tiene de la patogénesis producida por otras especies como B. melitensis y B. abortus , hipotetizar sobre qué podría estar pasando en los casos de infección por esta bacteria en humanos.
Los síntomas de la infección por B. canis se han descrito en forma esporádica o en brotes sucedidos en países como Argentina 15-17, Estados Unidos 18, y Japón 19. En estos casos, por lo general, el hallazgo del agente bacteriano fue accidental. En Colombia, la bacteria fue aislada de una persona asintomática, conviviente con caninos infectados 20, y fueron reportados dos médicos veterinarios con serología positiva y sintomatología compatible con la infección (datos sin publicar).
En los casos documentados en el mundo, la sintomatología varía desde infección asintomática 21, o casos que reportan una amplia variedad de síntomas, que incluyen fiebre ondulante o persistente, tos, dolor de garganta, sudoración, escalofríos, astenia, dolores musculares, articulares, artritis séptica, debilidad, anorexia, diarrea, pérdida de peso, adenitis, hepatomegalia, esplenomegalia, pleuritis, neumonía, endocarditis y osteomielitis 22-24.
Modelo de infección oral en humanos
El modelo oral de infección por B. canis en humanos que se propone en esta revisión se presentará en tres pasos:
1. Ingreso de la bacteria por vía oral; 2. paso por estómago y activación del operón ure ; 3. adherencia, invasión celular y tráfico intracelular: diferencias entre células no fagocíticas y fagocíticas; y 4. focalización de la infección.
Ingreso de la bacteria por vía oral (fig. 1, paso 1)
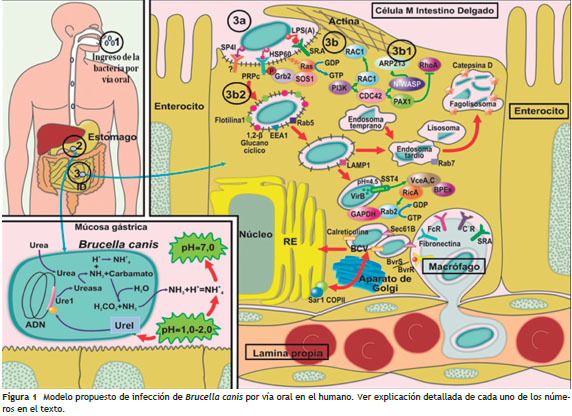
El tracto digestivo es un ambiente restrictivo para la colonización y multiplicación de microorganismos patogénicos. Esta restricción está dada por la presencia de factores limitantes como las defensinas, lactoferrina y lisozima en la saliva, el pH ácido gástrico, sales biliares, péptidos antimicrobianos, anticuerpos de mucosa, barreras epiteliales, la presencia de microbiota comensal y la respuesta inmune local 25.
En el caso del ingreso de Brucella canis al humano por vía oral, este se podría producir cuando la persona, luego de manipular material contaminado con fluidos como abortos, loquios, placentas, neonatos, meconio, leche, saliva u orina, provenientes de perros infectados, que contienen altas cantidades de Unidades Formadoras de Colonias (UFC) 26, no se lava las manos adecuadamente, contaminando sus alimentos y posteriormente consumiéndolos. El inóculo nec esario para infectar al humano no ha sido determinado, pero en caninos se sabe que por vía oral se necesita un inóculo de 10 6 UFC y que concentraciones de 10 3 a 10 6 organismos/ml se han detectado en orina de perros infectados. No se tiene información confirmada por cultivos sobre los inóculos en otro tipo de muestras de caninos 26.
Paso por estómago y activación del operón ure (fig. 1, paso 2)
Aunque se conoce poco sobre los factores de virulencia de Brucella canis que permiten una infección eficiente de las superficies de las mucosas, estudios de la infección por vía gastrointestinal en modelos como Helicobacteri pylori han dado algunas ideas de cómo ciertos factores de la bacteria y del hospedero pueden contribuir a este proceso 27. Posterior a la ingestión, la bacteria debe resistir los cambios de pH que se producen en el tracto digestivo.
Las bacterias ingeridas son capaces de tolerar el ambiente ácido del estómago y tienen una mayor probabilidad de sobrevivir y colonizar al hospedero 28.
Se ha descrito que B. abortus , B. melitensis y B. suis tienen en su genoma dos operones que codifican ureasa, ambos localizados en el cromosoma 1, denominadas ure1 y ure 2 29. En el genoma de las cepas Brucella canis HSK A52141 y Brucella canis ATCC 23365 disponibles en Gen- Bank, estos dos operones también están presentes (datos no mostrados). Es importante aclarar que no siempre la misma estructura genómica implica igual funcionamiento metabólico, pues este puede depender de otros factores como los mecanismos reguladores de expresión génica, modificaciones postraduccionales de las proteínas o interacciones proteínas-proteínas que serían dependientes también del tipo de hospedero que se esté infectando o de condiciones del nicho donde la bacteria requiere establecerse como factores ambientales, nutricionales o de pH 30.
En procariotas las ureasas son enzimas con varias subunidades que contienen níquel que cataliza la hidrólisis de la urea a dióxido de carbono y amonio 31.
El operón ure1 está conformado por los genes ureDABCEFG , y el operón ure2 está conformado por los genes ureABCEFGDT . El gen ureT del operón ure2 codifica una proteína transportadora de urea 32.
Los tres genes de la subunidad estructural ( ureABC ) están unidos a genes accesorios ( ureDEFG ) que codifican proteínas y están involucrados en el ensamble de la ureasa nativa 32.
La mayoría de las especies de Brucella muestran una fuerte actividad ureasa, derivada de ure1 pero no de ure2 , y esta actividad es responsable por la habilidad de Brucella de sobrevivir al tránsito estomacal y establecer una infección sistémica 33, siendo esto probablemente lo que también ocurre en el caso de la infección a humanos por parte de B. canis .
El operón ure1 es necesario para el óptimo crecimiento en cultivo, la actividad de la enzima ureasa y la supervivencia a pH bajo. El operón ure2 , aparentemente, aumenta la tasa de supervivencia a pH bajo 34.
La enzima ureasa (urea amidohidrolasa) cataliza la hidrólisis de la urea, conduciendo a la producción de carbamato y amonio 32.
En un ambiente acuoso, el carbamato rápida y espontáneamente se descompone para dar origen a una segunda molécula de amonio y a una de ácido carbónico. El ácido carbónico equilibra al agua, al igual que las dos moléculas de amonio, la cual se protona y produce iones de hidróxido de amonio. El amonio liberado es usado por la bacteria como una fuente de nitrógeno, y para la generación de ATP desde un fuerte gradiente de amonio y la reacción resulta en el incremento del pH de la zona circundante de la bacteria 34.
En sitios donde los microorganismos colonizan superficies epiteliales, tales como la flora normal de la cavidad oral o intestino y ciertas bacterias patogénicas, el metabolismo de la urea por ureasas microbianas puede tener un impacto importante sobre la integridad del tejido, la ecología microbiana y en general sobre la salud del hospedero 35.
Las ureasas bacterianas cumplen dos propósitos: neutralizar las condiciones ácidas del medio y proveer una fuente asimilable de nitrógeno.
El operón ure2 también incluye genes para el transporte de urea y níquel, el cual es necesario para la función adecuada de la ureasa 31.
La ureasa sirve como tampón para resistir el pH 1-2 del estómago, ya que permite producir CO 2 a partir de urea, creando un ambiente en el cual el pH incrementa hasta un ambiente neutro, lo que permite a la bacteria sobrevivir a su paso por este órgano 35 .
Adherencia, invasión celular y tráfico intracelular: diferencias entre células no fagocíticas y fagocíticas (fig. 1, paso 3)
Infección de células M (células no fagocíticas)
La infección de células M se encuentra descrita experimentalmente en B. melitensis y B. abortus 36, más no en B. canis . Se conoce que. una vez en el íleon, el medio es más propicio para la bacteria por el cambio de pH y la disminución parcial de la concentración de oxígeno; la bacteria tiene tropismo por las células M (por su denominación en inglés: Microfold) de la placa de Peyer 37, que hacen parte del tejido linfoide asociado a mucosas (MALT, por sus siglas en inglés), las cuales invade por medio de la unión entre moléculas de membrana y receptores de la célula M; el lípido A se une a los receptores tipo Scavenger (SRA, por sus siglas en inglés), la proteína de choque térmico 60 (HSP60) es reconocida por la proteína celular prionica (PrPC) y la proteína 41 de superficie de Brucella (SP41), se asocian receptores que contienen residuos de ácido siálico, ubicados en la membrana de la célula M 38.
Tráfico intracelular
Se desconocen los mecanismos de tráfico intracelular de B. canis , sin embargo, se ha determinado que otras especies del género Brucella invaden las células epiteliales a través del reclutamiento de filamentos de actina y el rearreglo de la membrana celular, de la siguiente manera.
Luego que Brucella entra en contacto con diferentes receptores de membrana de la célula M, se activan varias vías de señalización. La internalización del microorganismo involucra la activación de proteínas regulatorias del citoesqueleto de actina, llamadas pequeñas GTpasas, de la subfamilia Rho, incluyendo Ras, Rac1, Cdc42 y RhoA 33 (fig. 1: 3b y 3b1.); además, mediadores de las vías de señalización tales como GMP cíclico y Fosfoinositol 3 quinasa (PIK3), que actúa como segundo mensajero para señales de las GTpasas 39. Este sistema de regulación permite a la célula M activar el citoesqueleto de actina e induce la entrada de la bacteria por un proceso similar a la endocitosis denominado rizado de membrana.
Invasión y tráfico
El tráfico intracelular de Brucella en células epiteliales es similar al observado en fagocitos (fig. 1: 3b2) 40 ; inicia en el endosoma temprano, expresando la proteína unidora de pequeños GTP-Rab5 y el antígeno endosomal temprano (EEA1), esta interacción ocurre inmediatamente después de la internalización y es transitoria. Posteriormente, la vacuola siscontenedora de Brucella (BCV, por sus siglas en inglés) se enriquece en colesterol y en flotilina 1, proteína involucrada en la señalización de las balsas lipídicas asociada con maduración del fagosoma y la interacción con la vía endocítica.
Esta BCV también tiene en su membrana el 1,2-ß-glucano cíclico, que se ha propuesto modifica las balsas lipídicas ricas en colesterol de la vacuola, y controla su maduración, tanto en células epiteliales como en macrófagos 41.
Progresando hacia el autofagosoma, la BCV adquiere la glicoproteína de membrana (LAMP1), que es un marcador del endosoma tardío. Las BCV que contienen bacterias vivas acidifican el pH interno (pH 4-5) de la vacuola, lo cual permite la expresión de los 12 genes que conforman el operón virB , cuya presencia está confirmada en aislamientos de Brucella canis obtenidos a partir de hemocultivos de caninos colombianos 42. Palomares et al. 43 reportan la importancia de los genes virB10 y virB11 de este operon, como potenciales candidatos vacunales para conferir inmunidad protectora contra Brucella canis en hospederos murinos, esto podría explicar en parte los modelos de patogénesis de esta bacteria en otros hospederos. Además encontraron una alta inducción de producción de IFN γ IL-2, IL-4 e IL-10, que se asocia con una respuesta adecuada del hospedero ante la infección por esta bacteria.
Los doce genes de este operón virB secretan proteínas que conforman el sistema de secreción tipo IV de Brucella 44 , que traspasan la barrera de la vacuola y secretan en el citoplasma de la célula M las proteínas efectoras VceA, C, RicA y BPEs 45. Estas últimas, en conjunto con la proteína Rab2, reclutan más BCV, que, marcadas con Calreticulina y Sec61 γ (proteínas translocadoras), le permiten fusionarse con la membrana del Retículo Endoplásmico (RE) Rugoso y allí establecer su nicho replicativo 46.
Las BCV que contienen bacterias muertas o mutadas no se pueden acidificar y no siguen la vía al RE, sino que son eliminadas por el fagolisosoma 47.
Luego de la replicación en las BCV en el RE, B. canis se disemina vía el sistema de vacuolas de la célula M por medio de las vacuolas del Aparato de Golgi (AG), con ayuda de las moléculas Sar1 y COPII pasan por vacuolas a la lámina propia e infectan los macrófagos de esta zona y se diseminan por vía hematógena a otros órganos del sistema retículo endotelial, de allí a los órganos blancos de infección en el humano como hueso y articulaciones 48.
Infección en el macrófago (células fagocíticas)
En células fagocíticas (fig. 2), B. canis podría ser internalizada por fagocitosis, lo cual requiere un reclutamiento moderado de los filamentos de actina posterior a la interacción de la bacteria y los receptores Scavenger clase A (SRA) sobre la superficie de la membrana celular de los macrófagos 49. En la invasión a macrófagos se pueden dar dos casos, el primero que la bacteria no haya sido opsonizada porque es una infección nueva y el segundo que la bacteria que ingresa haya sido opsonizada por anticuerpos presentes de una infección previa 50.
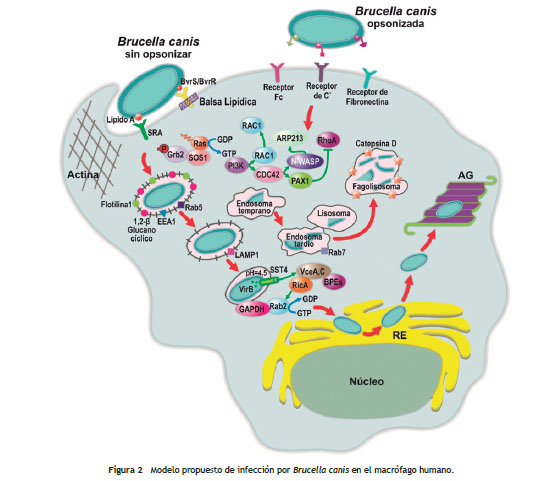
La bacteria opsonizada es internalizada vía el receptor Fc o por receptores del complemento. La opsonización de la bacteria o la activación de los macrófagos por IFN? aumentan la muerte intracelular de la bacteria dentro del hospedero 50 . Las bacterias no opsonizadas interactúan con receptores de lectina y fibronectina (fig. 2). Cuando ingresan bacterias no opsonizadas, esta puede sobrevivir y replicarse dentro de las células. Las balsas lipídicas, las cuales son microdominios ricos en colesterol en la membrana celular de los macrófagos, también participan en la internalización bacteriana, y adicionalmente estas balsas contribuyen a dirigir el tráfico intracelular de la bacteria 51.
La gran mayoría del inóculo bacteriano (80-90%) es fagocitado, por lo cual las bacterias son rápidamente dirigidas a los lisosomas y la mayoría de las bacterias son eliminadas por la acción bactericida de los radicales libres de oxígeno, óxido nítrico y enzimas dentro del fagolisosoma 52, además las células en las cuales el fagosoma que contiene Brucella se neutraliza, fallan en inducir la expresión del SST4 y como resultado la bacteria en las vacuolas neutralizadas es incapaz de replicarse. Este SST4 a través de efectores secretados puede limitar la extensión de la fusión con el lisosoma o actuar para excluir los marcadores lisosomales una vez los lisosomas se han fusionado con la BCV 53.
Pero otros estudios reportan que, después de 24 horas, algunas bacterias pueden escapar y, debido a la activación de genes de virulencia, son capaces de multiplicarse dentro de las células en su nicho definitivo 54,55. Estas bacterias que sobreviven son las capaces de replicarse y seguir la misma vía para el tráfico intracelular que el descrito para la células epiteliales. En este caso, la acidificación del fagosoma ( ˜ pH 4.0) que contiene la bacteria no la elimina, sino que activa la expresión de genes bacterianos esenciales para la sobrevivencia intracelular durante los estadios iniciales de la infección como los genes del operón virB que codifican el SST4 56, 57.
Focalización de la infección
Para que la bacteria se pueda focalizar en un tejido u órgano determinado, en el caso de la invasión a través del tracto digestivo, se debe dar transmigración de la bacteria preferencialmente a través de las células M. Los fagocitos intraepiteliales pueden también transportar Brucella canis desde el lumen intestinal a la lámina propia. Una vez la bacteria logra ingresar en las células epiteliales o fagocíticas en el sitio de entrada, se desplaza a través del sistema reticuloendotelial a los ganglios linfáticos y a los otros órganos de este sistema 58. De B. canis se puede inferir a partir de los cuadros clínicos reportados en humanos que se disemina a los mismos órganos que las especies lisas de Brucella , pero no hay estudios al respecto.
Por lo anterior, cabe la posibilidad de persistencia a largo término en el humano con formación de microgranulomas, similar a lo que se ha reportado en caninos 59, en donde la generación de una respuesta inflamatoria media tiene consecuencias importantes para la persistencia de Brucella canis en el tejido. La respuesta típica del tejido a la infección por B. melitensis y B . abortus es la inflamación granulomatosa, evidenciado por estudios histopatológicos de biopsias de ratones y humanos donde se encuentran pequeños granulomas en hígado, bazo, médula ósea y otros tejidos afectados por la bacteria 60, este granuloma causado por Brucella sp. recibe el nombre de bruceloma, que se caracteriza por la presencia de necrosis con un halo periférico de macrófagos epitelioides (macrófagos con una cantidad aumentada de citoplasma), linfocitos, células plasmáticas e infiltrado polimorfo nuclear en el área necrótica 60. Precisamente los macrófagos epitelioides son un sitio conocido de persistencia bacteriana durante la infección. La respuesta granulomatosa se reconoce como una respuesta del hospedero para contener a la bacteria que fue interiorizada pero no fue eliminada por el macrófago. Se cree que el IFN-γ, IL-12/23p40, y el factor de necrosis tumoral alfa (TNF-a) son producidos en el bruceloma y participan en su formación y/o mantenimiento 61.
Mientras la respuesta granulomatosa a la infección por B. abortus , B. melitensis y especies marinas de Brucella ha sido descrita en la literatura 62,63, se sabe poco sobre cómo Brucella canis puede producir este tipo de cuadros en sus hospederos caninos y humanos.
La formación del granuloma en Brucella parece ser una respuesta que restringe la replicación bacteriana, pero debido a la sobrevivencia en el macrófago mediado por el SST4, la respuesta no es suficiente para eliminar la bacteria de la lesión, resultando en un punto muerto entre el hospedero y el patógeno. Generalmente, este punto muerto beneficia a la biología de los patógenos cuya transmisión depende de un estado de portador crónico, que permite al patógeno permanecer en estado latente 61.
Posterior a la focalización, se esperaría entonces que el hospedero responda con la producción de anticuerpos, sobre este tema existen pocas publicaciones, Lee et al. 64 utilizan el modelo murino para identificar la cinética de anticuerpos frente a la infección por Brucella canis , ellos evaluaron por 8 semanas diferentes isotipos de inmunoglobulinas, encontrando que los anticuerpos tipo IgG se empezaron a detectar a los 7 días pos-infección con pico máximo a los 35 días, siendo IgG2a el más abundante. Esto podría indicar cuanto tiempo tardaría en instalarse la infección en este modelo.
Conclusión
Todavía quedan muchos vacíos en el conocimientos de la infección por Brucella canis en el humano, apenas hasta ahora con métodos moleculares se están empezando a esclarecer los diferentes mecanismos que pueden usar las especies de Brucella para producir infección en sus hospederos, como la diferencia en la estructura de los ácidos grasos, los cuales se ha visto que, en cepas de Brucella canis de México y Colombia 65, son similares a los presentes en cepas lisas de B. abortus y B. melitensis que producen infección en humanos. Son esas mínimas diferencias a nivel de estructura y del genoma de estas especies y las interacciones de sus proteínas con el hospedero las que podrían permitir en el futuro establecer los verdaderos factores que deciden por qué una especie puede afectar a animales y humanos al mismo tiempo, pero producir cuadros diferentes en los dos hospederos como el caso de Brucella canis en caninos y en humanos, lo cual a su vez tendría importancia en la forma de diagnosticar a tiempo y tratar en forma adecuada la infección por esta bacteria en nuestro medio.
Infección
* Autor para correspondencia.
Correo electrónico: miryan.sanchez@gmail.com (M.M. Sánchez-Jiménez).
0123-9392/$ - see front matter © 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados.
Bibliografía
1. Banai M, Corbel MJ. Taxonomy of Brucella. Open Vet Sci J. 2010; 4:85-101. [ Links ]
2. Lucero NE, Escobar GI, Ayala SM, Jacob N. Diagnosis of human brucellosis caused by Brucella canis. J Med Microbiol. 2005;54:457-61. [ Links ]
3. Wanke MM. Canine brucellosis. Animal Reprod Sci. 2004;82- 83:195-207. [ Links ]
4. Giraldo CA, Ruiz-Cortés ZT, Olivera M. Brucella canis en Medellín (Colombia), un problema actual. Rev Udcaactual Divulg Cient. 2009;12:210-20. [ Links ]
5. Olivera M, Giraldo CA, Di-Lorenzo C. Identificación por PCR de Brucella canis en sangre y leche canina: Reporte de un caso. Arch Med Vet. 2011;43:295-8. [ Links ]
6. Ruíz JD, Giraldo CA, López LV, Chica JF. Seroprevalencia de Brucella canis en perros callejeros del Centro de Bienestar Animal La Perla, Medellín (Colombia), 2008. Rev Colomb Cienc Pecu. 2010;23:166-72. [ Links ]
7. Agudelo-Flórez P, Castro B, Rojo-Ospina R, Henao-Villegas S. Canine brucellosis: Seroprevalence and risk factors in pets from eleven neighbourhoods in Medellin, Colombia. Rev Salud Pública. 2012;14:644-56. [ Links ]
8. Castrillón-Salazar L, Giraldo-Echeverri CA, Sánchez-Jiménez MM, Olivera-Angel M. Factores asociados con la seropositividad a Brucella canis en criaderos caninos de dos regiones de Antioquia, Colombia. Cad Saúde Pública. 2013;29:1955-73. [ Links ]
9. Lucero NE, Maldonado PI, Kaufman S, Escobar GI, Boeri E, Jacob NR. Brucella canis causing infection in an HIV-infected patient. Vect-Borne Zoon Dis. 2010;10:527-9. [ Links ]
10. Corbel MJ. Brucellosis: an overview. Emerg Infect Dis. 1997;3:213-21. [ Links ]
11. Piampiano P, McLeary M, Young LW, Janner D. Brucellosis: unusual presentations in two adol escent boys. Pediatr Radiol. 2000;30:355-7. [ Links ]
12. Wallach JC, Giambartolomei GH, Baldi PC, Fossati C. Human infection with M-strain of Brucella canis . Emerg Infect Dis. 2004;10:146–8. [ Links ]
13. Lawaczeck E, Toporek J, Cwikla J, Mathison BS. Brucella canis in a HIV-Infected Patient. Zoonoses Public Hlth. 2011 58:150-2. [ Links ]
14. Ying W, Nguyen MQ, Jahre JA. Brucella canis endocarditis: case report. Clin Infect Dis. 199 9;29:1593-4. [ Links ]
15. Soloaga R, Salinas A, Poterallo M, Margari A, Suar B, Lucero N, et al. Bacteriemia por Brucella canis . Aislamiento con el Sistema Bact-Alert. Rev Argent Microbiol. 2004;36:81-4. [ Links ]
16. Lucero NE, Corazza R, Almuzara MN, Reynes E, Escobar GI, Boeri E, et al. Human Brucella canis outbreak linked to infection in dogs. Epidemiol Infect. 2010;138:280–5. [ Links ]
17. Lucero N, Jacob N, Ayala S, Escobar G, Tuccillo P, Jacques I. Unusual clinical presentation of brucellosis caused by Brucella canis . J Med Microbiol. 2005;54:505-8. [ Links ]
18. Monroe PW, Silberg SL, Morgan PM, Adess, M. Seroepidemiological investigation of Brucella canis antibodies in different human population groups. J Clin Microbiol. 1975;2:382-6. [ Links ]
19. Nomura A, Imaoka K, Imanishi H, Shimizu H, Nagura F, Maeda K, et al. Human Brucella canis infections diagnosed by blood culture. Emerg Infect Dis. 2010;16:1183-5. [ Links ]
20. Olivera M, Di Lorenzo C. Aislamiento de Brucella canis en un humano conviviente con caninos infectados. Informe de un caso. Colomb Med. 2009;40:218- 20. [ Links ]
21. Polt SS, Dismuke WE, Flint A, Schaefer J. Human brucellosis caused by Brucella canis . Clin ical features and immune response. Ann Inter Med. 1982;97:717-9. [ Links ]
22. Manias V, Nagel A, Mollerach A, Mendosa M, Freyre H, Gómez A, et al. Endocarditis por Bru cella canis : primer caso documentado en un paciente adulto en Argentina. Rev Arg Microbiol. 2013;45:50-3. [ Links ]
23. Sayan M, Erdenlig S, Stack J, Kilic S, Guducuoglu H, Aksoy Y, et al. A serological diagnostic survey for Brucella canis infection in Turkish patients with brucellosis-like symptoms. Jpn J Infect Dis. 2011;64:516-9. [ Links ]
24. Paixão TA, Roux CM, den Hartigh AB, Sankaran-Walters S, Dandekar S, Santos RL, et al. Establishment of systemic Brucella melitensis infection through the digestive tract requires urease, the type IV secretion system, and lipopolysaccharide O antigen. Infect Immun. 2009;77:4197-208. [ Links ]
25. Scheftel J. Brucella canis : Potential for zoonotic transmission. Comp Contin Edu Practicing Vet. 2003;25:846-52. [ Links ]
26. Greene CE, Carmichael LE. Canine brucellosis. En: Greene CE. Infectious diseases of the dog and cat.3.ª ed. St. Louis, MO: Saunders Elsevier; 2006. p. 369-81. [ Links ]
27. Montecucco C, Rappuoli R. Living dangerously : how Helicobacter pylori survives in the human stomach. Nat Rev. 2001;2:457-65. [ Links ]
28. Marcus EA, Moshfegh AP, Sachs G, Scott DR. The periplasmic a -carbonic anhydrase activity of Helicobacter pylori is essential for acid acclimation. J Bacteriol. 2005;187:729-38. [ Links ]
29. Bandara AB, Contreras A, Contreras-Rodríguez A, Martins AM, Dobrean V, Poff-reichow S, et al. Brucella suis urease encoded by ure I but not ure2 is necessary for intestinal infection of BALB / c mice. BMC Microbiol. 2007;14:1-14. [ Links ]
30. Eskra L, Covert J, Glasner J, Splitter G. Differential expression of iron acquisition genes by Brucella melitensis and Brucella canis during macrophage infection. PLoS One. 2012;7:e31747. [ Links ]
31. Sangari FJ, Cayón AM, Seoane A, García-lobo JM. Brucella abortus ure2 region contains an acid-activated urea transporter and a nickel transport system. BMC Microbiol. 2010;10:107-18. [ Links ]
32. Sangari FJ, Seoane A, Rodríguez MC, Agüero J, Lobo JMG. Characterization of the urease operon of Brucella abortus and assessment of its role in virulence of the bacterium. Infect Immun. 2007;75:774-80. [ Links ]
33. Paulsen IT, Seshadri R, Nelson KE, Eisen JA, Heidelberg JF, Read TD, et al. The Brucella suis genome reveals fundamental similarities between animal and plant pathogens and symbionts. Proc Natl Acad Sci U.S.A. 2002;99:13148–53. [ Links ]
34. Hong W, Sano K, Morimatsu S, Scott DR, Weeks DL, Sachs G, et al. Medium pH-dependent redistribution of the urease of Helicobacter pylori. J Med Microbiol. 2003;52:211-6. [ Links ]
35. Burne RA, Chen YYM. Bacterial ureases in infectious diseases. Microb Infect. 2000;2:533-42. [ Links ]
36. Clark MA, Jepson MA. Intestinal M cells and their role in bacterial infection. Int J Med Microbiol. 2003;293:17-39. [ Links ]
37. Moreno E, Gorvel JP. Invasion, intracellular trafficking and replication of Brucella organisms in professional and non professional phagocytes. En: López-Goñi I, Moriyón I, editores. Brucella: molecular and cellular biology. 1.ª ed. Norfolk: Horizon Bioscience; 2004. p. 280-306. [ Links ]
38. Martín-Martín AI, Vizcaíno N, Fernández-Lago L. Cholesterol, ganglioside GM1 and class A scavenger receptor contribute to infection by Brucella ovis and Brucella canis in murine macrophages. Microbes Infect. 2010;12:246-51. [ Links ]
39. Li G, Zhang XC. GTP hydrolysis mechanism of Raslike GTPases. J Mol Biol. 2004;340:921-32. [ Links ]
40. Jubier-Maurin V, Loisel S, Liautard JP, Köhler S. The intramacrophagic environment of Brucella spp. and their replicative niche. En: López-Goñi I, Moriyón I, editores. Brucella: molecular and cellular biology. 1.ª ed. Norfolk: Horizon Bioscience; 2004. p. 307-34. [ Links ]
41. Arellano-Reynoso B, Lapaque N, Salcedo S, Briones G, Ciocchini AE, Ugalde R, et al. Cyclic beta-1,2-glucan is a Brucella virulence factor required for intracellular survival. Nat Immunol. 2005;6:618-25. [ Links ]
42. De la Cuesta-Zuluaga JJ, Sánchez-Jiménez MM, Martínez-Garro J, Olivera-Angel M. Identification of the virB operon genes encoding the type IV secretion system, in Colombian Brucella canis isolates. Vet Microbiol. 2013;163:196-9. [ Links ]
43. Palomares-Resendiz E, Arellano-Reynoso B, Hernández-Castro R, Tenorio-Gutiérrez V, Salas-Téllez E, Suárez-Güemez FDAE. Immunogenic response of Brucella canis virB10 and virB11 mutants in a murine model. Front Cell Infect Microbiol. 2012;2:1-5. [ Links ]
44. Boschiroli ML, Ouahrani-Bettache S, Foulongne V, Michaux-Charachon S, Bourg G, Allardet-Servent A, et al. Type IV secretion and Brucella virulence. Vet Microbiol. 2002;90:341-8. [ Links ]
45. Delrue RM, Martínez-Lorenzo M, Lestrate P, Danese I, Bielarz V, Mertens P, et al. Identification of Brucella spp. genes involved in intracellular trafficking. Cell Microbiol. 2001;3:487-97. [ Links ]
46. Celli J, Gorvel J. Organelle robbery : Brucella interactions with the endoplasmic reticulum. Curr Opin Microbiol. 2004;7:93-7. [ Links ]
47. Rittig MG, Alvarez-Martinez MT, Porte F, Liautard JP, Rouot B. Intracellular survival of Brucella spp. in human monocytes involves conventional uptake but special phagosomes. Infect Immun. 2001;69:3995-4006. [ Links ]
48. Atluri VL, Xavier MN, de Jong MF, den Hartigh AB, Tsolis RM. Interactions of the human pathogenic Brucella species with their hosts. Annu Rev Microbiol. 2011;65:523-41. [ Links ]
49. Kim S, Watarai M, Suzuki H, Makino S, Kodama T, Shirahata T. Lipid raft microdomains mediate class A scavenger receptordependent infection of Brucella abortus . Microbial Path. 2004;37:11-9. [ Links ]
50. Rittig MG, Kaufmann A, Robins A, Shaw B, Sprenger H, Gemsa D, et al. Smooth and rough lipopolysaccharide phenotypes of Brucella induce different intracellular trafficking and cytokine/chemokine release in human monocytes. J Leuk Biol. 2003;74:1045-55. [ Links ]
51. Watarai M, Makino SI, Fujii Y, Okamoto K, Shirhata T. Modulation of Brucella -induced macropinocytosis by lipid rafts mediates intracellular replication. Cell Microbiol. 2002;4:341-55. [ Links ]
52. Rambow-Larsen AA, Petersen EM, Gourley CR, Splitter GA. Brucella regulators: self-control in a hostile environment. Trends Microbiol. 2009;17:371-7. [ Links ]
53. Alonso A, Garcia del Portillo F. Hijacking of eukaryotic functions by intracellular bacterial pathogens. Internal Microbiol. 2004;7:181-91. [ Links ]
54. Pei J, Ficht TA. Brucella abortus rough mutants are cytopathic for macrophages in culture. Infect Immun. 2004;72:440-50. [ Links ]
55. von Bargen K, Gorvel JP, Salcedo SP. Internal affairs: investigating the Brucella intracellular lifestyle. FEMS Microbiol Rev. 2012;36:533-62. [ Links ]
56. Köhler S, Michaux-Charachon S, Porte F, Ramuz M, Liautard JP. What is the nature of the replicative niche of a stealthy bug named Brucella ? Trends Microbiol. 2003;11:215-9. [ Links ]
57. Celli J, de Chastellier C, Franchini DM, Pizarro-Cerda J, Moreno E, Gorvel JP. Brucella evades macrophage killing via virB -dependent sustained interactions with the endoplasmic reticulum. J Exp Med. 2003;198:545-56. [ Links ]
58. Baldwin CL, Goenka R. Host immune responses to the intracellular bacteria Brucella : Does the bacteria instruct the host to facilitate chronic infection? Crit Rev Immunol. 2006;26:407-42. [ Links ]
59. Megid J, Mathias LA, Robles CA. Clinical manifestations of brucellosis in domestic animals and humans. Open Vet Sci J. 2010;4:119-26. [ Links ]
60. Albayrak A, Albayrak F. Hepatic granulomas associated with brucellosis. Hepat Mont. 2011;11:1–2. [ Links ]
61. Bhardwaj SS, Saxena R, Kwo PY. Granulomatous liver disease. Curr Gastro enterol Rep. 2009;11:42-9. [ Links ]
62. Fernández Fernández MA, García de Paso Mora M, Mateos Checa R, Croche B, Porras González A, Obando Santaella I. Brucellosis infection presenting with cholestasis. Int J Infect Dis. 2010;14:e322-24. [ Links ]
63. Sohn AH, Probert WS, Glaser CA, Gupta N, Bollen AW, Wong JD, et al. Human neurobrucellosis with intracerebral granuloma caused by a marine mammal Brucella spp. Emerg Infect Dis. 2003;9:485-8. [ Links ]
64. Lee SI, Islam MA, Khatun MM, Choi GY, Jung JM, Baek BK, Kakoma I. Immunoglobulin profiles in acute Brucellosis experimentally induced by Brucella canis in BALB/c mice. Vector Borne Zoonotic Dis. 2010;10:927-30. [ Links ]
65. Brower A, Lucero N, Okwumabua O, Gopaul KK, Whatmore AM, Cravero SL, et al. Newly identified variability in Brucella canis fatty-acid content is associated with geographical origin. Epidemiol Infect. 2012;141:852-8. [ Links ]













