Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.17 no.4 Bogotá Oct./Dec. 2013
REPORTE DE CASO
Leishmaniasis cutánea y anfotericina B liposomal. Reporte de caso
Juan Diego Vélez L. a, * y Diana Cristina Carrillo C. b
a Departamento de Infectología, Fundación Valle del Lili, Cali, Valle del Cauca, Colombia
b Convenio Universidad Instituto Colombiano de Estudios Superiores de INCOLDA,, Fundación Valle del Lili, Cali, Valle del Cauca, Colombia
Recibido el 12 de julio de 2013; aceptado el 26 de noviembre de 2013
Resumen La leishmaniasis cutánea es una zoonosis producida por diferentes especies del parásito del género Leishmania . Existen 2 tipos de leishmaniasis, la que se conoce como del nuevo mundo y la del viejo mundo, que son causadas por diferentes especies. La forma de leishmaniasis más común en nuestro medio es la cutánea, rara vez con compromiso sistémico aun en pacientes HIV positivos. El tratamiento consiste en Glucantime, alternativamente miltefosine, los cuales tienen una toxicidad signifi cativa y pueden fallar en un número sustancial de casos. La opción de tratamiento para estos pacientes es la anfotericina B, de las cuales la forma liposomal tiene menor toxicidad renal pero un alto costo y difi cultades para su disponibilidad. Se reporta el caso de un paciente con enfermedad renal crónica y leishmaniasis cutánea, en quien estaba contraindicado el Glucantime y presentó falla terapéutica con miltefosine. Recibió tratamiento con anfotericina B liposomal en una dosis única de 15 mg/kg con adecuada tolerancia, deterioro no signifi cativo de la función renal y resolución de las lesiones cutáneas hasta los 30 y 60 días de seguimiento.
© 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados.
PALABRAS CLAVE
Leishmaniasis cutánea/ terapia; Anfotericina B; Anfotericina B/ farmacocinética; Anfotericina B/efectos Adversos
Cutaneous leishmaniasis and liposomal amphotericin B. Case report
Abstract Cutaneous leishmaniasis is a zoonosis caused by various species of Leishmania parasite. There are two types, known as New World and Old World leishmaniasis, which are caused by different species. The most common form of leishmaniasis in our area is mucocutaneous, which rarely has systemic involvement, even in HIV-positive patients. Glucantime is the first choice of therapy, or alternatively miltefosine, both of which have significant toxicity and can fail in a substantial number of cases. The alternative choice of treatment for these patients is amphotericin B, from which the liposomal form has less renal toxicity but a high cost and low availability. We report the case of a patient with chronic renal disease and cutaneous leishmaniasis, in whom Glucantime was contraindicated and therapeutic failure with miltefosine occurred. He was treated with liposomal amphotericin B in a single dose of 15mg/kg with adequate tolerance, no significant deterioration of renal function and resolution of skin lesions after 30 and 60 days of follow up.
© 2013 ACIN. Published by Elsevier España, S.L. All rights reserved.
KEYWORDS:
Leishmaniasis; Cutaneous/therapy; Amphotericin B; Amphotericin B/ pharmacokinetics; Amphotericin B/ adverse effects
Introducción
La leishmaniasis cutánea es una zoonosis producida por diferentes especies del parásito de género Leishmania. Produce lesiones que pueden afectar la piel, mucosas o la forma visceral 1. En Colombia, para el año 2012 se presentaron 9.546 casos de los cuales 97,9% fueron de la forma cutánea, 1,8% mucosa y menos de 1% visceral 2. Tiene predominio por áreas rurales por debajo de los 1.500 metros sobre el nivel del mar 3.
Los tratamientos disponibles en nuestro país incluyen las sales de amonio pentavalente (antimoniato de N-metil glucamina) y estibogluconato de sodio, isotionato de pentamidina y miltefosina con porcentajes de curación de 90-95%, 84-96%, 84-91% respectivamente 3. En los casos de falla terapéutica se considera el uso de anfotericina B. Existe una amplia experiencia en el manejo de la leishmaniasis del viejo mundo con una dosis única de anfotericina B liposomal, con excelentes resultados, buena tolerancia y a un costo razonable. Sin embargo esta forma de tratamiento no ha sido reportado en la leishmaniasis del nuevo mundo.
A continuación se presenta el caso de un paciente con leishmaniasis cutánea con falla terapéutica al tratamiento convencional que recibió tratamiento con una dosis única de anfotericina B liposomal.
Reporte de caso
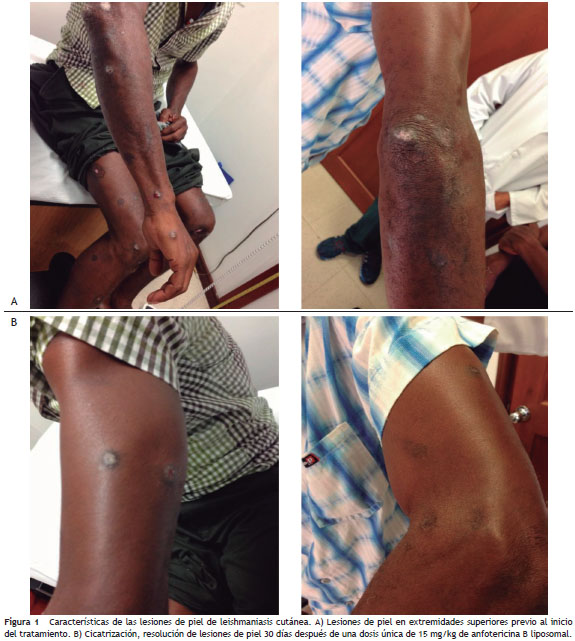
Paciente masculino de 56 años de edad, con antecedente de hipertensión arterial, enfermedad renal crónica, procedente del área rural de la costa pacífica de Colombia. Consultó por 1 año de evolución de leishmaniasis cutánea con confirmación histopatológica de la biopsia de piel, y por resultado del cultivo de aspirado de lesiones y análisis por zimodemas, de infección por Leishmania (Viannia) panamensis . Recibió tratamiento con miltefosine con leve mejoría de las lesiones y no recibió otras opciones tales como sales de amonio pentavalente por elevación de la creatinina ni pentamidina por no encontrarse disponible en el país. Ingresó con una creatinina de 1,38 mg/dl, nitrógeno ureico de 12 mg/dl, depuración de creatinina de 80 ml/min, transaminasas normales y sin trastornos electrolíticos asociados. Al examen físico se observaron numerosas lesiones en la piel en ambos pabellones auriculares, extremidades superiores e inferiores (fig. 1a). Se consideró darle una dosis única de 15 mg/kg de anfotericina B liposomal con el objetivo de mejorar sus lesiones con la menor toxicidad renal y la hospitalización más corta posible. El paciente toleró la infusión del medicamento y fue dado de alta 24 horas después. Se realizó seguimiento de función renal durante hospitalización y posteriormente a 30 días presentando elevación de la creatinina inicial hasta 1,76 mg/dl. Se observó disminución del tamaño de las lesiones, desaparición de las induraciones y cicatrización de lesiones previamente activas a 30 días de tratamiento. Dos meses después, el paciente tenía aún una creatinina elevada en 2 mg/dl pero sus lesiones permanecieron sanas (fig. 1b).
Discusión
Los tratamientos actuales para leishmaniasis cutánea están poco justificados y tienen una efectividad subóptima que puede ser debido a la variedad de especies infectantes y a la distribución geográfica de la enfermedad 4. La principal desventaja es el tiempo de tratamiento requerido para alcanzar la curación y los efectos adversos de los medicamentos.
La anfotericina B es un antibiótico poliénico usado como agente antimicótico. Para el caso de Leishmaniasis se considera que la acción de la anfotericina B es debida a la interacción con el ergosterol que contiene el parásito 5. Otro mecanismo de acción de la anfotericina B puede ser la generación de metabolitos oxidativos que produce estimulación funcional de los fagocitos in vitro 6. Luego de una infusión intravenosa de anfotericina B liposomal la droga es liberada de su trasportador, se distribuye predominantemente con lipoproteína y es tomada preferiblemente por órganos del sistema fagocítico mononuclear 6 . La anfotericina B liposomal tiene una tasa de curación de 97% para leishmaniasis visceral sin resistencia reportada, sin embargo su uso está limitado por la nefrotoxicidad que resulta en falla renal 7,8.
Para leishmaniasis cutánea, el tratamiento con anfotericina B liposomal a dosis 3 mg/kg/día hasta 10 dosis administradas en un período de 21 días reportó una curación de 84% (16 de 19 pacientes) con una incidencia de eventos adversos hasta de 65% 9. La dosis acumulada en este estudio fue en promedio de 21 mg/kg (rango 6-3 mg/kg) 9. En Israel, Solomon et al. reportaron 13 pacientes con Leishmaniasis cutánea con L. tropica que recibieron Anfotericina B Liposomal a una dosis de 3 mg/kg/día durante 5 días y una sexta dosis al día 10 para un acumulado de 18 mg/kg 10. Se documentó una curación de 84,6% a 12 meses de seguimiento e incidencia de eventos adversos de 23% 10. En Bolivia, este mismo autor realizó un estudio observacional prospectivo de 34 pacientes con leishmaniasis cutánea por L . braziliensis que recibieron anfotericina B Liposomal a dosis de 3 mg/kg día por 5 días consecutivos y una sexta dosis al día 10 comparado con 34 pacientes que recibieron estibogluconato de sodio a dosis 200 mg/kg durante 3 semanas 11. Reportó una curación completa de 85% (29 de 34 pacientes) comparado con 70% en el grupo que recibió estibogluconato de sodio sin observarse recaídas a 29 meses de seguimiento 11 . Sin embargo, en Brasil, Motta et al. reportaron 50% de curación en un ensayo clínico abierto de 35 pacientes con leishmaniasis cutánea que recibieron anfotericina B liposomal a dosis de 1,5 mg/kg/día durante 5 días, dosis menor a las utilizadas en los otros estudios 12.
La dosis recomendada para anfotericina B liposomal en leishmaniasis es de 2 a 3 mg/kg día en infusión para una dosis total de 20-40 mg/kg para leishmaniasis cutánea y hasta 60 mg/kg para leishmaniasis que compromete mucosas 13. Sin embargo, los datos farmacocinética y farmacodinámica (Pk/Pd) de esta sustancia en infecciones fúngicas, en donde actúa sobre el mismo sustrato, han demostrado hasta ahora que la acción de este medicamento depende de la relación pico/MIC 14,15. En candidiasis invasiva, la farmacodinamia ha mostrado el aumento de la tasa de muerte micótica a medida que la concentración excede la MIC en 2 a 10 veces 16.
Aunque se desconoce si esta misma relación se cumple en infecciones parasitarias como esta, los datos disponibles en el tratamiento de la leishmaniasis del viejo mundo con una sola dosis de anfotericina B liposomal de 15 mg/kg muestran excelentes resultados, con una mínima toxicidad y una duración del tratamiento corta. En India, un estudio de una sola dosis de anfotericina B liposomal de 10 mg/kg mostró una eficacia de 95% en leishmaniasis visceral 8.
Teniendo en cuenta los estudios previos de Pk/Pd de la anfotericina B liposomal en modelos de infecciones invasivas por hongos y que la toxicidad renal de este medicamento está relacionada más con el tiempo de duración de la exposición que con la dosis del medicamento, consideramos dar una dosis de 15 mg/kg en una sola administración. Se observó curación de las lesiones a 30 y 60 días de seguimiento con deterioro de la función renal. Esto sugiere que la dosis única de anfotericina B liposomal pudiera ser efectivas en el tratamiento de leishmaniasis del nuevo mundo y que probablemente para esta enfermedad podrían cumplirse las mismas condiciones fármaco dinámicas que para las micosis, es decir, que la efectividad este medicamento estuviera dada por la relación Pico/MIC, sin embargo hay que tener en cuenta la toxicidad renal que puede ser alta, siendo mayor con la anfotericina B deoxicolato y mucho menos con anfotericina B liposomal 17. Se requieren estudios de eficacia y seguridad de este medicamento en dosis altas y únicas en el tratamiento de leishmaniasis cutánea del nuevo mundo.
Conclusiones
La anfotericina B liposomal en una dosis alta y en una administración única pudiera ser un efectivo como alternativa para el tratamiento de leishmaniasis cutánea del nuevo mundo al igual que lo es en la del viejo mundo. Esto permitiría un tratamiento con una sola dosis, una toxicidad menor, periodos de hospitalización cortos y una menor incapacidad para los pacientes.
* Autor para correspondencia.
Correos electrónicos: jdvelez1@gmail.com, Jvelez@fcvl.org (J.D. Vélez L).
0123-9392/$ - see front matter © 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados.
Bibliografía
1. Reithinger R, Dujardin JC, Louzir H, Pirmez C, Alexander B, Brooker S. Cutaneous leishmaniasis. Lancet Infect Dis. 2007;7:581-5. [ Links ]
2. Instituto Nacional de Salud de Colombia. Casos por evento Leishmaniasis 2012. Sistema de vigilancia en Salud Pública – SIVIGILA. [ Links ]
3. Ministerio de Protección Social, Organización Mundial de la Salud (OMS). Guía de atención integral de leishmaniasis. Bogotá: OMS; 2010. p. 1-62. [ Links ]
4. Grogl M, Hickman M, Ellis W, Hudson T, Lazo JS, Sharlow ER, et al. Review: Drug discovery algorithm for cutaneous leishmaniasis. Am J Trop Med Hyg. 2013;88:216-21. [ Links ]
5. Ashley ESD, Lewis R, Lewis JS, Martin C, Andes D. Pharmacology of systemic antifungal agents. Clin Infect Dis. 2006;43:S28-S39. [ Links ]
6. Groll AH, Piscitelli SC, Walsh TJ. Antifungal pharmacodynamics: Concentration-effect relationships in vitro and in vivo. Pharmacotherapy. 2001;21:133S-48S. [ Links ]
7. Chattopadhyay A, Jafurulla M. A novel mechanism for an old drug: Amphotericin B in the treatment of visceral leishmaniasis. Biochem Biophys Res Commun. 2011;416:7-12. [ Links ]
8. Balasegaram M, Ritmeijer K, Lima MA, Burza S, Ortiz Genovese G, Milani B, et al. Liposomal amphotericin B as a treatment for human leishmaniasis. Expert Opin Emerging Drugs. 2012;17:493-510. [ Links ]
9. Wortmann G, Zapor M, Ressner R, Fraser S, Hartzell J, Pierson J, et al. Lipsosomal amphotericin B for treatment of cutaneous leishmaniasis. Am J Trop Med Hyg. 2010;83:1028-33. [ Links ]
10. Solomon M, Pavlotsky F, Leshem E, Ephros M, Trau H, Schwartz E. Liposomal amphotericin B treatment of cutaneous leishmaniasis due to Leishmania tropica. J Eur Acad Dermatol Venereol. 2011;25:973-7. [ Links ]
11. Solomon M, Pavlotzky F, Barzilai A, Schwartz E. Liposomal amphotericin B in comparison to sodium stibogluconate for Leishmania braziliensis cutaneous leishmaniasis in travelers. J Am Acad Dermatol. 2013;68:284-9. [ Links ]
12. Motta JO, Sampaio RN. A pilot study comparing low-dose liposomal amphotericin B with N-methyl glucamine for the treatment of American cutaneous leishmaniasis. J Eur Acad Dermatol Venereol. 2012;26:331-5. [ Links ]
13. Goto H, Lindoso JAL. Cutaneous and mucocutaneous leishmaniasis. Infect Dis Clin North Am. 2012;26:293-307. [ Links ]
14. Andes D. In vivo pharmacodynamics of antifungal drugs in treatment of candidiasis. Antimicrob Agents Chemother. 2003;47:1179-86. [ Links ]
15. Wiederhold NP, Tam VH, Chi JD, Prince RA, Kontoyiannis DP, Lewis RE. Pharmacodynamic activity of amphotericin B deoxycholate is associated with peak plasma concentrations in a neutropenic murine model of invasive pulmonary aspergillosis. Antimicrob Agents Chemother. 2006;50:469-73. [ Links ]
16. Lepak AJ, Andes DR. Antifungal PK/PD considerations in fungal pulmonary infections. Semin Respir Crit Care Med. 2011; 32:783-94. [ Links ]
17. Deray G. Amphotericin B nephrotoxicity. J Antimicrob Chemother. 2002;49 Suppl 1:37-41. [ Links ]













