Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.18 no.4 Bogotá Sep./Dec. 2014
https://doi.org/10.1016/j.infect.2014.06.002
ORIGINAL
http://dx.doi.org/10.1016/j.infect.2014.06.002
Caracterización de pacientes hospitalizados con infecciones causadas por micobacterias no tuberculosas, en un hospital de alta complejidad en Colombia
Franco Eduardo Montúfar a , b , * , Camilo A. Madrid b , c , María C. Montufar b, c, Carolina Aguilar d , Carolina Saldarriaga a , Miguel A. Mesa c , Alicia Quiroga c , Carlos E. Builes c , John J. Zuleta d y Olga L. Molina e
aSección de Enfermedades Infecciosas, Departamento de Medicina Interna, Hospital Pablo Tobón Uribe, Medellín, Colombia
bGrupo de Investigación en Enfermedades Respiratorias e Infecciosas GIERI, Medellín, Colombia
cFacultad de Medicina, Universidad Pontificia Bolivariana, Medellín, Colombia
dUnidad de Investigación de Epidemiología Clínica, Hospital Pablo Tobón Uribe, Medellín, Colombia
eDepartamento de Microbiología, Hospital Pablo Tobón Uribe, Medellín, Colombia
Recibido el 19 de diciembre de 2013; aceptado el 6 de junio de 2014
Disponible en Internet el 28 de julio de 2014
Resumen
Antecedentes: Las infecciones por micobacterias no tuberculosas (MNT) se describen en los últimos años con mayor frecuencia, especialmente en pacientes con inmunosupresión y en pacientes tratados por procedimientos estéticos. Las MNT incluyen especies del género Mycobacterium , diferentes del complejo Mycobacterium tuberculosis y Mycobacterium leprae .
Objetivo: Describir las características demográficas y clínicas de pacientes hospitalizados con infecciones por MNT.
Metodología: Estudio descriptivo retrospectivo.
Resultados: De 187 pacientes con infección por micobacterias documentadas por cultivo, 17 (9,1%) tuvieron infección por MNT. Edad promedio de 38,4 ± 19,2 años. El 58,82% fueron hombres. Las principales comorbilidades fueron VIH/sida (41,17%), diabetes mellitus (23,53%), enfermedad renal crónica (17,64%), terapia inmunosupresora (17,64%) y neoplasias (17,64%). En los coinfectados con VIH el recuento de CD4 fue <50 en 85,71%. Las especies más frecuentes fueron complejo M. avium (CMA) 35,29%, M. abscessus (17,65%) y M. chelonae (11,76%). Las formas de infección fueron: diseminada (35,29%), pulmonar (23,53%), piel y tejidos blandos (17,64%) y gastrointestinal (11,76%). Estancia promedio de 22,1 días; un 23,53% requirió atención en UCI. La mortalidad general fue 23,53%.
Conclusión: Las infecciones por MNT causan una serie de condiciones patológicas, los pacientes inmunocomprometidos son la población de mayor riesgo y las formas diseminada y pulmonar,las más frecuentes. La sospecha temprana así como la toma de muestras adecuadas y el uso de métodos diagnósticos apropiados son indispensables para su diagnóstico oportuno y tratamiento adecuado.
PALABRAS CLAVE
Epidemiología; VIH; Micobacterias no Tuberculosas; Inmunosupresión
© 2013 ACIN. Publicado por Elsevier España, S.L.U. Todos los derechos reservados.
Characteristics of inpatients with nontuberculous mycobacterial infections in a highly complex hospital in Colombia
Abstract
Background: Nontuberculous mycobacteria (NTM) infections has been described more frequently in recent years, especially in immunosuppression conditions and after cosmetic surgical procedures. The NTM include species of the genus Mycobacterium , other than Mycobacterium tuberculosis complex and Mycobacterium leprae.
Objective: To describe the demographic and clinical characteristics of Colombian in-patientswith NTM infections.
Methodology: A retrospective descriptive study.
Results: In 187 patients with culture- confirmed mycobacterial infection, 17 (9,1%) had NTM.The mean age was 38,4 ± 19,2 and 58,82% were men. Major comorbidities were: HIV/AIDS(41,1%), diabetes mellitus (23,5%), chronic renal disease (17,6%), immunosuppressive therapy(17,6%) and neoplasms (17,6%). In patients co-infected with HIV, CD4 count was <50 in 85,7%.The most frequent species were M. avium complex (MAC) in 35,2%, M. abscessus in 17,6% and M. chelonae in 11,7%. Infections were disseminated (35,2%), pulmonary (23,5%), skin and soft tissue (17,6%) and in gastrointestinal system (11,7%). The average hospital stay was 22,1 day sand 23,5% required intensive care unit. Overall mortality was 23,5%.
Conclusion: MNT infections cause a number of pathological conditions, being more frequent in immunocompromised patients. The disseminated and pulmonary forms were the most common. Early clinical suspicion and appropriate samples and diagnostic assays, are crucial for early diagnosis and treatment.
KEYWORDS
Epidemiology; HIV; Non-tuberculousmycobacteria; Immunosupression
© 2013 ACIN. Published by Elsevier España, S.L.U. All rights reserved.
0123-9392/© 2013 ACIN. Publicado por Elsevier España, S.L.U. Todos los derechos reservados.
Introducción
Colombia es un país donde la tasa de incidencia de tuberculosis (TB) se ha mantenido en los últimos años alrededorde 25/100.000 habitantes, con tendencia de incremento en las formas extrapulmonares y en la incidencia de TB en menores de 15 años 1 . Las infecciones por micobacterias no tuberculosas (MNT) usualmente generan compromiso de los siguientes órganos y sistemas: piel y tejidos blandos, tracto respiratorio, tejido linfoide, osteoarticular, gastrointestinal y las formas diseminadas. Este tipo de infecciones se describen en los últimos años con mayor frecuencia, especialmente en pacientes con inmunosupresión ya sea por infección por virus de la inmunodeficiencia humana (VIH)o por otras causas, y también asociadas a procedimientos estéticos. No es claro si existe realmente un incremento en la incidencia de infecciones por MNT, o si estamos ante la presencia de mejores técnicas de diagnóstico microbiológico o en una búsqueda más activa de infecciones pormicobacterias 2-5.
El concepto MNT se utiliza para distinguir las especies de micobacterias que no pertenecen al complejo Mycobacterium tuberculosis ni son Mycobacterium leprae . Las enfermedades causadas por MNT se conocen como micobacteriosis para diferenciarlas de la tuberculosis causada por todos los miembros del Complejo Mycobacterium tuberculosis incluido Mycobacterium bovis y la lepra causada por Mycobacterium leprae 6.
La clasificación del género MNT establecida por Runyonen 1959, con base en sus características fenotípicas (crecimiento y pigmentación), nos permite agrupar y clasificarlas especies de importancia clínica (tabla 1), sin embargo en esta no se incluyen todas las especies identificadas aposteriori 7,8.
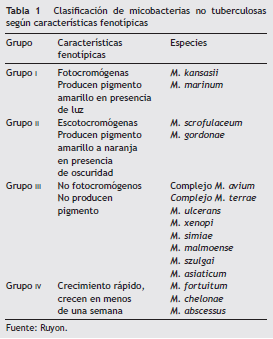
Actualmente se establecen relaciones entre las características genotípicas y fenotípicas, que han permitido la creación de árboles filogenéticos que agrupan la mayoría de las micobacterias. En la tabla 2 podemos observar las especies de micobacterias que se ha demostrado que causan enfermedad en humanos.

Las MNT son organismos ambientales, encontrados enaguas, polvos, suelos, animales y alimentos y, por tal motivo, no fueron consideradas patógenas inicialmente y su hallazgo era interpretado como colonización o, en algunos casos, como contaminación de los cultivos. El relativo lento crecimiento comparado con otras bacterias y la presencia de ácidos micólicos en su pared hacen que estas especies sean resistentes a los tratamientos de aguas con cloro 9-11.
Normalmente las especies de MNT no son patógenos obligados y generalmente no causan enfermedad, sin embargo cuando hay detrimento del sistema inmune del huésped o hay rotura de las barreras de piel o mucosas, estos gérmenes pueden conllevar enfermedades potencialmente fatales 6,12,13. La importancia de las infecciones por MNT está en relación con el mejor entendimiento de su cuadro clínico, sus mecanismos patogénicos, el desarrollo de métodos diagnósticos y las características del huésped a los que nos vemos enfrentados en los últimos años, especialmente cuando su sistema inmune está alterado.
El mecanismo patogénico exacto no es conocido, pero por la formación de granulomas y la presencia de formas diseminadas, se considera que su patogenia pudiese ser similar a TB. La infección pulmonar es adquirida a través de inhalación de aerosoles provenientes de suelos o aguas contaminadas y, a partir del compromiso pulmonar inicial, puede dar lugar a las formas diseminadas. La ingestión de alimentos o aguas contaminadas es otra forma de adquirir la enfermedad y posteriormente por diseminación hematógena generar formas diseminadas. La rotura de barreras cutáneas y de mucosas predispone a infecciones usualmente localizadas, situación que especialmente vemos en infecciónes asociadas a trauma y a procedimientos estéticos 8,13,14.
No se conoce realmente, cuando la enfermedad está presente, si esta se produjo por reactivación, reinfección o infección exógena primaria.
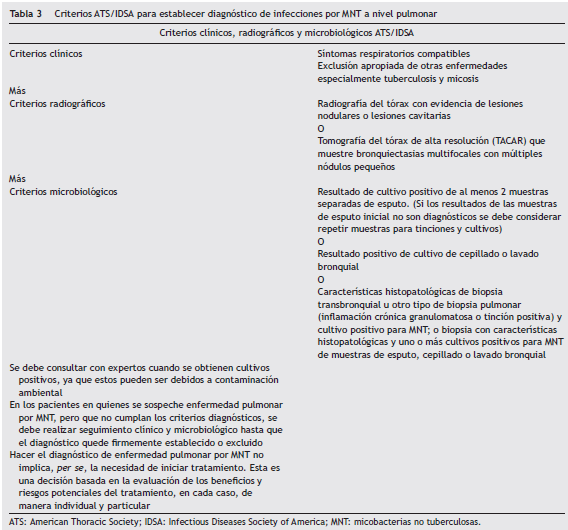
El compromiso o infección pulmonar por MNT usualmente está asociado a inmunosupresión y a defectos estructurales pulmonares previos. No es fácil establecer el diagnóstico de compromiso pulmonar por MNT: se requiere, además del cuadro clínico sugestivo, determinar el compromiso radiológico y el aislamiento microbiológico. Los criterios definidos por la Sociedad Americana del Tórax y la Sociedad Americana de enfermedades infecciosas (ATS/IDSA) deben ser aplicados en el diagnóstico de la enfermedad pulmonar por MNT. Sin embargo, están en mora de ser revisados, ya que ante la dificultad del diagnóstico microbiológico, el desarrollo de las pruebas de biología molecular ha ganado espacio y se consolidan como métodos diagnósticos y deberán ser incluidas en los criterios de diagnóstico de enfermedad de MNT 15 (tabla 3).
Las MNT se consideran de poca contagiosidad y no se ha demostrado transmisión por aerosoles, lo cual tiene implicaciones epidemiológicas, pues no requeriría aislamiento por aerosoles, ni tampoco estudios epidemiológicos a sus contactos 8,14.
Las infecciones de piel y tejidos blandos están relacionadas siempre con inoculación directa de la MNT a través de traumas, heridas quirúrgicas y con inyecciones, especialmente en procedimientos estéticos, sin embargo también se describen casos de compromiso cutáneo asociado a inmunosupresión, como es el caso de pacientes trasplantados, donde las formas cutáneas también pueden ser la expresión de formas diseminadas. Las manifestaciones cutáneas son variadas: patrón esporotricoide (diseminación linfocutánea), foliculitis recurrente, forunculosis recurrente, nódulos-abscesos subcutáneos que se fistulizan, úlceras y las formas crónicas con fibrosis, fístulas y deformidades retractiles del sitio afectado. En Colombia y en el mundo se han descrito brotes epidémicos asociados a procedimientos estéticos y en pacientes inmunosuprimidos, generando deformidades muchas veces irreparables 5,13-18.
La mayoría de las MNT patógenas pueden causar infecciones de piel y tejidos blandos, siendo las más frecuentes las de crecimiento rápido ( M. fortuitum, M. cheloney M. abscesus ), pero también son frecuentes por M. marinumy por micobacterias de crecimiento lento como M. ulcerans que ocasiona la enfermedad de Buruli descrita en 1937 en Australia y en 1942 en África tropical, enfermedad que se ha considerada como una de las más frecuentes producidas por micobacterias después de tuberculosis y lepra.
El diagnóstico de infección de piel y tejidos blandos por MNT se establece por cultivo, pero la sospecha clínica con base en una anamnesis que haga énfasis en factores de riesgo, las manifestaciones clínicas, el bajo rendimiento de tinciones directas y la negatividad de estudios microbiológicos habituales, apoyados también por hallazgos histopatológicos en biopsias, llevan a establecer el diagnóstico 5,13-19.
Horsburg en 1996 realizó una revisión de infecciones de relevancia clínica causadas por MNT y la mayoría de los casos quedaron agrupados en 4 síndromes clínicos: enfermedad pulmonar, compromiso ganglionar, compromiso de piel y tejidos blandos y la forma diseminada. Esta última, especialmente en huésped inmunosuprimido 6. Sin embargo, además de los síndromes clínicos descritos, también hay compromiso de tracto gastrointestinal y compromiso osteoarticular 20.
Dentro de las MNT, el complejo Mycobacterium avium (CMA) es la especie que causa enfermedad pulmonar con mayor frecuencia 21; pero el compromiso pulmonar también se puede observar en M. kansasii , M. malmoense , M. abscessus y M. xenopi 22.
En el trabajo realizado por Crespo en Cali (Colombia) para identificar la prevalencia de micobacterias en pacientes con VIH, encontró que la prevalencia de MNT fue del 5%, pero en esa población estudiada solo en el 1% se consideró que MNT fue causante de enfermedad. Las especies de MNT aisladas fueron M. gordonae (2%), M. sulgai (1%), M. fortuitum (1%)y M. avium (1%) 23.
Murcia-Aranguren, en Bogotá, encontró que en 3 centros que atienden población de VIH/sida, de 286 pacientes incluidos con infección VIH estudiados para detectar oportunistas, solo 16 (5,6%) fueron positivos para cualquier especie de micobacteria; M. avium fue aislado en 13 (4,54%), M. tuberculosis en 4 (1,4%) y en 2 (0,7%) pacientes se aisló en forma simultánea M. tuberculosis y M. avium 17.
En nuestro país, hay algunas series descritas de compromiso cutáneo por MNT; estas, en la mayoría de los casos, asociadas a procedimientos estéticos de mesoterapia, pero también existen formas cutáneas ocasionadas por inoculación directa en programas de desensibilización en pacientes alérgicos, así como manifestación de enfermedad diseminada o compromiso cutáneo asociado a inmunosupresión en pacientes trasplantados y oncológicos. La mayoría de estos casos son ocasionados por MNT de crecimiento rápido y se caracterizan por lesiones nodulares dolorosas, úlceras o fístulas. Las especies más frecuentemente aisladas en estas series fueron M. chelonea, M abscessus y M. fortiutum 14,15,24. Sin embargo las formas esporotricoides que simulan carcinomas escamocelulares también han sido descritas en pacientes con inmunosupresión de base, comodiabetes mellitus 19.
En contraste con M. tuberculosis , cuyo reporte es obligatorio a nivel mundial, las infecciones por MNT no se reportan sistemáticamente, por lo que se carece de datos precisos acerca de su verdadera incidencia y prevalencia. Sin embargo en los países de alta prevalencia de TB, se describen cada días más casos de infecciones por MNT y esto ha generado interés por su descripción, con el fin de identificar sus características clínicas, factores de riesgo, comorbilidad y ubicación geográfica, así como de optimizarlos métodos de detección e implementación de pruebas de biología molecular. El complejo M. avium es la MNT predominante en la mayoría de países, seguida de M. gordonae y M. xenopi . Importantes diferencias han sido observadas en la incidencia, prevalencia y ubicación geográfica de M. xenopi,M. kansasii y micobacterias de crecimiento rápido 25-29.
El objetivo de este estudio es describir las características epidemiológicas, clínicas y microbiológicas de los pacientes con infecciones por MNT y aportar datos para la epidemiología colombiana y el entendimiento de las infecciones por MNT.
Metodología
Tipo de estudio
Estudio observacional descriptivo retrospectivo.
Población
Pacientes hospitalizados con aislamiento microbiológico de MNT y confirmación de la especie por cultivo, atendidos en el Hospital Pablo Tobón Uribe (HPTU), centro de alta complejidad de atención, Medellín, Antioquia, Colombia, entre el 1 de enero de 2004 y el 31 de diciembre de 2010.
Se excluyeron aquellos pacientes que no tenían en la historia clínica la información de las variables demográficas, clínicas, durante la hospitalización en la cual se realizó el aislamiento.
Recolección de datos
Los pacientes con aislamiento microbiológico de MNT se identificaron en la base de datos del grupo de microbiología del Hospital Pablo Tobón Uribe. Se evaluó la historia clínica de cada uno de ellos para identificar las variables (demográficas, clínicas, microbiológicas y desenlaces).
El método utilizado para el aislamiento microbiológicode las MNT durante los años 2004 a 2008 fue el medio de cultivo sólido Ogawa Kudoh y desde el 2009 se utiliza adicionalmente el método automatizado BD BACTEC TM MGIT TM ,equipo de Becton Dickinson.
Análisis estadístico
Las variables cuantitativas se expresaron como media y rango. Las variables cualitativas como frecuencias absolutas y relativas. Se utilizó el programa SPSS 13.0.
Fuentes de financiación
Los investigadores no recibieron dinero de ninguna institución, el Hospital Pablo Tobón Uribe ofreció al grupo investigador todo el apoyo logístico necesario para llevar a cabo la recolección de datos y elaboración del artículo de investigación.
El protocolo de investigación fue aprobado por el Comité de nvestigaciones y Ética en Investigaciones del Hospital Pablo Tobón Uribe.
Resultados
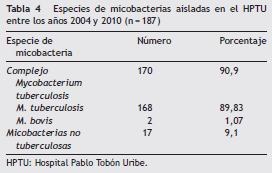
De 204 pacientes con infección por micobacterias, 187 fueron documentadas por cultivo; de estas, el 91,9% fueron M. tuberculosis y el 9,1%, MNT (tabla 4).
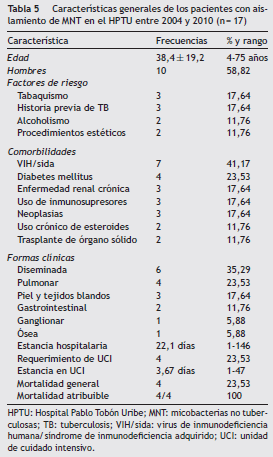
La edad promedio de los pacientes con infección por MNT fue 38,4 ± 19,2 años (rango 4 a 75), 10 (58,82%) fueron hombres. Se identificaron como factores de riesgo tabaquismo e historia previa de tuberculosis en 17,64%, alcoholismo y procedimiento estéticos en 11,76%. Al ingreso, la fiebre fue el síntoma predominante en 82,53%, seguida de síntomas respiratorios 23,53% y manifestaciones cutáneas 17,64%. Las principales comorbilidades fueron VIH/sida 50,0% y diabetes mellitus 23,54%, seguidas por enfermedad renal crónica, neoplasias y uso crónico de esteroides con17,64% cada una. Trasplante de órgano y uso crónico de esteroides fueron las otras 2 comorbilidades en el 11, 76% respectivamente (tabla 5).
En los pacientes con infección VIH/sida el 85,6% (6/7) tuvieron recuento de CD4 menor de 50: El recuento promedio en estos pacientes fue de 25 ± 20 cel/ml y la carga viral promedio de 83,344 ± 40,796 copias/ml, todos ellos sin tratamiento antirretroviral o en falla inmunovirológica.
Las presentaciones clínicas extrapulmonares fueron el 76,4% y de estas en orden de frecuencia: infección diseminada 35,29%, piel y tejidos blandos 17,64%, gastrointestinal17,64%, ganglionar 5,88% y compromiso óseo 5,88%.
Las especies de MNT aisladas con mayor frecuencia fueron: CMA (35,29%), M. abscessus (17,65%), M. chelonae (11,76%) (tabla 6).
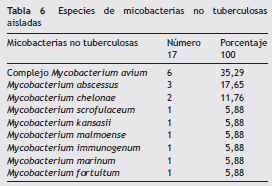
Las formas diseminadas 6/17 (35,29%) ocurrieron en 4 pacientes con inmunosupresión por VIH y en 2 trasplantados renales. Fueron ocasionadas por CMA en 4 casos (23,52%), M. abscessus en 1 (5,88%) y por M. malmoense en 1 (5,88%).
El compromiso pulmonar estuvo presente en 4 pacientes (23,53%) y fueron ocasionados por M. chelonae , M.scrofulaceum , M. abscessus y M. kansasii . Los patrones de compromiso pulmonar observados fueron infiltrados fibro-nodulares, bronquiectasias y distribución miliar. No se observaron lesiones cavitarias.
Las formas cutáneas 3/17 (17,64%) fueron ocasionadas por M. fortuitum , M. marinum y M. immunogenum; estas se caracterizaron por lesiones nodulares, fístulas y úlceras, 2de ellas asociadas a procedimientos quirúrgicos.
El compromiso de tracto gastrointestinal ocurrió en 2 pacientes y fue ocasionado por CAM y M. abscessus. Tuvimos un caso de compromiso óseo por M. chelonae y un caso de compromiso ganglionar por CAM.
En los pacientes con infección VIH/sida, 6 casos fueron ocasionados por CAM y uno por M. malmoense .
La estancia hospitalaria promedio fue de 22,1 días (rango1 a 146 días). De los pacientes hospitalizados el 23,53% requirió atención en UCI con una estancia promedio de 3,67 días (rango 1 a 47 días). La mortalidad general fue del 23,53%y, en todos los casos, la mortalidad ocurrió en pacientes atendidos en UCI y fue atribuida a infección diseminada.
Discusión
Las infecciones por MNT se describen cada vez con mayor frecuencia en países de alta prevalencia de tuberculosis, relacionados cada vez más con la búsqueda activa por parte del clínico y también por avances tecnológicos en diagnóstico microbiológico y de biología molecular 3,4,7,8,13,14,20,23,25-31.
Es una entidad que se debe tener en cuenta en pacientes inmunosuprimidos y, como lo muestra nuestra población, la inmunosupresión es un factor determinante en la forma de presentación clínica 5,13,18,19,30. Las causas de inmunosupresión descritas como factores de riesgo en otros estudios son infección VIH/sida, uso de inmunosupresores, medicamentos antifactor de necrosis tumoral (anti-TNF) y enfermedades que depriman el sistema inmune.
Los estudios y descripciones realizados en Colombia identifican como los principales factores de riesgo la inmunosupresión por VIH, la diabetes mellitus, el haberse realizado procedimientos quirúrgicos estéticos o mesoterapia y la escarificación cutánea para desensibilización de alérgenos 14,15,17,19,24,29.
En nuestra serie, las principales comorbilidades identificadas fueron VIH/sida, diabetes mellitus, uso de terapias inmunosupresoras, enfermedad renal crónica, neoplasias y trasplante de órgano. Todas ellas generan inmunosupresión de tipo celular y exponen a los pacientes a una serie de infecciones que tiene como uno de sus principales mecanismos de defensa la función celular T y, dentro de estas, las infecciones por micobacterias. También se describen como factores de riesgo para infección por MNT, tabaquismo y lesiones estructurales toracopulmonares como fibrosis quística, bronquiectasias y deformidad de la pared torácica. En nuestros pacientes documentamos como factores de riesgo tabaquismo, alcoholismo y procedimientos estéticos. Adicionalmente en el 17,64%, se identificó el antecedente de haber sufrido de tuberculosis pulmonar. Este último antecedente no ha sido establecido como factor de riesgo, pero es llamativo en nuestra serie, dado que la gran mayoría delos pacientes tienen inmunosupresión de base y es posible que este diagnóstico de tuberculosis solo se haya realizado por tinciones para bacilos ácido alcohol resistentes y no por cultivo, lo cual nos haría pensar en la posibilidad de un mal diagnóstico previo.
Las infecciones por MNT usualmente causan en el paciente inmunocomprometido enfermedad extrapulmonary diseminada, como se corroboró en nuestra serie. Si bien CMA es unos de las principales causas de enfermedad diseminada, tuvimos 2 casos de infección diseminada causada por M. abscessus y M. malmoense , causas infrecuentes, pero también descritas 5,6,8,21,22,31.
La infección pulmonar por MNT se caracteriza usualmente por compromiso difuso, con infiltrados reticulares, alveolares, nodulares y de aspecto miliar. Se describen 4 patrones de compromiso pulmonar: enfermedad cavitaria, bronquiectasias, fibronodular y neumonitis de hipersensibilidad 6,8,20,21,31. En nuestros pacientes no se evidenció enfermedad cavitaria y tampoco había historia de lesiones estructurales previas y es llamativo, además, que el compromiso pulmonar fuese causado por MNT infrecuentes en enfermedad pulmonar y no por CMA, especie que generalmente es descrita como el principal agente etiológico de compromiso pulmonar en micobacteriosis 5,8,20,25,26,31.
Las formas cutáneas son similares a las descritas en otras series, siendo el compromiso nodular y abscesos subcutáneos los más frecuentes. Los 3 pacientes tuvieron como factor de riesgo cirugías y estado de inmunosupresión 13-16,19,24.
En pacientes inmunosuprimidos por infección VIH/sida, el conteo de CD4 es un factor predisponente para infecciones por MNT y, especialmente, de formas diseminadas cuando el conteo es menor de 50. En nuestra población 6 de los7 pacientes (85,71%) con infección por VIH tenían CD4 < 50, con un promedio de 25 ± 20 cel/ml, asociado esto a carga viral elevada, por carencia de terapia antirretroviral y falla inmunovirológica. En 6 casos el agente etiológico fue CMA y en uno M. malmoense . Hallazgos similares a los descritos enseries de otros países. Es indispensable en nuestra población implementar la profilaxis con macrólidos, especialmente en la población más susceptible con recuento de CD4 = 50, para evitar morbimortalidad asociada; conducta olvidada o no tenida en cuenta por el concepto erróneo de que en nuestra población la prevalencia de MNT es baja 5,6,8,17,23,28,31.
A pesar de ser un número reducido de pacientes y de ser solo pacientes hospitalizados, nuestro grupo aporta datos sobre el comportamiento epidemiológico de las infecciones por MNT, especialmente en pacientes con inmunosupresión. Esto nos obliga en nuestras instituciones a tener en cuenta los factores de riesgo y comorbilidades asociados a las infecciones por MNT, a pensar en ellas dentro de los diagnósticos diferenciales y a implementar profilaxis para las mismas cuando estas estén indicadas, situaciones que no son norma en nuestra práctica.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de intereses
Los autores declaran que no tienen conflictos de intereses ni recibieron dinero de ninguna institución. El Hospital Pablo Tobón Uribe ofreció al grupo investigador todo el apoyo logístico necesario para llevar a cabo la recolección de datos y elaboración del artículo de investigación. El protocolo de investigación fue aprobado por el Comité de Investigaciones y Ética en Investigaciones del Hospital Pablo Tobón Uribe.
* Autor para correspondencia. Correos electrónicos: frmontufar@yahoo.com, frmontufar@gmail.com (F.E. Montúfar).
Bibliografía
1. WHO | Global tuberculosis control 2011 [Internet]. WHO. Disponible en: http://www.who.int/tb/publications/global report/2011/gtbr11 full.pdf [ Links ]
2. Mostowy S, Behr MA. The origin and evolution of Mycobacterium tuberculosis. Clin Chest Med. 2005;26(2):207-16, v-vi. [ Links ]
3. Chien HP, Yu MC, Wu MH, Lin TP, Luh KT. Comparison of the BACTEC MGIT 960 with Löwenstein-Jensen medium for recovery of mycobacteria from clinical specimens. Int J Tuberc Lung Dis.2000;4(9):866-70. [ Links ]
4. Lu D, Heeren B, Dunne WM. Comparison of the automated mycobacteria growth indicator tube system (BACTEC 960/MGIT) with Löwenstein-Jensen medium for recovery of mycobacteria from clinical specimens. Am J Clin Pathol. 2002;118(4):542-5. [ Links ]
5. Tortoli E. Clinical manifestations of nontuberculous mycobacteria infections. Clin Microbiol Infect. 2009;15:906-10. [ Links ]
6. Field SK, Cowie RL. Lung disease due to the more commonnon tuberculous mycobacteria. Chest. 2006;129(6):1653-72. [ Links ]
7. Runyon EH. Anonymus micobacteria in pulmonary disease. Med Clin North Am. 1959;43:273-90. [ Links ]
8. García García JM, Palacios Gutiérrez JJ, Sánchez Antuña AA. Infecciones respiratorias por micobacterias no tuberculosas. Arch Bronconeumol. 2005;41(4):206-19. [ Links ]
9. Primm TP, Lucero CA, Falkinham 3rd JO. Health impacts of environmental mycobacteria. Clin Microbiol Rev.2004;17(1):98-106. [ Links ]
10. Falkinham 3rd JO. Nontuberculous mycobacteria in the environment. Clin Chest Med. 2002;23(3):529-51. [ Links ]
11. De Groote MA, Huitt G. Infections due to rapidly growing mycobacteria. Cin Infect Dis. 2006;42(12):1756-63. [ Links ]
12. Falkinham 3rd JO. Epidemiology of infection by nontuberculous mycobacteria. Clin Microbiol Rev. 1996;9(2):177-215. [ Links ]
13. Alcaide F, Esteban J. Infecciones cutáneas y de partes blandas por micobacterias no tuberculosas. Enferm Infecc Microbiol Clin. 2010;28 supl1:46-50. [ Links ]
14. García L, Garzón M, Orjuela D, Mejía G, Llerena C. Micobacterias no tuberculosas asociadas a procedimientos de mesoterapia en Colombia, 2004-2007. Infectio. 2010;14(2):93-6. [ Links ]
15. Correa NE, Catano JC, Mejía GI, Realpe T, Orozco B, Estrada S, et al. Outbreak of mesotherapy-associated cutáneous infections caused by Mycobacterium chelone in Colombia. Jpn J Infect Dis.2010;63:143-5. [ Links ]
16. Solar M, Salomón M, Bravo F, Seas C, Gotuzzo E, Culqui D, et al. Infección cutánea por micobacterias atípicas de crecimiento rápido (MACR) debido a mesoterapia cosmética. Reporte de casos y revisión de la literatura. Folia Dermatol Perú.2005;16(3):127-35. [ Links ]
17. Murcia-Aranguren M, Gómez-Marin J, Alvarado F, Bustillo J, Mendivelson E, Gómez B, et al. Frequency of tuberculous and non-tuberculous mycobacteria in HIV infected patients from Bogota, Colombia. BMC Infect Dis. 2001;1:21. [ Links ]
18. Chastain M, Buckley J, Russo G. Infección por el complejo Mycobacterium chelonae/abscessus en un paciente con trasplante hepático. Int J Dermatol. 2001;40:769-74. [ Links ]
19. Lesmes BL, Ramírez AF, Rolon M, Castro E. Mycobacterium marinum y lesión verrugosa simulando carcinoma escamocelular. Rev Col Cancerologia. 2004;8(2):45-51. [ Links ]
20. Horsburgh Jr CR. Epidemiology of disease caused by non-tuberculosis micobacteria. Semin Respir Infect. 1996;11(4):244-51. [ Links ]
21. Gutiérrez ME, Rey RJ, Vicente A, Montoto M, Hoffman M. Lady Windermere syndrome. Female by nature. Medicina (B Aires).2009;69 1 Pt 2:167-9. [ Links ]
22. Ellis SM. The spectrum of tuberculosis and non-tuberculous mycobacterial infection. Eur Radiol. 2004;14 Suppl 3:E34-42. [ Links ]
23. Crespo MP, Corral R, Alzate A. Micobacterias no tuberculosas en personas VIH positivas y en personas sin factores de riesgo a la infección. Colombia Med. 1997;28:136-216. [ Links ]
24. Estrada S, Díaz J, Jaramillo E, Mejía G, Orozco B, Posada P, et al. Un brote por Mycobacterium chelonae, subespecie abscessus asociado a hiposensibilización en pacientes alérgicos. Acta Méd Colomb. 1992;17(2):72-6. [ Links ]
25. Hoefsloot W, van Ingen J, Andrejak C, Angeby K, Bauriaud R,Bemer P, et al. The geographic diversity of nontuberculous mycobacteria isolated from pulmonary samples: An NTM-NET collaborative study. Eur Respir J. 2013;42(6):1604-13, doi:10.1183/09031936.00149212. Epub 2013 Apr 18. [ Links ]
26. Van Ingen J. Diagnosis of nontuberculous mycobacterial infections. Semin Respir Crit Care Med. 2013;34(1):103-9, doi:10.1055/s-0033-1333569. Epub 2013 Mar 4. [ Links ]
27. Fusco da Costa AR, Falkinham 3rd JO, Lopes ML, Barretto AR, Felicio JS, Sales LH, et al. Occurrence of nontubercuous mycobacterial pulmonary infection in an endemic area of tuberculosis. PLoS Negl Trop Dis. 2013;7(7):e2340, doi:10.1371/journal.pntd.0002340. Print 2013. [ Links ]
28. Alvarez-Uria G. Lung disease caused by nontuberculous mycobacteria. Curr Opin Pulm Med. 2010;16(3):251-6, doi:10.1097/MCP.0b013e3283378fa3. [ Links ]
29. Castro CM, Puerto G, García LM, Orjuela DL, Polo CL, Garzón MC, et al. Molecular identification of non-tuberculous mycobacteria. Biomedica. 2007;27(3):439-46. [ Links ]
30. Herdman AV, Steele Jr JC. The new mycobacterial species–emerging or newly distinguished pathogens. Clin Lab Med.2004;24(3):651-90, vi. [ Links ]
31. Griffith DE, Aksamit T, Brown-Elliott BA, Catanzaro A, Daley C, Gordin F, et al. An official ATS/IDSA statement: Diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. Am J Respir Crit Care Med. 2007;175(4):367-416. [ Links ]













