Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Infectio
versão impressa ISSN 0123-9392
Infect. vol.19 no.3 Bogotá set./dez. 2015
https://doi.org/10.1016/j.infect.2014.11.004
REPORTE DE CASO
http://dx.doi.org/10.1016/j.infect.2014.11.004
Curso clínico de pacientes de trasplante autógeno de médula ósea portadores del virus linfotrópico humano
Juan Carlos Pineda a, * , Juan Diego Vélez b , Pablo Andrés Moncada b , Fernando Rosso b y Francisco Javier Jaramillo c
a Posgrado de Medicina Interna, Universidad ICESI, Fundación Valle del Lili, Cali, Colombia
b Servicio de Enfermedades Infecciosas, Fundación Valle del Lili, Cali, Colombia
c Servicio de Trasplante de Médula Ósea, Fundación Valle del Lili, Cali, Colombia
Recibido el 11 de enero de 2014; aceptado el 6 de noviembre de 2014
Disponible en Internet el 11 de marzo de 2015
Resumen La infección por virus linfotrópico humano 1 es frecuente en la costa pacífica colombiana y se ha relacionado con leucemia/linfoma de células T del adulto y mielopatía en una proporción baja de los seropositivos. En pacientes con trasplante de órganos sólidos pareciera que estas patologías se desarrollan más rápidamente que en los otros escenarios pero se desconoce el curso de la infección por virus linfotrópico humano 1 en trasplante de médula ósea por lo cual describimos 3 casos de pacientes seropositivos y linfoma que fueron llevados a trasplante autógeno. Uno de ellos tuvo recaída de su patología hematológica y falleció a consecuencia de la misma, otra paciente presentó un cuadro compatible con mielopatía asociada al virus linfotrópico humano 1 y la última, una enfermedad injerto contra hospedero. En las personas seropositivas y que necesitan un trasplante de células hematopoyéticas se requiere una búsqueda activa de este virus para hacer seguimientos y evaluar su impacto real en los desenlaces y saber si el curso de la infección podría cambiar con el régimen condicionante del trasplante.
PALABRAS CLAVE
Virus linfotrópico T humano 1; Trasplante autógeno; Linfoma; Paraparesia espástica tropical; Enfermedad injerto contra huésped
© 2014 ACIN. Publicado por Elsevier España, S.L.U. Este es un artículo Open Access bajo la licencia CC BY-NC-ND ( http://creativecommons.org/licenses/by-nc-nd/4.0/ ).
Clinical evolution of carriers of human T-lymphotropic virus 1 after autologous hematopoietic stem cell transplantation
Abstract Human T-lymphotropic virus 1 infection is common in Colombia´s Pacific coast and has been linked to adult T-cell leukemia/lymphoma and human T-lymphotropic virus 1-associated myelopathy in a low percentage of cases. In patients with solid organ transplantation, these diseases occur more quickly than in other scenarios but in bone marrow transplantation the true impact is unknown. We describe 3 seropositive patients with lymphoma who underwent autologous stem cell transplantation; in one case there was relapse of the hematologic malignancy and death occurred as a result. Another patient had symptoms compatible with human T-lymphotropic virus 1-associated myelopathy and the last patient had a graft vs. host disease. In seropositive people who need hematopoietic cell transplantation, an active search for this virus is required to be able to follow and assess the virus´s impact on outcomes, as well as to assess whether the evolution could change according to the transplant conditioning regimen.
KEYWORDS
Human T-lymphotropic virus 1; Autologous Transplantation Lymphoma; Spastic paraparesis tropical; Graft vs. host disease
© 2014 ACIN. Published by Elsevier España, S.L.U. This is an open access article under the CC BY-NC-ND license ( http://creativecommons.org/licenses/by-nc-nd/4.0/).
0123-9392/© 2014 ACIN. Publicado por Elsevier España, S.L.U. Este es un artículo Open Access bajo la licencia CC BY-NC-ND ( http://creativecommons.org/licenses/by-nc-nd/4.0/ ).
Introducción
La infección por virus linfotrópico humano 1 (HTLV-1) afecta a 15-20 millones de personas en el mundo y su prevalencia varía del 37% en algunas regiones de Japón al 0,0039% en Francia 1 ; en Colombia es frecuente en la costa pacífica (2,8-5,3%) 2 pero menos en ciudades como Bogotá (0,07%) 3 . La importancia de este virus es su asociación con leucemia/ linfoma de células T del adulto (ATL) y mielopatía asociada al HTLV-1 (HAM), también con la hiperinfección por Strongyloides stercoralis la cual puede tener un curso complejo en pacientes hematológicos 4. En trasplante de médula ósea (TMO) no está clara la implicación de la presencia del HTLV-1 luego de la fijación del injerto y es difícil saber si la infección es pasada, activa, en progresión o reactivación pues solo disponemos de una prueba de IgG para su diagnóstico. Presentamos 3 pacientes seropositivos llevados a TMO con sus diferentes escenarios y desenlaces clínicos.
Descripción de los casos
En nuestra institución, del 2011 al 2013 hemos realizado 92 TMO en adultos, 79 autógenos, 8 alogénicos de donante familiar y 5 de cordón umbilical. En la valoración pretrasplante se tamizan anticuerpos contra HTLV 1 y 2 por método de inmunoanálisis quimioluminiscente de micropartículas y se confirma con inmunoanálisis en látex cuando son positivos. Esta prueba no distingue entre los 2 serotipos y solo muestra la presencia de IgG sin dar una relación directa con la carga viral. En la tabla 1 están las principales características de 3 pacientes con linfoma y respuesta parcial a quimioterapia de primera línea quienes fueron llevados a TMO autógeno con prueba confirmatoria positiva para HTLV.
Caso 1
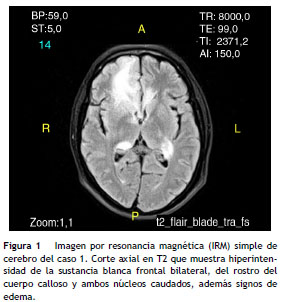
Tenía un diagnóstico inicial de linfoma difuso de células B grandes en 2010 sin respuesta a quimioterapia de primera línea, se revisó nuevamente la histopatología en 2012 y se reclasificó como un linfoma de células T anaplásico ALK negativo; con este último diagnóstico se hizo el TMO. En el día 48 postrasplante presenta convulsiones tónico-clónicas generalizadas y adenomegalias. El hemograma mostraba 4.040 leucocitos/ _ l, 2.290 neutrófilos/ _ l, 930 linfocitos/ _ l, hemoglobina 9,7 g/dl y plaquetas 126.000/ _ l, deshidrogenasa láctica 1.067 U/l (valor normal hasta 214 U/l). La imagen de resonancia magnética (IRM) cerebral tenía una lesión de aspecto neoproliferativo ( fig. 1 ) y el análisis de líquido cefalorraquídeo fue negativo para infecciones, pero la citometría evidenciaba neoplasia de fenotipo T con expresión de CD3, CD5 y CD4. Se consideró una recaída del linfoma en el sistema nervioso central y se trató con radioterapia y esteroides con mala evolución pues fallece en el día 78 por progresión de la enfermedad.
Caso 2
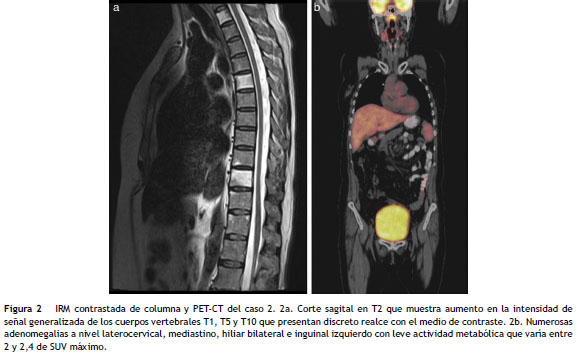
En el día 71 postrasplante presentó síntomas respiratorios y urinarios, no se documentó ningún germen y se investigó un síndrome relacionado con el injerto; recibió un ciclo corto de esteroides, con mejoría. Nuevamente se hospitalizó en el día 270 por parestesias y disminución de la fuerza en miembros inferiores, dificultad para la micción y estreñimiento, tenía fuerza 4/5 de predominio distal, hiperreflexia generalizada, signo de Hoffman positivo y Babinski bilateral, sin nivel sensitivo. El hemograma y la deshidrogenasa láctica eran normales. La IRM de columna no mostraba signos de mielopatía ( fig. 2 a). El líquido cefalorraquídeo fue negativo para infecciones y células tumorales pero no teníamos disponible el análisis para HTLV. En la electroforesis de proteínas se observó una tenue banda en la región gamma. Se realizó una tomografía por emisión de positrones (PET-CT) donde se vieron numerosas adenomegalias ( fig. 2 b) pero estas no eran susceptibles de biopsia por su tamaño y ubicación. Se consideró una HAM y se administraron esteroides, con mejoría parcial; actualmente está en seguimiento.
Caso 3
En el día 4 postrasplante presentó diarrea con bacteriemia por Escherichia coli productora de _ -lactamasas de espectro extendido y recibió tratamiento con meropenem. En el día 20 tuvo un rash eritematoso pruriginoso generalizado. El hemograma mostraba 2.360 leucocitos/ _ l, 1.610 neutrófilos/ _ l, 450 linfocitos/ _ l, hemoglobina 10,2 g/dl y plaquetas 12.000/ _ l, deshidrogenasa láctica 362 U/l, bilirrubinas normales, AST 40,5 U/l (valor normal hasta 32 U/l) y ALT 36,9 U/l (valor normal hasta 33 U/l). Se investigó una toxicodermia relacionada con las sulfas usadas en la profilaxis pero se tomó una biopsia de piel y fue compatible con enfermedad de injerto contra huésped; se dieron esteroides con mejoría y continuó en seguimiento ambulatorio.
Revisión de la literatura y discusión
La mayoría de los portadores del HTLV-1 permanecen asintomáticos y durante su vida el riesgo de ATL es del 1-5% y de HAM del 0,3-4% 1,4 . En el primer escenario hay una expansión clonal por los genes Tax/HBZ e incorporación del ADN proviral en los CD4, aumentando las mitosis, mientras para el segundo los CD8 producen citocinas que dañan la mielina y los axones 4,5. Aunque la transmisión se realiza principalmente por lactancia, relaciones sexuales y transfusiones 4, se ha reportado a través de órganos sólidos, con aparición de trastornos linfoproliferativos y una mielopatía de progresión más rápida 6,7. Hay también casos de ATL derivada del donante 8 y HAM después de TMO 9. El uso de ciclosporina ha sido considerado un factor que acelera las manifestaciones clínicas de esta infección 6; de hecho en modelos animales su empleo antes de la primoinfección aumenta la expresión del ADN proviral pero si se usa después del contacto con el virus se disminuye dicha situación 10.
Sin embargo, la tamización para HTLV-1 previa a un trasplante no es una práctica generalizada y va de la mano de la prevalencia pues la especificidad de las pruebas es baja donde no es frecuente el virus 6,11, pero dado el riesgo de transmisión a través de injertos se ha empezado a realizar más frecuentemente 7. La utilidad de evaluar al HTLV en trasplante de órganos sólidos podría implicar la profilaxis con zidovudina o raltegravir, tal como han propuesto algunos autores 11, pero en pacientes con linfoma sometidos a TMO esto no es claro y no hay evidencia sólida que permita recomendar esta conducta, más aún si no son del tipo ATL.
En los casos presentados vemos escenarios clínicos disímiles. Por un lado, la disminución de la carga proviral con los inmunosupresores haría una recaída de la ATL menos probable, como se vio en un reporte donde hubo supervivencia libre de enfermedad de 12 años 12, pero en nuestro paciente la recaída fue rápida y fatal. Nuestra otra paciente presentó HAM a los 9 meses tras el TMO mientras en otro reporte se dio después de 3 años 9. Finalmente, en nuestro último caso la enfermedad injerto contra huésped es muy llamativa en un TMO autógeno pues es un evento raro que no ha sido reportado por otros autores 13 .
En una serie de casos se observó que el TMO autógeno no aumentó la supervivencia de los pacientes con ATL, sin embargo, no analizaron el impacto del HTLV-1 en este desenlace 14; pero un estudio más grande de TMO alogénico encontró que la seropositividad del donante sí la disminuía en forma significativa 15. Por otro lado, un análisis retrospectivo encontró desaparición de la carga proviral tras el TMO alogénico en todos los casos aunque con reaparición en algunos de ellos después de los 36 meses, pero no pudieron establecer relación con recaídas 16; dicho efecto se puede asociar con la reconstitución inmune postrasplante que lleva al reconocimiento de la proteína viral HBZ con una respuesta inmunoespecífica del injerto contra el HTLV-1 17 .
Con nuestros datos actuales no podemos establecer el papel real del HTLV en los pacientes con cualquier tipo de linfoma sometidos a TMO pero se puede considerar latente el riesgo de inducir neoplasia o recaídas 8. Para el tratamiento están disponibles el interferón- _ que es capaz de suprimir la expresión genética del virus y llevar a una interrupción del ciclo celular y combinado con zidovudina a apoptosis de las células infectadas 18,19, el raltegravir que disminuye la carga proviral aunque no más de 6 meses 20, y también la prosultiamina que podría tener un efecto en el número de copias y la disfunción motriz en pacientes con HAM 21. Sin embargo, en la práctica no hay eficacia contundente con dichas intervenciones 4 y por eso la utilidad de encontrar el virus es discutible; en nuestros casos ningún paciente recibió antirretrovirales antes ni después del TMO. Aun así, recomendamos la búsqueda rutinaria de los anticuerpos contra HTLV-1 en los pacientes y donantes en países de alta prevalencia para así poder determinar el verdadero impacto de esta infección en el desenlace postrasplante y definir la necesidad de pruebas de laboratorio adicionales como la carga proviral.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
* Autor para correspondencia.
Correo electrónico: jpinedaruiz@gmail.com (J.C. Pineda).
Bibliografía
1. Proietti F, Carneiro-Proietti A, Catalan-Soares B, Murphy E. Global epidemiology of HTLV-I infection and associated diseases. Oncogene. 2005;24:6058-68. [ Links ]
2. Gessain A, Cassar O. Epidemiological aspects and world distribution of HTLV-1 infection. Front Microbiol. 2012;3:388. [ Links ]
3. Martínez-Nieto O, Isaza-Ruget M, Rangel-Espinosa N, Morales- Reyes O. Seroprevalencia de anticuerpos para virus linfotrópicos humanos (HTLV I/II) en donantes de sangre de una Clínica de Bogotá, Colombia. 1999-2004. Rev salud pública. 2007;9:253-61. [ Links ]
4. Verdonck K, González E, van Dooren S, Vandamme A, Vanham G, Gotuzzo E. Human T-lymphotropic virus 1: Recent knowledge about an ancient infection. Lancet Infect Dis. 2007;7:266-81. [ Links ]
5. Cook L, Elemans M, Rowan A, Asquith B. HTLV-1: Persistence and pathogenesis. Virology. 2013;435:131-40. [ Links ]
6. Glowacka I, Korn K, Potthoff S, Lehmann U, Kreipe H, Ivens K, et al. Delayed seroconversion and rapid onset of lymphoproliferative disease after transmission of human T-cell lymphotropic virus type 1 from a multiorgan donor. Clin Infect Dis. 2013;57:1417-24. [ Links ]
7. Toro C, Benito R, Aguilera A, Bassani S, Rodríguez C, Calderón E, et al. Infection with human T lymphotropic virus type I in organ transplant donors and recipients in Spain. J Med Virol. 2005;76:268-70. [ Links ]
8. Tamaki H, Matsuoka M. Donor-derived T-cell leukemia after bone marrow transplantation. N Engl J Med. 2006;354: 1758-9. [ Links ]
9. Emmanouilides C, Territo M. HTLV-I-associated myelopathy following allogeneic bone marrow transplantation. Bone Marrow Transpl. 1999;24:205-6. [ Links ]
10. Haynes R, Ware E, Premanandan C, Zimmerman B, Yu L, Phipps A, et al. Cyclosporine-induced immune suppression alters establishment of HTLV-1 infection in a rabbit model. Blood. 2010;115:815-23. [ Links ]
11. Armstrong M, Corbett C, Rowe I, Taylor G, Neuberger J. HTLV-1 in solid-organ transplantation: Current challenges and future management strategies. Transplantation. 2012;94: 1075-84. [ Links ]
12. Tholouli E, Liu Yin J. Successful treatment of HTLV-1-associated acute adult T-cell leukemia lymphoma by allogeneic bone marrow transplantation: A 12 year follow-up. Leuk Lymphoma. 2006;47:1691-2. [ Links ]
13. Van Besien K, Loberiza F, Bajorunaite R, Armitage J, Bashey A, Burns L, et al. Comparison of autologous and allogeneic hematopoietic stem cell transplantation for follicular lymphoma. Blood. 2003;102:3521-9. [ Links ]
14. Phillips A, Willim R, Savage D, Horwitz S, Isola L, Zain J, et al. A multi-institutional experience of autologous stem cell transplantation in North American patients with human T-cell lymphotropic virus type-1 adult T-cell leukemia/lymphoma suggests ineffective salvage of relapsed patients. Leuk Lymphoma. 2009;50:1039-42. [ Links ]
15. Hishizawa M, Kanda J, Utsunomiya A, Taniguchi S, Eto T, Moriuchi Y, et al. Transplantation of allogeneic hematopoietic stem cells for adult T-cell leukemia: A nationwide retrospective study. Blood. 2010;116:1369-76. [ Links ]
16. Shiratori S, Yasumoto A, Tanaka J, Shigematsu A, Yamamoto S, Nishio M, et al. A retrospective analysis of allogeneic hematopoietic stem cell transplantation for adult T cell leukemia/lymphoma (ATL): Clinical impact of graftversus-leukemia/lymphoma effect. Biol Blood Marrow Transpl. 2008;14:817-23. [ Links ]
17. Narita T, Ishida T, Masaki A, Suzuki S, Ito A, Mori F, et al. HTLV-1 bZIP factor-specific CD4 T cell responses in adult T cell leukemia/lymphoma patients after allogeneic hematopoietic stem cell transplantation. J Immunol. 2014;192:940-7. [ Links ]
18. Cachat A, Chevalier S, Alais S, Ko N, Ratner L, Journo C, et al. Alpha interferon restricts human T-lymphotropic virus type 1 and 2 de novo infection through PKR activation. J Virol. 2013;87:13386-96. [ Links ]
19. Kinpara S, Kijiyama M, Takamori A, Hasegawa A, Sasada A, Masuda T, et al. Interferon- _ (IFN- _ ) suppresses HTLV-1 gene expression and cell cycling, while IFN- _ combined with zidovudine induces p53 signaling and apoptosis in HTLV-1-infected cells. Retrovirology. 2013;10:52. [ Links ]
20. Treviño A, Parra P, Bar-Magen T, Garrido C, de Mendoza C, Soriano V. Antiviral effect of raltegravir on HTLV-1 carriers. J Antimicrob Chemother. 2012;67:218-21. [ Links ]
21. Nakamura T, Matsuo T, Fukuda T, Yamato S, Yamaguchi K, Kinoshita I, et al. Efficacy of prosultiamine treatment in patients with human T lymphotropic virus type I-associated myelopathy/tropical spastic paraparesis: Resultsfrom an open-label clinical trial. BMC Med. 2013;11:182. [ Links ]













