Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.20 no.1 Bogotá Jan./March 2016
https://doi.org/10.1016/j.infect.2015.05.001
ORIGINAL
http://dx.doi.org/10.1016/j.infect.2015.05.001
Bacteremia por Staphylococcus coagulasa negativo con concentración inhibitoria mínima para vancomicina ≥ 2
Franco E. Montúfar Andradea,e, * , Camilo A. Madrid Muñozb,e, Juan P. Villa Franco b , e , Laura M. Diaz Correa b,e, Juan D. Vélez Rivera b,e, Juliana Vega Miranda b , e , Ana María Bedoya Londoñoa, John J. Zuleta Tobón c , María C. Montufar Pantojad,e y Grupo de Investigación GIERI
a Hospital Pablo Tobón Uribe, Medellín, Colombia
b Facultad de Medicina, Posgrado Medicina Interna, Universidad Pontificia Bolivariana, Medellín, Colombia
c Unidad de Investigación de Epidemiología Clínica, Hospital Pablo Tobón Uribe, Medellín, Colombia
d Facultad de medicina, Pregrado, Universidad Pontificia Bolivariana, Medellín, Colombia
e Grupo de Investigación en Enfermedades Respiratorias e Infecciosas (GIERI), Medellín, Colombia
Recibido el 21 de enero de 2015; aceptado el 19 de mayo de 2015
Disponible en Internet el 9 de septiembre de 2015
Resumen
Introducción: La bacteremia por Staphylococcus coagulasa negativo (SCN) es una infección que actualmente genera significativa morbimortalidad dado el tipo de pacientes a los que afecta y el cambio en el perfil de susceptibilidad a los antibióticos.
Objetivo: Describir características de los pacientes con aislamientos de SCN en sangre con CIM para vancomicina ≥2.
Metodología: Estudio observacional descriptivo en pacientes hospitalizados ≥ 15 años.
Resultados: De 130 aislamientos, 38 (29,23%) tenían CIM para vancomicina ≥ 2. La mediana de edad fue de 54 años y la razón hombre:mujer, de 1,37:1.
Las especies más frecuentes fueron: S. epidermidis (71,1%), S. haemolyticus (13,2%) y S. hominis (7,9%). El 44,7% tenían antecedentes de inmunosupresión, siendo las más importantes: neoplasias (28,9%), enfermedad reumatológica (5,2%) y VIH (2,6%). El 81,5% tenían accesos vasculares, el 97,3% antecedente de hospitalización previa y el 60,5% habían requerido manejo en la UCI. El 81,4% tuvieron exposición previa a antibióticos, y los más utilizados fueron: betalactámicos (78,9%) y vancomicina (50%). En el 2,6% se documentó endocarditis infecciosa.
De los aislamientos de SCN con CIM para vancomicina ≥2 µg/ml, el 26,3% fueron sensibles a meticilina. Los principales tratamientos recibidos fueron: daptomicina (31,5%), vancomicina (21%), linezolid (15,7%) y betalactámicos (10,5%). Se utilizó terapia combinada en el 10,5%. La mortalidad general fue del 15,8%, y la mortalidad atribuible, del 33,3%.
Conclusión: Un porcentaje considerable de aislamientos tenían heterorresistencia para vancomicina. La bacteremia estuvo asociada con accesos vasculares, hospitalizaciones previas, tratamientos en cuidado intensivo y exposición previa a antibióticos. La inmunosupresión es la comorbilidad más importante, y la mortalidad es significativa.
PALABRAS CLAVE
Staphylococcus coagulasa negativo; Vancomicina; Concentraciones inhibitorias mínimas; Bacteremia
© 2015 ACIN. Publicado por Elsevier España, S.L.U. Este es un artículo Open Access bajo la licencia CC BY-NC-ND ( http://creativecommons.org/licenses/by-nc-nd/4.0/ ).
Coagulase-negative Staphylococcus bacteremia with Vancomycin minimum inhibitory concentrations ≥ 2
Abstract
Introduction: Currently, coagulase-negative Staphylococcus (CNS) bacteremia is an infection that leads to significant morbidity and mortality given the type of patients affected and the recent changes in antimicrobial susceptibility.
Objective: To describe the characteristics of patients with CNS blood isolates with vancomycin MIC ≥ 2.
Methodology: Descriptive observational study on hospitalised patients ≥ 2 15 years of age.
Results: Of 130 isolates, 38 (29,23%) contained vancomycin MIC ≥ 2. The median age was 54 years and the male:female ratio was 1.37:1.
The most frequent species were S. epidermidis (71.1%), S. haemolyticus (13.2%) and S. hominis (7.9%). Some 44.7% of patients had a history of immunosuppression, including: neoplasms (28.9%), rheumatologic disease (5.2%) and HIV (2.6%). Some 81,5% had vascular access; 97.3% had previous hospitalisations and 60.5% had required intensive care. A total of 81.4% of the patients had prior exposure to antibiotics and the most commonly used were beta-lactams (78.9%) and vancomycin (50%). Infective endocarditis was documented in 2.6%.
Of the CNS isolates with vancomycin MIC ≥ 2, 26.3% were sensitive to methicillin. The main treatments received were: daptomycin (31.5%), vancomycin (21%), linezolid (15.7%) and betalactams (10.5%). Combined therapy was performed in 10.5%. The overall mortality was 15.8% and attributable mortality was 33.3%.
Conclusion: A significant proportion of isolates were hetero-resistant to vancomycin. The bacteremia was associated with vascular access, previous hospitalisations, intensive care treatments and prior antibiotic exposure. Immunosuppression is the most important comorbidity and mortality is significant.
KEYWORDS
Coagulase negative Staphylococcus ; Vancomycin; Minimum inhibitory concentration; Bacteremia
© 2015 ACIN. Published by Elsevier España, S.L.U. This is an open access article under the CC BY-NC-ND license
http://dx.doi.org/10.1016/j.infect.2015.05.001
0123-9392/© 2015 ACIN. Publicado por Elsevier España, S.L.U. Este es un artículo Open Access bajo la licencia CC BY-NC-ND
( http://creativecommons.org/licenses/by-nc-nd/4.0/ ).
Introducción
En décadas anteriores, los aislamientos microbiológicos de Staphylococcus coagulasa negativo (SCN) no eran centro de atención, pues la gran mayoría de casos eran considerados contaminación. A través del tiempo se les ha reconocido como causa importante de infecciones del torrente sanguíneo, especialmente en poblaciones inmunosuprimidas o pacientes con dispositivos médicos como accesos vasculares y prótesis, entre otros, que alteran las barreras naturales 1 .
Actualmente en los países desarrollados la gran mayoría de aislamientos microbiológicos intrahospitalarios en sangre son por cocos grampositivos, incluyendo los aislamientos por SCN, que se encuentran en los primeros 10 lugares 2-4, y en algunos estudios es la primera causa de bacteremia nosocomial 5 .
Entre el 70 y el 80% de los aislamientos de SCN son causados por SCN resistentes a meticilina 6, por lo cual se considera que el manejo empírico de primera línea sean los glucopéptidos (vancomicina y teicoplanina). Sin embargo, aunque es poco usual, también existen descripciones de surgimiento de SCN resistentes a vancomicina o con concentraciones inhibitorias mínimas (CIM) cada vez más altas, similar a lo descrito para S. aureus , lo que conlleva implícito pérdida de la actividad antibiótica in vivo de los glucopéptidos 7 . A este respecto, el estudio realizado por Fajardo Olivares et al. 8 en unidades de cuidados intensivos (UCI) en España identificó los aislamientos en sangre de SCN, y al hacer análisis de sensibilidad a los diferentes antibióticos encontró que en el 61% de los casos había pérdida de la sensibilidad a vancomicina. De manera similar, Ahlstrand et al. 9, en el estudio realizado en Suecia en pacientes con neoplasia hematológica, al realizar el análisis de los aislamientos de SCN durante 3 décadas encontraron que el 28,1% tenían una CIM para vancomicina ≥ 2 mg/l. En Colombia no se encontraron reportes de bacteremias por SCN en adultos.
En nuestra institución, por ser un centro de referencia de alta complejidad, nos enfrentamos cada vez con mayor frecuencia a infecciones por SCN tanto de torrente sanguíneo como de otros sitios, y es ante la necesidad de conocer las características clínicas y microbiológicas en nuestra institución y en nuestro medio que el grupo de investigación GIERI decidió realizar un estudio sobre las características demográficas, microbiológicas, clínicas y los desenlaces de los pacientes con aislamientos en sangre de SCN con CIM para vancomicina ≥ 2.
Metodología
Tipo de estudio
Estudio observacional descriptivo en pacientes hospitalizados ≥ 15 años con aislamiento en sangre de Staphylococcus coagulasa negativo (SCN) en el Hospital Pablo Tobón Uribe (HPTU), en un periodo de tiempo de 26 meses.
Población
Se incluyeron pacientes mayores de 15 años, sin discriminación de sexo, con primer aislamiento microbiológico en sangre de SCN entre el 1 de enero de 2010 y el 29 de febrero de 2012, atendidos en el HPTU, centro de cuarto nivel localizado en la ciudad de Medellín, Antioquia, Colombia.
Se excluyeron los pacientes con aislamiento de SCN con CIM para vancomicina < 2 µg/ml o que no tenían en la historia clínica la información de las variables demográficas, clínicas, microbiológicas y desenlaces durante la hospitalización en la cual se realizó el aislamiento.
Recolección de datos
Los pacientes con aislamiento microbiológico en sangre de SCN se identificaron en nuestra institución a través de la base de datos del software WHONET 10 . Se evaluó la historia clínica de cada uno de ellos para identificar las variables (demográficas, clínicas, microbiológicas y desenlaces), se incluyeron en el análisis solo los casos con primer aislamiento en sangre de SCN.
El laboratorio de microbiología del HPTU trabaja con el sistema VITEK ® 2 de la casa comercial Biomerieux. La metodología utilizada para definir la CIM es microdilución en caldo con las tarjetas AST-P577. Se confirmó la CIM para vancomicina como sensible, intermedia o resistente según el protocolo que sugiere el Clinical and Laboratory Standards Institute (CLSI) 11 . Los puntos de corte para clasificar la susceptibilidad (resistente, sensible o intermedio) de los SCN según las CIM se definieron acorde a las recomendaciones del CLSI 2012 11, y se evaluó la susceptibilidad a meticilina, vancomicina, clindamicina, trimetoprim sulfametoxazol, linezolid, rifampicina, tetraciclina, quinupristín, dalfopristín, tetraciclina y quinolonas.
Análisis estadístico
Las variables cuantitativas se expresaran como mediana y rango intercuartílico (RIQ) (P 25-75 ). Las variables cualitativas, como frecuencias absolutas y relativas. Se utilizó el programa Microsoft Office Excel 2010.
La conducción de esta serie de casos fue orientada según las recomendaciones de Dekkers et al. 12.
El protocolo de investigación fue aprobado por el Comité de Investigaciones y Ética en Investigaciones del Hospital Pablo Tobón Uribe.
Resultados
Origen y tipo de aislamientos de Staphylococcus coagulasa negativo
Entre el 1 de enero de 2010 y el 29 de febrero de 2012 se identificaron en el HPTU un total de 1.008 aislamientos de SCN en cualquier muestra y cualquier edad ( fig. 1 ), de los cuales las 3 especies más frecuentes fueron Staphylococcus epidermidis (541; 54%), Staphylococcus hominis ss. hominis (145; 14%) y Staphylococcus haemolyticus (103; 10%). De estos 1.008 aislamientos, 880 corresponden a pacientes hospitalizados, de los cuales en 271 (30%) la CIM para vancomicina fue ≥ 2 µg/ml. De estos 271 aislamientos, 266 (98%) tenían CIM de 2 µg/ml y 5 (2%) tenían CIM de 4 µg/ml
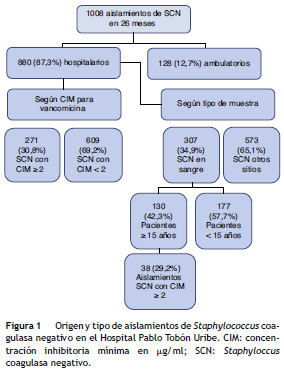
De los 880 aislamientos de pacientes hospitalizados, se identificaron 307 (34,9%) aislamientos en sangre en pacientes de todas las edades; 130 (42,3%) de los aislamientos corresponden a pacientes ≥ 15años. De los aislamientos en ≥ 15años, 38 (29,2%) tenían CIM para vancomicina ≥ 2 µg/ml, 100% de los casos con CIM = 2 µg/ml ( fig. 1 ).
Aislamientos en sangre de Staphylococcus coagulasa negativo en pacientes hospitalizados ≥ 15 años
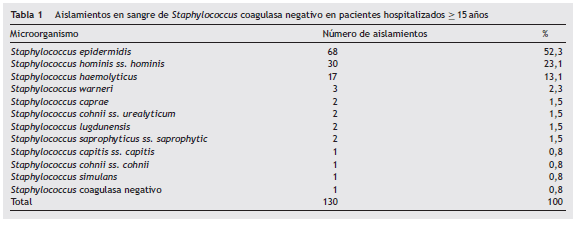
De los 130 aislamientos de SCN en sangre, las especies más frecuentes fueron S. epidermidis (68; 52%), S. hominis ss. hominis (30; 23%), S. haemolyticus (17; 13%), S. warneri (3; 2,3%) y S. caprae (2; 1,5%) ( tabla 1 ).
Aislamientos en sangre de Staphylococcus coagulasa negativo con concentraciones inhibitorias mínimas para vancomicina ≥ 2 µg/ml, en pacientes hospitalizados ≥ 15 años
Las características generales de los pacientes con aislamientos de SCN con CIM para vancomicina ≥ 2 µg/ml se muestran en la tabla 2 . La mediana de edad fue de 54 años RIQ (41 a 66,75), la relación hombre:mujer fue 1,37:1, la dependencia o área en donde el paciente se encontraba a la hora de la toma de la muestra fue: urgencias (13; 34,2%), salas de hospitalización general (11; 28,9%), UCI (8; 21,1%) y UCE (6; 15,8%); las 3 especies de SCN más frecuentes fueron S. epidermidis (27; 71,1%), S. haemolyticus (5; 13,2%) y S. hominis ss. hominis (3; 7,9%).
Respecto a las comorbilidades, se encontró de manera global que el 44,7% de los pacientes tenían causas de inmunosupresión. Dentro de estas, un paciente con virus de la inmunodeficiencia humana (VIH) (2,6%), un paciente trasplantado hepático (2,6%), 2 pacientes con enfermedad reumatológica en terapia inmunosupresora (5,3%), uso de inmunosupresores por otras causas en 2 (5,3%) y 11 pacientes con neoplasias (28,9%)
El uso de dispositivos o accesos vasculares invasivos (catéter venoso central, catéter central de inserción periférica y catéter arterial) previos o durante el aislamiento se encontró en 31 pacientes (81,6%). Como hallazgo llamativo, encontramos que 16 (42,1%) tenían antecedente de cirugía del tracto gastrointestinal. De los 38 pacientes, 37 (97,3%) tenían antecedente de al menos una hospitalización previa y 23 (60,5%) habían requerido manejo en la unidad de cuidados intensivos. En un paciente (2,6%) se documentó endocarditis infecciosa. La exposición previa a antibióticos se documentó en el 81,6% de los casos, y los antibióticos que con más frecuencia se utilizaron previamente fueron vancomicina (50%) y betalactámicos (78,9%). En el 52,6% de los casos se habían utilizado también otros antibióticos. Solo 7 (18,4%) pacientes no tenían antecedente de uso previo de antibióticos.
Los tratamientos instaurados para bacteremia fueron los siguientes: daptomicina, 31,6% (información de CIM en dos casos 0,94 y 0,125; sensibles acorde a las guías del CLSI); vancomicina, 21%; linezolid, 15,8%; betalactámicos, 10,5% (CIM para oxacilina ≤0,25 µg/ml); trimetoprimsulfametoxazol, 10,5% con CIM ≤10 µg/ml, y el 10,5% recibieron terapia combinada con vancomicina más aminoglucósido (5,2%) y vancomicina más clindamicina (5,2%).
La mortalidad general fue del 15,8%, y en solo 2 (33%) fue atribuible a la bacteremia por SCN; estos pacientes venían en tratamiento con vancomicina. Los otros pacientes fallecieron por otras causas; dentro de estas, en el 33% la causa de la muerte fue sepsis por gérmenes gramnegativos. En el 33% de los casos la bacteremia por SCN estaba resuelta al momento de la muerte.
Discusión
El surgimiento de SCN como causa importante de infección hospitalaria es una realidad que impacta en la morbimortalidad de los pacientes. Los hallazgos microbiológicos de los países en desarrollo, como los nuestros, difieren significativamente a los de los países desarrollados; en estos últimos predominan las infecciones por gérmenes grampositivos y la resistencia a los antimicrobianos, especialmente a vancomicina, es mucho mayor a la que encontramos generalmente en países como el nuestro 1-6 . En nuestros países predominan las infecciones por gérmenes gramnegativos, y es en ellos donde tenemos el mayor problema de resistencia bacteriana 6.
Del total de los aislamientos en sangre de SCN, identificamos que el 29,2% tenían CIM para vancomicina ≥ 2 µg/ml, a diferencia de otros estudios descritos en la literatura mundial, donde se acerca a valores superiores al 60% 8,9.
Las 3 principales especies de SCN con CIM para vancomicina ≥ 2 µg/ml más frecuentes en nuestra serie fueron S. epidermidis (71,1%), S. haemolyticus (13,2%) y S. hominis ss. hominis (7,9%), porcentajes muy similares a los descritos en otros estudios 8,13 .
Las principales áreas o dependencias donde los pacientes se encontraban hospitalizados al momento del aislamiento microbiológico en nuestro estudio fueron la UCI y la UCE, con el 21,1 y el 15,8% de los casos, respectivamente; cifras inferiores a las reportadas en otros estudios, donde los aislamientos en la UCI son de alrededor del 40% de los casos 8,14 .
El antecedente de inmunosupresión, la hospitalización en la UCI y la presencia de catéteres han sido previamente descritos como variables relacionadas con aislamiento en sangre de SCN 9,13,14, hallazgos similares a lo encontrado en nuestro estudio.
En esta serie encontramos que de los 130 pacientes con primer aislamiento en sangre de SCN, 32 (24,6%) fueron sensibles a meticilina, porcentaje similar para los 38 aislamientos con CIM para vancomicina ≥ 2 µg/ml, donde el 26,3% fueron también sensibles a meticilina. Esto difiere de lo reportado por Cuevas et al. 15, estudio español donde la resistencia a meticilina es del 32,5%, pero se asemeja a los reportes actuales en diferentes series y países, donde la resistencia es mayor al 70% y alcanza incluso valores tan altos como 90,2% 6,8,16,17.
El porcentaje de aislamientos en sangre con CIM para vancomicina ≥ 2 µg/ml en nuestra serie fue del 29,2%, menor al descrito en otros estudios en la población general 5,6 y con mayor diferencia a lo descrito en poblaciones con enfermedad hematológica 9.
Respecto a la sensibilidad de otros antibióticos en los aislamientos de SCN con CIM para vancomicina ≥ 2 µg/ml, el 100% eran sensibles a linezolid, el 97,3% a quinupristín/ dalfopristín, el 86% a rifampicina, el 55% a clindamicina, el 42% a ciprofloxacino y el 26,3% a meticilina, hallazgos muy similares a los descritos en otros estudios 6,8,13,16,18 . No se evaluó de rutina la sensibilidad a daptomicina; solo 2 pacientes cuentan con resultados y ambos son sensibles, pues es un antibiótico que recientemente ingresó a nuestro país.
Si tenemos en cuenta que la farmacocinética y la farmacodinamia en el tratamiento de los pacientes con bacteremia por SCN con CIM para vancomicina ≥ 2 ug/ml, es poco probable que la vancomicina alcance una AUC/MIC adecuada; adicionalmente, el uso de linezolid no se encuentra aprobado para bacteremia, y un 47,8% de los pacientes recibieron un manejo inadecuado.
Como limitantes inherentes a nuestro estudio tenemos varios elementos: a) ausencia de grupo de comparación; b) sesgos de selección; c) sesgos de medida, y d) la posibilidad de datos incompletos o no reportados en la historia clínica. Adicionalmente el número de aislamientos de SCN con CIM para vancomicina ≥ 2 µg/ml fue pequeño.
Sin embargo, nuestra serie nos permite aportar datos epidemiológicos al comportamiento de SCN en nuestras instituciones, identificar los factores de riesgo y comorbilidades asociadas, así como las posibilidades de tratamiento.
La heterorresistencia o resistencia a vancomicina en nuestra población no es tan alta como la reportada en otras series y países.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de intereses
Los autores declaran que no tienen conflicto de intereses ni recibieron dinero de ninguna institución. El Hospital Pablo Tobón Uribe ofreció al grupo investigador todo el apoyo logístico necesario para llevar a cabo la recolección de datos, análisis estadístico y elaboración del artículo de investigación.
Agradecimientos
Especial agradecimiento a los integrantes del Grupo de Investigación en Enfermedades Respiratorias e Infecciosas que participaron en algunas de las fases del estudio: Viviana M. Palacio Castaño, Luz E. Pérez Jaramillo, María A. Monsalve, Humberto Zapata, Melissa Mejía, Natalia Salazar Valderrama, Luisa Guarín H.
* Autor para correspondencia.
Correos electrónicos: frmontufar@yahoo.com, frmontufar@yahoo.com (F.E. Montúfar Andrade).
Bibliografía
1. Rogers KL, Fey PD, Rupp ME. Coagulase-negative staphylococcal infections. Infect Dis Clin North Am. 2009;23:73-98. [ Links ]
2. Zhanel GG, DeCorby M, Laing N, Weshnoweski B, Vashisht R, Tailor F, et al. Antimicrobial-resistant pathogens in intensive care units in Canada: Results of the Canadian National Intensive Care Unit (CAN-ICU) study, 2005-2006. Antimicrob Agents Chemother. 2008;52:1430-7. [ Links ]
3. Zhanel GG, DeCorby M, Adam H, Mulvey MR, McCracken M, Lagacé-Wiens P, et al. Prevalence of antimicrobial-resistant pathogens in Canadian hospitals: Results of the Canadian Ward Surveillance Study (CANWARD 2008). Antimicrob Agents Chemother. 2010;54:4684-93. [ Links ]
4. Fridkin SK, Edwards JR, Tenover FC, Gaynes RP, McGowan JE Jr. Antimicrobial resistance prevalence rates in hospital antibiograms reflect prevalence rates among pathogens associated with hospital-acquired infections. Clin Infect Dis. 2001;33:324-30. [ Links ]
5. Wisplinghoff H, Bischoff T, Tallent SM, Seifert H, Wenzel RP, Edmond MB. Nosocomial bloodstream infections in US hospitals: Analysis of 24,179 cases from a prospective nationwide surveillance study. Clin Infect Dis. 2004;39:309-17. [ Links ]
6. Diekema DJ, Pfaller MA, Schmitz FJ, Smayevsky J, Bell J, Jones RN, et al. Survey of infections due to Staphylococcus species: Frequency of occurrence and antimicrobial susceptibility of isolates collected in the United States, Canada, Latin America, Europe, and the Western Pacific region for the SENTRY Antimicrobial Surveillance Program, 1997-1999. Clin Infect Dis. 2001;32 Suppl 2:S114-32. [ Links ]
7. Sakoulas G, Moise-Broder PA, Schentag J, Forrest A, Moellering RC Jr, Eliopoulos GM. Relationship of MIC and bactericidal activity to efficacy of vancomycin for treatment of methicillinresistant Staphylococcus aureus bacteremia. J Clin Microbiol. 2004;42:2398-402. [ Links ]
8. Fajardo Olivares M, Hidalgo Orozco R, Rodríguez Garrido S, Rodríguez-Vidigal FF, Vera Tomé A, Robles Marcos M. Activity of vancomycin, ciprofloxacin, daptomycin, and linezolid against coagulase-negative staphylococci bacteremia. Rev Esp Quimioter. 2011;24:74-8. [ Links ]
9. Ahlstrand E, Svensson K, Persson L, Tidefelt U, Söderquist B. Glycopeptide resistance in coagulase-negative staphylococci isolated in blood cultures from patients with hematological malignancies during three decades. Eur J Clin Microbiol Infect Dis. 2011;30:1349-54. [ Links ]
10. WHO Collaborating Centre for Surveillance of Antimicrobial Resistance. WHONET software [consultado 21 Ene 2015]. Disponible en: http://www.who.int/drugresistance/whonetsoftware/en/ [ Links ]
11. Cockerill F. Performance Standards for Antimicrobial Susceptibility Testing: Twenty-First Informational Supplement. Wayne, PA: Clinical and Laboratory Standards Institute; 2012. [ Links ]
12. Dekkers OM, Egger M, Altman DG, Vandenbroucke JP. Distinguishing case series from cohort studies. Ann Intern Med. 2012;156 1 Pt 1:37-40. [ Links ]
13. Natoli S, Fontana C, Favaro M, Bergamini A, Testore GP, Minelli S, et al. Characterization of coagulase-negative staphylococcal isolates from blood with reduced susceptibility to glycopeptides and therapeutic options. BMC Infect Dis. 2009;9:83. [ Links ]
14. Beekmann SE, Diekema DJ, Doern GV. Determining the clinical significance of coagulase-negative staphylococci isolated from blood cultures. Infect Control Hosp Epidemiol. 2005;26:559-66. [ Links ]
15. Cuevas O, Cercenadoa E, Goyanesa MJ, Vindelb A, Trincadob P, Boqueteb T, et al. Staphylococci in Spain: Current status and evolution of antimicrobial resistance (1986-2006). Enferm Infecc Microbiol Clin. 2008;26:269-77. [ Links ]
16. Farrell DJ, Mendes RE, Ross JE, Sader HS, Jones RN. LEADER Program results for 2009: An activity and spectrum analysis of linezolid using 6,414 clinical isolates from 56 medical centers in the United States. Antimicrob Agents Chemother. 2011;55:3684-90. [ Links ]
17. Kuti JL, Kiffer CRV, Mendes CMF, Nicolau DP. Pharmacodynamic comparison of linezolid, teicoplanin and vancomycin against clinical isolates of Staphylococcus aureus and coagulase-negative staphylococci collected from hospitals in Brazil. Clin Microbiol Infect. 2008;14:116-23. [ Links ]
18. John MA, Pletch C, Hussain Z. In vitro activity of quinupristin/ dalfopristin, linezolid, telithromycin and comparator antimicrobial agents against 13 species of coagulase-negative staphylococci. J Antimicrob Chemother. 2002;50:933-8. [ Links ]













