Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.20 no.3 Bogotá July/Sept. 2016
https://doi.org/10.1016/j.infect.2015.06.001
ORIGINAL
http://dx.doi.org/10.1016/j.infect.2015.06.001
Resultados en la práctica clínica del tratamiento de la hepatitis crónica por virus B con tenofovir y entecavir
Diana Hortaa,*, Alberto Fernandez-Atutxaa, Mireia Miquela,b, Mercedes Vergaraa,b, Meritxell Casasa y Jordi Sánchez-Delgadoa,b
a Unidad de Hepatología, Servicio de Digestivo, Hospital de Sabadell, Universitat Autònoma de Barcelona, Sabadell, España
b Servicio de Farmacia, CIBER-ehd Instituto Carlos III, Madrid, España
Recibido el 20 de abril de 2015; aceptado el 4 de junio de 2015
Disponible en Internet el 29 de octubre de 2015
Resumen Actualmente hay pocos datos sobre los resultados obtenidos con tenofovir y entecavir en la práctica clínica.
Objetivo: Valorar la respuesta viral y la seguridad de tenofovir y entecavir en un periodo de 5 años.
Material y métodos: Estudio observacional en donde se incluyó a todos los pacientes con hepatitis crónica por virus B que iniciaron tratamiento con tenofovir o entecavir desde enero de 2008 hasta diciembre de 2012.
Resultados: De un total de 70 pacientes: 42 (60%) en tratamiento con entecavir y 28 (40%) con tenofovir. Un 75,7% eran hombres, con una edad media de 53 (DE 14) años. Un 70% eran caucásicos. Se realizó biopsia hepática en 46 pacientes (F0 8,7%; F1 6,5%; F2 26,1%; F3 43,5% y F4 15,2%). El 51,4% eran naïve. Del grupo de pacientes previamente tratados, un 17,6% había recibido interferón; un 26,4% interferón inicialmente y luego análogos; y un 55,8% otros análogos de los nucleósidos o de los nucleótidos. El tiempo de seguimiento fue de 36 (DE 12) meses. El DNA del VHB inicial medio era de 31.570.006 UI/mL (rango 24-1.100.000.000 UI/mL).Todos ellos, excepto 3, presentaron un DNA indetectable al año del tratamiento. De los 10 con HBeAg+, 2 de ellos presentaron seroconversión. Los valores de creatinina y la estimación del filtrado glomerular (EFG) fueron de 0,9 (DE 0,3) mg/dL y de 93,92 ml/min/1,73 m2 (DE 21,92) al inicio y creatinina 0,93 (DE 0,27) mg/dL y EFG 91,7392 ml/min/1,73 m2 (DE 21,38) al año de seguimiento.
Conclusiones: Entecavir y tenofovir son eficaces y seguros en la práctica clínica en pacientes con hepatitis crónica por virus B.
PALABRAS CLAVE
Hepatitis B; Hepatitis crónica; Antivirales orales; Tenofovir; Entecavir
© 2015 ACIN. Publicado por Elsevier España, S.L.U. Este es un artículo Open Access bajo la CC BY-NC-ND licencia (http://creativecommons.org/licencias/by-nc-nd/4.0/).
Results in clinical practice of treatment of chronic hepatitis b virus with tenofovirand entecavir
Abstract The current first line treatment for chronic hepatitis B virus is with entecavir andtenofovir. However, there are few data regarding the results obtained from these treatmentsin clinical practice.
Objective: To assess viral response and safety of treatment with entecavir and tenofovir in a 5-year follow-up.
Material and methods: Observational study on patients with chronic hepatitis B virus who begantreatment with tenofovir or entecavir between January 2008 and December 2012.
Results: Seventy patients were included; 42 (60%) were treated with entecavir and 28 (40%)with tenofovir. Of these, 75.7% were men, with an average age of 53 (SD ± 14) years, and mostwere white (70%). A liver biopsy was performed on 46 patients (F0 8.7%; F1 6.5%; F2 26.1%;F3 43.5% and F4 15.2%). Of all the patients, 51.4% were treatment naïve, and of the groupof previously treated patients, 17.6% had received interferon; 26.4% had received interferonfollowed by one or more analogues; and 55.8% had received other nucleoside or nucleotideanalogues.The time of follow-up was 36 (SD ± 12) months. The average initial DNA was 31,570,006UI/mL (range 24-1,100,000,000 UI/mL). All except 3 presented undetectable DNA after oneyear of treatment. Ten patients were HBeAg-positive at the beginning of the treatment and 2seroconverted. At the beginning of the treatment, creatinine was 0.9 (SD ± 0.3) mg/dL and theestimated glomerular filtration rate (eGFR) was 93.92 ml/min/1.73 m2(DE 21.92); both keepingstable after a year of treatment (creatinine levels 0.93 SD ± 0.27 mg/dL, eGFR 91.7392 SD± 21.38 ml/min/1.73 m2).
Conclusions: Entecavir and tenofovir are safe and effective in clinical practice for the treatmentof chronic hepatitis B virus, both in treatment-naïve patients and in those previously treated.
© 2015 ACIN. Published by Elsevier España, S.L.U. This is an open access article under the CCBY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
http://dx.doi.org/10.1016/j.infect.2015.06.001
0123-9392/© 2015 ACIN. Publicado por Elsevier España, S.L.U. Este es un artículo Open Access bajo la CC BY-NC-ND licencia (http://creativecommons.org/licencias/by-nc-nd/4.0/).
Introducción
El virus de la hepatitis B (VHB) es un problema de salud global. Se estima que en el mundo hay entre 350 y 400 millones de portadores del antígeno de superficie del VHB(HBsAg), lo que confiere cronicidad a la infección. Por otro lado, más de 500.000 muertes anuales son atribuidas a complicaciones relacionadas con la hepatitis crónica B (HCB), como son el fallo hepático, la cirrosis o el desarrollo de hepatocarcinoma 1. En España se estima una prevalencia de entre un 2 y un 7%, figurando entre los países con una prevalencia intermedia2.
El objetivo del tratamiento es mejorar la calidad de vida y la supervivencia1. Está establecido que la supresión de la concentración del DNA del VHB a niveles indetectables escapaz de reducir la progresión a cirrosis, e incluso se ha descrito que favorece la regresión de la fibrosis hepática,con la consecuente disminución del riesgo de descompensaciones, del desarrollo de hepatocarcinoma y de la muerte por causa hepática3. Además, la supresión viral aumenta la probabilidad de la seroconversión del HBeAg (en pacientes HBeAg+) e incluso la del antígeno de superficie B (HBsAg).
En España existen 5 análogos de los nucleósidos y nucleótidos aprobados para el tratamiento de la infección crónicapor VHB: lamivudina (LAM), adefovir dipivoxil (ADV), telvibudina, entecavir (ETV) y tenofovir disoproxil fumarato (TDF), sin embargo, tanto la guía europea1 como la guía americana4 recomiendan el uso preferentemente de los análogos de tercera generación (ETV y TDF) como tratamiento de primera elección en la HCB. Los estudios de registro y los ensayos clínicos realizados muestran que estos 2 fármacos, de administración oral, presentan una alta potencia antiviral (94 y88% en HBeAg− y del 88 y 61% en HBeAg+ en el primer año de tratamiento con TDF y ETV respectivamente5-7 y a los 5 años del 99% en HbeAg− con TDF y del 94% en HbeAg− y HbeAg+ con ETV8,9, una alta barrera genética al desarrollo de resistencias y una buena tolerancia. La tasa de efectos adversos es baja. Los más frecuentes son la disfunción renal, la acidosis láctica, la osteopenia y la osteoporosis10.
A pesar de que ETV y TDF tienen una alta eficiencia en la supresión viral, las tasas de seroconversión son bajas por lo que, en la mayoría de los casos, se convierte en un tratamiento de uso crónico1,4.
Recientemente, se ha publicado un estudio multicéntrico a nivel del territorio español sobre práctica clínica en pacientes con HCB11.
El objetivo de nuestro estudio es valorar la respuesta viral y la seguridad del tratamiento con ETV y TDF en pacientes con infección crónica por VHB en práctica clínica habitual, complementando los datos ya existentes en nuestro medio.
Material y métodos
Población de estudio
Se incluyó de forma consecutiva a todos los pacientes diagnosticados de HCB que iniciaron tratamiento en nuestro centro con ETV o TDF entre enero del 2008 y diciembre del 2012. Los criterios de exclusión del estudio fueron:
- Seguimiento inferior a 6 meses.
- Pacientes en tratamiento de la hepatitis B como quimioprofilaxis por recibir tratamiento con quimioterapia o inmunomoduladores.
- Coinfección por el virus de la inmunodeficiencia humana,la hepatitis crónica por virus C y hepatitis crónica por virus delta.
Una vez iniciado el tratamiento con ETV o TDF, los pacientes fueron controlados a los 3 meses y, si el DNA del VHB era indetectable, se seguían posteriormente cada 6 meses concontroles analíticos y serológicos. A los pacientes diagnosticados de cirrosis hepática, ya fuera por criterios clínicos, analíticos, de imagen habituales o por biopsia hepática, se les realizaba una ecografía hepática cada 6 meses como cribado de hepatocarcinoma y una endoscopia digestiva para detección y profilaxis de varices esofágicas.
Variables
La información analizada se obtuvo a través de las historias clínicas y de la base informática de datos analíticos del hospital. Los datos referentes a la identidad de los pacientes obtenidos fueron confidenciales a todos los efectos, cumpliendo con la Ley Orgánica de 15/1999, de Protección de Datos de Carácter Personal.
Se recogieron datos demográficos de los pacientes (edad,sexo y etnia), así como datos referentes al tratamiento antiviral (fármacos previamente recibidos, duración, finalización o aparición de resistencias), datos histológicos como el estado de fibrosis pretratamiento en los casos en los que se realizó una biopsia hepática.
Como parámetros analíticos se recogieron los niveles de transaminasas, plaquetas y la bilirrubina total sérica. Los parámetros serológicos recopilados fueron el HBeAg, HBeAc, HBsAg y nivel de DNA del VHB. En referencia a la monitorización de la función renal, se recogió la creatinina sérica y se realizó la estimación del filtrado glomerular (EFG) con la fórmula del Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) al inicio y al año de iniciar el tratamiento.
Determinaciones serológicas
Los marcadores serológicos para el virus B: HBsAg, HBeAg y anticuerpos HBc, HBs y HBe se determinaron mediante inmunoanálisis quimioluminiscente de micropartículas (CMIA) mediante el analizador Architect I-2000 (Abbott Diagnostics, Chicago, EE. UU).
El DNA del VHB se cuantificó mediante reacción en cadena de la polimerasa a tiempo real con un intervalo de medida de 20 a 1.700.000.000 UI/mL (COBAS Ampliprep/COBAS Taq-Man, Roche Diagnostics, New Jersey, EE. UU.).
Análisis estadístico
Se realizó mediante el programa SPSS 21. Las variables continuas se expresan con media y DE o con mediana y rango según su distribución, y las variables categóricas mediante porcentajes.
Resultados
El número de pacientes que iniciaron tratamiento durante el periodo de inclusión fue de 86; 16 no cumplían los criterios de inclusión y fueron excluidos del estudio (fig. 1). Finalmente, fueron evaluados 70 pacientes.
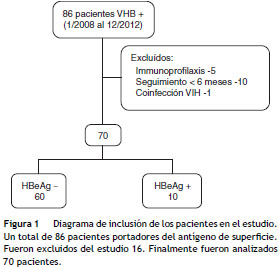
Las características demográficas, clínicas y analíticas al inicio del tratamiento se muestran en la tabla 1. Como se observa en la tabla, la mayoría de los pacientes son varones con una edad media de 53 (DE 14) años y caucásicos.
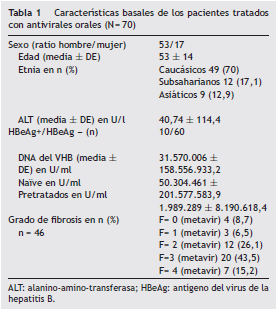
El tratamiento se prescribió cumpliendo los criterios establecidos en las guías de práctica clínica habitual parala HCB1,2,4.
Se realizó biopsia hepática en un 65,7% de los pacientes(n = 46). Un 69,6% de los pacientes (n = 32) presentaba fibrosis significativa con un índice Metavir superior a 2 y, en un 15,2% (n = 7) de las biopsias, se encontraron hallazgos histológicos característicos de cirrosis. Un 75% (n = 18) de los pacientes no biopsiados presentaban cirrosis por criterios clínicos, analíticos y de imagen. El resto de los pacientes no fue biopsiado por contra indicaciones relativas: síndrome de Down (n = 2) o por negativa del paciente (n = 4).
De los 7 casos con fibrosis no significativa en la biopsia, 6 iniciaron tratamiento: bien porque habían evolucionado a estadios más avanzados de la enfermedad (n = 4) (no todas las biopsias fueron realizadas justo antes de comenzar el tratamiento), bien porque tenían una alta actividad inflamatoria (n = 2).
En el momento de realización del estudio, nuestro centro no contaba aún con el astografía hepática, por lo que no disponemos de los datos de el astografía basal.
El 51,4% (n = 36) no había realizado ningún tratamiento previo. De los pacientes tratados previamente con otros fármacos activos para la hepatitis B, un 17,6% (n = 6) del total de la muestra había recibido interferón; un 26,4% (n = 9) interferón inicialmente y luego análogos (n = 6 LAM, n = 2 ETV yn = 1 ADV) y un 55,8% (n = 19) había realizado tratamiento previo con otros análogos de los nucleósidos o nucleótidos(n = 10 con LAM, n = 2 con ADV, n = 7 con LAM + ADV).
El 60% de los pacientes (n = 42) inició tratamiento con ETV y un 40% con TDF (n = 28) a criterio del médico prescriptor. El tiempo de seguimiento fue de 36 ± 12 meses.
Supresión de DNA viral (fig. 2)
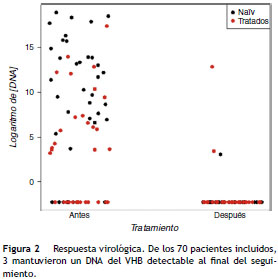
Al finalizar el estudio (diciembre de 2012), de los 70 pacientes incluidos, un 95,7% (n = 67) tenían un DNA del VHB indetectable. En 3 pacientes, este era detectable en el último control analítico: 2 pacientes que habían recibido tratamiento previo y un paciente naïve. Uno de los casos era un paciente cirrótico y diabético inicialmente tratado con INF y que, por mala tolerancia, se cambió a LAM. Posteriormente, se añadió ADV, que recibió durante 31 meses y que se cambió a TDF debido a su mayor eficacia y menor tasa de resistencias. Durante el tratamiento con TDF el paciente fue diagnosticado de una nefropatía diabética grado IV con una EFG de 46,5 ml/min/1,73 m2, por lo que se ajustó la dosis de TDF al aclaramiento renal del paciente (un comprimido cada 48 h). A los 34 meses de tratamiento con TDF, el paciente presentó un rebrote viral con un DNA del VHB de 440.243UI/mL. El estudio de resistencias detectó mutaciones en elgen de la transcriptasa reversa (L180 M, m204 V y m250 V), las cuales proporcionaban resistencia a LAM, emtricitabina y ETV.
El segundo caso correspondía a un paciente tratado previamente con INF que, por mala tolerancia, se cambió a ETV y que recibió durante 12 meses; finalmente se añadió TDF al tratamiento por rebrote viral, atribuido a resistencias virales. En el momento de la recogida de datos, el DNA del VHB seguía siendo detectable (30 UI/mL), aunque se había objetivado un importante descenso de este con el tratamiento doble con ETV y TDF. En el tercer caso, se trataba de un paciente naïve en tratamiento con ETV y con un DNA del VHB indetectable durante los 24 meses de tratamiento. No obstante, en el último control analítico disponible el DNA del VHB fue de 21 UI/mL, que no fue valorable, dado que el aumento no fue superior a un logaritmo.
Seroconversión de antígeno e de hepatitis B y seroconversión del HBsAg
De los 70 pacientes con HCB incluidos en el estudio, 10 pacientes (14%) eran HBeAg+. De estos, 2 presentaron seroconversión a HBeAc+ con un DNA del VHB indetectable. El primer caso era un paciente naïve en tratamiento con TDF. El segundo había recibido tratamiento previo con INF que había realizado durante 12 semanas y que abandonó voluntariamente durante 4 meses por cambio temporal de domicilio. Al retomar los controles habituales, se inició tratamiento con ETV porque la carga viral era elevada, con el que presentó seroconversión del HBeAg. Al finalizar el estudio, ambos casos seguían en tratamiento con antivirales orales, dado que hacía menos de un año de la seroconversión. El tiempo medio de tratamiento transcurrido hasta la seroconversión fue de 12 meses.
De los 8 pacientes que no presentaron seroconversión, 4 de ellos (50%) eran naïve y el resto había realizado tratamiento previo, bien con INF y posteriormente otro análogo (3 casos) o bien solo con otro análogo (un caso). Todos presentaban un DNA del VHB negativo y transaminasas normales tras el inicio del tratamiento y durante el seguimiento.
Por otra parte, ningún paciente presentó seroconversión del HBsAg.
Seguridad y efectos adversos
No se objetivaron efectos adversos durante el tratamiento con ETV o TDF. El tratamiento fue muy bien tolerado.
Ningún paciente desarrolló alteración de la función renal relacionada con el tratamiento (elevación de más de 0,5 mg/dL del nivel basal de creatinina plasmática o una EFG < 50 mL/min/1,73 m2).
No se encontraron diferencias en el nivel de creatinina sérica medio al inicio (0,91 ± 0,3 mg/dL; valor normal 0,5-0,9 mg/dL), ni al año del tratamiento (0,93 ± 0,27 mg/dL) ni de la EFG al inicio (93,92 ± 21,92 ml/min/1,73 m2; valor normal varones 70 ± 14 mL/min/1,73 m2; valor normal mujeres 60 mL ± 10 ml/min/1,73 m2) ni al año de tratamiento (91,7392 ± 21,38 ml/min/1,73 m2).
Discusión
El tratamiento de la infección crónica por el VHB ha evolucionado con los años, desde la época de la LAM hasta la aparición de los análogos de tercera generación (ETV yTDF), de gran potencia y alta barrera genética. Estos fármacos constituyen, hoy en día, el tratamiento de primera línea1,2,5,6. Estos 2 análogos presentan una alta eficacia y un buen perfil de seguridad. Esta última condición, la seguridad, es de gran importancia dado que la administración de ETV o TDF suele ser crónica7,12.
Si bien el objetivo primario del tratamiento es la seroconversión del HBsAg y, por tanto, la curación de la infección, esta situación se obtiene en un porcentaje muy bajo de los pacientes13. Por tanto, en los pacientes en tratamiento antiviral se considera que mantener niveles de transaminasas normales y DNA del VHB indetectables es un resultado satisfactorio, ya que reduce el riesgo de progresión de la enfermedad, con una mejoría significativa del pronóstico1,8, pudiendo incluso revertir el grado de fibrosis3,4,7,8,14.
Diversos ensayos clínicos analizan la eficacia de los anti-virales orales de tercera generación que muestran unos porcentajes de supresión virológica a los 4 y 5 años de tratamiento con ETV del 94-95% y del 97-99% con TDF (en HBeAg+y HBeAg−; respectivamente)6,8,9.
Existen varios estudios de práctica clínica que evalúan la eficacia de TDF o ETV en pacientes con HCB: Lampertico et al. realizaron un estudio multicéntrico en 19 centros europeos con una cohorte de 302 pacientes naïve, los cuales recibieron tratamiento con TDF durante una media de28 meses (rango 0-60). Se presentaron los resultados a los 3 años de seguimiento. Al año, se observó que un 84% de los pacientes presentaba supresión viral, mientras que, a los3 años, esta cifra aumentaba hasta el 95% de la población total (del 66 al 86% en pacientes HBeAg+ y del 74 al 98% en los HBeAg−)15, resultado equiparable al hallado por nosotros.
Así, en otro estudio de práctica clínica realizado en 10 centros de referencia europeos entre el 2005 y el 2010 con una cohorte de 333 pacientes con HCB tratados con ETV en monoterapia, se obtuvo un porcentaje de respuesta virológica del 90% en pacientes HBeAg+ y del 99% en HBeAg− en pacientes naïve a los 144 semanas de tratamiento16.
Además, en un análisis posterior con 373 pacientes de la misma cohorte, se observó que los niveles de descenso del DNA del VHB eran comparables entre los pacientes sin cirrosis (n = 274), con cirrosis compensada (n = 89) y descompensada (n = 9)17.
En nuestro estudio, se obtuvieron resultados similar esa los anteriores trabajos de práctica clínica previamente mencionados, con un 95,7% de pacientes que presentaron supresión del DNA del VHB al año de tratamiento. La supresión viral fue prácticamente universal: independientemente del grado de fibrosis pretratamiento y de si habían recibido tratamiento previo o no.
Este dato refuerza el conocimiento de la alta eficacia clínica que tienen estos 2 análogos orales en la infección crónica por hepatitis B.
En los pacientes con HBeAg+, uno de los objetivos del tratamiento es la obtención de la seroconversión con la pérdida del HBeAg y la aparición de su correspondiente anticuerpo(HBeAc)1,4. En algunos estudios, se señala que es posible suspender el tratamiento transcurridos 6-12 meses tras la seroconversión a HBeAg si no existe cirrosis ni fibrosis significativa. No obstante, algunos pacientes requieren reiniciar el tratamiento por respuesta serológica o virológica fallida18. Por este motivo, algunos autores aconsejan una mayor duración del tratamiento de consolidación tras la seroconversión con el objetivo de mantener una respuesta viral sostenida, por lo que los pacientes que habían seroconvertido mantenían todavía el tratamiento antiviral19,20.
En nuestro medio, cabe destacar el estudio Oriente de Buti et al.11, en el cual se analizaron los resultados de 190 pacientes naïve tratados durante 48 semanas con ETV en 25 centros de España. En este estudio se describe una tasa de pérdida del HBeAg del 26% y una tasa de seroconversión del 22% al año de tratamiento, que coincide con la obtenida por nuestro grupo. En otros estudios se ha descrito un porcentaje de seroconversión a HBeAc del 21% al año de tratamiento con ETV o TDF5,21.
Por otra parte, en el estudio mencionado anteriormente de Lampertico et al.15 un 36% de los pacientes HBeAg+ seroconvirtió a los 3 años de tratamiento con TDF. Este mayor porcentaje de seroconversión respecto al estudio de Butiet al. (36 vs. 22%) se explicaría por una mayor duración del tratamiento (144 semanas vs. 48 semanas en el estudio de Lampertico et al y Buti et al; respectivamente)
En nuestro estudio, pese a que se trata de un número reducido de pacientes, los resultados son similares a los publicados (20%), y no se ha detectado hasta la fecha serorreversión, si bien continuaban con el tratamiento anti-viral. Por norma general, el tratamiento con análogos orales es de uso crónico, dado que su cese se asocia normalmente a reactivación viral7.
El tratamiento prolongado con análogos de los nucleósidos y de los nucleótidos presenta una limitación importante:el riesgo de selección de mutantes del VHB resistentes.
Los 2 fármacos con menos probabilidades de desarrollar resistencias son el ETV y el TDF. Hasta la fecha, no se han comunicado resistencias al TDF, excepto por un par de casos descritos en pacientes con respuesta virológica parcial, definida como DNA del VHB detectable a la semana 4822. En cuanto al ETV, las resistencias son menores del 1% a los 3 y 4 años en enfermos no tratados previamente1,4,21,22, pero del 15-19% en pacientes tratados previamente con LAM, por lo que se considera que en este subgrupo no es una buena opción terapéutica23.
La seguridad y tolerabilidad es importante debido a que la mayoría de los pacientes debe realizar tratamiento a largo plazo o indefinido.
En un estudio de práctica clínica reciente, se observa un buen perfil de seguridad de ETV o TDF tanto en pacientes cirróticos compensados como en descompensados 24 lo que se ajustaría a los resultados obtenidos en nuestro estudio. Si bien hay algún caso descrito de acidosis láctica en pacientes con función hepática deteriorada (Model for End-Stage Liver Disease MELD score ≥ 20) en pacientes tratados con ETV10. Todos los pacientes de nuestro estudio tenían una cirrosis compensada.
La alteración de la función renal se ha visto en pacientes con el virus de la inmunodeficiencia humana en tratamiento con TDF, en especial, en aquellos pacientes con enfermedad renal preexistente25.
En el estudio de Marcellin et al.9, al sexto año de tratamiento con TDF, menos de un 1,5% de los pacientes presentó un incremento de más de 0,5 mg/dL de la creatinina sérica, fósforo menor de 2 mg/dL o una EFG < 50 mL/min/1,73 m2.
En 3 estudios globales aleatorizados de 675 pacien-tes naïve, que recibieron tratamiento con TDF durante 3 años, se observó un aumento del nivel de creatinina sérica > 0,5 mg/dL respecto al basal en menos del 1% depacientes, y un descenso de la EFG < 50 mL/min/1,73 m2enun 0,5% de los pacientes26.
En otros estudios de práctica clínica se obtuvieron resultados similares, sin observarse alteración de la función renal con el tratamiento a largo plazo con TDF12,21,27,28.
Dado que todos los antivirales orales son excretados por vía renal, se deben registrar los niveles de creatinina sérica y el filtrado glomerular inicial y ajustar las dosis en casos de filtrado glomerular 4,21,27< 50 mL/min/1,73 m2.
En nuestro estudio no se detectó alteración de la función renal ni aparición de otros efectos adversos relacionados con el tratamiento en el primer año, periodo en el que es más frecuente la alteración de la función renal29.
Este estudio presenta una serie de limitaciones por serun estudio retrospectivo. En primer lugar, el hecho de no disponer de biopsia hepática de todos los pacientes incluidos, a pesar de que, en la mayoría de los casos, esta no fue realizada por tratarse de pacientes con cirrosis hepática por criterios clínicos, analíticos o de imagen. Otra limitación es no disponer de los valores de elastografía antes y después de realizar el tratamiento con ETV o TDF, dado que en las fechas de realización del estudio nuestro centro no disponíade esta herramienta.
En conclusión, ETV y TDF son fármacos eficaces y seguros en la práctica clínica para el tratamiento de la HCB tanto en pacientes naïve como en previamente tratados.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de interés.
*Autor para correspondencia. Correo electrónico: dhorta@tauli.cat (D. Horta).
Bibliografía
1. European Association for the study of the Liver. EASL clinical practice guidelines: Management of chronic hepatitis B virus infection. J Hepatol. 2012;57:167-85. [ Links ]
2. Buti M, García-Samaniego J, Prieto M, Rodriguez M, Sánchez-Tapias JM, Suárez E, et al. Consensus document of the Spanish Association for the Study of the Liver on the treatment of hepatitis B infection (2012) en español. Gastroenterol Hepatol. 2012;35:512-28. [ Links ]
3. Iloeje UH, Yang Hi, Su J, Jen CL, You SL, Chen CJ. Predicting cirrhosis risk based on the level of circulating hepatitis B viral load. Gastroenterology. 2006;130:678-86. [ Links ]
4. Lok AS, McMahon BJ. Chronic hepatitis B: Update 2009. Hepatology. 2009;50(3):661-2. [ Links ]
5. Marcellin P, Heathcote EJ, Buti M, Gane E, de Man RA, Krastev Z. Tenofovir disoproxil fumarate versus adefovir dipivoxil for chronic hepatitis B. N Engl J Med. 2008;359:2442-55. [ Links ]
6. Heathcote EJ, Marcellin P, Buti M, Gane E, De Man RA, Kras-tev Z. Three-year efficacy and safety of tenofovir disoproxil fumarate treatment for chronic hepatitis B. Gastroenterology.2011;140:132-43. [ Links ]
7. Asselah T, Marcellin P. Long-term results of treatment withnucleoside and nucleotide analogues (entecavir and tenofovir) for chronic hepatitis B. Clin Liver Dis. 2013;17(3):445-50. [ Links ]
8. Chang TT, Liaaw YF, Wu SS, Schiff E, Han KH, Lai CL. Long-termentecavir therapy results in the reversal of fibrosis/cirrhosis and continued histological improvement in patients with chronic hepatitis B. Hepatology. 2010;52:886-93. [ Links ]
9. Marcellin P, Buti.M, Gane E, Tsai N, Sievert W, Jacobson IM. Six years of treatment with tenofovir disoproxil fumarate for chronic hepatitis b virus infection is safe and well tolerated and associated with sustained virological, biochemical, and serological responses with no detectable resistance. Hepatology,2012; 56: Suppl 1:Abstract 374. [ Links ]
10. Lange CM, Bojunga J, Hofmann WP, Wunder K, Mihm U, ZeuzemS. Severe lactic acidosis during treatment of chronic hepatitis B with entecavir in patients with impaired liver function. Hepatology. 2009;50:2001-6. [ Links ]
11. Buti M, Morillas RM, Prieto M, Diago M, Pérez J, Solà R. Efficacy and safety of entecavir in clinical practice in treatment-naive Caucasian chronic hepatitis B patients. Eur J Gastroenterol Hepatol. 2012;24(5):535-42. [ Links ]
12. Lee CI, Kwon SY, Kim JH, Choe WH, Lee CH, Yoon EL. Efficacy and safety of tenofovir-based rescue therapy for chronic hepatitis B patients with previous nucleo(s-t)ide treatment failure. Gut Liver. 2014;8:64-9. [ Links ]
13. Ceylan B, Yardimci C, Fincanci M, Eren G, Tozalgan U, Muderri-soglu C. Comparison of tenofovir and entecavir in patients with chronic HBV infection. Eur Rev Med Pharmacol Sci. 2013;17:2467-73. [ Links ]
14. Marcellin P, Gane E, Buti M, Afdhal N, Sievert W, Jacobson IM. Regression of cirrhosis during treatment with tenofovir disoproxil fumarate for chronic hepatitis B: A 5-year open-label follow-up study. Lancet. 2013;381(9865):468-75. [ Links ]
15. Lampertico P. 525 Tenofovir monotherapy for naÏve patientswith chronic hepatitis B: a multicenter European study in clinical practice in 302 patients followed for 30 months. Hepatology. 2012;56 (Suppl 2):S208. [ Links ]
16. Zoutendijk R, Reijnders JG, Brown A, Zoulim F, Mutimer D, Deterding K. Entecavir treatment for chronic hepatitis B: Adaptation is not needed for the majority of naive patients with a partial virological response. Hepatology. 2011;54(2):443-51. [ Links ]
17. Zoutendijk R, Reijnders JGP, Zolium F, Brown A, Mutimer DJ, Deterding K. Virological response to entecavir is associated with a better clinical outcome in chronic hepatitis B patients with cirrhosis. Gut. 2013;62:760-5. [ Links ]
18. Reijnders JG, Perquin MJ, Zhang N, Hansen BE, Janssen HL.Nucleos(t)ide analogues only induce temporary hepatitis B eantigen seroconversion in most patients with chronic hepatitisB. Gastroenterology. 2010;139:491-8. [ Links ]
19. Wang L, Liu F, Liu YD, Li XY, Wang JB, Zhang ZH. Stringent cessation criterion results in better durability of lamivudine treatment: A prospective clinical study in hepatitis B eantigen-positive chronic hepatitis B patients. J Viral Hepat. 2010;17:298-304. [ Links ]
20. Pol S, Lampertico P. First-line treatment of chronic hepatitis B with entecavir or tenofovir in ´real-life´ settings: From clinical trials to clinical practice. J Viral Hepat. 2012;19(6):377-86. [ Links ]
21. Chang TT, Gish RG, de Man RA, Gadano A, Sollano J, Chao YC.A comparison of entecavir and lamivudine for HBeAg-positive chronic hepatitis B. N Engl J Med. 2006;354(10):1001-10. [ Links ]
22. Gish RG, Lok AS, Chang TT, de Man RA, Gadano A, Sollano J. Entecavir therapy for up to 96 weeks in patients with HBeAg-positive chronic hepatitis B. Gastroenterology. 2007;133:1437-44. [ Links ]
23. Calleja JL, Penas B. Entecavir: A new hope for the treatment of chronic hepatitis B en español. Gastroenterol Hepatol. 2007;30:285-93. [ Links ]
24. Miquel M, Nuñez O, Trapero-Maraguán M, Díaz-Sánchez A, Jiménez M, Arenas J. Efficacy and safety of entecavirand/or tenofovir in hepatitis B compensated and decompensated cirrhotic patients in clinical practice. Ann Hepatol. 2013;12:205-12. [ Links ]
25. Hall AM, Hendry BM, Nitsch D, O.Connolly J. Tenofovir-associated kidney toxicity in HIV-infected patients: A review ofthe evidence. Am J Kidney Dis. 2011;57:773-80. [ Links ]
26. Marcellin P, Berg T. Effects of tenofovir disoproxil fumarate on renal function in chronic HBV patients in 3 global randomized studie. J Hepatol. 2011;54:S296-7. [ Links ]
27. Buti M. HBeAg-positive chronic hepatitis B: Why do I treat mypatients with nucleos(t)ide analogs? Liver Int. 2014;34 Suppl1:108-11. [ Links ]
28. Ridruejo EM, Silva O. Safety of long-term nucleos (t)idetreatment in chronic hepatitis B. Expert Opin Drug Saf. 2012;11:357-60. [ Links ]
29. Liaw YF, Sheen IS, Lee CM, Akarca US, Paptheodoridis GV, Suet-Hing Wong F. Tenofovir disoproxil fumarate (TDF), emtricitabine-TDF, and entecavir in patients with decompensated chronic hepatitis B liver disease. Hepatology. 2011;53:62-72. [ Links ]













