Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.20 no.3 Bogotá July/Sept. 2016
https://doi.org/10.1016/j.infect.2015.10.001
ORIGINAL
http://dx.doi.org/10.1016/j.infect.2015.10.001
Concordancia entre las técnicas de IFD, PCR y ELISA para determinar la frecuencia de Bordetella parapertussis y Bordetella pertussis en un brote de tos ferina en el departamento de Antioquia (Colombia) en 2013
Efraín Andrés Montilla-Escudero * , Fabiola Rojas-Baquero y Adriana Paola Ulloa-Virguez
Grupo de Microbiologia, Direccion de Redes en Salud Pública, Instituto Nacional de Salud, Bogotá, Colombia
Recibido el 6 de julio de 2015; aceptado el 7 de octubre de 2015
Disponible en Internet el 17 de diciembre de 2015
Resumen
Objetivo: Obtener la concordancia de técnicas diagnósticas y confirmar el diagnóstico de los casos probables de tos ferina captados por inmunofluorescencia directa (IFD) durante un brote en 2013 en el departamento de Antioquia.
Materiales y métodos: Se analizaron los datos demográficos, clínicos, epidemiológicos y de resultados de laboratorio de casos probables de tos ferina confirmados por IFD en un pico de tos ferina en 2013 en el departamento de Antioquia. Las muestras de aspirado nasofaríngeo y suero fueron recolectadas y recibidas entre los periodos epidemiológicos IV - VII de 2013. Todos los pacientes confirmados por IFD fueron confirmados por PCR o ELISA. El análisis de concordancia se realizó por índice kappa.
Resultados: De las 180 muestras procesadas en el LSP de Antioquia, 134 (74%) fueron positivas por la técnica de IFD, de las cuales se confirmaron por PCR 109 muestras con 24 (22%) positivas para B. parapertussis , 3 (2,8%) para B. pertussis , 17 (15,6%) para Bordetella spp. y 18 (16,5%) con infección mixta por B. pertussis y B. parapertussis . De 81 casos que se confirmaron por ELISA, 31 (38,3%) fueron positivos. En el municipio de La Estrella la edad media de los casos confirmados fue de 6,6 años y la mediana de 3 años (rango: 2-4 años). Con respecto a los casos del municipio de Medellín, la edad media fue de 28,7 años y la mediana de 25 años (rango: 12-42 años). En su mayoría, en los síntomas no hubo diferencias significativas, excepto para la tos paroxística entre los casos confirmados de B. parapertussis y B. pertussis (p = <0,04) del municipio de La Estrella. De acuerdo con el índice kappa, los resultados mostraron una fuerza de concordancia pobre y sin grado de acuerdo con los resultados de las pruebas de PCR y ELISA comparados con IFD, índice kappa: (IFD/PCR: K = 0,0944) y (IFD/ELISA: K = - 0,4533).
Conclusiones: Durante este análisis, en el 2013 la población de Antioquia fue afectada por la circulación de B. parapertussis y B. pertussis en población adolescente y adulta en Medellín y en la población de 2-4 años en La Estrella. Actualmente, la PCR y la ELISA son las técnicas adecuadas para el diagnóstico de tos ferina. La IFD por su subjetividad y baja concordancia se encuentra en desuso.
PALABRAS CLAVE
Bordetella pertussis ; Bordetella parapertussis ; Tos ferina; Reacción en cadena de la polimerasa; Ensayo por inmunoabsorción ligado a enzimas; Inmunofluorescencia directa
© 2015 ACIN. Publicado por Elsevier España, S.L.U. Este es un artículo Open Access bajo la CCBY-NC-ND licencia (http://creativecommons.org/licencias/by-nc-nd/4.0/).
Correlation among the DIF, PCR and ELISA techniques for determining the frequency of Bordetella parapertussis and Bordetella pertussis in an outbreak of whoopingcough in the department of Antioquia, Colombia, 2013
Abstract
Objective: To determine the correlation between diagnostic techniques and to confirm the diagnosis of probable cases of whooping cough captured by direct immunofluorescence (DIF) during an outbreak in 2013 in the department of Antioquia.
Materials and methods: We analysed the demographic, clinical, and epidemiological data and the laboratory results of probable cases of whooping cough confirmed by DIF at a peak of whooping cough in 2013 in the department of Antioquia. The nasopharyngeal aspirate and serum samples were collected and received between the epidemiological periods IV - VII of 2013. All patients confirmed by DIF were confirmed by polymerase chain reaction (PCR) and/or enzyme-linked immunosorbent assay (ELISA). The analysis of agreement was performed using the kappa index.
Results: Of the 180 samples processed in the public health laboratory of Antioquia, 134 (74%) were positive using the DIF technique of which 109 samples were confirmed by PCR, with 24 (22%)samples positive for B. parapertussis , 3 (2.8%) for B. pertussis , 17 (15.6%) for Bordetella spp. and18 (16.5%) for mixed infection by B. pertussis and B. parapertussis . Of the 81 cases confirmed by ELISA, 31 (38.3%) were positive. In the municipality of La Estrella, the mean age of the confirmed cases was 6.6 years, and the median was 3 years (range, 2-4 years). For the municipality of Medellin, the mean age was 28.7 years, and the median was 25 years (range, 12-42 years). For most of the symptoms, there were no significant differences, except for paroxysmal cough among the confirmed cases of B. parapertussis and B. pertussis ( p = <.04) in the municipality of La Estrella. According to the kappa index, the results showed poor correlation strength and no agreement with the results of the PCR and ELISA tests compared with DIF, kappa index: (DIF/PCR: K = 0.0944) and (DIF/ELISA: K = - 0.4533).
Conclusions: During this analysis in 2013, Antioquia was affected by the circulation of B. parapertussis and B. pertussis in the adolescent and adult population in Medellin and the 2-4 year-old population in La Estrella. Currently, PCR and ELISA are the recommended techniques for diagnosing whooping cough. Due to its subjectivity and low correlation, DIF is in disuse.
KEYWORDS
Bordetella pertussis ; Bordetella parapertussis ; Whooping cough; Polymerase chain reaction; Enzyme-linked immunosorbent assay; Direct immunofluorescence.
© 2015 ACIN. Published by Elsevier España, S.L.U. This is an open access article under the CCBY-NC-ND license (http://creative commons.org/licenses/by-nc-nd/4.0/).
http://dx.doi.org/10.1016/j.infect.2015.10.001
0123-9392/© 2015 ACIN. Publicado por Elsevier España, S.L.U. Este es un artículo Open Access bajo la CC BY-NC-ND licencia (http://creativecommons.org/licencias/by-nc-nd/4.0/).
Introducción
La tos ferina es una enfermedad prevenible por vacuna,altamente contagiosa, causada por Bordetella pertussis(B. pertussis) , un cocobacilo gramnegativo no fermentador, de requerimientos nutricionales especiales, que afectaexclusivamente al humano, que es el único reservorio 1 . Laenfermedad tiene un amplio espectro de manifestacion esclínicas que depende de la edad del diagnóstico, estado devacunación, previa infección con el microorganismo, transferencia pasiva de anticuerpos, tratamiento antimicrobiano,entre otras 2-6.
La infección causada por B. parapertussis produce uncuadro que se distingue por manifestaciones clínicas menosseveras que las de la tos ferina y que se presenta con menorfrecuencia que B. pertussis 7,8 . Las infecciones causadas por B. pertussis, B. parapertussis , entre otros agentes bacterianos y virales que causan síndrome coqueluchoide, puedenser indistinguibles y, por tanto, el diagnóstico por técnicas de laboratorio es necesario para especificar el agenteetiológico 9 .
Las metodologías actualmente utilizadas para la detección de B. pertussis y B. parapertussis son el cultivo y la reacción en cadena de la polimerasa (PCR) 10,11. El ensayo por inmunoabsorción ligado a enzimas (ELISA) con sueros pareados para la detección del isotipo IgG contra la toxina pertussis es útil para el diagnóstico de tos ferina causada por B. pertussis , sin embargo, se necesitan sueros pareados (lapso de 15 días) para obtener un resultado 12. En casos especiales, se puede realizar un ELISA utilizando un solo espécimen; no obstante, se debe tener en cuentalas restricciones de su uso como diagnóstico, a menosque estos análisis se realicen en un contexto de brote, principalmente cuando estén involucradas las poblaciones adolescente y adulta 13,14. La inmunofluorescencia directa(IFD) es un ensayo observador dependiente que actualmente no se recomienda como diagnóstico para tos ferina debido a la baja sensibilidad y especificidad comparadas con las técnicas actualmente avaladas: PCR, ELISA y cultivo 15,16.
La vigilancia de la tos ferina en Colombia se realiza a través de la notificación individual de casos probables y a través de las búsquedas secundarias como la búsqueda activa institucional, la cual se define como la notificación de un caso positivo desde el Laboratorio de Salud Pública (LSP) con el fin de evaluar las búsquedas trimestrales de las instituciones de salud en donde se atendió el caso en los registros de atención, y como la búsqueda activa comunitaria, la cual consiste en la indagación o rastreo intencionado de casos probables de tos ferina que puedan estar ocurriendo o pudieron haberse presentado en la comunidad y que no hayan consultado a una institución de salud 17-19 .
Como medida de prevención se cuenta con la vacuna de DPT (difteria, Bordetella pertussis de célula entera y tétanos) y, de acuerdo con el esquema nacional de vacunación del Programa Ampliado de Inmunización (PAI) del Ministerio de Salud y Protección Social (MSPS), se cuenta también con la aplicación de la vacuna pentavalente (difteria, tétanos, pertussis, hepatitis B recombinada y Haemophilus influenzae tipo b) a los 2, 4 y 6 meses de edad con 2 refuerzos a los 18 meses y a los 5 años con la vacuna de DPT. Para el 2013 la cobertura fue del 91% en Colombia para las 3 primeras dosis 17 . Como medida de tratamiento antimicrobiano, los medicamentos recomendados son la claritromicina y la eritromicina, y aunque el medicamento recomendado para los menores de un año es la azitromicina, en el 2013 no se encontraba cubierto por el Plan Obligatorio de Salud para el tratamiento de tos ferina.
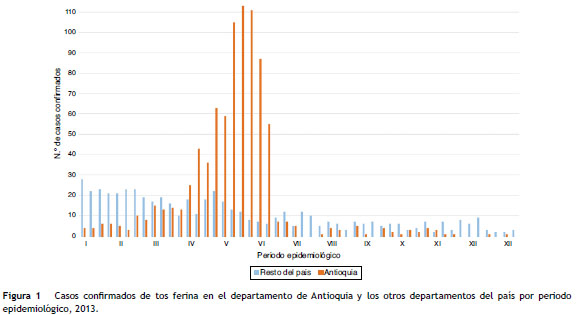
En Colombia han existido múltiples brotes de tos ferina, sin embargo, pocos se publican y reportan como diagnóstico la PCR en tiempo real. No obstante, algo parecido se reportó en un brote de 2006 en Cesar, donde los casos confirmados pertenecían a una comunidad indígena en la que la PCR de formato convencional para la detección única de IS 481 detectó un mayor número de casos positivos comparada con la IFD: 6 casos que fueron positivos para PCR pero negativos para IFD 20 . En el 2012, la Organización Panamericana de la Salud emitió una alerta epidemiológica para Colombia, Canadá, Argentina, Chile y los Estados Unidos, la cual contenía un llamado de atención para que estuvieran preparados en la prevención, control y diagnóstico de tos ferina debido al aumento de los casos confirmados 21 . En 2013, la Secretaría Seccional de Salud y Protección Social de Antioquia detectó un aumento de casos confirmados en el departamento por B. pertussis en el periodo epidemiológico iv al vii 22,23 (ver fig. 1), el aumento fue detectado a través de los resultadospor IFD realizados por el LSP de Antioquia y reportado al Grupo de Inmunoprevenibles y Grupo de Microbiología del Instituto Nacional de Salud 22 (INS). Con el fin de caracterizar con técnicas sensibles y específicas (PCR en tiemporeal y ELISA) la situación del departamento, el objetivo del estudio fue obtener la concordancia entre técnicas diagnósticas, y confirmar el diagnóstico de los casos probables de tos ferina captados por IFD durante un pico de tos ferina en 2013.
Materiales y métodos
Muestras
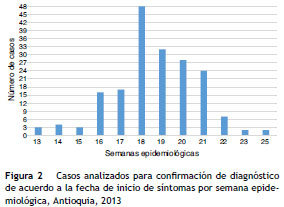
Se recolectaron muestras de aspirados a través de la búsqueda activa comunitaria de contactos sintomáticos de pacientes con resultados positivos para IFD y de la búsqueda activa institucional a través de la revisión mensual de bases de datos del Sivigila de tos ferina del 2013 por el Grupo de Inmunoprevenibles del INS. En total se procesaron 180 aspirados nasofaríngeos por la técnica de IFD realizado porel LSP entre la semana epidemiológica 13 a la semana 25. Las muestras fueron enviadas al Grupo de Microbiología para confirmación de PCR en tiempo real, transportadas a 4 ° C y mantenidas a -20 ° C antes de su procesamiento. De las 180 muestras 109 cumplieron con los criterios de procesamiento por PCR en tiempo real de acuerdo a los lineamiento nacionales 24 . A las 71 muestras rechazadas para el procesamiento por PCR en tiempo real se solicitó toma de muestras de suero para realizar la confirmación de tos ferina por la técnica de ELISA. Los criterios de inclusión para la toma demuestras de suero fueron: pacientes que hubieran comenzado el tratamiento antimicrobiano, y que durante la toma de muestras hubiesen estado dentro de la ventana de los 15 días hasta los 3 meses a partir del inicio de los síntomas, pacientes mayores de 10 años sin antecedente de aplicación de vacuna o con un mínimo de 2 años entre el inicio de síntomas y la aplicación de la última dosis de DPT 14,25 . En la figura 2 se muestra por semana epidemiológica de acuerdo con la fecha de inicio de síntomas de los casos probables analizados.
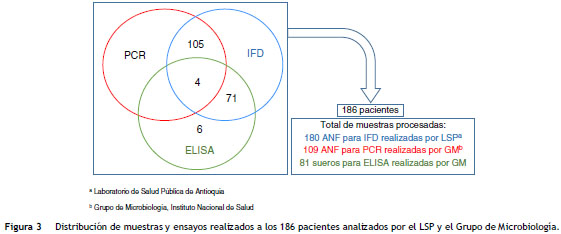
Consecuentemente, la Secretaría de Salud de Antioquia envió los 71 sueros para la confirmación por ELISA y adicionalmente envió 6 sueros de contactos sintomáticos que habían iniciado tratamiento profiláctico y no habían tenido resultado de IFD ni muestra nasofaríngea. Agregado a lo anterior, también recolectaron 4 sueros de pacientes que habían sido analizados por IFD y PCR, pero que en el momento de la toma del aspirado nasofaríngeo habían comenzado el tratamiento antimicrobiano, por lo cual se analizaron 81 muestras de suero para ELISA. En total se procesaron 370 muestras para diagnóstico y confirmación de B. pertussis con las técnicas de IFD, PCR y ELISA que pertenecían a 186 casos probables (ver fig. 3).
Obtención de datos demográficos, clínicos, epidemiológicos y de laboratorio
Se realizó un estudio descriptivo transversal retrospectivo. Se analizaron los datos de la fecha de inicio de síntomas, dosis de vacuna, síntomas, duración de la tos y resultados de laboratorio recolectados de la base de datos de Sivigila 2013, de la base de datos del laboratorio de Antioquia y de la base de datos del Grupo de Microbiología. Los especímenes recolectados pertenecían a casos de los municipios de La Estrella (n: 94; 50,5%), Medellín (n: 62; 33,3%), San José de la Montaña (n: 16; 8,6%), Itagüí (n: 6; 3,2%), Pueblorrico(n: 3; 1,6%), Girardota (n: 2; 1,1%), Sabaneta (n: 2; 1,1%) y Rionegro (n: 1; 0,5%).
Ensayo de reacción en cadena de la polimerasa
A las 109 muestras de aspirado nasofaríngeo se les realizó la extracción de ADN con el kit de Qiamp DNA mini kit (Qia-gen, Alemania) a partir de 200 µl de muestra y siguiendo las recomendaciones del fabricante; los eluidos obtenidos fueron almacenados a 4 ° C hasta su posterior procesamiento. Las secuencias de iniciadores y las sondas usadas en el análisis fueron las reportadas por Tatti et al. 9 con modificación en los fluoróforos, quencher, concentración de sonda para IS 481 y la ausencia de sondas e iniciadores para B. holmesii (ver tabla 1).

La PCR dúplex fue diseñada para la búsqueda de B. parapertussis y Bordetella spp. usando en la misma reacción los blancos pIS 1001 e IS 481. Se realizó una PCR singleplex para la búsqueda de la toxina pertussis ( ptx S1) con el fin confirmar la presencia de B. pertussis cuando el resultado era positivo para IS 481 . Las dos PCR se realizaron en un volumen final de 25 µl con adición de 4 µl de ADN a una concentración de 2X de máster mix TaqMan Gene Expression (Applied Biosystems). Las condiciones de ciclado paralos blancos IS 481 y pIS 1001 fueron 2 min a 50 ? C para activación de la enzima uracilo N-glicosilasa (UNG), denaturación inicial de 10 min a 95 ? C y 45 ciclos con denaturación de 15 sa 95 ? C y anillamiento de 1 min a 60 ? C. El ensayo con ptx S1 se realizó con las mismas condiciones anteriormente descritas, excepto por la temperatura de anillamiento que fue de 57 ° C 26.
Interpretación de la PCR
El resultado del ensayo de PCR se consideró negativo si el valor de Ct fue mayor o igual a 40. Una muestra es positiva para B. pertussis si el valor de Ct para los blancos IS 481 y ptx S1 son menores a 40; se consideró como B. spp. las muestras que presentaban un valor de Ct mayor o igual a 35e igual o inferior a 40 para IS 481 y negativo para ptx S1. Si una muestra es positiva para p IS 1001 con un valor de Ct = 40 con resultado positivo o negativo para ptx S1, se consideró B. parapertussis 9 .
Ensayo de ELISA
Se utilizó el estuche comercial de ELISA para la búsqueda de anticuerpos IgG contra la toxina pertussis de Virion-Serion de acuerdo con el estudio de Rifflemann et al. 27 . El ensayo se realizó según las recomendaciones del fabricante a partir de 10 µl de suero. Las lecturas se realizaron en el equipo Multiskan EX Thermo scientific (Alemania). Se consideraron muestras positivas con resultado = 94 UE/ml 13 . Además, se tuvo en cuenta, en las condiciones de recolección de la muestra, que se hubiese tomado entre la tercera semana y hasta los 3 meses desde el inicio de la presentación de los síntomas, y que la última dosis de la vacuna hubiese sido aplicada con más de 3 años de anterioridad.
Ensayo de IFD
Esta técnica fue realizada por el LSP de Antioquia de acuerdo con las recomendaciones del estuche comercial (Difco TM FA Bordetella pertussis , Beckton Dicikinson, Alemania), en la cual realizaron extendidos de los aspirados nasofaríngeos sobre láminas porta objetos; luego usaron el conjugado comercial de anticuerpos policlonales marcados con isotiocianato de fluoresceína o FITC dirigidos contra los lipoligosacáridos y lipopolisacáridos de la pared de B. pertussis ; por último, examinaron los extendidos en un microscopio de fluorescencia en el objetivo de inmersión (100X).
Análisis de datos
Los datos obtenidos se analizaron con Epi-info 7.1 y Epidat 4.1. La prueba de chi-cuadrado se utilizó para comparar las proporciones de síntomas entre los casos positivos, negativos y por especie. La prueba t, para comparar las medias de duración de síntomas. El índice kappa se utilizó para analizar la concordancia de los resultados obtenidos de la IFD con PCR y ELISA.
Resultados
De las 180 muestras procesadas por el LSP de Antioquia, 134(74%) fueron positivas por la técnica de IFD, de las cuales el 84% eran procedentes de los municipios de Medellín y La Estrella, y de estas muestras los resultados obtenidos por IFD para B. pertussis fueron n = 56 (96,6%) y 55 (58,5%) respectivamente (ver tabla 2). De los 180 aspirados nasofaríngeos procesados por IFD, 109 (61%) muestras se pudieron analizar por PCR, de las cuales 94 eran procedentes del municipio de La Estrella (ver tabla 2); de estas muestras 55 (58,6%) fueron positivas para B. pertussis analizadas por la técnica de IFD, sin embargo, los resultados obtenidos por PCR en tiempo real arrojaron que, de las 94 muestras, 24 (25,5%) eran positivas para B. parapertussis , 18 (19,1%) eran positivas para coinfección B. pertussis y B. parapertussis , 11(11,7%) eran positivas para Bordetella spp. y 2 (2,1%) eran positivas para B. pertussis (ver tabla 2). De acuerdo con los análisis realizados por IFD y por la PCR en tiempo real, de las muestras procedentes del municipio de La Estrella, el 55% de los resultados fueron positivos tanto por IFD como para PCR. Sin embargo, esta coincidencia no se observó reflejada en la concordancia entre las muestras analizadas por las 2 técnicas: PCR positivos e IFD negativos 23 (24%), PCR negativo se IFD positivos 23 (24%), y concordaron entre las 2 técnicas:32 (34%) positivas y 16 (17%) negativas.
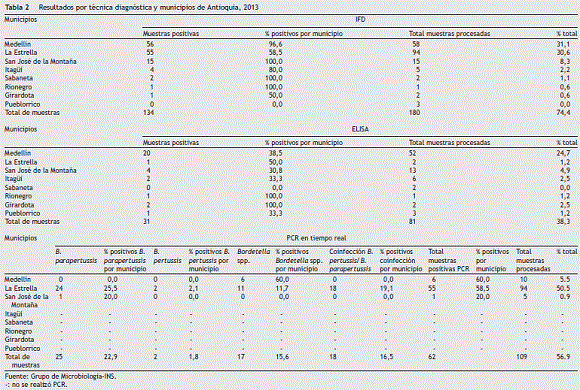
Para las muestras procedentes del municipio de San José de la Montaña todas las muestras, 15 (100%), fueron positivas para B. pertussis de acuerdo con los resultados de IFD. Sin embargo, de estas 5 muestras que se enviaron para confirmar por PCR en tiempo real, ninguna fue positiva para esta especie excepto una (20%) que fue positiva para B. parapertussis. Para las muestras procedentes del municipio de Medellín, de las 58 muestras procesadas para IFD, 56 (96,6%) fueron positivas para B. pertussis ; de estas, 10 muestras fueron enviadas para confirmación por PCR en tiempo real, donde se obtuvo que 6 (60%) muestras fueron positivas para Bordetella spp.
De las 81 muestras recolectadas para ELISA, el 65% pertenecían a los municipios de Medellín y San José de la Montaña, donde 20 (38,5%) y 4 (30,8%) fueron positivas, respectivamente, confirmando la presencia de niveles de anticuerpos asociados a infección por B. pertussis (ver tabla 2). Comparando los resultados de IFD y ELISA para las muestras procedentes del municipio de Medellín, de los 58 pacientes diagnosticados por IFD en Medellín, a 48 (83%) se les pudieron recolectar muestras de suero, donde 18 (37,5%) muestras fueron positivas para ELISA y 56 (96,6%) para IFD. De estas 48 muestras de suero con resultados de IFD, concordaron 18 (37,5%) muestras positivas y 2 (4,2%) negativas y no concordaron 28 (58,3%) muestras que fueron positivas para IFD y negativas para ELISA, que se interpreta como falsos positivos.
De 15 pacientes con muestras para IFD procedentes del municipio de San José de la Montaña solamente se obtuvieron 12 (80%) muestras para ELISA con resultados de IFD, donde 4 (33%) fueron positivas para ELISA de 12 (100%) muestras positivas para IFD. Por lo tanto, 4 (33%) muestras fueron fueron concordantes para las 2 técnicas y 8 (66,6%) muestras fueron positivas para IFD y negativas para ELISA, que se interpretan como falsos positivos.
De acuerdo con los resultados encontrados por las diferentes técnicas, se realizó un análisis de concordancia entre lo emitido por IFD y PCR e IFD con ELISA. Para el análisis de concordancia de IFD y PCR se parte de que del total de 109 muestras procesadas para confirmación por PCR en tiempo real el 50,5% (55) de los resultados concordaron con los emitidos por IFD y el 49,5% (54) no fueron concordantes con la técnica de IFD; de los no concordantes el 28% (31) fueron falsos negativos y el 21% (23) falsos positivos. Tomando como técnica de referencia la PCR, el análisis de concordancia entre las 2 pruebas arrojó un índice kappa K = 0,0944, que se interpreta como fuerza de concordancia pobre (ver tabla3). Con respecto a la concordancia de IFD y ELISA, de 75 pacientes que tenían tanto muestras de suero como aspirado nasofaríngeo, 28 (37,3%) resultados concordaron por las 2 técnicas y 43 (62,7%) no concordaron y, de estos resultados, 43 (57,3%) fueron falsos negativos y el 5,3% (4) fueron falsos positivos. Tomando como técnica de referencia la ELISA, el análisis de concordancia entre las 2 pruebas arrojó uníndice Kappa K= - 0,4533 que se interpreta como grado de no concordancia (ver tabla 3).

El 88% (164) de los casos probables se encontraron registrados en Sivigila; por tanto, el 12% (22) de los casos no tenían la información clínica ni epidemiológica ingresada al sistema nacional de vigilancia. Del total de casos probables, 81 (43,5%) fueron casos confirmados por ELISA o PCR, de los cuales estaban registrados en Sivigila 73 (90,1%) casos. La media de duración de tos fue de 9,4 días para los casos confirmados por PCR o ELISA, y la de casos negativos fuede 10,8 días, sin diferencias estadísticamente significativas (tabla 4). Con referencia a los otros síntomas registrados para los casos positivos, el 41,9% presentaron tos paroxística, 26,6% vómito postusivo y 10% apnea, sin diferencias significativas al compararlos con los casos negativos (ver tabla 4).
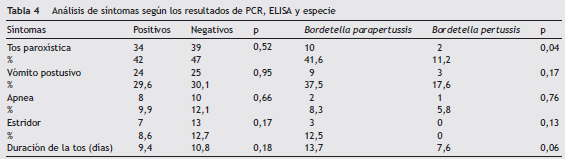
Con un total de 41 pacientes positivos para B. parapertussis y B. pertussis se encontró que la media de duración de tos fue mayor para los casos de B. parapertussis con 13,7 días comparada con 7,6 días de los casos con B. pertussis , sin diferencias estadísticamente significativas (tabla 4), aunque el 49% de los pacientes tenían tos de másde 2 semanas para los casos de B. pertussis comparada con el 41% de los casos de B. parapertussis . No obstante, hubo diferencia significativa en la proporción de tos paroxística de los casos de B. parapertussis comparada con los casos de B. pertussis (ver tabla 4).
La edad media de los casos positivos en el municipio de La Estrella fue de 6,6 años y la mediana de 3 años (rango inter-cuartil: 2-4 años); de las 94 muestras procedentes de este municipio 55 (58,5%) fueron positivas por PCR o ELISA, de las cuales 50 (91%) de estos casos tenían registrado el antecedente de vacunación en Sivigila. En la tabla 5 se muestra por rangos de edad el antecedente de vacunación de los casos positivos, donde se observa que el 86% (n = 43) de los casos se encuentran en el rango de edad de 1-4 años donde el79% (n = 34) tenían el esquema completo para 3 dosis y un refuerzo de acuerdo con el esquema de vacunación. Por otro lado, el 11% (n = 5) tenían esquemas incompletos y el9% (n = 4) no tenían ninguna dosis aplicada (ver tabla 5).
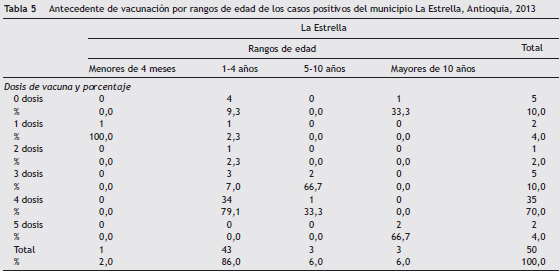
Analizando los resultados de especie y el estado de vacunación se observa en general para este municipio que el 70%(n = 35) tenían un esquema completo de los cuales el 10%(n = 5) fueron positivos para B. pertussis y el 24% (12) presentaban coinfección de B. pertussis - B. parapertussis (ver tabla 6) .

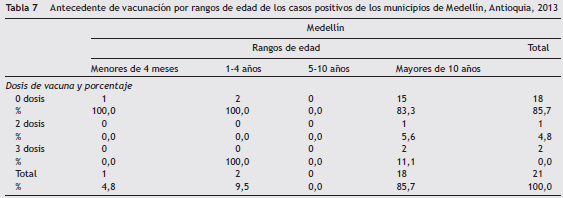
La edad media de los casos positivos en el municipio de Medellín fue de 28,7 años y la mediana de 25 años (rangointercuartil: 12-42 años). De las 58 muestras procedentesdel municipio de Medellín, el 38% (n = 22) fueron positivaspor PCR o ELISA, de las cuales el 95% (n = 21) tenían antecedente de vacunación registrado en Sivigila. En la tabla 7 se observa que el 86% (n = 18) de los casos positivos en Medellín se agruparon en el rango de edad de mayores de 10 años y el 83% (n = 15) no tenían ninguna dosis de vacuna aplicada,6% (n = 1) 2 dosis y el 11% (n = 2) 3 dosis y, de acuerdo con el 100,0 esquema de vacunación, ninguno de los casos cumplió con el esquema. En cuanto a los resultados por especie, todos los casos en Medellín fueron positivos para B. pertussis.
Discusión
Los resultados del diagnóstico realizado a los casos probables de tos ferina con la técnica de IFD no fueron concordantes comparados con la técnica de PCR. De acuerdo con lo encontrado en la literatura, la técnica tiene una baja sensibilidad para detectar casos: 11,4% 28 , 18% 29 y 52,2% 16 . Al comparar los resultados de IFD con ELISA el 89% (n = 67) fueron muestras positivas para ELISA y el 37% (n = 28) para IFD. Solo el 32% (n = 24) de las muestras eran concordantes como positivas de las 75 muestras analizadas por las 2 técnicas. Actualmente la ELISA es una de las técnicas con mayor sensibilidad recomendada por el CDC y FDA para confirmaciónde brotes 10 .
En los protocolos usados para diagnóstico 9,10 de tos ferina por el laboratorio, se realiza de forma rutinaria la especiación de las muestras debido a que diferentes agentes pueden causar manifestaciones clínicas similares a la tos ferina 30,31 . De acuerdo con los hallazgos de este estudio, al comparar los resultados de especies entre PCR e IFD, solo el 24% (n = 26) de las muestras fueron positivas para el blanco IS 481 del 57%(n = 62) de muestras positivas por IFD. Estos resultados indican que el 33% (n = 36) de las muestras analizadas por IFD no era B. pertussis . El conjugado que se usó para el diagnóstico en el LSP de Antioquia no detecta B. parapertussis y los resultados de la confirmación mostraron que el 22%(n = 24) de las muestras positivas eran B. parapertussis , que se puede interpretar como una posible reacción cruzada. En general, la especificidad de la IFD es baja. De acuerdo conun brote en Canadá en el periodo 1989-1991 donde el LSP delnorte de Alberta (Canadá) encontró que la especificidad deIFD comparada con la PCR era del 58,3% 32 , donde el 87% de las muestras eran falsos positivos y el 35% cumplían con los criterios de inclusión de caso probable; también evaluaron la reactividad cruzada con patógenos aeróbicos, anaerobios del microbioma de la cavidad oral y de la nasofaringe, en la cual encontraron que 3 microorganismos tenían reactividad cruzada con la prueba de IFD comercial 32 , por tanto, los resultados de IFD con anticuerpos poli- o monoclonales son dependientes del número de microorganismos presentes en la muestra y por tener la característica de ser un ensayo observador dependiente, subjetiva y codependiente de la experiencia del analista puede causar imprecisiones a la hora de interpretar la técnica. Según los análisis realizados con el índice kappa, se encontró un grado muy bajo de concordancia entre la técnica de IFD comparada con PCR y ELISA. Por tal razón, en el 2006 los Centros para el Control y Prevención de las Enfermedades (CDC), con el apoyo de la escuela de medicina de Harvard, publicaron en el reporte semanal de morbimortalidad (MMWR) que los métodos diagnósticos adecuados para confirmar casos de tos ferina son el cultivo, la PCR y la serología.
En el municipio de La Estrella, los resultados de PCR mostraron que, del total de casos positivos, el 42% (n = 23) eran B. parapertussis y el 33% (n = 18) presentaron infección mixta de B. parapertussis y B. pertussis. Por tanto, el 75% de los pacientes estaban infectados con B. parapertussis , que era el principal agente causal de la sintomatología en los pacientes entre 1 y 4 años clasificados como casos probables de tos ferina en ese municipio. Esta frecuencia es mayor que la observada en la provincia pakistaní de Khyber Pukhtoonkhawa, donde se ha reportado una frecuencia del 35% 33, en Alemania con el 36% en la vigilancia de 1993-1995 34 o en Finlandia con el 39,2% de 1994-1997 35 . Una duración de tos superior a 2 semanas se presentó en el 49 yel 41% de los casos confirmados para B. pertussis y B. parapertussis , respectivamente. Este resultado contrasta con lo encontrado en Alemania en el periodo 1992-1994 en que la proporción de tos de duración mayor a 2 semanas para B. pertussis y B. parapertussis fue del 26 y del 18%, captando el 57 y el 37% de los casos en la cuarta semana desdeel inicio de los síntomas; este hallazgo puede indicar demanera indirecta una oportuna intervención de la Secretaríade Salud de Antioquia y su red hospitalaria en la captaciónde casos sospechosos de tos ferina 36,37 . El 70% de los casos en La Estrella tenían un esquema completo de vacunación. Sin embargo, la vacunación está dirigida a B. pertussis y estudios en modelos murinos han demostrado que la vacuna celular tiene una eficacia menor contra B. parapertussis que contra B. pertussis 38 . No obstante, el 30% de los casos no tenían el esquema completo de vacunación, lo que aumentó la probabilidad de ser una población susceptible y transmisora de B. pertussis .
Frecuentemente los casos positivos para B. pertussis presentan con mayor frecuencia tos paroxística comparados con B. parapertussis 8 . No obstante, en el municipio de La Estrella se encontraron más casos de paroxismos por B. parapertussis que con B. pertussis. Este hallazgo ha sido encontrado en 1/3 de los niños que han presentado manifestaciones típicas de tos ferina causadas por B. pertussis 36 . Aunque en general no se encontraron diferencias en la presentación de síntomas con excepción de la tos paroxística, tanto entre los confirmados por B. parapertussis como por B. pertussis , algunos estudios han reportado que existen diferencias en la media de recuento de leucocitos, causada, probablemente, por la producción de la toxina pertussis en B. pertussis y la no transcripción de este factor de virulencia en B. parapertussis por la ausencia de la zona promotora del gen 36,39 . Actualmente el recuento de leucocitos no se reporta en la ficha epidemiológica en Colombia, dato que podría aportar información en la clasificación de los casos. La discriminación por síntomas para asociar un agente etiológico causante del síndrome coqueluchoide sigue siendo unreto para el diagnóstico clínico, debido a la amplia lista de microorganismos que causan este síndrome: virus sincitial respiratorio, Chlamydophila pneumoniae , Mycoplasmapneumoniae y B. parapertussis , entre otros 30,31. Por talrazón es necesario que los laboratorios clínicos y, especialmente, los laboratorios de referencia regionales tengan técnicas lo suficientemente específicas para conocer los agentes etiológicos que circulan en la población y para que sean un aporte a la toma de decisiones clínicas y de control, entre otras.
En el municipio de Medellín los casos no fueron confirmados por PCR. No obstante, el ELISA fue un ensayo fundamental para confirmar los casos por B. pertussis en adolescentes y adultos, por tal razón actualmente se ha convertido en la técnica para el diagnóstico en estos grupos de edad, debido a la mayor sensibilidad del ensayo en las etapas tardías de la enfermedad 14 . De los casos positivos en la población adolescente y adulta en Medellín, ninguno tenía el esquema completo de vacunación. No obstante, se ha reportado que la duración máxima de la inmunidad por vacuna celular en promedio se puede mantener 6 años; por tanto, la protección en Colombia, cumpliendo con el calendario de vacunación cuando el último refuerzo se aplica a los 5 años se puede deducir que la vacuna puede inducir una respuesta protectora hasta los 11 años de edad de acuerdo con los estudios de efectividad en la vacuna 37 . Actualmente se conoce que la principal fuente de transmisión de la tosferina en neonatos e infantes 40 es la población adolescente y adulta, sin embargo esta población tambien es susceptible a presentar la enfermedad como se reporta en varios países con alta cobertura. En Estados Unidos se encontró en el periodo 2006-2010, en pacientes entre 50 y 65 años, la incidencia reportada estuvo entre 2,1 y 4,1 casos/100.000 habitantes 41 . En Colombia también se han reportado casos en estas poblaciones: en el periodo 2012-2013 se confirmaron 596 y 458 casos, respectivamente, en mayores de 15 años 42,43 y, de acuerdo con los datos encontrados en este estudio, 23 (12,4%) pacientes confirmados eran mayores de 18 años. De acuerdo con los hallazgos históricos, tener la posibilidad de considerar más medidas de control como la aplicación de un refuerzo de vacuna en adolescentes y adultos que disminuiría la incidencia en esta población, y también minimizaría la probabilidad de contagio a los menores de un año, que son los más afectados 40,44 .
En los últimos años se han reportado brotes de tos ferina a nivel mundial. En el 2012 el Secretario de Salud del Estado de Washington declaró una epidemia de tos ferina, puesto que el número de casos notificados en Washington en 2012 había llegado a 2.520 (37,5 casos/100.000 habitantes) un aumento de 1.300% comparado con el mismo periodo en 2011 y el mayor número de casos notificados que en cualquier otro año desde 1942; la frecuencia de B. pertussis y B. parapertussis fue de 90,7 y 5,7% respectivamente 45 . Se han presentado brotes con diferentes especies de Bordetella de los que se han descrito recientemente fue en Ohio donde la coinfección entre B. pertussis con 48 (29%) casos confirmados y B. holmesii con 112 (68%) muestras de 164 muestras de 298 muestras en total fueron captadas por PCR múltiple 7. En la ciudad de San Petesburgo en Rusia, en el periodo 1998-2000, la frecuencia de B. parapertussis osciló en un 13%, incluyendo las infecciones mixtas con B. pertussis 46 . En Finlandia, un estudio en el periodo 1994-1997 señaló que lafrecuencia de B. parapertussis fue del 32 y del 7,2% en infecciones mixtas 35 ; las especies fueron diferenciadas por PCR y cultivo.
El 12% de los pacientes no estaban registrados en Sivigila, por lo tanto, es necesario hacer un llamado de atencióna los grupos de vigilancia epidemiológica para disminuir lasubnotificación. La especiación del género Bordetella encasos probables de tos ferina es fundamental para confirmar el agente causal 9,26,46 . No se realizaron cultivos durante el periodo de estudio, debido a que el ensayo no estaba implementado durante la época del brote en el LSP. Hay que considerar que, aunque se mantuvieron las muestras en congelamiento ( - 20 ° C), realizar cultivos posteriormente sin las condiciones mínimas de temperatura (4 ° C a 35 ° C) o sin mantener los aspirados después de obtenidos en medios de transporte semisólidos Regan Lowe y sin cultivarlos en menos de una semana en placas de medio Regan Lowe, hace que la probabilidad de recuperar el microorganismo hubiera sido mínima 24,47,48 . Fortalecer el cultivo no es solo importante para el diagnóstico, sino también para la vigilancia por el laboratorio, debido a que los aislamientos recuperados pueden analizarse por medio de tecnologías de tipificación molecular, por ejemplo: electroforesis de campos pulsados ( Pulsed-field Gel Electrophoresis ) 49 , tipificación multilocus de secuencias ( Multilocus sequence typing ) 50 , análisis de las repeticiones en tándem de número variable en múltiples loci ( Multiple-Locus Variable number tandem repeatAnalysis ) 51 y la secuenciación de genoma completo 52, entre otras. Estas herramientas ofrecen la oportunidad de entender los cambios de la población de B. pertussis en el tiempo 49 , la caracterización específica de brotes 53 , la búsqueda de relaciones entre los aislamientos circulantes y las cepas o antígenos usados en vacunas 54, y el efecto de la vacunación en la evolución del microrganismo 52, entre otros.
En Colombia para el 2012 de todos los casos reportados anivel nacional el 61,2% (n = 2.419) de los casos confirmados no tenían ninguna dosis aplicada de vacuna, de los cuales 932 (38,5%) casos ocurrieron en menores de 2 meses, lo que explica el alto número de casos. Sin embargo, también se observaron casos en población vacunada: por ejemplo,de 580 casos, el 58,2% tenían aplicada la primera dosis en el rango de edad 2-3 meses, el 43,3% de 223 casos confirmados tenían aplicada la segunda dosis en el rango de edad de 4-5 meses y el 45,5% de 357 casos tenían la tercera dosis en el rango de edad de 6-11 meses. Para 2013 aumentó esta cifra de casos en población vacunada dondeel 38% de 472 casos en el rango de edad de 4-5 meses tenían la segunda dosis y el 45,5% de 357 casos en elrango de edad de 6-11 meses tenían la tercera dosis 23,42,55 . De acuerdo con este estudio, también se halló que de un 70% (n = 35) de los casos confirmados con esquema completo, el 10% (n = 5) fueron infectados por B. pertussis yel 24% (n = 12) de los casos con infección mixta dentro del rango de 1-4 años. Por tanto, obtener aislamientos a partir de la vigilancia por laboratorio sirve para conocer el tipo de cepas circulantes, debido a la evidencia de cambios en las características antigénicas y genotípicas de las cepas circulantes de B. pertussis. Por ejemplo, se ha reportado que los alelos que expresan los diferentes antígenos de las cepas circulantes en gran parte difieren de los expresados por las cepas utilizadas en la producción de vacunas 56,57 .
Desde el 2007, la Organización Mundial de la Salud (OMS) en cooperación con CDC han recomendado que la técnica adecuada para realizar el diagnóstico de tos ferina (definida como enfermedad causada por B. pertussis ) sea la PCR en tiempo real debido a la alta sensibilidad y especificidad. Por otro lado, esta técnica tiene la característica de obtener resultados oportunos que mejoran y apoyan las acciones en salud pública. Otra ventaja es que desde un mismo ensayo se puede realizar la especiación de las muestras que aumenta la búsqueda de otras especies de Bordetella 9,10,15 . En la actualidad, Colombia, dentro de los lineamientos nacionales, recomienda el uso de esta técnica para el diagnóstico 24 . Sin embargo, preocupa que 33 de los 35 LSP no tengan implementada la técnica molecular y hasta el momento se siga centralizando el diagnóstico en el Laboratorio Nacional de Referencia (Grupo de Microbiología, INS) 55 , lo que afecta a la oportunidad de los resultados en un evento de notificación obligatoria y de impacto en salud pública.
Se aclara que el LSP de Antioquia en el 2013 realizó el diagnóstico con IFD, técnica con la que se venía trabajando desde 1995 y que a partir de varias capacitaciones y actualizaciones con el Grupo de Microbiología del INS, el LSP ha pasado por un proceso de transición con las 2 técnicas (IFD-PCR) desde finales de 2013 hasta 2015 y actualmente realiza el ensayo molecular y el cultivo como pruebas diagnósticas. Entre las limitaciones de este análisis están que no se realizó el diagnóstico por cultivo para el aislamiento de los agentes involucrados en el brote y no se obtuvo muestra de suero para los pacientes con resultado de PCR con el fin de haber obtenido la concordancia entre la PCR y la ELISA.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran quehan seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos A la doctora Diana Posada del Laboratorio de Salud Pública de Antioquia y a la doctora Marcela Arrubla del Grupo deVigilancia de la Secretaría de Salud de Antioquia.
* Autor para correspondencia. Correo electrónico: emontilla@ins.gov.co (E.A. Montilla-Escudero).
Bibliografía
1. Matto S, Cherry JD. Molecular pathogenesis, epidemiology, and clinical manifestations of respyratory infections due to Bordetella pertussis and other Bordetella subspecies. Clin Microbiol Rev. 2005:326-82. [ Links ]
2. Irena N, Ema KGB, Rimantas E. Clinical presentation of pertussis in fully immunized children in Lithuania. BMC Infect Dis. 2005;5. [ Links ]
3. Preziosi MP, Halloran E. Effects of pertussis vaccination on disease: Vaccine efficacy in reducing clinical severity. Clin Infect Dis. 2003;37:772-9. [ Links ]
4. Tozzi AE, Rava L, Ciofi degli Atti ML, Salmaso S. Clinical presentation of pertussis in unvaccinated and vaccinated children in the first six years of life. Pediatrics. 2003;112:1069-75. [ Links ]
5. Yaari E, Yafe-Zimerman Y, Schwartz SB, Slater PE, Shvartzman P, Andoren P, et al. Clinical manifestations of Bordetella pertussis infection in immunized children and young adults. CHEST.1999:1254-8. [ Links ]
6. Heininger U. Recent progress in clinic and basic research. Eur J Pediatr. 2001;160:203-13. [ Links ]
7. Rodgers L, Martin SW, Cohn A, Budd J, Marcon M, Terranella A, et al. Epidemiologic and laboratory features of a large out-break of pertussis-like illnesses associated with cocirculating Bordetella 2010-2011. Clin Infect Dis. 2013;56:322-31. [ Links ]
8. Mastrantonio P, Stefanalli P, Giuliano M, Herrera Rojas Y, Ciofi Degli Atti M, Anemona A, et al. Bordetella parapertussis infection in children: Epidemiology, clinical symptoms, and molecular characteristics of isolates. J Clin Microbiol. 1998;36:999-1002. [ Links ]
9. Tatti KM, Sparks KN, Boney KO, Tondella ML. Novel multitarget real-time PCR assay for rapid detection of bordetella species inclinical specimens. J Clin Microbiol. 2011;49:4059-66. [ Links ]
10. World Health Organization. Laboratory manual for the diagnosisof whooping cough caused by Bordetella pertussis/Bordetellaparapertussis; 2014 [consultado 15 Ene 2015]. Disponible en: http://apps.who.int/iris/bitstream/10665/127891/1/WHOIVB14.03 eng.pdf [ Links ]
11. Faulkner A, Skoff T, Martin S, Cassiday P, Tondella ML. Pertussis. En: Roush SW, Baldy LM, editores. Manual for the surveillance of vaccine-preventable diseases. Atlanta: Centers for Disease Control and Prevention; 2012, pp.10.1-10.12. [ Links ]
12. Menzies SL, Kadwad V, Pawloski LC, Lin TL, Baughman AL, Martin M, et al. Development and analytical validation of animmunoassay for quantifying serum anti-pertussis toxin antibodies resulting from Bordetella pertussis infection. Clin Vaccine Immunol. 2009;16:1781-8. [ Links ]
13. Baughman AL, Bisgard KM, Edwards KM, Guris D, Decker MD, Holland K, et al. Establishment of diagnostic cut off points for levels of serum antibodies to pertussis toxin, filamentous hemagglutinin, and fimbriae in adolescents and adults in the United States. Clin Diagn Lab Inmunol. 2004:1045-53. [ Links ]
14. Vaz-de-Lima L, Martin M, Pawloski L, Leite D, Rocha K, de Brito C, et al. Serodiagnosis as adjunct assay for pertussis infection in São Paulo, Brazil. Clin Vaccine Immunol. 2014;21:636-40. [ Links ]
15. World Health Organization. Laboratory manual for the diagnosis of whooping cough caused by Bordetella pertussis, Bordetella parapertussis. [Online].; 2007 [consultado 1 Mar 2014]. Disponible en: www.who.int/vaccines-documents/. [ Links ]
16. Loeffelholz MJ, Thompson CJ, Long KS, Gilchrist MJ. Comparison of PCR, culture, and direct fluorescent-antibody testing for detection of Bordetella pertussis . J Clin Microbiol. 1999:2872-6. [ Links ]
17. Equipo inmunoprevenibles. Protocolo de vigilancia en salud pública, tosferina. 2014. Protocolo nacional de vigilancia [consultado 15 Ene 2015]. Disponible en: http://www.ins.gov.co [ Links ]
18. Instituto Nacional de Salud. Lineamientos 2015 para la prevención, vigilancia y control en salud pública. 2015. Lineamiento nacional de vigilancia y control [consultado 15 Ene 2015]. Disponible en: http://www.ins.gov.co/lineas-de-accion/Subdireccion-Vigilancia/Lineamientos%20y%20Documentos/01%20LINEAMIENTOS%202015.pdf [ Links ]
19. Instituto Nacional de Salud. Instructivo para la búsqueda activa en la vigilancia enfermedades prevenibles por vacunas. 2011. Intructivo de búsqueda activa para Colombia. [consultado15 Ene 2015]. Disponible en: http://www.ins.gov.co/lineas-de-accion/Subdireccion-Vigilancia/Lineamientos%20y%20Documentos/Anexo%203%20Intructivo%20Busqueda%20BAC.pdf [ Links ]
20. Morón L, Cárdenas IM, Gracia M, Moreno J, Campo A. Brote de tos ferina en un asentamiento indígena del municipio de PuebloBello, Cesar, 2006. Inf Quinc Epidemiol Nac. 2008;13:33-48. [ Links ]
21. Pan American Health Organization. Epidemiological alert pertussis (whooping cough). En: Alerta epidemiológica. PAHO/WHO; 2012 [consultado 17 Mar 2013]. Disponibleen: http://www.paho.org/hq/index.php?option=com docman&task=docview&gid=17052&Itemid [ Links ]
22. Ulloa A. Informe de vigilancia de tos ferina, periodo epidemiológico VII. Informe de evento. Bogotá: Instituto Nacional de Salud, Dirección de Prevención y Análisis del Riesgo en Salud Pública; 2013. [ Links ]
23. Villalobos A. Informe del evento de tos ferina, hasta el periodo epidemiológico XIII, Colombia, 2014. Informe de evento tosferina. Bogotá: Instituto Nacional de Salud, Dirección de Prevención y Análisis del Riesgo en Salud Pública; 2014. [ Links ]
24. Montilla Escudero EA, Rojas Baquero F. Guía para la vigilancia por laboratorio de tos ferina; 2014 [consultado 2 Mar 2015].Disponible en: http://www.ins.gov.co/tramites-y-servicios/examenes-de-inter%C3%A9s-en-salud-publica/Microbiologa/Forms/AllItems.aspx [ Links ]
25. Hallander H, Ljungman M, Storsaeter J, Gustafsson L. Kinetics and sensitivity of ELISA IgG pertussis antitoxin after infection and vaccination with Bordetella pertussis in young children, 117. APMIS; 2009. p. 797-807, 11. [ Links ]
26. Tatti K, Wu K, Tondella M, Cassiday P, Cortese M, Wilkins P. Development and evaluation of dual-target real-time polymerase chain reaction assays to detect Bordetella spp. Diagn Microbiol Infect Dis. 2008;61:264-72. [ Links ]
27. Riffelmann M, Thiel K, Schmetz J, Wirsing von Koenig CH. Performance of commercial enzyme-linked immunosorbent assays for detection of antibodies to Bordetella pertussis . J Clin Microbiol. 2010;48:4459-63. [ Links ]
28. Tilley P, Kanchana M, Knight I, Blondeau J, Antonishyn N, Deneer H. Detection of Bordetella pertussis in a clinical laboratory by culture, polymerase chain reaction, and direct fluorescent antibody staining; accuracy, and cost. Diagn Microbiol Infect Dis.2000;37:17-23. [ Links ]
29. She RC, Billetdeaux E, Phansalkar AR, Petti CA. Limited applicability of direct fluorescent-antibody testing for Bordetella sp. and Legionella sp. specimens for the clinical microbiology laboratory. J Clin Microbiol. 2007;45:2212-4. [ Links ]
30. Walsh P, Overmeyer C, Kimmel L, Feola M, Pusavat J, Tuan AnhNguyen B, et al. Prevalence of Bordetella pertussis and Bordetella parapertussis in samples submitted for RSV screening. West J Emerg Med. 2008;9:135-40. [ Links ]
31. Hallander H, Gnarpe J, Gnarpe H, Olin P. Bordetella pertussis: Bordetella parapertussis , Mycoplasma pneumoniae, Chlamydia pneumoniae and persistent cough in children. Scand J Infect Dis. 1999;31:281-6. [ Links ]
32. Ewanowich C, Chui L, Paranchych M, Peppler M, Marusyk R, Albriton W. Major outbreak of pertussis in Northern Alberta, Canada: Analysis of discrepant direct fluorescent-antibody and culture results by using polymerase chain reaction methodology. J Clin Microbiol. 1993;31:1715-25. [ Links ]
33. Bokhari H, Said F, Syed MA, Mughal A, Kazi YF, Heuvelman K, et al. Whooping cough in Pakistan: Bordetella pertussis vs. Bordetella parapertussis in 2005-2009. Scand J Infect Dis. 2011;43:818-20. [ Links ]
34. Liese J, Renner C, Stojanov S, Belohradsky B. Clinical and epidemiological picture of B. pertussis and B. parapertussis infection safter introduction of acellular pertussis vaccines. Arch Dis Child. 2003;88:684-7. [ Links ]
35. He QV, Arvilommi H, Aittanen B, Mertsola J. Whooping cough caused by Bordetella pertussis and Bordetella parapertussis in an immunized population. JAMA. 1998:635-7. [ Links ]
36. Heininger U, Stehr K, Schmitt-Grohé S, Lorenz C, Rost R, Chrisenson P, et al. Clinical characteristics of illness caused by Bordetella parapertussis compared with illness caused by Bordetella pertussis . Pediatr Infect Dis J. 1994;13:306-9. [ Links ]
37. Wirsing von König CH, Halperin S, Riffelmann M, Guiso N. Pertussis of adults and infants. Lancet Infect Dis. 2002;2:744-50. [ Links ]
38. David S, van Furth R, Mooi F. Efficacies of whole cell and a cellular pertussis vaccines against Bordetella parapertussis in a mouse model. Vaccine. 2004;15-16:1892-8. [ Links ]
39. Arico B, Rappuoli R. Bordetella parapertussis and Bordetella bronchiseptica contain transcriptionally silent pertussis toxingenes. J Bacteriol. 1987;169:2847-53. [ Links ]
40. Wiley KE, Zuo Y, Macartney KK, McIntyre PB. Sources of pertussis infection in young infants: A review of key evidence informing targeting of the cocoon strategy. Vaccine. 2013;31:618-25. [ Links ]
41. McGuiness CB, Hill J, Fonseca E, Hess G, Hitchcock W, Krish-narajah G. The disease burden of pertussis in adults 50 years old and older in the United States: A retrospective study. BMC Infect Dis. 2013;13:32. [ Links ]
42. Ulloa AP. Informe del evento de tos ferina, hasta el periodo epidemiológico XIII del año 2012. Bogotá D.C: Instituto Nacional de Salud, Equipo Funcional inmunoprevenible, Dirección de Vigilancia y Análisis del Riesgo en Salud Pública; 2013. [ Links ]
43. Villalobos A, Nieto D. Informe final tos ferina, Colombia, 2013. Bogotá D.C: Instituto Nacional de Salud, Equipo Funcional Inmunoprevenible, Dirección de Vigilancia y Análisis del Riesgo en Salud Pública; 2014. [ Links ]
44. de Greeff SC, Mooi FR, Westerhof A, Verbakel JMM, Peeters MF, Heuvelman CJ, et al. Pertussis disease burden in the household: How to protect young infants. Clin Infect Dis. 2010;50:1339-45. [ Links ]
45. Centers for Disease Control and Prevention. Pertussis Epidemic; Washington: 2012. MMWR. 2012;61:517-522. [ Links ]
46. Kourova N, Caro V, Weber C, Thiberge S, Chuprinina R. Comparison of the Bordetella pertussis and Bordetella parapertussis isolates circulating in Saint Petersburg between 1998 and 2000 with Russian vaccine strains. J Clin Microbiol. 2003;41:3706-11. [ Links ]
47. Morrill W, Barbaree J, Fields B, Sanden G, Martin W. Effects of transport temperature and medium on recovery of Bordetella pertussis from nasopharyngeal swabs. J Clin Microbiol. 1988;6:1814-7. [ Links ]
48. Regan J, Lowe F. Enrichment medium for the isolation of Bordetella. J Clin Microbiol. 1977;6:303-9. [ Links ]
49. Hardwick TH, Cassiday P, Weyant RS, Bisgard KM, Sanden GN. Changes in predominance and diversity of genomic subtypes of Bordetella pertussis isolated in the United States, 1935-1999. Emerg Infect Dis. 2002;8:44-9. [ Links ]
50. King AJ, van Gorkom T, Pennings JL, van der Heide HG, He Q, Diavatopoulos D, et al. Comparative genomic profiling of Dutchclinical Bordetella pertussis genomic profiling of duch clinical Bordetella pertussis isolates using DNA microarrays: Identification of genes absent from epidemic strains. BMC Genomics. 2008;9. [ Links ]
51. Schouls L, van der Heide H, Vauterin L, Vauterin P, Mooi F. Multiple-locus variable-number tandem repeat analysis of Dutch Bordetella pertussis strains reveals rapid genetic changes with clonal expansion during the late 1990s. J Bacteriol. 2004:186. [ Links ]
52. Xu Y, Liu B, Gröndahl-Yli-Hannuksila K, Tan Y, Lu Feng TK, Wang L, et al. Whole-genome sequencing reveals the effect of vaccination on the evolution of Bordetella pertussis . Sci Rep. 2015;5. [ Links ]
53. Bowden KE, Williams MM, Cassiday PK, Milton A, Pawloski L, Harrison M, et al. Molecular epidemiology of the pertussis epidemic in Washington State in 2012. J Clin Microbiol. 2014;52:3549-57. [ Links ]
54. Bottero D, Gaillard ME, Fingermann M, Weltman G, Fernández J, Sisti F, et al. Pulsed-field gel electrophoresis, pertactin, pertussis toxin s1 subunit polymorphisms, and surfaceome analysis of vaccine and clinical Bordetella pertussis strains. Clin Vaccine Immunol. 2007;14:1490-8. [ Links ]
55. Montilla Escudero EA, Villalobos AP. Informe de vigilancia en salud pública de tos ferina, 2011-2014. Análisis del evento. Bogotá: Instituto Nacional de Salud, Dirección de Redes en Salud Pública y Dirección de Vigilancia y Análisis de Riesgo en Salud Pública; 2014. [ Links ]
56. Bart M, Harris S, Advani A, Arakawa Y, Bottero D, Bouchez V, et al. Global population structure and evolution of Bordetella pertussis and their relation ship with vaccination. mBio. 2014;5. [ Links ]
57. Mooi F. Bordetella pertussis and vaccination: The persistence of a genetically monomorphic pathogen. Infect Genet Evol. 2010;10:36-49. [ Links ]













