Introducción
Colombia es un país ubicado en el trópico y endémico para distintas enfermedades febriles agudas de origen infeccioso, de las cuales, en el caso de malaria se puede realizar un diagnóstico oportuno y rápido, no así en las otras causas de síndrome febril no palúdico, por lo que quedan sin diagnóstico etiológico claro. A pesar del intento de la OMS por generar algoritmos diagnósticos y terapéuticos en la enfermedad febril aguda, todavía existe mucha confusión acerca del enfoque y manejo del paciente con fiebre sin foco aparente en el servicio de urgencias y, más aún, en su seguimiento hospitalario e incluso ambulatorio1-3.
Se define síndrome febril agudo (SFA) como el estado mórbido con inicio repentino de fiebre, de menos de 7 días de evolución, en pacientes entre 5 y 65 años, en los cuales no se hayan identificado signos ni síntomas relacionados con un foco infeccioso aparente4. Actualmente, en Colombia existen más de 60 enfermedades infectocontagiosas consideradas de interés en salud pública, con un comportamiento endemoepidémico en más del 85% del territorio nacional, que se manifiestan a través de SFA5. Debido a la diversidad de enfermedades causantes y a la posibilidad de que el cuadro corresponda a un caso de malaria, dengue, rickettiosis u otras enfermedades potencialmente letales y de importancia en salud pública, es muy importante para el médico colombiano tener la capacidad de abordar los casos para garantizar una atención apropiada y una selección de las pruebas diagnósticas apropiadas, con las limitaciones usuales en nuestro medio, y de tomar las decisiones terapéuticas en un tiempo razonable.
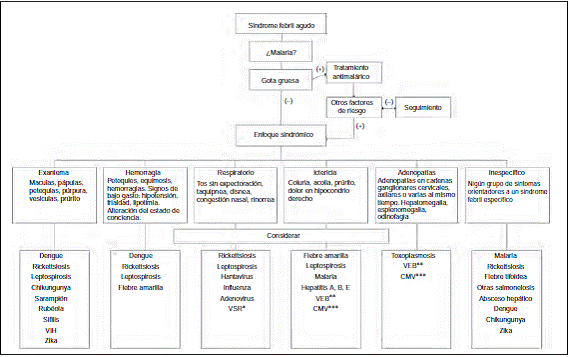
Ante la necesidad de optimizar el proceso de diagnóstico de un paciente febril sin foco y lograr el pronto inicio del tratamiento, se han propuesto distintas estrategias. La primera y más importante ha sido crear un algoritmo diagnóstico como guía para el profesional de la salud, algoritmo que debe adecuarse a las características geográficas y poblacionales, dependientes de las distintas regiones de nuestro país. Con la información obtenida a finales de los años noventa fue posible conocer una aproximación de la prevalencia de signos y síntomas acompañantes del SFA en población colombiana y, con base en esto, se propone una aproximación sindromática a la luz de la clínica para el debido estudio y diagnóstico de la noxa infecciosa (fig. 1). El objetivo principal de esta revisión es mostrar el enfoque clínico sindromático, realizar una sucinta revisión de las enfermedades más frecuentes, así como de los signos de alarma, tratamiento, prevención y notificación en el país, y guiar al médico general y especialista para brindar un enfoque adecuado y racional de este síndrome.
Búsqueda de la literatura
Se realizó una búsqueda de la literatura utilizando las palabras claves "síndrome febril", "fiebre", "síndrome febril agudo" y sus correspondientes términos en inglés en las bases de datos PubMed, Scielo, Google Schoolar, así como búsquedas en las páginas electrónicas del Ministerio de Salud y búsquedas manuales de los artículos referenciados por las publicaciones colombianas. El período de búsqueda fue desde 1995 en adelante. Se revisaron todos los artículos que incluyeran descripciones clínicas, epidemiológicas del síndrome febril en Colombia o de las pruebas diagnósticas disponibles en el país.
Enfoque clínico del síndrome febril agudo
Una forma práctica de enfocar el SFA es hacer la división entre malárico o palúdico y no malárico, con una amplia variedad de enfermedades que se pueden presentar de esta forma, unas que alcanzan su autorresolución y otras causantes de enfermedades severas que pueden ser mortales. Sin embargo, la malaria se confunde fácilmente con otras enfermedades. Por lo que es práctico hacer un enfoque sindromático. Además de los síntomas propios del estado proinflamatorio del síndrome febril (mialgias, astenia, escalofríos, inyección conjuntival, artralgias), es imprescindible que el clínico realice una anamnesis y examen físico completo con el fin de hallar claves diagnósticas en el debido enfoque de la enfermedad6. En la figura 1 se ilustra un enfoque sindromático de enfermedades infecciosas, de acuerdo con síntomas o signos cardinales que las acompañen. De esta forma es posible identificar diferentes escenarios del síndrome febril, en los que los síntomas adicionales permiten facilitar el diagnóstico diferencial. Adicionalmente a los principales síndromes que se describen abajo, el SFA puede presentarse con erupción dérmica (exantema, usualmente conocido por el anglicismo rash)7,8. Con la erradicación de algunas enfermedades exantemáticas en nuestro continente, los médicos y el personal de salud cada vez se encuentran menos familiarizados con los diferentes aspectos semiológicos del exantema, como la zona anatómica de inicio, su distribución, su diseminación, así como otros síntomas acompañantes. Suele encontrarse exantema en los pacientes con rickettsiosis y, en algunas ocasiones, es posible identificar una lesión que señala la puerta de entrada. Las adenopatías, de predominio cervical e inguinal, acompañaron los cuadros mórbidos de fiebre y malestar general. En este punto el SFA se cruza con el de mononucleosis, que se caracteriza por fiebre, dolor faríngeo, hepatoesplenomegalia y adenopatías. Este síndrome tiene aproximaciones diferentes según la edad y no se ampliará en adelante. Por su parte, los síntomas respiratorios inespecíficos no asociados a síndrome de consolidación pulmonar, dados por catarro, taquipnea, rinorrea y tos sin expectoración, deben enfocar a la búsqueda activa del virus influenza y otros9. Un gran número de síndromes clínicos respiratorios puede ser catalogados como faringitis, laringitis, traqueítis, laringotraquitis (croup) o bronquitis; también se han categorizado síndromes desde el punto de vista epidemiológico, como sucede con la infección respiratoria aguda grave que corresponde a pacientes con los mencionados síntomas respiratorios y que requieren hospitalización. Estos últimos síndromes tampoco serán considerados en adelante. También hemos incluido el ébola que, aunque no está en nuestro país, podría diseminarse potencialmente fuera de África, y nos pareció importante incluirlo para ampliar el conocimiento sobre la enfermedad.
El patrón de la fiebre es muy importante en la anamnesis para orientar el diagnóstico sindromático y su potencial etiología, aunque desafortundamente su sensibilidad no parece muy elevada. En la malaria, clásicamente se ha descrito la fiebre por episodios, con aparición cada tercer día (fiebre terciana benigna [P. vivax], o maligna [P. falciparum]). En este escenario los episodios febriles son alternados, con períodos de temperatura normal y ausencia casi total de los síntomas. El episodio febril aparece de forma súbita con escalofríos importantes, seguidos de sudoración profusa. En Colombia, la malaria no complicada suele presentarse con fiebre, escalofríos, cefalea, sudoración y mialgias o artralgias10. Por otro lado, algunas enfermedades pueden presentarse con fiebre en un patrón bifásico, con una fase inicial inespecífica, seguida de resolución de la fiebre y de su reaparición algunos días después, secundaria a una fase inmunológica de la enfermedad, como se observa en la leptospirosis y en la fiebre amarilla11. En el dengue, por ejemplo, esta fase secundaria en la que se resuelve la fiebre se puede acompañar de los episodios hemorrágicos (usualmente después del quinto día de síntomas).
La aparición de ciertos síntomas pueden acompañar la enfermedad, pero no ser marcadores de ella. Por ejemplo, se observa diarrea con frecuencia en paciente con dengue, lo que podría indicar que el tracto gastrointestinal corresponde al foco infeccioso. Por otro lado, los pacientes con fiebre tifoidea pueden presentarse con diarrea o con estreñimiento con frecuencias similares. Así que es importante definir de forma sistemática la presencia de diarrea, intensidad y frecuencia, tipo de deposición (explosiva, disentérica, hemorrágica, etc.), presencia de dolor abdominal (signos de alarma en dengue, por ejemplo); dolor muscular, su localización (la leptospira puede presentar dolor muscular en gemelos de forma frecuente) y frecuencia. Se debe identificar, si hay cefalea, el momento de aparición y la intensidad (concomitante con la fiebre en la rickettsiosis, después de la desaparición o en la fase inmune en la leptospirosis), patrón y concomitancia con signos cutáneos (fiebre, cefalea y exantema indican meningococcemia, por ejemplo). Otra pregunta relevante es la aparición de casos concomitantes en la misma zona geográfica o en el grupo de pacientes con exposición común, ya que puede apuntar a la presencia de brotes, los cuales se han observado en infecciones por Rickettsia spp.12, enfermedad de Chagas13 y fiebre tifoidea (con exposición a comidas contaminadas).
En la figura 1 se muestra la etiología más frecuentemente identificada en las diferentes formas de presentación del SFA.
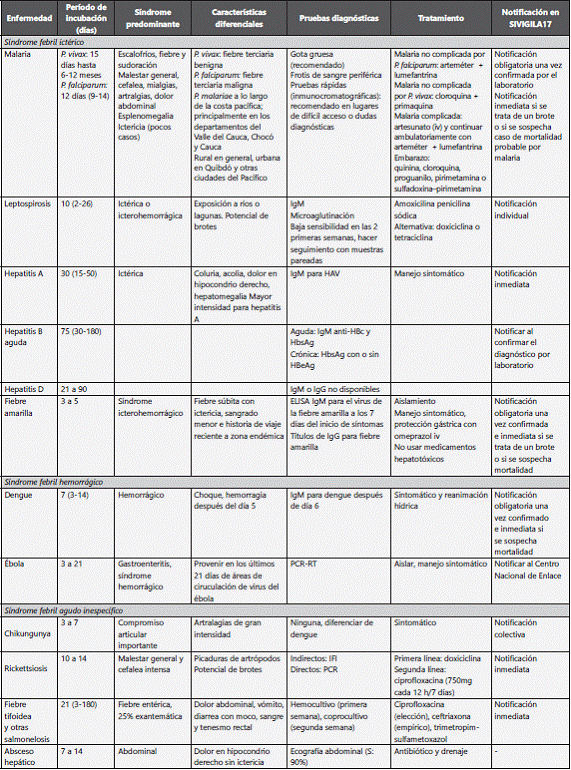
Arroyave et al. realizaron un estudio sobre la etiología del SFA en municipios del Urabá antioqueño en donde la prevalencia de infección por dengue era cercana al 37%, seguida de leptospirosis (14%), rickettsiosis (2,7%) e infección por arena y coronavirus (0,5%)4. En la tabla 1 se presentan los síntomas, claves diagnósticas y datos de vigilancia más importantes de las principales enfermedades causantes de síndrome febril agudo. Un estudio más reciente en el Quindío mostró como primera causa el dengue (43,6%), seguido de rickettiosis (6,8%) y leptospirosis (6,8%)14. De forma interesante, este último estudio identificó coinfección por dengue y rickettsiosis.
Enfermedades frecuentes o graves como causa de los síndromes febriles agudos en Colombia
Enfermedades que suelen dar un síndrome ictérico
El síndrome febril ictérico abarca cualquier síntoma consecuente de obstrucción biliar o inflamación del parénquima hepático; entre los síntomas más frecuentes se encuentran acolia, coluria, ictericia y dolor en hipocondrio derecho. La ictericia suele ser el signo clínico más evidente y su mecanismo de producción (hiperbilirrubinemia directa o indirecta) suele ayudar a establecer el origen de la enfermedad.
Malaria
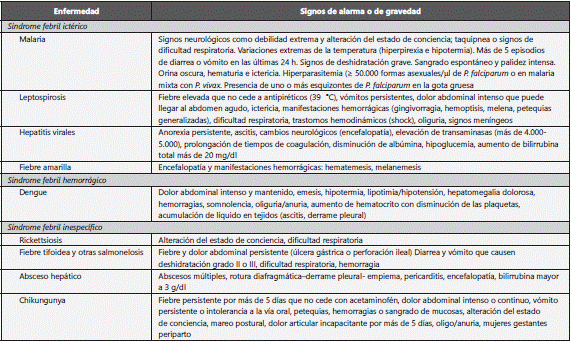
La malaria es una enfermedad infecciosa muy importante a la hora de enfrentar un SFA, por su alta prevalencia en los países del trópico y su alto riesgo de mortalidad si no es tratada. Es la enfermedad que debe descartarse inicialmente ante un SFA. Su diagnóstico se realiza ante un cuadro clínico con fiebre actual o reciente (menos de una semana), escalofríos intensos y paroxísticos, fiebre y sudoración profusa, cefalea, síntomas gastrointestinales, mialgias, artralgias, náuseas, vómitos, anemia y esplenomegalia. El agente etiológico corresponde a un parásito protozoario del género Plasmodium, cuyas especies P. vivax y P. falciparum son las más comunes, con una prevalencia aproximada de 70 y 30%, respectivamente en el territorio colombiano. P. malariae se encuentra en pocos municipios en Colombia, en focos dispersos a lo largo de la costa pacífica15; principalmente en los departamentos del Valle del Cauca, Chocó y Cauca16; mientras que P. ovale no se ha documentado en Colombia. Es transmitida por las hembras de Anopheles infectadas. La malaria es una enfermedad que puede presentarse en brotes y puede clasificarse como malaria no complicada, la cual incluye signos o síntomas de la enfermedad general y malaria complicada, con signos de alarma (ver tabla 2). También se consideran de alto riesgo mujeres en estado de embarazo y personas con signos como debilidad extrema y alteración del estado de conciencia, taquipnea o signos de dificultad respiratoria, variaciones extremas de la temperatura (hiperpirexia e hipotermia), signos de deshidratación grave, sangrado espontáneo, hematuria e ictericia o hiperparasitemia15. El diagnóstico de malaria se realiza mediante la visualización del parásito en muestra de sangre, por medio del frotis de sangre periférica o la gota gruesa. Esta última es la primera opción diagnóstica en Colombia, tiene mayor sensibilidad que otras pruebas diagnósticas, debe repetirse en 24 h si se tiene caso probable de malaria con gota gruesa negativa, o en las siguientes 8-12 h si se observan menos de 100 parásitos por ml de sangre. Otra forma de realizar el diagnóstico es la detección de antígenos parasitarios (pruebas inmunocromatográficas o pruebas rápidas). Su sensibilidad es igual o incluso mayor al 95% pero disminuye si hay menos de 500 formas parasitarias (fp) por ml de sangre en infecciones por P. falciparum, o menos de 5.000 fp por ml de sangre en infecciones por P. vivax. Otro método diagnóstico es usar la PCR para especies de Plasmodium, la cual suele ser accesible en laboratorios de referencia o en el Instituto Nacional de Salud (INS). Al diagnosticar al paciente, se requiere la identificación de la especie del parásito, la densidad parasitaria (fp por ml de sangre) y tener en cuenta contraindicaciones y estado de embarazo. Se remite al lector a la guía nacional para su manejo15. En caso de muerte por malaria, el Sistema de Vigilancia en Salud Pública (SIVIGILA) solicita el envío de la lámina de gota gruesa para verificación de resultados de lectura por el Laboratorio de Parasitología del INS y las muestras de viscerotomía al laboratorio de enfermedad de la Dirección de Redes del INS.
También solicita las actas de las reuniones de análisis para todos los casos de muerte y malaria complicada17.
Leptospirosis
Es una zoonosis reemergente de distribución mundial causada por varias serotipos patógenos de Leptospira spp., presente en animales reservorios, tanto domésticos como salvajes, principalmente roedores, y que es excretada por orina que contamina el ambiente tanto urbano como rural18. En Colombia se ha detectado la circulación de L. interrogans de las serovariedades Icterohaemorrhagiae/Copenhageni, Pomona, L. noguchii serovariedades Nicaragua y Orléans, L. alexanderi, L. weilii, L. alstonii, L. borgpetersenii, L. santarosai en diversos animales que incluyen cerdos y ratas, entre otros19. El contacto directo de la piel o de las mucosas con áreas contaminadas transmitirá la infección. El período de incubación es generalmente de 10 días; la enfermedad febril empieza con sintomatología inespecífica: cefalea, escalofrío, vómito, mialgias severas, conjuntivitis que puede durar de 5 a 10 días. En el 5 a 10% de los casos el paciente puede presentar ictericia, manifestaciones hemorrágicas, insuficiencia renal, insuficiencia hepática, y una forma más grave descrita como síndrome pulmonar hemorrágico, el cual tiene hasta un 50% de mortalidad. La segunda fase de la enfermedad se caracteriza por exantema, puede cursar con uveítis e incluso con meningitis. La tamización se puede hacer con IgM por ELISA u otras técnicas y se confirma con títulos de microaglutinación en muestras pareadas (la segunda muestra se toma 10-15 días después de la primera): títulos iguales o mayores a 1:200 hacen diagnóstico y títulos 1:400 en la primera muestra se correlacionan con casos fatales. Las pruebas de IgM tienen baja sensibilidad en las primeras 2 semanas de la enfermedad y microaglutinación es un marcador con importantes limitaciones debido a las diferentes serovariades presentes en un área geográfica20. Se puede realizar detección de ADN por PCR en muestras de orina y, en casos graves, biopsias o autopsias con coloración de plata positiva en hígado, riñón y pulmón. Se puede hacer diagnóstico por nexo epidemiológico sin requerir pruebas diagnósticas adicionales. El manejo antibiótico de primera elección para casos leves es amoxicilina 500mg cada 8 h por 7-10 días o penicilina sódica 2 a 4 millones cada 6 h iv por 7 días. Si el paciente es alérgico a la penicilina puede administrarse doxiciclina 100mg cada 12 h por 7 días o tetraciclina 500mg cada 6 h por 7 días. La prevención debe estar dirigida a evitar el contacto con roedores y sus excretas, y a proteger los animales domésticos y de interés económico mediante la inmunización en zonas endémicas. En soldados que deben viajar a zonas endémicas en brote se ha probado profilaxis con doxiciclina, con alta efectividad21.
Hepatitis virales
Hepatitis A
El virus de la hepatitis A se transmite por vía fecal-oral, por lo cual es una enfermedad endémica en países con precarios servicios de saneamiento básico. En Colombia se ha visto un descenso en el número de casos en los últimos años. Sin embargo, los departamentos por donde transcurren el río Magdalena y el Cauca continúan con incidencias muy elevadas y brotes en épocas de inundación22. El período de incubación promedio es de 30 días. La primera fase de la enfermedad es una fase febril preictérica acompañada de síntomas inespecíficos tales como: cefalea, astenia, vómito, dolor abdominal y diarrea. En niños, la sintomatología es de menor intensidad y con frecuencia se presneta de forma asintomática. Posteriormente, se da la defervescencia y se inicia la fase ictérica, en la que los síntomas son los de la fase anterior asociados a ictericia, coluria y acolia. Un 10% de los casos puede ser recurrente y manifestarse 1-4 meses después del episodio inicial, resolviéndose completamente el cuadro entre las 16 y 40 semanas, dependiendo del estado inmunológico del paciente. La hepatitis fulminante se da en 0,3 a 0,4% de los casos y su principal factor de riesgo es la edad avanzada. Puede complicarse con edema cerebral, hemorragia masiva gastrointestinal y sepsis. El período de mayor eliminación de virus por las heces y, por tanto, de mayor transmisión va desde la segunda mitad del período de incubación hasta la primera semana de inicio de ictericia.
El diagnóstico se confirma por estudio serológico buscando IgM. Las pruebas de función hepática alteradas orientan el diagnóstico. El manejo de la presentación clínica clásica es sintomático, se deben evitar todos los hepatotóxicos (incluyendo el acetaminofén). La prevención se da con la vacunación.
Hepatitis B
Es un virus ADN pequeño de la familia Hepadnaviridae que infecta a los seres humanos y primates. Se transmite por contacto con sangre o fluidos corporales, se replica en sus hepatocitos y puede causar diferentes manifestaciones clínicas desde la enfermedad aguda asintomática hasta infección crónica con evolución a cirrosis y cáncer hepatocelular23. Su período de incubación oscila entre 30 y 180 días. En pacientes con enfermedad aguda sintomática puede observarse ictericia, coluria, adinamia extrema, náuseas, vómito y dolor abdominal. En el paciente joven la infección aguda suele ser asintomática; sin embargo, la edad es un factor que predice cronicidad: se presenta en el 90% de los infectados en período perinatal, un 30% en los infectados durante la infancia y un 6% en edades superiores. En cuanto al diagnóstico, la hepatitis B aguda se caracteriza por la presencia de antígeno de superficie (HBsAg) y de anticuerpos IgM contra el antígeno nuclear o core (IgM anti-HBC). Posteriormente, se generan anticuerpos contra el antígeno de superficie (anti-HBs) y dicho antígeno desaparece. La infección crónica por hepatitis B se caracterizará por la presencia de HBsAg por más de 6 meses, con o sin concurrencia del HBeAg, que evidenciará qué tan contagioso es el paciente23. El tratamiento de la hepatitis B aguda es alivio sintomático y rehidratación, sea por vía oral o parenteral. El tratamiento de la enfermedad crónica no se trata en esta revisión.
La forma de prevenir la enfermedad es mediante la vacunación y se debe realizar la titulación de IgG contra HBsAg para verificar el estado de la inmunidad posterior a la vacunación. Se puede realizar inmunización pasiva administrando inmunoglobulina específica contra la hepatitis B posteriormente a la exposición.
En pacientes con hepatitis B crónica reactivada o hepatitis B grave se puede considerar la coinfección por el virus D (o delta), que aumenta la probabilidad de cronicidad o progresión a cirrosis y formas malignas. El diagnóstico definitivo se realiza con pruebas serológicas IgM e IgG o por hibridación in situ en tejido hepático. El manejo es sintomático, se deben evitar los hepatotóxicos y, en caso de falla hepática fulminante, el paciente debe ser llevado a trasplante hepático.
Fiebre amarilla
La fiebre amarilla es una enfermedad viral transmitida por el mosquito del género Haemagogus que se caracteriza por producir un síndrome febril icterohemorrágico, también conocido como la enfermedad del "vómito negro"24. Su período de incubación es de 3 a 5 días y el cuadro clínico inicia con una temperatura corporal superior a 39 °C, postración, osteomialgias e ictericia. Las manifestaciones hemorrágicas se asocian a casos graves. En los casos con encefalopatía, se asocian a mortalidad cercana al 30%. En la fase inicial de la enfermedad suele presentarse fiebre, bradicardia, ictericia, dolor abdominal y hepatomegalia dolorosa a la palpación. En la fase tardía, por compromiso hepático, se presenta un déficit de los factores de coagulación, produciendo coagulación intravascular diseminada (CID) secundaria. Suele cursar con leucopenia, prolongación de los tiempos de coagulación y elevación de transaminasas y bilirrubinas. A su vez, puede cursar con hipoglucemia. En Colombia se ha identificado principalmente en los departamentos del Norte de Santander (selva del Catataumbo), César, Magdalena y Guajira (en las inmediaciones de la Sierra Nevada de Santa Marta), y en la selva amazónica. Es capaz de producir brotes. Su diagnóstico se hace por medio de IgG e IgM para el virus de la fiebre amarilla. En el caso de ELISA IgM, se debe tomar la muestra, una semana después del inicio de los síntomas, mientras que los títulos de IgG suelen aparecen más tardíamente, por lo que no son útiles en el escenario del SFA. Todos los casos probables deben ser estudiados enviando las muestras de suero al laboratorio de virología de la Dirección Redes en Salud Pública del INS17. El tratamiento consiste en el aislamiento del paciente (para evitar la reintroducción de un ciclo urbano) y en el manejo sintomático, principalmente. Se indica protección gástrica con omeprazol iv y no usar medicamentos hepatotóxicos. Las tasas de mortalidad reportadas se encuentran entre el 25 y el 50%.
Enfermedades que suelen dar un síndrome hemorrágico
Las manifestaciones hemorrágicas como petequias, gingivorragia, equimosis, prueba de torniquete positiva o derrame pleural pueden enfocar el diagnóstico a posibles agentes etiológicos muy prevalentes en la población colombiana. Aunque aquí se describe fundamentalmente el dengue, vale la pena recordar que en los pacientes con compromiso hepático grave (síndrome ictérico) y disfunción de este órgano es frecuente encontrar ictericia y hemorragia de forma concomitante, como se observa en la fiebre amarilla, la leptospirosis y las infecciones virales agudas. En el viajero internacional, es importante considerar en este grupo a los pacientes con sospecha de ébola.
Dengue
Colombia es un país endémico para dengue, pues su vector Aedes aegypti (ahora denominado Stegomya aegypti) y el A. albopictus (S. albopictus) se encuentran en zonas urbanas y rurales cuya altura está por debajo de los 2.200 metros sobre el nivel del mar, lo que corresponde al 90% del territorio nacional25. En 2014 se reportaron 42.861 casos totales, 94 muertes por dengue y 1.486 casos de dengue grave, dada la circulación simultánea de los 4 serotipos de dengue en nuestro país26. Su período de incubación es de 7 días (3 a 14 días) y su presentación clínica se manifiesta en 3 etapas. La primera etapa se caracteriza por fiebre de 2 a 7 días de duración asociada a síntomas inespecíficos tales como: cefalea, dolor retroocular, artralgias, mialgias, puede aparecer exantema o eritema facial. Posteriormente, con la defervescencia se inicia la etapa crítica, dada por la extravasación de plasma a tejidos, cuya manifestación más grave puede ser el choque27. En esta etapa se debe evaluar al paciente y buscar signos de alarma (ver tabla 2). La última etapa es la de recuperación, caracterizada por la mejoría clínica del paciente, la eliminación del exceso de líquido, aunque el paciente puede permanecer con adinamia, bradipsiquia y exantema tardío28. El tratamiento del dengue es sintomático y de soporte, poniendo especial atención a los signos de bajo gasto (hipotensión), sangrado (palidez, hipotensión, baja en los valores de hemoglobina y plaquetas) o compromiso sistémico (deterioro del estado de conciencia, choque, etc.). Es importante considerar el diagnóstico diferencial de dengue en pacientes con sospecha de chikungunya (ver más adelante), así como infección por rickettsias y leptospirosis (fig. 1). Los pacientes con comorbilidades, menores de 5 años, embarazadas, mayores de 65 años o con riesgo social sin signos de alarma deben manejarse intrahospitalariamente con hidratación, en lo posible, por vía oral. En pacientes con dengue grave se debe iniciar reanimación hídrica intravenosa que garantice adecuada perfusión tisular y óptima diuresis, con monitoría continua hasta resolver la condición de gravedad28. Para confirmar el diagnóstico se debe tomar muestra de sangre a partir del sexto día de inicio de los síntomas y solicitar prueba de IgM para detectar anticuerpos recientes contra el virus. Puede realizarse el aislamiento viral por PCR en laboratorios de referencia con una muestra recolectada en los primeros 5 días del inicio de los síntomas. En los casos de sospecha de mortalidad por dengue, se debe almacenar muestra de suero del paciente y realizar autopsia o viscerotomía (se toman fragmentos de hígado, bazo, pulmón, ganglios y cerebro para realizar estudios histopatológicos e inmunohistoquímicos). El diagnóstico diferencial en diferentes áreas de la selva en América Latina incluye otros arbovirus como fiebre amarilla (reconocida en Colombia en el Amazonas y en el Catatumbo y alrededores de la Sierra Nevada de Santa Marta), Oropuche, Mayaro y la encefalitis equiva venezolana.
Ébola
Los virus causantes del ébola son conocidos desde el siglo pasado. El brote actual comenzó a finales de 2013 en zonas rurales de Guinea. Rápidamente se extendió a Sierra Leona y Liberia, países con problemas serios de infraestructura sanitaria y en donde no se había identificado previamente brotes de ébola. La enfermedad tiene 3 fases: una inicial con un cuadro febril agudo inespecífico, una con síntomas gastrointestinales que aparecen después del tercer día y, en cerca del 20%, con síntomas hemorrágicos. La deshidratación que ocurre con la fase gastrointestinal es muy grave y resulta, en ausencia de atención médica, en importantes alteraciones electrolíticas y sepsis. Una proporción importante de pacientes pueden cursar simultáneamente con malaria o bacteriemia. Finalmente, ocurre una fase de resolución en la cual el paciente fallece en falla multiorgánica o se recupera.
La transmisión ocurre de persona a persona por exposición a secreciones o sangre y el tiempo de incubación oscila entre 3 y 21 días, con un promedio de 12 días. El área de circulación y riesgo se define con base en los datos internacionales (en estos momentos se circunscribe a los 3 países anotados). El tratamiento es sintomático y se hace en centros especializados para evitar la transmisión a la comunidad. En el ébola, las medidas de bioseguridad son fundamentales y en los centros especializados se intenta disminuir el riesgo de transmisión cruzada por el uso de desinfectantes (hipoclorito en África). En el momento no hay vacuna, pero hay varias iniciativas en desarrollo. Si se sospecha SFA en paciente proveniente de las áreas de riesgo en los últimos 21 días, se debe aislar sin manipular o tomar muestras y contactar al Centro Nacional de Enlace (teléfono: [1] 5953525).
Enfermedades que dan síndrome febril agudo inespecífico
Rickettsiosis
La rickettsiosis es una enfermedad febril aguda antes conocida como la fiebre de Tobia (Cundinamarca) o "fiebre manchada de las Montañas Rocosas" (1899, Norteamérica). Los agentes etiológicos de esta enfermedad pertenecen al género Rickettsia. Estas bacterias se transmiten por la picadura (contacto de la sangre con saliva o heces infectadas) de artrópodos hematófagos: garrapatas, pulgas, piojos o ácaros y su circulación se ha documentado en áreas rurales en Colombia. Por ello, es muy importante en el interrogatorio incluir pregunta acerca de exposición en áreas de llanura o pastos, contacto con garrapatas, síntomas concomitantes en personas en similares condiciones (brotes). El período de incubación es de 10 a 14 días. Se caracteriza por síntomas como: fiebre >38 °C, cefalea, malestar general y, después de 2-7 días del inicio de la infección, puede aparecer un brote en la piel del tronco, extremidades, zona periaxilar y palmas de las manos. El 50% presentan náuseas, vómito y otros síntomas gastrointestinales al inicio de la infección29,30. Ocasionalmente puede presentarse hipovolemia, isquemia de extremidades y órganos. En otros casos, puede producirse síndrome meníngeo (estupor y coma), edema cerebral y pulmonar o CID31. Como prueba diagnóstica indirecta, se usa la detección de anticuerpos circulantes por medio de la inmunofluorescencia indirecta o de la reacción de inmunoperoxidasa en suero. Las pruebas serológicas se deben repetir para realizarlas de forma pareada con 2-4 semanas de diferencia y evaluar el cambio en los títulos de anticuerpos, de forma que el diagnóstico inmunológico suele ser retrospectivo. También hay pruebas directas para la detección del antígeno, los ácidos nucleicos o cultivo del organismo. La PCR a partir de muestras de sangre está disponible para estudio de brotes y actividades de investigación en algunas universidades y en el INS32. El tratamiento de primera línea es con doxiciclina 200 mg al día por 10 días y, en segunda línea, ciprofloxacina, 750 mg cada 12 h por 7 días.
Fiebre tifoidea y otras formas de salmonelosis
Estas enfermedades son producidas por serotipos del microorganismo Salmonella enterica typhi y paratyphi A, B o C. Estos son bacilos gramnegativos, anaerobio facultativos, que se transmiten por la ingesta de agua y alimentos contaminados con heces u orina de enfermos o portadores. En algunas zonas del país, la transmisión se puede dar a través de la ingesta de mariscos y ostras procedentes de lechos marítimos infestados. En la costa atlántica se ha documentado ampliamente su presencia en comidas de venta en la calle33. Su período de incubación tiende a modificarse de acuerdo con la dosis infectante (105 a 108 UFC) y fluctúa de 3 días a 3 meses, por lo regular con límites de una a 3 semanas. En la gastroenteritis paratifoidea, el tiempo de incubación suele ser de uno a 10 días34.
Las manifestaciones clínicas se presentan bajo 2 modalidades: la forma gastrointestinal, producida por la serotipos no typhi, y las formas invasivas (denominadas en muchos textos como septicémicas), que incluyen la fiebre entérica (fiebre tifoidea), la bacteriemia y las formas localizadas producto de la bacteriemia (artritis, meningitis, etc.)34. Aproximadamente 48 h después de la ingesta del alimento o el agua contaminados, se inicia un cuadro de dolor abdominal, acompañado de vómito y diarrea que pueden variar en intensidad y volumen, usualmente en cantidad moderada y acompañados de sangre o moco y tenesmo rectal. En la formas invasivas se presenta fiebre (mayor de 39 °C), cefalea, anorexia, dolor abdominal, diarrea o estreñimiento, bradicardia relativa y hepatoesplenomegalia. El exantema rosado, no pruriginoso, en el tronco puede aparecer hasta en el 25% de los infectados. La mortalidad está asociada principalmente al desarrollo de complicaciones gastrointestinales, como la perforación, y hemorragias intestinales y puede ocurrir en el 10% de los casos y ser ≤1% con el inicio inmediato de terapia antibiótica34.
Cerca del 10% de los casos de especies no typhi pueden producir bacteriemia y formas localizadas.
Las pruebas de laboratorio para la confirmación de fiebre tifoidea y paratifoidea son hemocultivo, que es positivo en la presentación temprana de la infección, coprocultivo y mielocultivo, durante la segunda semana, con una sensibilidad mayor del 98%. En Colombia no se ha podido establecer de manera real la incidencia del evento, debido a métodos diagnósticos utilizados para su confirmación y, aunque hay un alto grado de notificación, la mayoría de los casos quedan como probables y solo una parte de los notificados se confirma por los métodos diagnósticos recomendados35.
La administración de líquidos y reposición de electrolitos en caso de diarreas profusas, acompañada del manejo del dolor y la fiebre, debe ser siempre el primer paso en la terapéutica de la infección. En el tratamiento empírico de los pacientes con gastroenteritis invasiva y en pacientes con sospecha de fiebre tifoidea se recomienda el uso de ceftriaxona, debido a que las quinolonas, aunque son de primera elección, tienen altas tasas de resistencia en nuestro medio frente a otras enterobacterias, lo que limita su uso empírico. Las quinolonas constituyen en la actualidad la primera línea de tratamiento de la fiebre tifoidea. Administradas por vía oral o por vía parenteral iv han demostrado ser muy activas contra la mayoría de las serotipos de Salmonella, incluida la S. typhi. Otra opción es el inicio de trimetroprim sulfametoxazol36.
Absceso hepático
El absceso hepático se define como una enfermedad aguda o subaguda, que se presenta en pacientes de mediana edad, sin preferencia de género, cuya sintomatología principal es fiebre y dolor en hipocondrio derecho37. En Colombia se estima que más del 85% de los abscesos hepáticos son de etiología amebiana, secundarios a infección por Entamoeba histolytica. El porcentaje restante tiene etiología bacteriana polimicrobiana, predominantemente secundaria a infección por E. coli, Klebsiella, Streptococcus y Pseudomonas38. Desde la perspectiva del SFA, el principal factor de riesgo asociado es la infección previa por E. histolytica. Otros pacientes, fuera del contexto de SFA, tienen factores de riesgo generales o de enfermedad abdominal como la ingesta de alcohol superior a 150g/día, diabetes mellitus, enfermedad de árbol biliar, traumatismo hepático o infección mesentérica o peritoneal en curso. Colombia presenta diversas zonas endémicas en donde se produce la transmisión orofecal de quistes del complejo E. histolytica/dispar, factor netamente dependiente del acceso a servicios públicos y de las condiciones de vivienda.
El ser humano es el reservorio principal del parásito, que expulsa los quistes a través de las heces, los cuales son reingeridos a través del agua, vegetales o comida contaminada por otro individuo. Aunque la enfermedad más frecuente de E. histolytica es la colitis, en algunos pacientes el parásito ingresa a la circulación enterohepática y se establece predominantemente a nivel del lóbulo hepático derecho (cuadrante 6 y 8) en forma de absceso único, uniloculado, que produce la sintomatología típica de fiebre y dolor abdominal en hipocondrio derecho39. El hallazgo de absceso único aumenta la probabilidad de esta etiología.
El diagnóstico incluye pruebas de laboratorio en busca, predominantemente, de anemia, hipoalbuminemia, elevación de transaminasas, fosfatasa alcalina y leucocitosis. La ecografía abdominal tiene una sensibilidad que oscila entre el 85 y el 95%, por lo que, sumada a su amplia disponibilidad y bajo costo, se considera el método diagnóstico de elección ante la sospecha de un absceso hepático, ya sea amebiano o piógeno40. Aunque existen pruebas serológicas y moleculares, estas no suelen estar disponibles fácilmente. La tomografía abdominal con contraste solo debe realizarse para descartar diagnósticos diferenciales y complicaciones como masa, fístula o rotura. Se suele realizar drenaje percutáneo (y cultivo) a aquellas colecciones de más de 5 cm, localizadas en lóbulo izquierdo y con falla terapéutica41. El tratamiento de primera línea es metronidazol 750 mg cada 8 h por 5-10 días. Es importante recordar que los pacientes con amebiasis invasiva deben recibir de forma rutinaria tratamiento para la erradicación de quistes con teclozán (500 mg por 3 dosis).
Chikungunya
Enfermedad febril aguda causada por el virus Chikungunya, transmitida por la picadura del mosquito del género Aedes, en Colombia A. aegypti, A. albopictus42. En la actualidad, estudios realizados en población blanco de epidemias a lo largo de países de Centroamérica y Suramérica estiman tasas de ataque entre el 38 y el 63%, con cohortes de pacientes entre el 3 y el 28% de los pacientes en los que se produce infección asintomática. Su período de incubación puede variar de 3 a 7 días después de la picadura de un mosquito infectado. No existe riesgo de transmisión del virus en leche materna, secreciones, aparato respiratorio, relaciones sexuales, contacto directo, gotas ni aerosol con la persona infectada. Se observan poliartralgias en el 70-100% de los afectados y poliartritis en el 12-32% de los infectados. Una característica que lo diferencia es justamente el compromiso articular, que en hasta el 20% de los casos puede extenderse por varios meses con un impacto de morbilidad importante43. La mortalidad es baja y usualmente se ve en grupos de edad extrema o en pacientes con gran comorbilidad o coinfección con dengue44. En Colombia se ha observado un exantema difuso en la mayoría de los pacientes y está reportado hasta en el 77% de los casos45. Puede presentarse en formas atípicas con menigoencefalitis, síndrome de Guillain Barré, neuritis óptica, retinitis, entre otros. El diagnóstico se hace por clínica, y se debe diferenciar del dengue, dada la transmisión por el mismo vector. En Colombia su diseminación ha sido regional, con gran cantidad de pacientes en diversas áreas geográficas, lo que motivó suspender la notificación individual y no se dispone de prueba de IgM específica. El tratamiento es sintomático con acetaminofén. Los AINE pueden ser utilizados idealmente después del séptimo día de enfermedad y por períodos de no más de 5 días, y se han observado pacientes con efectos adversos serios por la utilización de estos medicamentos intramusculares.
Virus Zika
Este es un arbovirus que puede ser transmitido por mosquitos del género Aedes. Puede producir un cuadro clínico inespecífico, aunque tradicionalmente se ha relacionado con exantema, conjuntivitis, artralgias y fiebre. Durante los últimos años ha tenido una extensa actividad en la Polinesia y de allí se ha diseminado a América, introducido a través de Brasil46. Dada la transmisión por el mismo vector del dengue y el chikungunya, se ha observado diseminación en las mismas áreas geográficas, incluyendo Colombia. Teniendo en cuenta que el cuadro clínico es leve y parece no asociarse con frecuencia a desenlaces graves con la misma frecuencia que otros arbovirus, su valor epidemiológico más importante es hacer diagnóstico diferencial con el dengue y el chikungunya.
Al momento, el diagnóstico se podría realizar a través de los laboratorios de salud pública.
Toxoplasmosis aguda
La toxoplasmosis aguda es producida por la ingestión de Toxoplasma gondii, un parásito que puede ser transmitido por la exposición a ooquistes en las heces de felinos, por contaminación de aguas o alimentos, o por consumo de quistes tisulares del parásito en carnes mal cocinadas. El cuadro agudo se observa solamente en el 10 al 20% de los pacientes, que pueden presentar síntomas. El cuadro clínico puede ser indistinguible de otras formas de infección febril aguda, o puede asociarse con adenopatías múltiples, e incluso con formas graves que simulan sepsis o síndrome de dificultad respiratoria aguda de origen bacteriano. En Colombia ha sido descrita la presentación aguda en militares que tuvieron consumo de agua estancada durante el desarrollo de operaciones en la selva colombiana. El cuadro clínico incluyó cefalea, fiebre, adenopatías y, con menor frecuencia, compromiso gastrointestinal, respiratorio e incluso cardíaco47. Debido a que es una zoonosis transmitida por vía oral, el diagnóstico debe considerarse en viajeros con exposición a agua no tratada o purificada y, como en el caso mencionado previamente, se puede presentar en brotes48. El diagnóstico se puede hacer mediante serología, con la identificación de IgM en el paciente sintomático o la seroconversión con muestras de suero pareados. El tratamiento recomedado es con una sulfa como trimetoprim/sulfametoxazol o sulfadiazina/pirimetamina.
Fiebre en el viajero de ciudades a sitios endémicos
El síndrome febril en el viajero tiene una connotación diferente desde la perspectiva de que no se trata de individuos que viven en el área endémica, sino que solamente están transitoriamente en ella, debido a trabajo, turismo, visita a familiares o amigos, entre otras actividades.
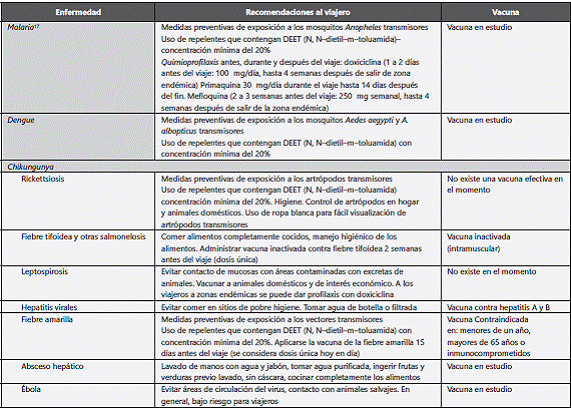
Es importante indagar en el viajero que presenta SFA dónde ha permanecido durante el viaje, pues esa información brinda al médico probabilidades diagnósticas de acuerdo con el lugar que haya visitado. Hoy en día, por la facilidad de transporte hacia distintas partes del mundo, el profesional de la salud se ve constantemente enfrentado a posibilidades diagnósticas poco comunes e incluso desconocidas para él. El desarrollo tecnológico ha logrado, por lo tanto, un constante cambio en la epidemiología de las enfermedades. Colombia, al ser un país con la presencia de conflicto armado interno, presenta una serie de problemáticas (violencia, desplazamiento forzado, entre otros) que aumentan la frecuencia de casos de SFA en un migrante. Se ha de tener siempre presente que el SFA puede o no estar relacionado con los viajes que haya realizado el paciente y, así mismo, se debe educar al viajero de acuerdo con el lugar que vaya a visitar, en cuanto a posibles enfermedades que pueda adquirir allí, a cómo prevenirlas, si es posible o, al menos, se le deben recomendar acciones que disminuyan el riesgo de adquisición de dichas enfermedades (ver tabla 3).
El médico de urgencias ante un viajero con cuadro febril agudo debe realizar una anamnesis completa que le permita establecer la cronología del viaje, área geográfica visitada, motivo del viaje, si es posible, identificar actividades de riesgo, indagar antecedentes de vacunación y administración de medicamentos profilácticos antes o durante el viaje49. En la revisión por sistemas debe hacer especial énfasis en los síntomas cardinales que caracterizan cada síndrome febril (ver fig. 1) y en el examen físico el clínico debe evaluar signos que le apoyen su sospecha diagnóstica. Una vez establecido el diagnóstico sindromático y teniendo en cuenta las posibles etiologías, es clave que el médico conozca los períodos de incubación y la prevalencia de los patógenos para establecer un diagnóstico presuntivo y tener en cuenta diagnósticos diferenciales50.
Es claro que en Colombia la primera sospecha diagnóstica debe ser malaria, seguida de dengue, fiebre tifoidea, hepatitis virales, absceso hepático, leptospirosis y rickettsiosis. A los viajeros que visitan Colombia se les exige vacuna de fiebre amarilla para visitar ciertas zonas del país como la Sierra Nevada de Santa Marta, Catatumbo y Amazonas. Aunque Colombia es un país endémico para malaria, oficialmente no se recomienda quimioprofilaxis, aunque creemos que esta debería considerarse en un grupo importante de viajeros.
También en estos casos debe considerarse la notificación al Sistema de Vigilancia, ya que permite recabar información sobre situación geográfica de diversas enfermedades y un mejor conocimiento de la distribución de estas enfermedades en nuestro país (fig. 2).