Introducción
Salmonella spp. es el agente etiológico de la Salmonelosis, una de las enfermedades de transmisión alimentaria (ETA) con importantes repercusiones en salud pública1, que produce síntomas gastrointestinales como diarrea. Anualmente, esta enfermedad ocasiona 2,2 millones de muertes a nivel mundial, siendo los niños la población más vulnerable2.
Los alimentos que con mayor frecuencia se han asociado a la transmisión de este microorganismo son el huevo, pollo y productos lácteos, entre otros3,4; el huevo es un alimento importante en la canasta familiar colombiana, con alto valor nutricional y debido a su bajo costo es asequible a gran parte de la población, viéndose esto reflejado en un consumo per cápita de 252 unidades para el 2015 y una proyección de 266 para el 20165. Adicionalmente, se ha presentado un crecimiento en la producción mundial anual del 4%6, por su parte, en Colombia se evidenció un aumento en la producción del 3,61% para el 2014 (691.756 toneladas) con respecto al año inmediatamente anterior que fue de 667.649 toneladas; para el 2015 el aumento fue del 9,12% con una producción reportada de 728.555 toneladas5, este comportamiento también se ha evidenciado en el crecimiento en la producción mundial anual6.
Pocos son los países a nivel mundial que informan estadísticas detalladas sobre la prevalencia de Salmonella spp. En subproductos de origen aviar, uno de ellos es Estados Unidos, en donde a pesar de establecer controles rigurosos en la industria alimentaria se reportó un brote en 2010 cuya fuente más probable fueron huevos con cáscara contaminada7. Por otra parte Colombia no cuenta con datos detallados sobre la prevalencia de infecciones por Salmonella spp. originada a partir de productos de origen aviar.
Para la detección e identificación de este microorganismo se utilizan diferentes metodologías, como el cultivo microbiológico en medios selectivos y diferenciales, además de pruebas moleculares como la reacción en cadena de la polimerasa (PCR), Polimorfismo de Longitud en los fragmentos de Restricción (RFLP- REA) y PCR en tiempo real (qPCR), entre otras8. Reconociendo la implicación de este microorganismo en la salud pública, el objetivo de este estudio fue determinar la presencia de Salmonella spp. en huevos destinados para consumo humano provenientes de plazas de mercado y expendios de barrio de cuatro localidades de Bogotá - Colombia, mediante cultivo e identificación microbiológica y PCR-REA.
Materiales y Métodos
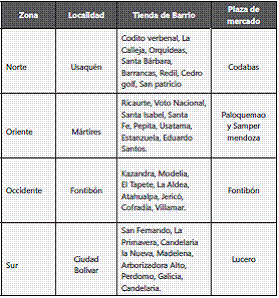
Población de estudio. Se seleccionaron cuatro localidades de Bogotá, ubicadas en cada uno de los extremos de la ciudad (Tabla 1); luego se procedió a seleccionar al azar tiendas de ocho barrios (una por cada barrio) y una o dos plazas de mercado de cada localidad.
Definición y recolección de las muestras. Una muestra correspondió a una mezcla (pool) de 5 huevos. En cada tienda de barrio se recolectaron dos muestras y en las plazas de mercado cuatro; se realizaron dos muestreos por localidad obteniendo 24 muestras en cada una de ellas, para un total de 96 muestras procesadas. Los huevos que presentaban fisuras o rupturas que pudiesen afectar la calidad interna fueron excluidos del estudio.
Las muestras fueron transportadas en condiciones de refrigeración hasta las instalaciones de la Pontificia Universidad Javeriana donde fueron procesadas.
Aislamiento e Identificación Microbiológica. Las muestras fueron procesadas siguiendo la norma NTC 4574: Microbiología de alimentos y de alimentos para animales y la metodología Oxoid Salmonella PrecisTM, validada y aprobada por AFNOR según la norma ISO 16140.
Se analizó tanto la cáscara como el contenido interno de cada una de las muestras, para lo cual se realizó pre-enriquecimiento no selectivo en caldo peptonado, enriquecimiento selectivo en Caldo tetrationate y cultivo en agares selectivos y diferenciales (Hektoen y XLT4)9,10,11. La metodología PrecisTM elimina el pre-enriquecimiento no selectivo, mediante el uso del caldo Salmonella BrillianceTM como medio de enriquecimiento selectivo con posterior cultivo en el medio cromogénico Salmonella BrillianceTM. Una vez se detectaron colonias presuntivas de Salmonella spp. se realizaron pruebas bioquímicas básicas como Oxidasa, TSI y Urea11,12,13; para la confirmación se utilizaron galerías Rapid OneTM, las cuales se incubaron a 35°C durante 4 horas, la lectura se realizó en el software de identificación ERIC- RapIDTM System.
Control de Calidad. Se utilizaron las cepas de referencia: S. Typhimurium ATCC 14028, S. Enteritidis ATCC 13076, S. Pullorum ATCC 13036.
Identificación Molecular. La cepas que bioquímicamente correspondieron a Salmonella, fueron sometidas a identificación molecular, para ello la extracción de DNA fue realizada según lo descrito por Paiva et al. (2009), 1 ml del caldo de cultivo de Salmonella spp. de 24 h de crecimiento se dispensó en tubos eppendorf y fueron centrifugados 3 min a 13000xg, luego el sedimento fue lavado dos veces con 500 μl de buffer TAE 1X, se centrifugó durante 3 min a 13000x g y finalmente fue resuspendido en 200 μl de agua ultra pura, se llevó a ebullición por 8 minutos y se almacenó a -20°C14. Posteriormente se realizó una PCR utilizando el estuche comercial de CorpoGen BM-00007(r), que permitió realizar la amplificación de un fragmento de 284 bp específico para el gen invA de Salmonella spp.
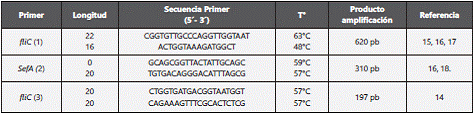
Para la identificación de los serovares S. typhimurium, S. enteritidis S. pullorum y S. gallinarum se utilizaron tres juegos de cebadores14,15,16,17,18(Tabla 2). En cada una de las reacciones se trabajó con un blanco y un control positivo de cepas ATCC.
Tabla 2 Cebadores usados para la identificación de S. typhimurium (1), S. enteritidis (2), S. pullorum y S. gallinarum (3).
Cada reacción se preparó a un volumen final de 25 μl, con 12,5 μl de master mix Promega(r), 8,5 μl de agua grado molecular, 3 μl de DNA y 0,5 μl de cada cebador. La amplificación de cada reacción se realizó usando el termociclador T100 Biorad(r).
Para Salmonella typhimurium se siguió la metodología descrita por Das Chagas et al., con una desnaturalización inicial de 94°C por 5´, 35 ciclos de desnaturalización 94°C por 30", anillamiento 55°C por 30", extensión 72°C por 30", y una extensión final de 72°C por 7´17. La amplificación de Salmonella Enteritidis se realizó de acuerdo con la metodología descrita por Akbarmehr con una desnaturalización inicial de 94°C por 5´, 35 ciclos de desnaturalización 94°C por 60", anillamiento 65°C por 30", extensión 72°C por 30", y una extensión final de 72°C por 7´19. Finalmente las condiciones de reacción para Salmonella gallinarum y S pullorum fueron las descritas por Paiva et al. (2009): desnaturalización inicial de 94°C por 5´, 35 ciclos de desnaturalización 94°C por 30", anillamiento 58°C por 30", extensión 72°C por 30", y una extensión final de 72°C por 7´14.
Las electroforesis de los productos de amplificación se realizaron en gel de agarosa al 1,5% teñido con SYBR(r) safe (Invitrogen).
Finalmente, para diferenciar entre Salmonella gallinarum y pullorum se realizó análisis de restricción enzimática (REA), según lo descrito por Paiva et al., brevemente: 5 μl del producto de la PCR, 1 μl de Hinp Buffer 10X, 0,1 μl de la enzima Hinp1l (New England, Biolabs) y 3,9 μl de agua grado molecular y se incubó a 37°C por 1 hora14. La electroforesis se realizó en gel de agarosa al 3% teñido con SYBR(r) safe (Invitrogen).
Resultados
Aislamiento e Identificación Microbiológica
De las 96 muestras obtenidas en las cuatro localidades, se detectó un 9,4% (n=9) de muestras positivas para Salmonella spp.; de éstas, el 55% (n=5) provenían del contenido interno y 44% (n=4) de cáscara. Respecto a los aislamientos por localidad, en Usaquén se detectaron muestras positivas en el primer y segundo muestreos, mientras en Fontibón hubo positividad solamente en el segundo. Los datos detallados por localidad y por muestreo se presentan en la figura 1.
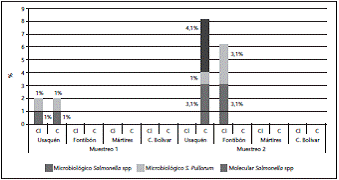
Figura 1 Porcentaje de muestras positivas a Salmonella spp (coincidencia de identificación entre los métodos microbiológico y molecular) en los dos muestreos realizados a las diferentes localidades de Bogotá. CI: Contenido Interno, C: Cáscara.
La identificación presuntiva con las galerías de Rapid One indicó que un 1% (n=1) fue presuntivo para S. pullorum, el resto de los aislamientos se clasificaron como Salmonella spp.
Identificación molecular
El 100% de las muestras (n=9) fueron identificadas mediante el estuche comercial de CorpoGen(r) BM-00007 como Salmonella spp. mediante la visualización del fragmento de 284pb en gel de electroforesis como se observa en la figura 2.
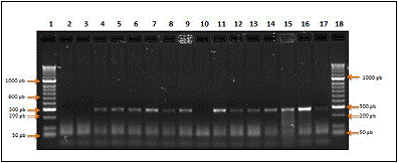
Figura 2 Electroforesis de PCR para muestras de huevo positivas con el estuche comercial de PCR (CorpoGen BM-00007). (1: Marcador Hyperladder II. 2: Blanco. 3: Control negativo. 4-9: Muestras huevo. 10: Control negativo. 11-13: Muestras huevo. 16: Control Positivo. 18: Marcador Hyperladder I. 14,15 y 17: Muestras pollo).
Del total de aislamientos identificados como Salmonella spp.
en ninguno se obtuvo productos de amplificación con los cebadores específicos para S. typhimurium, S. gallinarum, S. pullorum y S. enteritidis observándose únicamente la banda correspondiente al control positivo lo que permitió la validación de la prueba.
Se evidenció coincidencia en las dos pruebas de identificación utilizadas para la detección de Salmonella spp, como se ilustra en la figura 1.
Discusión
El presente estudio determinó la presencia de Salmonella spp. en huevos, con una prevalencia del 9,4%, que resulta ser similar a las reportadas por Suresh et al., Singh et al. y Betancor et al. en Uruguay e India donde se encontraron prevalencias del 5,5%, 7,7% y 9,4% respectivamente20,21,22, mientras otros reportes evidencian prevalencias cercanas a cero, como lo determinado para Canadá, Polonia, México, USA, Francia e Irán23,24,25,26,27,28. En Colombia, un estudio realizado en granjas de ponedoras de la Sabana de Bogotá en 1994 evidenció una prevalencia del 32,1%29, más recientemente en ciudades como Medellín y Tunja se reportaron prevalencias de 0% y 1,74% respectivamente12,30. La variación en los datos observados puede estar relacionada con la implementación de normas estrictas de bioseguridad en granjas y un adecuado manejo de los productos avícolas durante los últimos años; así como al método de recuperación empleado en el laboratorio, sin embargo, a pesar de no haberse encontrado una alta prevalencia en el último decenio, si se evidencia la contaminación de este alimento que debería estar libre de patógenos.
De manera específica, con respecto a los hallazgos por localidad, solamente en Usaquén y Fontibón se presentó positividad, cabe resaltar que estos resultados constituyen un primer acercamiento al conocimiento de este patógeno transmitido por huevo en la ciudad capital, por lo que no es posible hacer una comparación objetiva de estos datos, salvo la recomendación de profundizar en este tipo de estudios.
La presencia de Salmonella spp., reportada en este estudio, puede estar relacionada con las condiciones de manejo y almacenamiento de los huevos en los diferentes expendios de la ciudad, en los que se encontraban a temperatura ambiente y expuestos a la contaminación ambiental lo que favorece la presencia de microrganismos patógenos, ya que según las buenas prácticas establecidas para el manejo, éste alimento debe permanecer refrigerado (4°C) para conservar su buena calidad y disminuir la proliferación bacteriana31. Las deficientes condiciones de manejo están relacionadas con alta prevalencia de Salmonella spp. en cáscara, que para este estudio fue de 44%; en el caso del contenido interno la presencia fue de 55% donde la contaminación puede ocurrir por infección intraovarica cuando el ave se encuentra infectada por el patógeno sin presentar síntomas aparentes, también se puede relacionar con condiciones deficientes de manejo y almacenamiento, desde la postura hasta su distribución y comercialización20,21,30.
En cuanto a la identificación de los aislamientos de este estudio mediante PCR y REA, no fue posible determinar el serovar presente con los 4 pares de cebadores utilizados, lo que podría indicar la presencia de serovares menos comunes a lo reportado mundialmente, pues los serovares comúnmente asociados a ETA especialmente por alimentos de origen aviar son S. enteritidis y S. typhimurium32. En India se reportó S. enteritidis en el 89,7% de las muestras obtenidas a partir de la cáscara y en el 100% de las muestras de contenido interno20, otro estudio identificó a S. typhimurium en el 35,3% de las muestras evaluadas21; en Francia el 18,2% de aislamientos correspondió a S. typhimurium y el 45,5% a S. enteritidis27, adicionalmente en Uruguay el 13,79% de los asilamientos fueron tipificados como S. enteritidis22.
La presencia de este microorganismo representa un riesgo importante para la salud pública, pues la salmonelosis es una entidad que ocasiona severos trastornos gastrointestinales caracterizados por la presentación de cuadros diarreicos y en algunas ocasiones enfermedad sistémica, manifestaciones clínicas que de acuerdo con los reportes de literatura ocasionan tasas de hospitalización hasta del 35% y altas tasas de mortalidad que pueden llegar al 28%33,34, todo lo anterior se ve reflejado en los altos costos derivados de tratamiento y hospitalización que deben ser asumidos por el sistema de salud.
Las limitaciones del estudio están relacionadas con el muestreo, debido a que se escogieron cuatro localidades en relación a los puntos cardinales, lo que puede no reflejar la situación general de las demás localidades de la ciudad, adicionalmente el número de tiendas y plazas de mercado, así como el número de muestras analizadas fueron bajos, lo que puede limitar la validez externa del estudio; sin embargo, el haber escogido las localidades basados en los puntos cardinales y haber muestreado al azar las tiendas y plazas de mercado hace que la validez interna sea buena reflejando la calidad microbiológica del huevo para el consumo humano en relación a la presencia de Salmonella spp., siendo éste el primer estudio que indaga este aspecto en la ciudad de Bogotá.
Las dos técnicas utilizadas coincidieron en la identificación de Salmonella spp. evidenciándose que el 100% de los aislamientos microbiológicos fueron igualmente identificados mediante PCR; independientemente de no haberse identificado el serovar de Salmonella enterica presente tanto en cáscara como en contenido interno, la presencia de este patógeno sugiere un riesgo potencial en la salud pública, por lo que es necesario ampliar este tipo de estudios para conocer la situación real a nivel nacional frente a este patógeno.