Introducción
La tuberculosis (Tb) es una enfermedad infecciosa con una alta morbimortalidad, y según la Organización Mundial de la Salud (OMS), un tercio de la población mundial está infectada lo que representa un problema de salud pública. Para el 2014, se estimó que 9,6 millones de personas en el mundo adquirieron Tb1, mientras en Colombia, para el 2013 se notificaron 10.849 casos2.
La tuberculosis multidrogorresistente (MDR-TB), definida como la resistencia a medicamentos de primera línea (rifampicina-isoniacida)3, y la tuberculosis ampliamente resistente (XDR-TB), entendida como MDR-TB asociada a resistencia a medicamentos de segunda línea (cualquier fluoroquinolona y al menos un medicamento inyectable de los siguientes: amikacina, kanamicina, capreomicina), se han convertido en obstáculos para el control de la infección. En el 2014, la OMS estimó 480.000 casos de MDR-TB1. En Colombia, en el mismo periodo, se reportaron 103 casos MDR-TB y dos XDR-TB4. Por tal motivo, la OMS impulsa el acceso universal al diagnóstico y tratamiento5.
El proceso diagnóstico de la Tb, requiere de una evaluación clínica y ayudas diagnósticas complementarias6, además debería incluir pruebas de sensibilidad a medicamentos. Entre las técnicas de valoración a medicamentos se encuentra las proporciones múltiples, metodología catalogada como método de referencia, con un tiempo de respuesta aproximado de 28 días7. Otras más rápidas como BACTEC™460TB8 y BACTEC™MGIT9, evalúan el crecimiento bacteriano en presencia de antibiótico, con resultados entre 3 y 10 días. También están disponibles las técnicas de Biología Molecular (BM) basadas en la Reacción en Cadena de la Polimerasa (PCR), con resultados en un día y con el aval de la OMS10, entre éstas, Xpert® MTB/RIF, que detecta de forma simultanea Mycobacterium tuberculosis (MTB) y sensibilidad a rifampicina11; Genotype MDRplus (Hain-Lifescience-Nehren-Germany)12 que evalúa sensibilidad a medicamentos de primera línea y, requiere otro kit para detección a segunda.
Con el fin de optimizar el diagnóstico de la Tb y conocer los patrones de sensibilidad, se deben evaluar métodos emergentes como Anyplex™II_MTB/MDR/XDR, el cual consiste en una metodología por BM en tiempo real y PCR múltiplex, para la identificación del complejo MTB y detección de las mutaciones más frecuentes en los genes que confieren resistencia a medicamentos de primera línea (rifampicina e isoniazida) como también a fluoroquinolonas y drogas inyectables: amikacina, kanamicina, y capreomicina, con resultados en un día13. Esta técnica identifica 18 mutaciones que causan resistencia a rifampicina en el gen rpoB, 7 mutaciones que causan resistencia a isoniazida en los genes katG e inhA, 7 mutaciones que causan resistencia a fluoriquinolonas en el gen gyrA y 6 mutaciones que causan resistencia a drogas inyectables en el gen rrs y en la región promotora eis.
De manera complementaria, el desempeño de una prueba, debería contar con aproximaciones como: utilidad, pertinencia y conductas terapéuticas a partir de resultados de laboratorio. Así, una prueba diagnóstica debe ser considerada como parte en la toma de decisiones clínicas, ya que hay una relación directa de éstas con: la eficacia, el mejoramiento del proceso diagnóstico, la estrategia terapéutica y asistencial14.
Este estudio evalúa la utilidad de Anyplex™II_MTB/MDR/XDR para la detección de MTB y sensibilidad simultánea a medicamentos de primera y segunda línea, a partir de muestra directa, además de una aproximación del impacto en la toma de decisiones terapéuticas en pacientes atendidos en un hospital de alta complejidad.
Material y métodos
Estudio descriptivo retrospectivo de corte trasversal (noviembre 2014 a junio 2015), con muestreo a conveniencia de pacientes con sospecha de Tb pulmonar, atendidos en el Hospital Universitario de San Vicente Fundación (HUSVF). Las muestras pulmonares (esputo y lavado broncoalveolar) debían tener disponible: baciloscopia, cultivo, prueba molecular y pruebas fenotípicas para fármacos anti tuberculosos cuando aplicó, además del correcto diligenciamiento de las historias clínicas electrónicas.
Pruebas convencionales y fenotípicas a medicamentos
La baciloscopia fue realizada por el método de Ziehl-Neelsen tradicional, el cultivo en Ogawa-Kudoh con Hidróxido de Sodio al 4%15, siguiendo los protocolos institucionales. A los cultivos positivos, se les realizó la prueba de proporciones múltiples para medicamentos de primera línea7 en el Laboratorio Departamental de Salud Pública, y para fármacos a segunda línea, con tecnología BACTEC-MGIT-9609 en el Instituto Nacional de Salud.
Anyplex™II_MTB/MDR/XDR
Los pasos de pretratamiento de las muestras, extracción de material genético y preparación de mezcla maestra para PCR múltiplex, se realizaron de forma manual acorde a las instrucciones del fabricante. Los pasos de amplificación y generación de curvas meelting, fueron realizados en el instrumento CFX-96TM (Bio-Rad), tres controles fueron incluidos en cada corrido: dos positivos (wild type resistent) y uno negativo. Los análisis e interpretación de datos se realizaron en el software Seegene Viewer 2.0
Datos clínicos
Se revisaron las historias clínicas de los pacientes, para extraer variables sociodemográficas, clínicas y microbiológicas. Se consideró que el resultado de Anyplex™II_MTB/MDR/XDR tuvo impacto, si fue registrado como base para tomar una conducta terapéutica en el paciente hasta dos días posteriores a su generación, en las siguientes categorías: Inicio de tratamiento, no implementación de tratamiento, mantener tratamiento inicial y cambio de tratamiento.
Análisis de información
La tabulación de los datos se realizó en Excel 2010®, y en SPSS-21.0® se calcularon descriptivos (tablas-gráficos), incluyendo el cálculo de la desviación estándar (DS). Epidat 4.1 de la Organización Panamericana de la Salud, fue utilizado para estadísticos de validez: sensibilidad, especificidad, valores predictivos e índice kappa; el método de referencia fue Ogawa-Kudoh.
El estudio fue aprobado por el comité de Investigación y de Ética del HUSVF. Según resolución 8430 de 1993 del Ministerio de Salud de Colombia, este estudio se considera sin riesgo, por ser de fuente secundaria.
Resultados
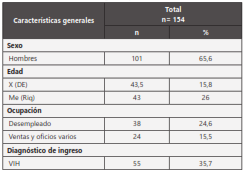
156 muestras consecutivas de 154 pacientes, fueron incluidas (tabla 1). Los porcentajes de positividad fueron: Cultivo Ogawa-Kudoh, 35,8% (n=56), coloración Ziehl-Neelsen, 31,4% (n=49), Anyplex™II_MTB/MDR/XDR, 40,3% (n=63); el 33,9% fueron positivas tanto por cultivo como por prueba molecular (53). Un aislamiento correspondió a una micobacteria atípica, no incluido para análisis posteriores.
Tabla 2 Rendimiento de Anyplex™II MTB/ MDR/XDR según Baciloscopia y tipo de muestra.

S= sensibilidad; E = especificidad
VPP = valor predictivo positivo; VPN = valor predictivo negativo
* = S, E, VPP y VPN no calculable
El índice Kappa entre Anyplex™II_MTB/MDR/XDR y Ogawa- Kudoh, fue de 0,84 (IC 95%: 0,75-0,93 y p:< 0,01). Para los aislamientos positivos por cultivo y prueba molecular (n=53), las pruebas fenotípicas presentaron una concordancia del 100% (Tabla 3).
Tabla 3 Caracterización a medicamentos antituberculosos por detección de genes de resistencia Anyplex™II MTB/ MDR/XDR. HUSVF, 2015

En el 57% (n=89) de los pacientes, el resultado de la prueba molecular fue registrado en la historia clínica como pauta para decisiones terapéuticas, de la siguiente manera: 51,6% (n=46) no implementación de tratamiento, 26,9% (n=24) mantener manejo terapéutico instaurado inicialmente, 19,1% (n=17) útil para iniciar de tratamiento, y 2,2% (n=2) para cambio de manejo antituberculoso, por reporte de alguna resistencia.
El tiempo para obtener el resultado: Anyplex™II_MTB/ MDR/ XDR fue de 3 días (DS±2,15), pues por programación del hospital la prueba se realiza tres veces por semana; para los cultivos positivos, de 27 días (DS±5,2), con el reporte de medicamentos a primera línea hasta 50 días (DS±10), y un acumulado total de 70 días (DS± 7,7) para fármacos de segunda línea.
Discusión
La prueba molecular Anyplex™II_MTB/MDR/XDR de reciente disponibilidad en el país y con escasa literatura sobre su rendimiento en Latinoamérica, ofrece ventajas sobre otras metodologías de BM en tuberculosis, por la posibilidad que ofrece de identificar en tiempo real genes de resistencia a varios medicamentos antituberculosos en un solo montaje. El presente estudio responde a la necesidad de documentar el desempeño de ésta, comparada con métodos tradicionales (coloración Ziehl-Neelsen y cultivo Ogawa-Kudoh), todavía de uso rutinario en varias instituciones en el país, que refleja una limitación en el diagnóstico microbiológico, ya que en Colombia para el 2013, solo el 75% de los casos de Tb notificados, fueron confirmados por el laboratorio2, evidenciando la necesidad de contar con técnicas que sean de mejor desempeño. Otro aporte del presente estudio, es la documentar la aproximación de la conducta terapéutica posterior al resultado de una prueba molecular, como factor importante en la implementación y seguimiento de nuevas ayudas diagnósticas.
La prueba Anyplex™II_MTB/ MDR/XDR, fue positiva en el 40,3%, que comparada con otros estudios que han reportado rendimientos del 13,6%16 y de 20,9%17, presentó un desempeño superior en nuestra población. Mientras que las pruebas convencionales como la coloración de Ziehl-Neelsen y el cultivo Ogawa-Kudoh, presentaron un rendimiento diagnóstico del 31,4% (n=49) y 35% (n=56) respectivamente. Una posible explicación al mejor desempeño de la prueba molecular, puede estar en relación con el tipo de población que consulta en la institución, que por el nivel de complejidad atiende un número importante de pacientes con coinfección con VIH (35,7% de los pacientes ingresados al estudio), trasplantados y con otro tipo de comorbilidades, que son factores de riesgo para progresión de Tb latente a Tb activa18, o casos de difícil manejo como son pacientes con problemas de adherencia al tratamiento antituberculoso, sospecha de fracaso o recaídas que requieren valoración especializada y pruebas rápidas de sensibilidad a fármacos, por lo que el 26,5% (n=13) de las baciloscopias positivas, correspondieron a pacientes con Tb previa.
La sensibilidad general fue del 96,3% (IC 95%: 90,51- 100), en contraste a estudios previos que reportaron 82,9% (IC 95%: 72,5-90,6)16, 87,5% (IC95%: 80- 94,9)19, y 86% (IC 95%: 68-96)17 (Figura 1); mientras que con baciloscopia negativa, se han reportado sensibilidades del 69,2% y 81,3%17,19, similares al presente trabajo del 77%, útil para la toma de decisiones terapéuticas mientras está disponible el resultado por cultivo (tabla 2).
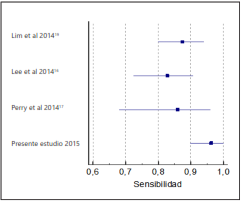
Figura 1 Gráfica Forest plot de la sensibilidad estimada para la detección de Mycobacterium tuberculosis comparado con otros estudios.
Respecto a los falsos negativos (dos casos), se ha descrito como causas, la presencia de inhibidores y errores técnicos 20, así como problemas en la calidad de la muestra, en especial el LBA, que por dilución, puede interferir en el límite de detección de la prueba.
Es importante tener en cuenta que se requiere una infraestructura y prácticas de laboratorio adecuadas de BM, que garanticen condiciones pre-analíticas óptimas, con el fin de evitar contaminaciones y falsos positivos.
Los nueve casos con cultivo negativo y Anyplex™II_MTB/ MDR/XDR positivo, se deben interpretar en conjunto con los datos clínicos y epidemiológicos del paciente, pues al tomar el cultivo como prueba de referencia, se clasificarían estos resultados como falsos positivos de la prueba molecular, que se pueden explicar en parte por falta de viabilidad bacteriana, inadecuado manejo de la muestra o restos de material genético de la micobacteria en los pacientes con antecedentes de Tb antigua. El centro de control de enfermedades (CDC) recomienda ante sospecha clínica media-alta de Tb, si la baciloscopia es negativa y prueba molecular positiva, considerar diagnóstico presuntivo21.
Frente a la monoresistencia, a nivel nacional, se ha reportado 3,42% a isoniazida y 0,41% a rifampicina22, y con leve aumen- to en los casos tratados previamente, en el presente estudio se presentaron dos casos. No se presentaron casos de XDR-TB, pero se detectó dos muestras del mismo paciente con MDR-TB más resistencia a inyectables; el factor de riesgo principal para desarrollar resistencia, es la exposición inadecuada a medicamentos antituberculosos23, elemento presente en este caso.
En el 43% (67 casos) de los pacientes, el resultado de Anyplex™II_MTB/MDR/XDR no fue registrado en la historia del paciente para definir alguna conducta terapéutica. Ésta situación debe llevar a una reflexión frente al principal uso de las ayudas diagnósticas, que es reducir el nivel de incertidumbre en la toma de conductas terapéuticas, ya que únicamente deberían solicitarse cuando el resultado vaya a influir en el manejo del paciente. La utilización indiscriminada de pruebas diagnósticas aumentan costos en el sistema, conduciendo a un detrimento en la calidad de la oferta futura24.
Como limitaciones podemos mencionar tres aspectos, pri- mero, aunque la concordancia a los fármacos antituberculosos fue del 100% en los cultivos positivos, evaluar el real desempeño de sensibilidad a medicamentos, requeriría un número mayor de aislamientos con algún tipo de resistencia; segundo, el método de referencia, no fue el óptimo, debido a que para el tiempo del presente estudio no se contaba con medios con medios líquidos de cultivo como BACTEC™MGIT, ni con la tinción de auramina-rodamina para las baciloscopias, ya que estas metodologías tienen mayor sensibilidad; y por último, el diseño retrospectivo, el cual implica posibles sesgos de calidad en la información.
Por otro lado, con la presente prueba molecular, se hace necesario la evaluación en muestras no respiratorias, debido a que informes previos de otros países25 y en Colombia26, la forma extrapulmonar muestra cifras importantes; también se debe realizar otras aproximaciones como por ejemplo de costo-beneficio y costo-efectividad, los cuales complementen el desempeño integral de la técnica evaluada en el presente estudio.
En conclusión, las pruebas moleculares no reemplazan las convencionales, sin embargo, se potencian cuando se combinan con datos clínicos y epidemiológicos. Anyplex™II_TB/ MDR/XDR, ofrece la posibilidad de un tamizaje rápido y confiable de Tb y su perfil de sensibilidad a fármacos comparable con las pruebas fenotípicas de primera y segunda línea, a partir de muestra directas y con un mejor desempeño en aquellas con baciloscopia positiva.
La implementación de nuevas ayudas diagnósticas, deben estar en concordancia con las necesidades en la atención del paciente, para que tengan un adecuado impacto en las acciones terapéuticas, con el fin de tener un abordaje integral en el proceso asistencial.