INTRODUCCION
La osteoporosis es un trastorno esquelético sistémico caracterizado por masa ósea baja asociada a pérdida de la resistencia del hueso (que depende a su vez de la mineralización de la matriz orgánica, grado de recambio óseo, geometría ósea, conservación de tejido trabecular y conectivo, recambio bioquímico y grosor de la cortical), lo que conlleva a fragilidad ósea y aumento del riesgo de fractura.1
Se calcula que 10 millones de estadounidenses mayores de 50 años tienen osteoporosis, y que otros 34 millones están en riesgo de la enfermedad. Se estima que hay 1,5 millones de fracturas por fragilidad cada año.2 La pérdida ósea con la edad es similar en los países de América Latina en comparación con los EE.UU., la prevalencia de osteopenia vertebral en mujeres de 50 años y más es de 45,5 a 49,6%, osteoporosis vertebral de 12.1 a 17,6%. En osteopenia de cuello femoral está presente desde 46 hasta 57% y osteoporosis 7,9 a 22%3. En un estudio poblacional de osteoporosis masculina realizado en un centro de reumatología y ortopedia en Barranquilla Colombia, se encontró que la edad media era de 57,65 años (SD+/-: 14,7); 71,4% eran mayores de 49 años, la prevalencia general de osteoporosis fue del 17,96%, y de osteopenia del 34,41%. La prevalencia más alta de osteoporosis fue encontrada en la categoría de edad de 70 a 79 años, y en el grupo de 40 a 49 años con 20,9%.
La osteoporosis es común en las personas con el virus de inmunodeficiencia humana (VIH). La etiología de la osteoporosis en los pacientes infectados por el VIH es probablemente multifactorial, involucrando a los factores de riesgo tradicionales como la edad, el bajo peso corporal, hipogonadismo, el tabaquismo, el consumo de alcohol, así como los efectos directos de la infección crónica por el VIH y los medicamentos antirretrovirales (ARV). Nuevas evidencias sugieren que el aumento de la prevalencia de la osteoporosis en las personas infectadas por el VIH se traduce en un mayor riesgo de fractura, que puede conducir a aumento de morbilidad y mortalidad5, 6, 7, 8.
Los pacientes con VIH pueden desarrollar varias complicaciones una de ellas es la afectación del hueso que incluye baja densidad mineral ósea, osteoporosis, osteonecrosis, y rara vez osteomalacia. La baja densidad mineral ósea que conduce a la osteoporosis es la patología más común del hueso. Esto puede resultar de la infección por VIH (directa o indirectamente), toxicidad antirretroviral, o como consecuencia de otras comorbilidades6.
En el inicio de la infección por VIH se producen muchos cambios, incluyendo el agotamiento masivo de células T del tejido linfoide gastrointestinal, alteraciones en la flora intestinal, aumento de la translocación bacteriana, la activación inmune, y excesiva inflamación sistémica9. Esta inflamación probablemente tiene efectos directos sobre el hueso a través de la activación de los osteoclastos y la supresión de la función de los osteoblastos8.
El estudio SMART que evaluó la terapia ARV continua vs terapia intermitente ARV; determinó que los pacientes que recibieron terapia continua tuvieron más pérdida de la DMO en comparación con los de terapia intermitente, dado que los primeros tuvieron un gran aumento en los marcadores de recambio óseo, el cual es uno de los mecanismos que producen la baja masa ósea en las personas con VIH que reciben terapia antiretroviral (TAR)10.
Un estudio transversal para verificar la influencia de citocinas proinflamatorias sobre el metabolismo óseo en pacientes con y sin terapia ARV, demostró que el aumento de la producción de estas citocinas principalmente en el grupo de viremia, estimuló la actividad de los osteoclastos con posterior disminución de masa ósea; condición más observada en el grupo de los pacientes que recibieron ARV11
Otro mecanismo por el cual se produce baja masa ósea es la alteración del metabolismo de la vitamina D producida por los medicamentos ARV. Dicha alteración se produce por inhibición (Inhibidores de la proteasa-IP) o inducción (Inhibido- res de la Transcriptasa Reversa No Nucleósidos -ITRNN) de la enzima CYP4508. El uso de inhibidores de la proteasa se asocia con la pérdida de DMO en varios estudios y se cree que está relacionada con la toxicidad para las células precursoras de osteoblastos12. A la inversa, inhibidores de la integrasa parecen tener poco impacto sobre la DMO8. El caso particular de Tenofovir, está implicado con frecuencia en la baja masa ósea, debido a su efecto en el túbulo proximal que conduce a un síndrome de Fanconi con pérdida de fosfato13.
Un meta-análisis, publicado en 2006, demostró tres veces más prevalente la osteoporosis en las personas infectadas por el VIH en comparación con los controles, personas sin VIH. Reportó que los hombres y mujeres con VIH expuestos a TAR y a inhibidores de proteasas tienen una prevalencia más alta que sus respectivos controles14. Los hombres y mujeres con VIH tuvieron un 3,7 veces mayor riesgo (IC95% 2,3 a 5,9) para osteoporosis y 6,4 veces mayor riesgo de baja densidad mineral ósea (T-score ≤1.0) ( IC95%: 3,7 a 11,3), en comparación con las personas VIH negativas14.
La densidad mineral ósea baja y las fracturas óseas se observan con frecuencia entre las personas jóvenes y mayores infectados por el VIH, con un máximo de tres veces la prevalencia de la osteoporosis y las tasas de fractura 30-70% más altos en comparación con los controles no infectados por VIH15. Comorbilidades relacionadas con el envejecimiento, como la osteoporosis, están aumentando en importancia para las personas infectadas por el VIH en la era de la terapia antiretroviral altamente efectiva (TARAE), siendo las fracturas una fuente importante de morbilidad16. Por otro lado. Harris y Brown, determinaron la prevalencia de periodo de fracturas de la columna vertebral, la cadera y la muñeca, sitios comúnmente asociados con la osteoporosis, fue más del 60% en los hombres y las mujeres infectadas por el VIH en comparación con personas no infectadas por VIH5.
Teniendo en cuenta los estudios reportados en la literatura mundial, se considera relevante conocer los trastornos de la densidad mineral ósea asociados en las personas con VIH atendidas en una institución de tercer nivel; dado que en el seguimiento clínico de 180 pacientes que reciben TAR, se han encontrado 4 casos con fracturas patológicas. En nuestro contexto no existen datos acerca de la densidad mineral ósea en las personas que reciben TAR, por lo tanto esta investigación tuvo como objetivo principal describir los trastornos de la densidad mineral ósea en los pacientes con VIH que reciben terapia Antiretroviral atendidos en una institución de tercer nivel de complejidad.
Materiales y métodos
Se realizó un estudio descriptivo de corte transversal. Como criterios de inclusión se seleccionaron pacientes con diagnóstico confirmado de VIH que reciben actualmente TAR sin cambios al menos en el último año, de ambos sexos, y cualquier estadio clínico. Se excluyeron: mujeres gestantes, menores de 20 años (dado por recomendaciones de fabricante del equipo Dual Energy X Ray Absorptiometry (DXA) utilizado para densitometrías), y pacientes con diagnóstico de cáncer concomitante (Linfomas).
Procedimiento
A cada paciente le fue realizada una densitometría ósea bajo el método de absorciometría de rayos X de energía dual, DXA de columna lumbar y cuello femoral. La clasificación de los resultados fue tomada según los criterios de la OMS: normales (T-score> -1,0), con osteopenia (T-score ≤ -1,0 y ≥ -2,5) y con osteoporosis (T-score <-2,5) 17. Variables sociodemográficas como edad, sexo fueron obtenidos directamente del registro de seguimiento del programa de VIH; las variables clínicas definidas de interés para el estudio fueron: antecedentes de infecciones oportunistas frecuentes (Tuberculosis, Toxoplasmosis cerebral), uso de glucocorticoides, consumo de cigarrillo, carga viral y estadio del VIH, estas tuvieron como fuente primaria para su recolección, los resultados consignados directamente en el sistema electrónico de historia clínica, el cual se encuentra interconectado con los resultados de paraclínicos enviados durante el desarrollo del proyecto. En cuanto a la caracterización de la TAR recibida por cada paciente, se obtuvo el nombre genérico y combinaciones de los mismos, igualmente la fecha de inicio de cada medicamento, la información sobre la TAR fue obtenida mediante las prescripciones realizadas en la historia clínica y los registros de seguimiento del programa.
Dado que el programa de VIH de la institución tiene implementado un seguimiento clínico por cohorte integrado por 230 pacientes, bajo el cumplimiento de criterios de inclusión y exclusión quedaron 180 pacientes, cantidad tal que no fue necesario de muestrear y se tomó la totalidad de estos pacientes.
Para el procesamiento de la información, se consignó la información pertinente a las variables del estudio en una hoja de cálculo, posteriormente se ejecutó un análisis exploratorio de los datos para identificar distribución de la variables y realización de prueba de normalidad de kolmogorov, posteriormente se evaluaron contrastes de hipótesis bivariadas de acuerdo a la naturaleza de la variable, se usaron pruebas no paramétricas como Mann-Whitney, Chi-cuadrado con corrección de Yates. Como medida de asociación se utilizó el OR con intervalos de confianza al 95%, como método de ajuste se aplicó una regresión logística binaria, todos los contrastes se tomaron significativos con p < 0,05. Se utilizó el software Stata 14.
Consideraciones éticas
Dando cumplimiento a la resolución 8430 de 1993, la investigación conto con el aval del comité de ética e investigación de Comfamiliar Risaralda mediante acta N°00012. Se solicitó a cada participante firma del consentimiento informado previa explicación de objetivos, beneficios y riesgos de participación. Los pacientes que fueron diagnosticados con algún trastorno de la densidad mineral ósea fueron remitidos a su entidad de salud para tratamiento oportuno.
Resultados
Se evaluaron 180 pacientes, de los cuales 76,5% pertenecían al sexo masculino, con un promedio de edad de 41 años (de 11,3 años), con un índice de masa corporal promedio (IMC) 24,2 Kg/ m2. En cuanto a los resultados densitométricos se clasificaron como normales 72,6%, Osteopenia 20,6% y osteoporosis en el 6,7%. De los 180 pacientes 4 presentaron fracturas patológicas, es decir el 2,2%. En la tabla 1 se describen las variables que caracterizan la muestra estudiada. Los medicamentos prescritos fueron los que conforman el último esquema antiretroviral y su distribución se puede ver en la figura 1.
Tabla 1 Características generales pacientes VIH con TAR de una institución de tercer nivel de complejidad n=180
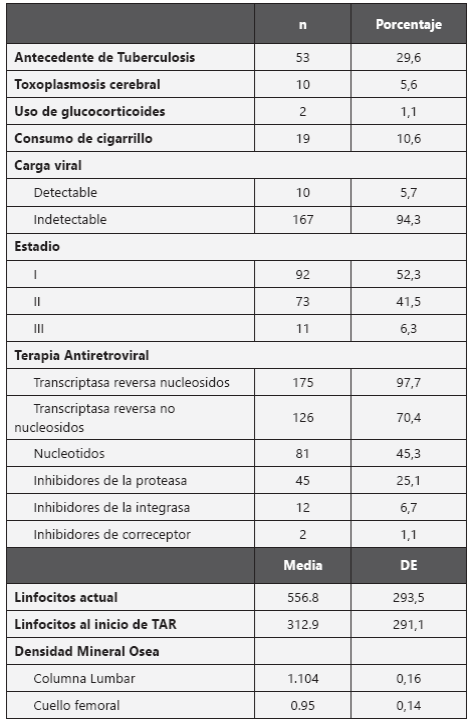
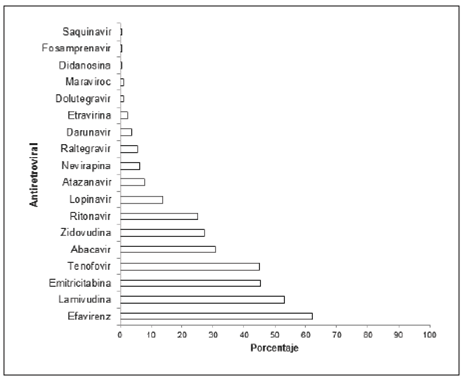
Figura 1 Distribución uso de antirretrovirales en pacientes con VIH en una institución de tercer nivel de complejidad
El análisis bivariado descrito en la tabla 2 muestra que existe una diferencia estadísticamente significativa de la pérdida de masa ósea según la edad (p= 0,0001), de igual manera que el tiempo de exposición a la terapia antiretroviral tiene un impacto importante (p=0,0056). Se observa también que los pacientes que reciben Inhibidores de la transcriptasa reversa no nucleósidos tienen un efecto importante en relación a la baja masa ósea (p=0,017).
Tabla 2 Análisis comparativo bivariado pacientes con VIH con TAR en una institución de tercer nivel de complejidad n=180 de normalidad p<0.05
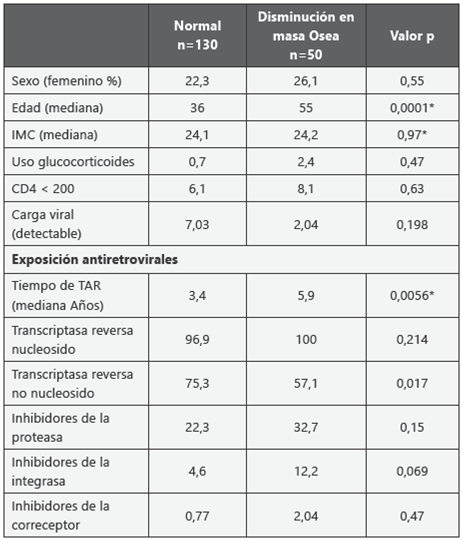
* prueba no paramétrica Mann-Whitney, prueba de normalidad p<0.05
El análisis multivariado mostró una significancia estadística importante de la Nevirapina (ORa 0.10 IC95% 0.01 - 0.8). Respecto a la combinación Tenofovir / Emtricitabina mostró una frecuencia más alta del efecto (ORc=1,376 IC95% 0,7 2,6) el cual ajustado por otras variables incrementa de manera importante (ORa 3,664 IC95% 1,2 - 11,0) y estadísticamente significativo (Tabla 3)
Tabla 3 Análisis multivariado en la relación antiretrovirales y la disminución de la masa ósea en pacientes VIH con TAR en una institución de tercer nivel de complejidad n=180
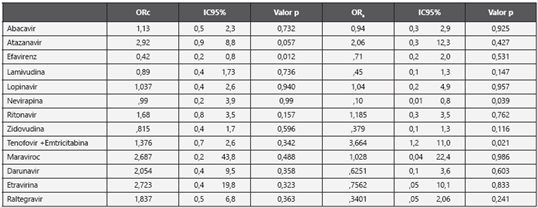
ORc: Odds Ratio crudo
ORa: Odds Ratio ajustado por edad, carga viral, linfocitos CD4, mediante modelo de regresión logística binaria, Tiempo de TAR
Discusión
A pesar de que el pronóstico de la enfermedad por VIH ha mejorado notoriamente con la introducción de la terapia ARV, se han observados toxicidades asociadas como es el caso de la disminución de la densidad mineral ósea.18. Estos trastornos de osteopenia y osteoporosis han sido descritos especialmente en los pacientes que reciben ARV.14
Este estudio mostró que la edad tuvo un papel importante en la baja masa ósea reportada; los pacientes con una mediana de 55 años tuvieron un hallazgo estadísticamente significativo (p=0,0001), variable independiente encontrada en otros estudios similares18,19.
El hallazgo de baja masa ósea fue más frecuente en los pacientes que llevaban más tiempo de exposición a la terapia. Se observó una mediana de 5.9 años en tiempo de exposición a medicamentos en los pacientes que reportaron un baja masa ósea en contraposición con una mediana de 3.4 años en tiempo de exposición a ARV en los pacientes con densitometría normal (p=0.0056). La baja densidad mineral ósea ha sido asociada a la duración de la terapia ARV en algunos grupos estudiados19,20,21.
La mayor frecuencia de baja masa ósea encontrada en el estudio está asociada a los pacientes que reciben Tenofovir/ Emtricitabina como parte del esquema, lo cual está en concordancia con otros estudios 22,23 .
El estudio ASSERT compara los cambios en la densidad mineral ósea en pacientes con Abacavir/Lamivudina y Tenofovir /Emtricitabina a las 48 semanas. Se demostró la pérdida de DMO en ambos grupos de tratamiento, con una pérdida de DMO significativamente mayor en el grupo de tenofovir/Emtricitabina que en el grupo de abacavir-lamivudina durante un período de 48 semanas24
De igual manera el estudio NEAT001/ANRS143,que comparó Darunavir/Ritonavir más Raltegravir y Darunavir/Ritonavir más Tenofovir/Emtricitabina, mostró que el régimen que tenía Raltegravir se asoció significativamente con menor pérdida de la masa ósea que el régimen que contenía Tenofovir/Emtri- citabina25. Otro estudio comparó Maraviroc frente a Tenofovir respecto de la densidad mineral ósea y concluyó que Maraviroc se asoció a menor pérdida ósea que el Tenofovir26. Se comparó un esquema con efavirenz/ Emtricitabina /tenofovir versus dolutegravir /abacavir/lamivudina en pacientes naive durante 144 semanas encontrándose resultados significativamente más bajos de trastornos en la densidad ósea en los pacientes que recibieron Dolutegravir/Abacavir/Lamivudina que en el primer esquema27. Se evidenció un efecto protector de la Nevirapina en cuanto a la disminución de la densidad mineral ósea, evento que concuerda con un estudio que comparó un esquema con Zidovudina/Lamivudina /Lopinavir/r y otro con Nevirapina /Lopinavir /ritonavir, los pacientes del primer esquema presentaron baja masa ósea asociada a Zidovudina /Lamivudina, demostrándose el efecto protector de la Nevirapina28. Otro estudio mostró como el cambio de un esquema con Tenofovir/Emtricitabina más un Inhibidor de la proteasa potenciado como Ritonavir, cuando se cambia a Raltegravir más Nevirapina evidenció a las 48 semanas un efecto de mejoría en la función renal y la densidad mineral ósea29.
De los 180 pacientes analizados en este estudio cuatro pacientes tuvieron un desenlace de fractura, es decir el 2.2%, tres pacientes eran mujeres mayores de 45 años y con una densitometría reportada como osteoporosis, dos de ellas tenían Tenofovir como parte del esquema ARV. El otro caso con desenlace de fractura fue un hombre de 53 años con densitometría reportada con osteopenia quien también recibía Tenofovir en el tratamiento.
La osteoporosis se ha convertido en una importante comorbilidad de la infección por VIH y se ha documentado un modesto aumento en el riesgo de fractura30. Los datos sugieren que el riesgo de fractura aumenta durante los primeros años después del inicio de la TAR, incluso en individuos relativamente jóvenes. Es de destacar que el aumento en la incidencia de fracturas está temporalmente alineado con la disminución aguda del 2-6% en la DMO que se ha reportado en múltiples estudios dentro de los primeros 2 años después del inicio del TAR 31. La relevancia clínica de la osteoporosis en la infección por VIH ha sido incierta; sin embargo, las fracturas por fragilidad se informan cada vez más en los pacientes infectados por el VIH 6.
Las limitaciones para este reporte de investigación se deben a que los pacientes no tenían una medición anterior de la densidad mineral ósea; no se tenía una línea de base cuando fueron diagnosticados con VIH. No se pudo realizar una medida significativa de la baja masa ósea con respecto a todos los antiretrovirales, dado que la mayoría de los pacientes se encuentran controlados inmunovirológicamente con esquemas básicos de primera línea para la fecha en la cual fueron formulados. Actualmente la Guía de manejo de VIH del Ministerio de Salud de Colombia recomienda la realización de densitometría ósea antes de iniciar la terapia ARV, según las recomendaciones para la población general (mayores de 50 años y posmenopáusica) y como seguimiento en las personas con VIH, cada dos años si hay progresión de enfermedad o en los resultados de la densitometría, o valor de CD4 bajo (<200 células/mm3), o uso de tenofovir33.
Además de las recomendaciones convencionales para las personas con VIH que presentan baja DMO, otras intervenciones son necesarias en esta población. En este sentido, la terapia antirretroviral se debe elegir teniendo en cuenta el riesgo del paciente de fracturas óseas; por lo cual la detección oportuna de la salud ósea para identificar los pacientes en situación de riesgo, evitará futuros problemas34.
La población con VIH generalmente es joven, por lo cual su expectativa de vida es alta y una complicación como la osteoporosis y la fractura limitaran o disminuirán drásticamente esta expectativa de vida y su calidad de vida.
Este estudio apoya la necesidad de seguir las recomendaciones de la guía de manejo en la consulta externa de los programas de VIH, realizando el tamizaje de la densidad mineral ósea a todos los pacientes que reciben Tenofovir como parte de un esquema ARV. De igual manera, es importante realizar más estudios en poblaciones similares en Colombia para tener una visión más completa de la problemática de los trastornos de la densidad mineral ósea de los pacientes con VIH en nuestro medio.
Conclusiones
Los resultados del estudio reportaron un mayor trastorno de baja masa ósea en los pacientes que recibían Tenofovir/ Emtricitabina como parte del esquema ARV. De igual manera mostró un efecto protector respecto de la DMO, en los pacientes que recibían Nevirapina. Se hace necesario realizar tamizaje DXA a todos los pacientes que reciben TAR, con el fin de realizar un diagnóstico y tratamiento temprano y evitar complicaciones del metabolismo del hueso que alteren la calidad de vida de las personas con VIH.














