Introducción
Las infecciones causadas por bacilos Gramnegativos se han constituido en un problema creciente en la práctica clínica debido al surgimiento de mecanismos de resistencia a casi la totalidad de antibióticos empleados para su manejo, lo que cual ha derivado en infecciones más graves, esquemas de tratamiento más largos y complejos1. El mecanismo de resistencia más común a este grupo bacteriano, lo constituye la producción de betalactamasas de espectro extendido (BLEE), un grupo de enzimas capaz de hidrolizar la mayoría de antibióticos beta-lactámicos, con excepción de los carbapenémicos, por lo que estos últimos se han constituido en el tratamiento de elección en infecciones por bacterias de ese tipo. No obstante, en la última década se ha presentado un incremento global en el reporte de infecciones por Enterobacteriaceae, y bacilos Gramnegativos no fermentadores como P. aeruginosa y A. baumannii resistentes a carbapenémicos2,3, generando un gran impacto clínico al reducir sustancialmente las opciones terapéuticas, mucho más cuando el desarrollo e investigación de nuevas moléculas ha declinado en todo mundo1.
Esta situación condujo al uso de las polimixinas, específicamente la polimixina E o colistina, como tratamiento de elección para tratar las infecciones por estos microorganismos multi-resistentes4.
La colistina ha sido usada clínicamente desde 1950 en el tratamiento de infecciones por bacterias Gramnegativas. El me- canismo de acción se explica por su naturaleza policatiónica con fracciones hidrófilas y lipófilas, las cuales actúan a través de interacciones electrostáticas con la membrana externa de las bacterias Gramnegativas desplazando competitivamente cationes divalentes de los lípidos de la membrana, que genera cambios en la permeabilidad y favorece la liberación del contenido intracelular5. En principio el uso del antibiótico se vio restringido por su asociación con casos de nefrotoxicidad y neurotoxicidad; sin embargo, dos razones han llevado a retomar su uso: i) estudios recientes que demuestran que la toxicidad es mucho menor de lo que se creía inicialmente6 y ii) la emergencia de bacterias multi-resistentes, específicamente Klebsiella pneumoniae, Pseudomonas aeruginosa y Acinobacter baumannii que sólo presentan susceptibilidad a este agente4.
Teniendo en cuenta lo anterior, el uso de la colistina se ha generalizado en algunos países endémicos para bacterias con resistencia a carbapenémicos; además en la literatura es frecuente encontrar textos que recomiendan su uso para casos específicos como el tratamiento de absceso hepático por P. aeruginosa multirresistente7, de infección por A. bau- mannii resistente a carbapenémicos8 y de endocarditis por K. pneumoniae resistente a carbapenémicos9 entre otros, con el advenimiento del uso de la colistina se ha comenzado a reportar la resistencia a este antibiótico en diferentes países del mundo, como Italia10, España11, Francia12, Argelia13, Reino Unido14 y Suiza15, así como en diferentes especies bacterianas como K. pneumoniae, A. baumannii y P. aeruginosa
El reporte de estos casos, sumado al uso excesivo, prolonga- do o inadecuado de la colistina, a la falta de adherencia del personal sanitario a las precauciones universales de higiene de manos y al uso cada vez más frecuente de técnicas diagnósticas y terapéuticas invasivas, hace suponer la aparición de brotes hospitalarios de bacterias resistentes a este antibiótico. La experiencia ha mostrado que los brotes hospitalarios generan un impacto importante en términos de morbilidad y mortalidad, en el cierre de salas hospitalarias y en los costos por los gastos en los que se incurren para tratar de contenerlos 16, por lo que toma relevancia el conocimiento de las características de los brotes de infecciones ocasionados por estas bacterias resistentes.
Por lo anterior se diseñó este estudio con el objetivo de describir las publicaciones sobre brotes hospitalarios ocasionados por enterobacterias resistentes a colistina, identificar las características clínicas de los individuos afectados, el mecanismo de resistencia involucrado, las formas de transmisión, los genotipos predominantes y las medidas de intervención destinadas a interrumpir la cadena de diseminación.
Material y métodos
Tipo de estudio: se realizó una revisión sistemática de la literatura siguiendo un protocolo definido a priori para las etapas de identificación, tamización, elección e inclusión descritas en la guía PRISMA (Preferred reporting items for systematic reviews and metaanalyses)
Etapa de identificación de estudios: en agosto del año 2015, se realizó una búsqueda de artículos de investigación originales en las bases de datos Pubmed, Science Direct, Scopus, Scielo y Lilacs. Las estrategias de búsqueda incluyeron los términos MeSh (Medical Subject Headings) y no MeSH Colistin, Resistant, Emergence, Outbreak, Klebsiella, Pseudomonas, Enterobacter, Acinetobacter; y se construyó el siguiente algoritmo para la base de datos Pubmed (((Colistin[Title]) AND Resistant[Title]) AND (Emergence[Title/Abstract] OR Outbreak[Title/Abstract])) AND (Klebsiella[Title/Abstract] OR Pseudomonas[ Title/Abstract] OR Enterobacter[Title/ Abstract] OR Acinetobacter[Title/Abstract]), para Science Direct TITLE(Colistin) AND TITLE(Resistant) AND TITLE-ABSTR- KEY(Emergence) OR TITLE-ABSTR-KEY(Outbreak) AND TITLE- ABSTR-KEY(Klebsiella) OR TITLE-ABSTR-KEY(Pseudomonas) OR TITLE-ABSTR-KEY(Enterobacter) OR TITLE-ABSTR- KEY(Acinetobacter), para Scopus TITLE (colistin) AND TITLE (resistant) AND TITLE-ABS-KEY (emergence) OR TITLE-ABS- KEY (outbreak) AND TITLE-ABS-KEY (Klebsiella) OR TITLE- ABS-KEY (Pseudomonas) OR TITLE-ABS-KEY (Enterobacter) OR TITLE-ABS-KEY (Acinetobacter), para Scielo (ti:(colistin AND resistant)) AND (ab:(Emergence OR outbreak)) AND (ab:(Klebsiella OR Acinetobacter OR enterobacter OR pseu- domonas)) y para Lilacs ((colistin) AND (resistant)) [Title words] AND ((outbreak) OR (emergence)) [Abstract words] AND ((Klebsiella) OR (Acinetobacter) OR (enterobacter) OR (pseudomonas)) [Abstract words], esto sin limitar la temporalidad de las publicaciones. La etapa finalizó con la exportación de los artículos identificados hacia los gestores de referencias Zotero y EndnoteWeb con el propósito de eliminar publicaciones duplicadas y garantizar la reproducibilidad.
Etapa de tamización: en esta etapa se realizó la lectura de los resúmenes de las publicaciones y a partir de ella se apli- caron los siguientes criterios de inclusión: i) que fuesen artículos originales, ii) con los términos de búsqueda en título, resumen y/o palabras clave, iii) publicados en inglés, español o portugués y iv) que su objetivo fuese describir brotes de bacterias resistentes a colistina.
Etapa de elección: los artículos tamizados en la fase anterior fueron excluidos dependiendo del cumplimiento de los siguientes criterios: i) artículos no disponibles en su totalidad en las bases de datos consultadas, ii) investigaciones que no presentasen el grado de relación genética de los aislados a partir de una técnica de tipificación molecular y iii) estudios con problemas de validez interna evaluados por la omisión en el texto de características de persona, tiempo y lugar.
La aplicación de los criterios de inclusión y exclusión fue realizada dos veces en un intervalo de tiempo de 1 mes para garantizar la reproducibilidad de la selección de la información.
Etapa de inclusión y recolección de la información: Debido a que las investigaciones no cumplían todas las recomendaciones descritas en la guía para la publicación de estudios de brotes ORION (Outbreak Reports and Intervention Studies Of Nosocomial infection)17, se construyó un base de datos en Microsoft Excel, con los artículos incluidos; donde se extrajo información relacionada con las variables de espacio, tiempo y lugar del estudio, año de publicación, país en el que se realizó el estudio, fecha inicial y final del brote, número de instituciones de salud involucradas y número de camas de cada institución como indicador indirecto del número de personas expuestas al brote. Así mismo características de los individuos afectados como número de personas infectadas o colonizadas con aislamiento resistentes a colistina, edad de las personas afectadas, comorbilidades, tipo de muestra de la que se obtuvo el aislamiento resistente, exposición previa a la colistina, manejo terapéutico y evolución de los pacientes; y características de los aislados, género y especie bacteriana, pruebas de susceptibilidad utilizadas, criterio para definir la resistencia, genes de resistencia que se encuentran simultáneamente con la resistencia a colistina y el genotipo. Finalmente se incluyeron las siguientes características del estudio del brote como indicador indirecto de la calidad de las publicaciones: identificación del caso índice o primario, descripción de la curva epidémica, inclusión de muestras del ambiente hospitalario, herramienta de epidemiología molecular utilizada y las intervenciones dirigidas a controlar el brote.
Análisis de la información: la descripción de los estudios se realizó con base en frecuencias absolutas y relativas en el software Microsoft Excel.
Resultados
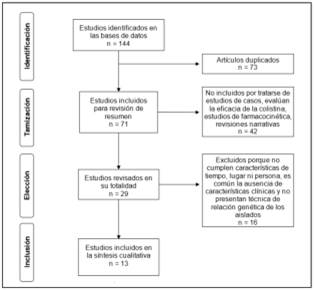
En la búsqueda inicial se identificaron 144 artículos (Scopus n= 62, Pubmed n= 59, Science Direct n= 18, Scielo n= 3, Li- lacs n= 2) con los términos de búsqueda en título, resumen y/o palabras clave, de ellos se eliminaron 73 duplicados, 42 por no cumplir los criterios de inclusión y 16 por cumplir con los criterios de exclusión (Figura 1).
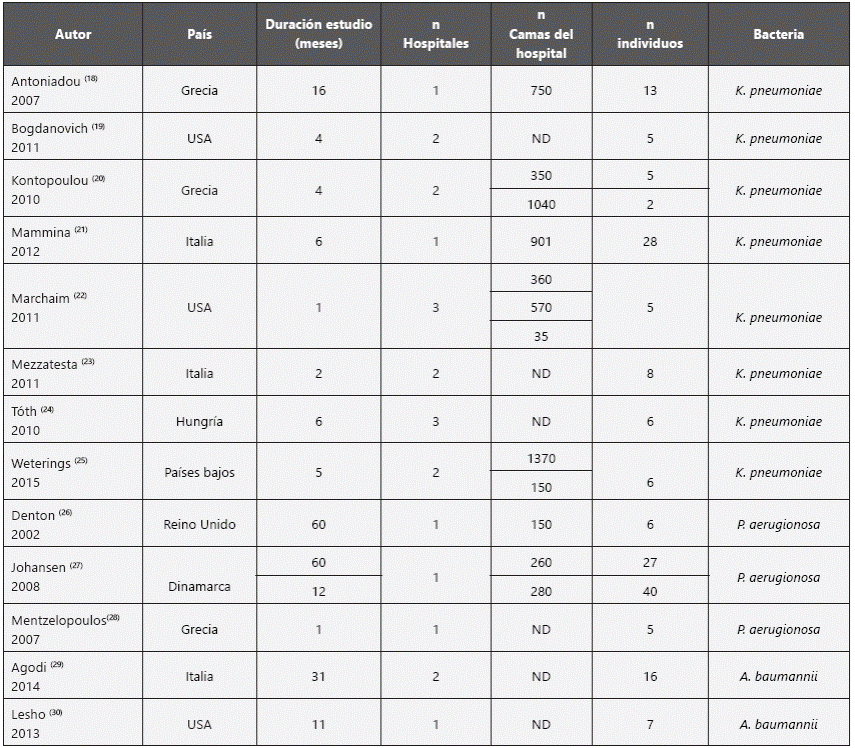
En total se incluyeron en la síntesis 13 artículos, el 69,2% (n=9) de ellos fue publicado en los últimos 5 años, en 7 países diferentes, 77% (n = 10) en Europa con predominio en Italia y Grecia. La mayoría de publicaciones 61,5% (n=8) reportan la resistencia a colistina en cepas de K. pneumoniae, seguido de P. aeruginosa y A. baumanni. Los brotes se han presentado en 22 instituciones hospitalarias diferentes, de todos los tamaños y afectan diferentes salas, incluidas instituciones pediátricas de pacientes con fibrosis quística y unidades de cuidado intensivo. El total de pacientes afectados fue de 179 con un rango que va de 5 a 40 pacientes por brote; la duración de los estudios osciló entre 1 a 60 meses (Tabla 1).
Características clínicas de los pacientes
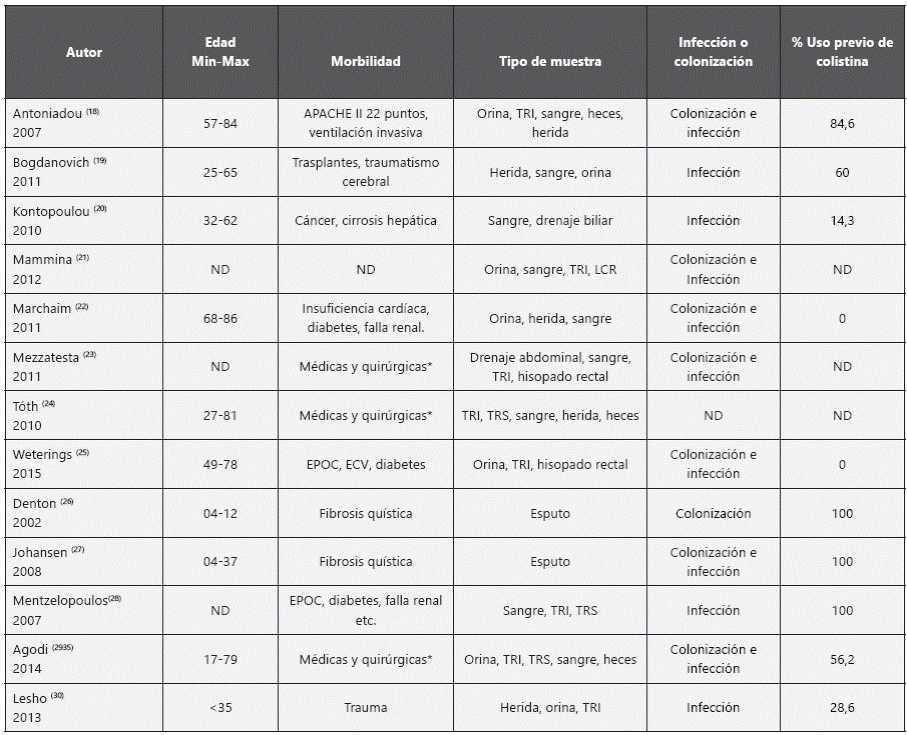
En alusión a las características clínicas de los pacientes se destaca que la infección o colonización se presentó en personas de todas las edades (4 a 86 años), con múltiples morbilidades, dispositivos médicos invasivos o contacto frecuente con los servicios de salud. Las muestras de las que se obtuvieron los aislados son variables e incluyen muestras de orina, tracto respiratorio superior e inferior, sangre, tracto gastrointestinal y heridas. En la mayoría de las investigaciones refieren el uso previo de colistina como factor desencadenante de la resistencia; no obstante, también se presentan casos de infección o colonización en la ausencia de uso pre- vio del antibiótico aunque presentan resistencia a carbapenémicos (Tabla 2). Sólo 5 estudios indican el tratamiento de los pacientes, que en todos los casos fue combinado e incluye aminoglicósidos más carbapenémicos y/o glicilciclinas, así como altas dosis de colistina más una glicilciclina y/o un aminoglicósido. La evolución de los pacientes fue variable y la mortalidad varió desde 0% hasta 85%, aunque esta no es atribuible a la infección.
Características fenotípicas y genotípicas de las bacterias
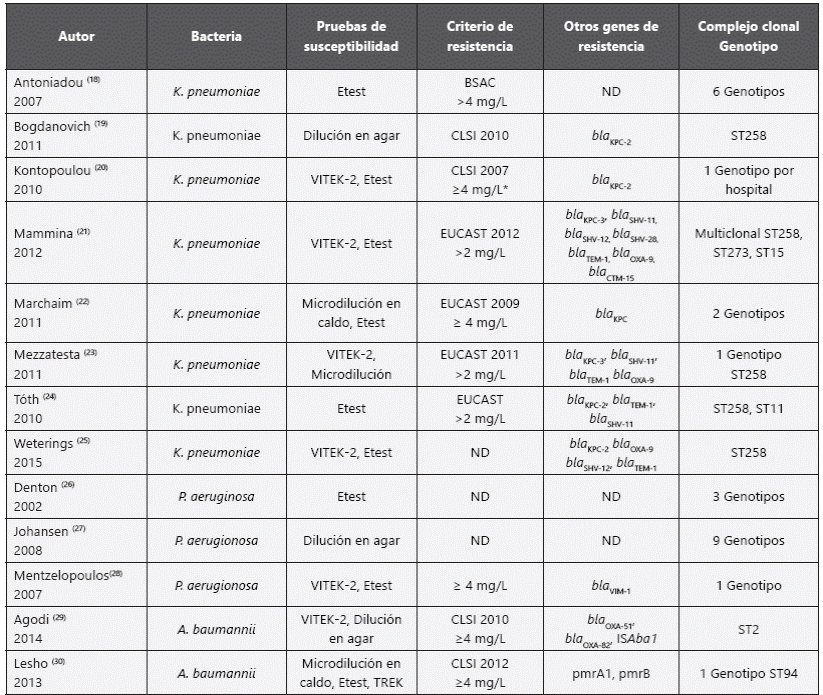
Las pruebas de susceptibilidad utilizadas fueron variables y dependían del microorgansmo evaluado, incluían microdilución en caldo, dilución en agar, Vitek-2 y Etest, siendo este último el más utilizado. En cuanto al criterio de susceptibilidad en K. pneumoniae el más utilizado fue el recomendado por EUCAST; sin embargo, se destaca que en algunos estudios aplicaron a K. pneumoniae el criterio de resistencia que sugiere la CLSI para A. baumannii. Por su parte, en A. baumannii el criterio utilizado fue el de CLSI 2012 y los estudios en P. aeruginosa no indican el criterio de susceptibilidad aplicado. El mecanismo de resistencia a colistina sólo fue descrito en una de las investigaciones en el que se relaciona con mutaciones puntuales en los genes pmrA1 y pmrB que codifican para lipopolisacáridos. En alusión a otros mecanismos de resistencia que se encuentran simultáneamente con la resistencia a colistina se encontró, que para el caso de K. pneumoniae los genes más comunes fueron los que codifican carbapenemasas (bla KPC-2 -2, bla KPC-3), y los genes de betalactamasas de espectro extendido (blaSHV-11, blaSHV-12, bla SHV-28, bla TEM-1, bla OXA-9, bla CTM-15). Asi mismo, el genotipo predominante de limpieza y desinfección de ambiente y equipos; la destinación acuerdo a MLST fue el ST-258, sin embargo, también se reportaron los ST11, ST273 y ST15.
En P. aeruginosa sólo un estudio reporta la presencia de genes de resistencia a cabapenemasas y corresponde al bla VIM-1 , por su parte lo complejos clonales encontrados fueron variables. Finalmente, en A. baumannii se reportaron los genes bla OXA-51-like , bla OXA-82 y la secuencia de inserción ISAba1 (Tabla 3).
Estudio y control de los brotes
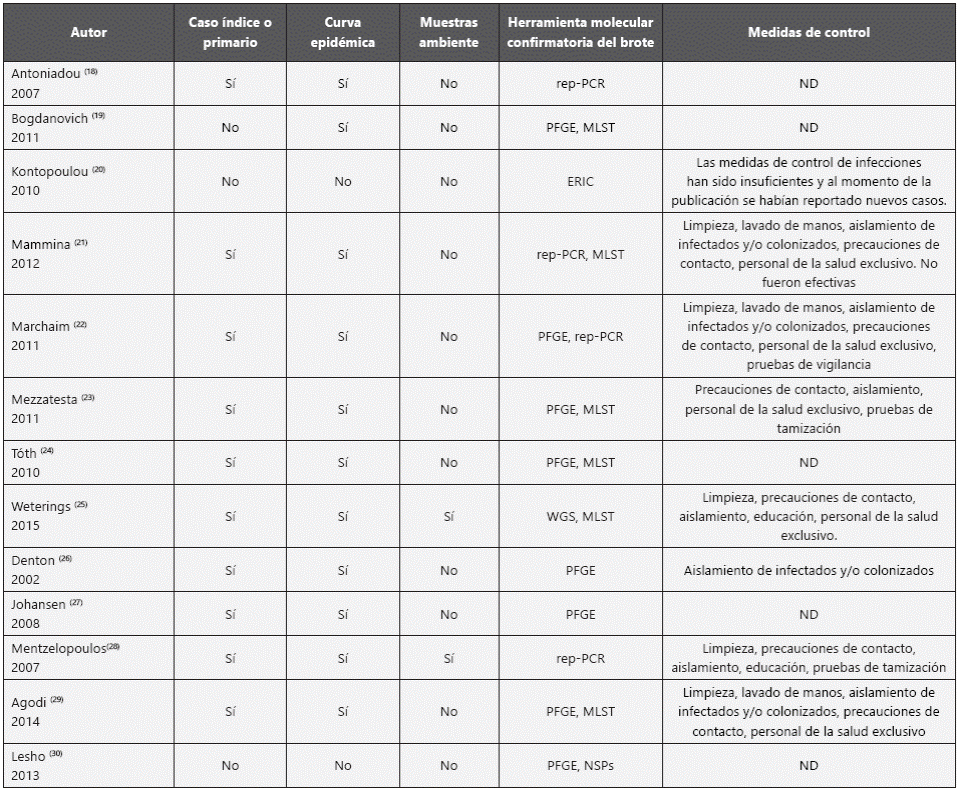
Con respecto a las características del estudio de brotes se encontró que en el 77% de las investigaciones se identificó el caso índice o primario, 85% presenta la curva epidémica y sólo 15% incluye muestras ambientales para identificar el origen de la infección. La herramienta de tipificación molecular más utilizada para describir el grado de relación genética de los aislados fue la electroforesis en gel de campo pulsado que se empleó en el 61% de las investigaciones, seguida por MLST que se empleó en el 46% de los estudios.
En cuanto a las medidas de control del brote se presentan la limpieza y desinfección de ambiente y equipos; la destinación de personal de salud exclusivo para el cuidado de los individuos infectados o colonizados; el aislamiento de contacto y la implementación de pruebas de tamización y/o vigilancia; pese a ello, dos investigaciones refieren que las medidas de control de brote no fueron efectivas pues se siguieron presentando nuevos casos (Tabla 4).
DISCUSIÓN
En este estudio se identificaron trece brotes de resistencia a colistina, reportados en 7 países diferentes, con predominio de Grecia e Italia lo cual coincide con la distribución global de carbapenemasas, donde Grecia es considerado un país endémico para KPC, que presenta además altas prevalencias de VIM, mientras que Italia presenta varios brotes que involucran bacterias portadoras de carbapenemasas del tipo KPC y VIM2. Estos hallazgos muestran como la emergencia de la resistencia a colistina se presenta en contextos de previa resistencia a carbapenémicos, donde se populariza el uso de la colistina como tratamiento de elección para bacterias multirresistentes. Sumado a lo anterior es importante resaltar que si bien no se encontraron estudios de brotes de resistencia a colistina en otros países endémicos como Colombia, estudios recientes han descrito la emergencia de la resistencia a este agente31.
En general los pacientes descritos en los estudios presentaban condiciones de base, con múltiples comorbilidades y exposición frecuente a ambientes que favorecen el desarrollo de infecciones asociadas a la atención en salud; no obstante, esta investigación coincide con estudios previos al indicar que no se circunscribe a un grupo etario ni a una comorbilidad específica32,33.
En cuanto a los factores de riesgo encontrados, el uso previo de colistina ha sido descrito como el factor de riesgo independiente más importante para la emergencia de resistencia con Odds Ratio de 7,7833; no obstante, los brotes se presentaron tanto en pacientes con uso previo del antibiótico como en ausencia de él.
En coherencia con lo anterior, en algunos estudios el análisis genotípico de los aislados reveló diversidad clonal que se asoció al incremento en la prescripción de colistina, sin embargo, en otros estudios se encontró una naturaleza clonal en los aislados del brote y ausencia de exposición previa a colistina, lo que evidencia que una vez seleccionados los aislados resistentes, estos tienen la habilidad para persistir y diseminarse rápidamente en el ambiente hospitalario34,35.
El manejo de los pacientes fue variable y en todos los casos que lo reportaron describen terapia combinada. Al respecto no hay consenso en la literatura; sin embargo, varias investigaciones han sugerido un efecto sinérgico de la colistina con otros antibióticos entre ellos rifampicina, imipenen, meropenem, sulbactam y tigeciclina36. Ante la creciente resistencia a colistina, son necesarias más investigaciones que evalúen el efecto sinérgico con otros antibióticos.
En relación con la mortalidad en los brotes, ésta no fue atribuible a la infección; sin embargo varió desde 0% hasta 85%. En este sentido, estudios de casos y controles no han encontrado diferencias en la mortalidad entre pacientes con aislados sensibles y resistentes a colistina33.
El mecanismo de resistencia exacto a colistina sólo fue es- tudiado en una de las investigaciones en la que se vinculó con mutaciones puntuales en los genes pmrA1 y pmrB; no obstante, otros mecanismos como la inactivación del gen mgrB37, las mutaciones en los genes lpxA, lpxC y lpxD38, en la proteína de membrana OprH39 y las modificaciones en los sistemas de regulación de dos componentes PmrAB y Pho- PQ40-42 no fueron reportados. En este punto es importante resaltar que todos los mecanismos de resistencia a colistina que se conocían hasta el momento estaban mediados por mutaciones cromosómicas; sin embargo, recientemente se reportó el primer caso de resistencia a colistina mediada por plásmidos transmisibles MCR-1; lo cual es bastante preocupante, al implicar la transferencia horizontal de éste mecanismo entre bacterias, en consecuencia un mayor riesgo de diseminación en cepas productoras de carbapenemasas, haciendo que estas infecciones lleguen a ser intratables43.
En este escenario, es importante fortalecer las medidas dirigidas a interrumpir la cadena de diseminación en los brotes que implican el cierre de servicios, aislamiento de pacientes, estrategias educativas en el personal sanitario en relación con las precauciones universales de contacto, personal sanitario de dedicación exclusiva, limpieza y desinfección de equipos, entre otros16. No obstante, a pesar que varias de las instituciones incluidas en este estudio implementaron esas recomendaciones los brotes persistían. Este resultado podría atribuirse a que en la mayoría de las investigaciones no se consideró la toma de muestras de ambiente ni del personal sanitario, de manera que es posible que el brote continuara por la persistencia de focos ambientales, trabajadores sanitarios colonizados o equipos de infusión contaminados que no fueron identificados en los centros sanitarios16.
Por otro lado, la identificación fenotípica de la resistencia a co- listina es un tema controversial, muestra de ello es la diversidad de metodologías que se utilizaron e incluyen Etest, dilución en agar, microdilución en caldo, Vitek-2 y Trek. Estudios previos que comparan esas metodologías concluyen que los métodos de gradiente de difusión no son adecuados para orientar decisiones clínicas y recomiendan utilizar sistemas automatizados como Vitek-2 o métodos de dilución44. Así mismo, los puntos de corte para las pruebas de susceptibilidad son divergentes. La British Society for Antimicrobial Chemotherapy45 y el European Committee on Antimicrobial Susceptibility Testing (EUCAST)46 coinciden en que para las enterobacterias y para Acinetobacter spp el punto de corte de susceptibilidad es ≤2 mg/l y el criterio de resistencia >2 mg/l y para Pseudomonas spp el cri- terio de susceptibilidad ≤4 mg/l y el de resistencia >4 mg/l. No obstante, el Clinical and Laboratory Standards Institute (CLSI) ha establecido para Acinetobacter spp sensibilidad ≤2 mg/l y resistencia ≥4 mg/l, para Pseudomonas aeruginosa, sensibilidad ≤2 mg/l y la resistencia ≥ 8mg/l y no ha establecido puntos de corte para Enterobacteriaceae47. Por lo expuesto se ha sugerido la importancia de establecer puntos de corte y metodologías de susceptibilidad unificadas de manera que faciliten realizar el seguimiento y monitorización de esta problemática36.
Entre las limitaciones de este estudio se destaca que las frecuencias de resistencia podrían depender de las pruebas de susceptibilidad utilizadas en cada investigación y de los puntos de corte elegidos; de manera que las comparaciones de los resultados deben interpretarse a la luz de la anterior limitación. Asimismo, los estudios incluidos no se adhieren a todas las recomendaciones descritas en la guía ORION lo que limita el alcance de las recomendaciones que pueden derivarse de la revisión. En adición a lo anterior es importante aclarar que varios estudios presentaban más de un aislado por paciente, por lo que sólo se tuvo en cuenta el primer aislado para evitar la sobreestimación de los casos. Otra de las limitaciones de este estudio se encuentra en que no incluye publicaciones en idiomas diferentes al inglés, español o portugués.
Conclusión
Este estudio pone de manifiesto que la emergencia de la resistencia a colistina no se circunscribe a un grupo etario ni a una comorbilidad específica, su importancia destaca en países donde la resistencia a carbapenémicos es endémica y evidencia dificultades para contener los brotes ocasionados por estas bacterias; esto permite alertar a las autoridades sanitarias y a los centros hospitalarios para establecer programas de vigilancia, prevención y control que orienten la detección precoz y la contención oportuna de esta problemática.