Introducción
Las infecciones de la piel y los tejidos blandos (IPTB) constituyen un conjunto de cuadros clínicos con diferente presentación y severidad, que afectan la piel, el tejido celular subcutáneo y el músculo1,2. Son altamente incidentes y uno de los primeros motivos de prescripción de antimicrobianos. Su etiología y curso clínico dependen de diferentes factores: estado inmunológico del paciente, localización geográfica, antecedente de trauma y/o cirugía previa, estilo de vida, exposición a mordeduras, uso previo de antibióticos, uso de otros medicamentos, comorbilidad, estado de las barreras protectoras y virulencia del microorganismo. Se han convertido en una causa creciente de consulta a los servicios de urgencias y hospitalización3,4, llegando a ser una causa importante de morbi-mortalidad e incremento de los costos en la atención médica, principalmente si se asocian a microorganismos multirresistentes como el S. aureus meticilino resistente (SAMR)5.
La mayoría de las IPTB son causadas por Staphylococcus aureus y estreptococos. Streptococcus spp son la principal causa de erisipelas. Las IPTB purulentas son frecuentemente causadas por S. aureus. Las celulitis son en su mayoría causadas por estreptococos ß hemolítico del grupo A(SBHGA) o S. aureus. Estafilococos y estreptococos son la causa más común de infecciones en usuarios de drogas endovenosas. Los bacilos Gram negativos son más comunes en infección de sitio quirúrgico de la pared abdominal, en pacientes inmunosuprimidos o en IPTB de la región perianal. Microorganismos inusuales como anaerobios, micobacterias y hongos pueden ser observados en pacientes inmunocomprometidos o después de inyecciones subcutáneas. Otros microorganismos se asocian a ciertos factores de riesgo como mordedura de animales (Pasteurella multocida), contacto con agua dulce (Aeromonas hydrophila), contacto con agua salada (Vibrio vulnificus y Chromobacterium violaceum) entre otros5.
En el norte de California se analizaron los registros de pacientes con IPTB de 2009 a 2011, se incluyeron 471,550 epi- sodios de infección, entre los pacientes con cultivo positivo, S. aureus fue de lejos el más frecuentemente aislado con 81% de los aislamientos, de estos 46% fueron SAMR, otros agentes aislados fueron SBHGA (10%) y bacterias Gram negativas (14%). Múltiples patógenos fueron identificados en 6% de los cultivos6.
En Colombia en un registro multicéntrico de IPTB, que incluyo pacientes que requerían más de 48 horas de hospita- lización, el microorganismo más frecuentemente aislado fue S. aureus con 23% (n: 261/1134), de los cuales 68.3% fueron SAMR[7]. Otros agentes en importancia fueron: E. coli con 6%, K. pneumoniae 4%, S. epidermidis 4% y P. aeruginosa 4%. Los pacientes con aislamientos por Gram negativos fueron frecuentes entre pacientes inmunosuprimidos, con infección perineal y con infección necrotizante.
En un estudio multicéntrico europeo de uso de tigeciclina en pacientes con IPTB se encontraron como principales agentes etiológicos S. aureus (52.7%), E. coli (18.0%) y E. faecium (12.0%). En este estudio la respuesta clínica de los pacientes fue 79.6% (183/230), 82.7% para los pacientes con APACHE II ≤15, y 85.1% para pacientes con infección de la comunidad8.
Tigeciclina primer representante licenciado de las glicilciclinas, análogas de las tetraciclinas descubiertas en 1993, con la particular propiedad de superar los principales mecanismos de resistencia bacteriana de sus antecesores, tiene aprobación en el tratamiento de las infecciones de piel y tejidos blandos. La dosis estándar de tigeciclina es 100 mg dosis de carga seguido por 50 mg cada 12 horas, en pacientes con IPTB tiene bajas concentraciones en estado estable entre 0.403 mg/L a 0.633 mg/L9. La vida media es larga, de 37 a 67 horas y tiene un alto volumen de distribución de 7,2 a 8,6 L/kg con una o múltiples dosis, respectivamente10. El parámetro farmacodinámico que define la actividad de tigeciclina es AUC/CIM (área bajo la curva/concentración inhibitoria mínima). Específicamente en pacientes con IPTB un AUC/ CIM≥17.9 es un predictor estadísticamente significativo de respuesta clínica (p=0.0376)11
El espectro microbiológico de tigeciclina es polimicrobiano, e incluye cocos Gram positivos, bacilos Gram negativos, anaerobios y microorganismos intracelulares como Mycoplasma spp., Legionella spp. y Chlamydia spp. Es de resaltar su acción sobre microorganismos resistentes como SAMR, enterococo resistente a vancomicina, Acinetobacter baumannii y Klebsiella pneumo- niae productores de carbapenemasas. Tigeciclina no es activo contra Pseudomonas aeruginosa, Proteus spp., Morganella spp, y Providencia spp.12. Los estudios confirman que el espectro polimicrobiano de tigeciclina le permite ser una adecuada alternativa como monoterapia para el manejo de IPTB en pacientes con estabilidad hemodinámica y condición clínica no critica.
Materiales y Métodos
Con el fin de generar recomendaciones en el uso clínico de la tigeciclina, se convocó a un proceso de consenso de expertos. Dado el potencial de su uso en infecciones por microorganismos multirresistentes, es de vital importancia evaluar su eficacia real, tanto en los estudios clínicos que llevaron a su licenciamiento como en los ensayos publicados posteriormente a tal fecha.
Para ello, el objetivo del consenso fue generar recomendaciones del uso de tigeciclina en el tratamiento de infecciones de piel y tejidos subcutáneos. Se tuvo en cuenta como pregunta de investigación: ¿En pacientes adultos con infección de piel y tejidos subcutáneos es no inferior el tratamiento con tigeciclina versus los comparadores antimicrobianos en curación clínica-microbiológica, eventos adversos y mortalidad?
Los desenlaces identificados fueron mortalidad, curación clínica, y además eventos adversos y eficacia microbiológica.
Se realizó una planeación de la búsqueda sistemática, utilizando filtros para metaanálisis y revisiones sistemáticas, en Octubre de 2015, utilizando como términos de búsqueda: Tigecycline [tiab]) OR tigecycline [Supplementary Concept], Soft tissue infections [MeSH], Soft tissue infection* [tiab]
La estrategia desarrollada en bases de datos como Medline a través de Pubmed, Embase y Central por Cochrane library, obtuvo estudios tipo metaanálisis, y de revisión sistemática, posteriormente se realizó la evaluación de la calidad de los estudios incluidos con la herramienta SIGN y la generación de tablas de evidencia.
Se utilizó la información de los metaanálisis relacionada con los desenlaces para infección de piel y tejidos subcutáneos específicamente; esto debido a que los estudios hacían un análisis global de la evidencia en varios escenarios como infección intraabdominal complicada, neumonía adquirida en comunidad, meticilino resistencia, y resistencia a vancomicina. Para aquellos desenlaces en los que no se encontró descrita la información de manera adecuada en los metaanálisis, se revisaron los estudios primarios relacionados y se extrajo la evidencia, esta situación se presentó con el desenlace de eventos adversos.
Para la evaluación del nivel de evidencia se utilizó el sistema GRADE, el cual hace especial énfasis en la presentación explícita y transparente de todo el proceso. Se construyó una tabla de síntesis de los resultados; esta tabla permite presentar para las comparaciones de interés el resumen de los estudios y sus resultados, así como la confianza en los mismos (calidad de la evidencia)3-4. Tabla 1 y tabla 2
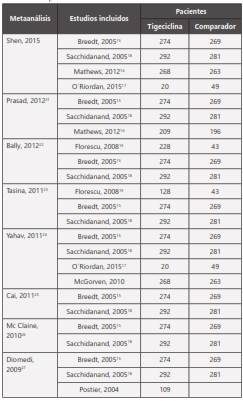
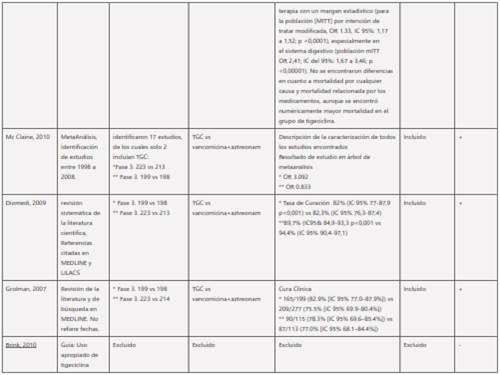
Tabla 1 Tabla de evidencia resultados de busqueda sistemática de uso de tigeciclina. Resultados de la búsqueda de los estudios clínicos que evaluaron tigeciclina en Infección de piel y tejidos subcutáneos de acuerdo a tipo estudio, población, tipo de comparación, resultados y nivel de evidencia. Se indican los estudios clínicos excluidos por baja calidad de la evidencia.


Las recomendaciones fueron puntuadas por los participantes en el consenso utilizando el método Delphi modificado. Se presentó el informe de la síntesis de la evidencia, y una lista de posibles recomendaciones fueron enviadas a los miembros del panel, junto con instrucciones sobre la metodología para puntuarlas. El diligenciamiento se hizo individualmente, sin que los expertos mantuvieran ningún tipo de comunicación o intercambio de opiniones. Cada experto recibió una definición escrita del concepto de «apropiado». Apropiado en el contexto de este método significa que «el esperado beneficio excede las esperadas consecuencias negativas por un margen suficientemente amplio como para que merezca la pena realizar el procedimiento».
Cada participante puntuó en una escala de uno a nueve dependiendo de qué tan apropiado consideró la realización de la recomendación.
Una puntuación de uno significa que la recomendación es extremadamente inapropiada para esa indicación, un nueve significa que la recomendación es extremadamente apropiada, y una puntuación de cinco indica que los riesgos y beneficios son aproximadamente iguales.
En la segunda ronda del método Delphi, el moderador de la reunión señaló las áreas de desacuerdo o confusión para discusión. Una vez se llevó a cabo la discusión entre los expertos se puntuó de nuevo cada indicación de la lista definitiva de recomendaciones en las que no se llegó a consenso13.
Recomendación
En la reunión de consenso se obtuvo, en la ronda final Delphi, un “acuerdo fuerte”, y un “grado de indicación para la reco- mendación”, con una mediana de 9 y un IC 8.3-9.1:
“En pacientes adultos con infección de piel y tejidos blandos (IPTB) complicada se considera que el uso de tigeciclina es equivalente a otras opciones terapéuticas antimicrobianas”.
Discusión de la evidencia
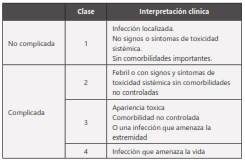
Las infecciones de piel y tejidos blandos pueden clasificarse según la severidad de los signos y síntomas de infección locales y sistémicos, la presencia de estabilidad hemodinámica y la presencia de comorbilidades14.
La definición de IPTB complicada que ha sido utilizada para la inclusión de los pacientes en los ensayos que evalúan el uso de tigeciclina, incluye pacientes con eritema o induración > 10 cm, compromiso sistémico, compromiso de tejidos subcutáneos o que requieren intervención quirúrgica. Todos estos estudios excluyeron pacientes con infecciones necrosantes9,15-19.
Los desenlaces primarios y secundarios de interés en los experimentos clínicos controlados incluyen: mortalidad, éxito clínico, éxito microbiológico e incidencia de eventos adversos. El análisis de la información de los 9 meta-análisis[20-28] que incluyeron 5 estudios clínicos aleatorizados con 1873 pacientes, y de ellos 952 asignados al brazo de tigeciclina, la cual no mostró inferioridad frente a los comparadores en estos desenlaces, excepto para eventos adversos en donde el grupo de tigeciclina presento mayor incidencia (tabla 3).
Tabla 3 Tigeciclina comparado con agentes antimicrobianos en infecciones de piel y tejidos subcutáneos. Presenta la comparación de la cura clínica, microbiológica, eventos adversos y mortalidad en infección de piel y tejidos subcutáneos entre tigeciclina y los antibióticos comparadores reportados en los estudios clínicos controlados, en los que no se observan diferencias estadísticamente significativas en los desenlaces evaluados
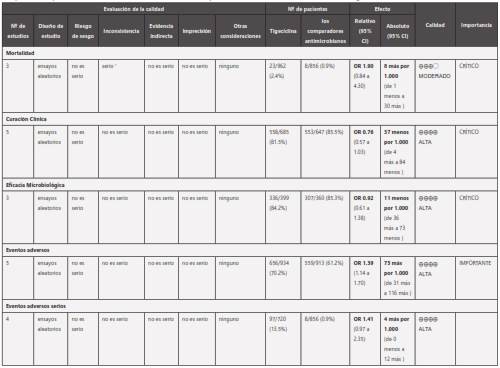
La calidad de la evidencia de los diferentes estudios para cada uno de los desenlaces evaluados es alta, excepto el aná- lisis de mortalidad en donde es moderada (tabla 3). Los metaanálisis revisados no contaron con funnel plot, sin embargo no se encontraron sesgos publicación importantes.
Análisis de eficacia clínica
La gráfica 1 contiene el resumen de la evaluación de eficacia con criterios de curación clínica de tigeciclina y los antibió- ticos comparadores utilizados en los estudios clínicos en la indicación específica de IPTB complicadas, ilustrando la no inferioridad de tigeciclina (RR= 0.76 IC95% 0,57 - 1.03). De manera similar, los metaanálisis de Shen F y cols[20] y otros autores[23, 25], no evidenciaron diferencias estadísticamente significativas que indicaran inferioridad de tigeciclina en IPTB complicadas frente a los antibióticos comparadores (Vancomicina + aztreonam, ampicilina/sulbactam, amoxicilina/cla- vulanato, delafloxacina). Estos análisis de no inferioridad de tigecilicina que contrastan con los resultados globales de los metaanálisis publicados parecen explicarse por el efecto negativo de dos estudios individuales con indicaciones no aprobadas por FDA, uno en neumonía adquirida hospitalariamente y otro en infecciones de pie diabético. En apoyo de esta afirmación los metaanálisis de Prasad21 y Cai25 al analizar solo los estudios con indicaciones aprobadas por FDA (infecciones intraabdominales complicadas, infecciones complicadas de piel y tejidos blandos y neumonía adquirida en la comunidad), encuentran que la eficacia y seguridad de tigeciclina fueron similares a las de los antibióticos comparadores.
Se concluye, con lo anterior, que tigeciclina es igualmente eficaz a otros antibióticos en el tratamiento de IPTB complicadas.
Análisis de la curación microbiológica
La gráfica 2 contiene el resumen de los resultados de curación microbiológica de los estudios clínicos aleatorizados en IPTB complicadas, comparando tigeciclina con otros antibióticos, ilustrando la no inferioridad de tigeciclina (RR= 0.92 IC95% 0,61 - 1.38). El metaanálisis de Shen y cols, el único que evalúa separadamente curación microbiológica en IPTB, no reporta tampoco diferencias estadísticamente significativas en este desenlace (RR= 1.00 IC95% 0,67 - 1.49)20.
La evidencia disponible permite concluir, por lo tanto, que el uso de tigeciclina en IPTB complicadas, resulta en tasas de curación microbiológica equivalentes a los antibióticos comparadores.
Análisis de Seguridad
En relación a la incidencia de eventos adversos entre el uso de tigeciclina y comparadores (vancomicina + aztreonam, ampicilina/sulbactam, amoxicilina/clavulanato o delafloxacina) en IPTB complicadas, se puede observar en la gráfica 3 que el uso de este medicamento se asocia a una mayor incidencia de eventos adversos con un RR de 1.39 (IC95%1.14 - 1.71). Al analizar eventos adversos serios no se evidencia diferencia estadísticamente significativa RR 1,41 (IC95%0,97 a 2,35) entre tigeciclina y comparadores (figura 4). Otros metaanálisis han evidenciado iguales resultados cuando comparan la unión de todos los eventos adversos y los eventos adversos de origen gastrointestinal (vómito y nausea), sin encontrar diferencias estadísticamente significativas entre eventos adversos serios o necesidad de suspensión del medicamento como consecuencia de algún evento adverso20,23,25.
Un análisis de cinco estudios observacionales realizados en Europa, del uso de tigeciclina para el tratamiento de IPTB, encontró una baja frecuencia de eventos adversos de origen gastrointestinal (náuseas 2.0% y vómito 0,5%)29.
Se concluye que el uso de tigeciclina en pacientes con IPTB complicadas no tiene diferencias estadísticamente significativas con otros comparadores en relación a eventos adversos serios, sin embargo puede asociarse a mayor frecuencia de eventos adversos leves de origen gastrointestinal.
Análisis de mortalidad
Los metaanálisis seleccionados para revisión no evidenciaron mayor mortalidad en los estudios específicos para IPTB complicadas RR 1,9 (IC95%0,84 a 4,3) (Figura 5). En el metaanálisis de Cai y cols, en los estudios en donde se emplea tigeciclina en indicaciones aprobadas por FDA, los autores tampoco observaron diferencia entre tigeciclina y los comparadores (vancomicina + aztreonam, imipenem-cilastataina, ceftriaxona + metronidazol o levofloxacina ) en todas las causas de mortalidad RR 1,47 (IC95% 0,96 a 2,27) o en la mortalidad posiblemente asociada al uso de medicamentos RR 2,06 (IC95%0,20 a 20,85)25.
Se concluye que en IPTB complicadas, el uso de tigeciclina no representa un exceso de mortalidad en comparación a otros antibióticos.
Uso de tigeciclina en el manejo de infecciones de piel y tejidos blandos causadas por SAMR
Existe un incremento en la frecuencia de aislamientos de S. aureus meticilino resistente asociado a la comunidad (SAMR- Co) como causa de infecciones en piel y tejidos blandos, estos reportes son encontrados principalmente en Norteamérica, en donde en algunas ciudades SAMR-Co es actualmente el patógeno más comúnmente cultivado de lesiones cutáneas de pacientes en urgencias30. SAMR-Co produce diversas manifestaciones clínicas que van desde el impétigo hasta infecciones severas que amenazan la vida como fascitis necrosante, sien- do la forma de presentación más común abscesos (50-75%) y celulitis (25-50%)31. Tigeciclina tiene actividad contra SAMR, aunque en las guías de la IDSA del 20141 no la mencionan como una opción en el tratamiento de infecciones de piel y tejidos blandos, en el consenso de la Sociedad Italiana de Enfermedades Infecciosas2, la tigeciclina es una opción en el tratamiento de infecciones por SAMR con el mismo grado de recomendación de vancomicina, linezolid o daptomicina (gra- do de recomendación A1). En el metaanálisis de Bally y cols, al evaluar los estudios que incluían pacientes hospitalizados con IPTB complicadas causadas por SAMR no encontraron diferencia en la tasa de respuesta clínica de tigeciclina al compararla con vancomicina OR 0,89 (IC95%0,61-1,27)22. De igual forma Tsoulas en una revisión de los metaanálisis publicados sobre el tratamiento de infecciones de piel y tejidos blandos por SAMR evidencia similar tasa de eficacia clínica y microbiológica al compararla con vancomicina32. Heizmann encontró una tasa de éxito en el tratamiento de 94% en IPTB complicadas causadas por SAMR tratadas con tigeciclina33.
Monoterapia con tigeciclina vs terapia combinada en el manejo de infecciones de piel y tejidos blandos
La terapia antibiótica combinada busca en teoría aumentar el espectro de actividad antimicrobiana, prevenir la emergencia de resistencia, sinergismo y disminución de la mortalidad. En el caso de infecciones por cocos Gram positivos se utiliza terapia combinada para disminuir la síntesis de toxinas (por ejemplo el uso de β-lactamicos + clindamicina en infecciones severas por S. pyogenes34), ante la presencia de material protésico o biopelícula (por ejemplo vancomicina o daptomicina mas rifampicina mas gentamicina en el caso de endocarditis de válvula protésica por SCN[35]) o como terapia de salvamento en infecciones por SAMR (por ejemplo el uso de vancomicina, daptomcina o fosfomicina combinadas con un B-lactamico en bacteriemia persistente36). La terapia combi- nada en el manejo de infecciones por bacilos Gram negativos no ha mostrado mejoría en desenlaces clínicos, incrementado los costos y toxicidad sin mejoría en términos de sobrevida o emergencia de resistencia37. Sin embargo en el manejo de infecciones por bacilos Gram negativos multirresistentes (A. baumanii MDR, enterobacterias productoras de BLEE, enterobacterias productoras de KPC, etc.) la combinación de dos o tres medicamentos (tigeciclina, colistina, carbapenémicos, fosfomicina) ha demostrado disminución en la mortalidad38.
Varios estudios in vitro, modelos de animales y reportes de casos muestran la eficacia de regímenes antimicrobianos que incluyen combinaciones con tigeciclina, muchos de estos estudios involucran microorganismos multirresistentes. Para el caso de microorganismos Gram positivos, tigeciclina mas rifampicina o daptomicina tiene sinergismo, tanto en estudios in vitro como en estudios in vivo39. Además, la adición de gentamicina a tigeciclina mejora la actividad de esta última contra la biopelícula asociada a S. aureus[40]. Para el caso de infecciones por bacilos Gram negativos multirresistentes, las combinaciones más estudiadas involucran el uso de tigeciclina con polimixinas, carbapenémicos y/o amino glucósidos39.
Otra ventaja que puede tener tigeciclina en el manejo de pacientes con IPTB complicadas, es en el ajuste de la terapia, en pacientes que han sido llevados a cultivo y tienen aislamientos polimicrobianos que incluyen Gram positivos (incluyendo SAMR y enterococo resistente a vancomicina), enterobacterias (incluyendo productoras de betalactamasas de espectro extendido) y anaerobios, la tigeciclina se puede utilizar en monoterapia y tiene un adecuado cubrimiento de todos los microorganismos.33,41.