Introducción
Teniendo en cuenta que el pollo es una de las proteínas de origen animal que más se consume a nivel mundial es de vital importancia asegurar la óptima calidad de este alimento para el consumo humano; cabe destacar que Colombia ocupa el puesto 24 en producción mundial de pollo1, y que el consumo per cápita durante los últimos 10 años ha venido aumentando de forma significativa de 20,1 a 30,2 kilogramos/ habitante en 2000 y 2015 respectivamente2, adicionalmente, hasta mayo de 2016 el departamento con mayor producción de carne de pollo fue Santander con el 24,6% del total de producción anual, seguido por Cundinamarca con un 20,1% y Valle con 16,2%3,4, estos datos reflejan el crecimiento de la industria avícola nacional durante los últimos años, lo que ha llevado a la implementación de diferentes normas con el fin de ofrecer un producto que cumpla con los requerimientos para ofrecer una carne en óptimas condiciones para el consumo humano y asegurar la entrega de un producto de excelente calidad nutricional5.
La salmonelosis es una de las enfermedades de transmisión alimentaria (ETA) más comúnmente reportada y con importantes repercusiones en salud pública6,7,8, los principales síntomas asociados a esta patología son desórdenes gastrointestinales que incluyen dolor abdominal, diarrea, vómito, fiebre y en algunos casos, puede ocasionar enfermedad sistémica e incluso elevadas tasas de mortalidad en la población expuesta7,8. Dentro de los alimentos comúnmente asociados a la presentación de brotes por Salmonella spp. están la carne de pollo, el huevo y productos lácteos8,9,10. Se estima que en Estados Unidos, Europa y Latinoamérica anualmente se notifican 15,19, 23,7 y 68,4 casos por 100000 habitantes respectivamente11. Para Latinoamérica, se calcula que el número de casos podría aumentar aproximadamente 29 veces más, si éstos fueran notificados, ya que muchos de ellos no son diagnosticados de la forma correcta12.
Son pocos los estudios en los que estiman la prevalencia de salmonelosis por consumo de pollo, pero se cree que entre el 15% y el 20% de las salmonelosis reportadas están asociadas con el consumo de esta carne13; Alemania y Estados Unidos reportan incidencias anuales por consumo de pollo de 120 y 14 casos por 100000 habitantes respectivamente14, en Colombia los datos revelaron un total de 7.219 casos de salmonelosis entre los años 2000 a 201315, sin embargo estos datos no especifican la posible fuente de contaminación.
Teniendo en cuenta las importantes implicaciones de Salmonella spp. en salud pública, el objetivo de este estudio fue determinar la prevalencia de este microorganismo en pechugas de pollo provenientes de plazas de mercado y expendios de barrio de cuatro localidades de Bogotá - Colombia, mediante cultivo e identificación microbiológica y PCR-REA.
Materiales y métodos
Población de estudio
Los muestreos fueron realizados en 4 localidades de la ciudad de Bogotá, ubicadas en cada uno de los extremos de la ciudad (tabla 1), en donde se seleccionaron al azar tiendas de ocho barrios (1 tienda por cada barrio) y la(s) plaza(s) de mercado de cada localidad.
Definición y recolección de las muestras
Una muestra estaba conformada por dos pechugas. En cada tienda de barrio se recolectó una muestra y en las plazas de mercado cuatro; se realizaron dos muestreos por localidad, recolectando 16 muestras por localidad, para un total de 72 muestras procesadas.
Las muestras fueron trasportadas en refrigeración hasta las instalaciones de la Pontificia Universidad Javeriana donde fueron procesadas.
Aislamiento e Identificación Microbiológica
Las muestras fueron procesadas siguiendo la norma NTC 4574: Microbiología de alimentos y de alimentos para animales y la metodología Oxoid Salmonella Precis TM®, validada y aprobada por AFNOR según la norma ISO 1614016.
En un recipiente estéril con 250 ml de agua peptonada al 0.1% se agregaron 25 g de la muestra para realizar el pre-enriquecimiento no selectivo, este fue llevado a incubación por 18 horas a 37°C. Posteriormente se realizó el enriquecimiento selectivo adicionando 0.1 mL del agua peptonada a 10 ml de caldo tetrationate y se llevó a incubación a 42°C por 24 horas17. Para la metodología Oxoid Salmonella Precis TM® se tomaron 25 g de muestra y se adicionaron a 225 mL de caldo ONE broth-Salmonella Base®, el cual se incubó a 42°C por 24 horas, esta metodología no requiere pre-enriquecimiento no selectivo, por ser un medio altamente nutritivo que permite la recuperación y crecimiento de Salmonella spp.16. A partir del caldo tetratrionate se realizó una siembra por agotamiento en los medios de cultivo Hecktoen y XLT417; por otro lado a partir del caldo ONE broth-Salmonella Base®, se sembró por agotamiento en el medio de cultivo Agar Salmonella Brilliance®. Todos los medios se incubaron a 37°C durante 24 horas. Una vez seleccionadas las colonias presuntivas de Salmonella spp., se realizaron pruebas bioquímicas básicas como TSI y Urea17; para la confirmación se utilizaron galerías Rapid One®, las cuales se incubaron a 35°C durante 4 horas, la lectura se realizó en el software de identificación ERIC- RapIDSystem.
Control de Calidad
Se utilizaron las cepas de referencia: S. Typhimurium ATCC 14028, S. Enteritidis ATCC 13076, S. Pullorum ATCC 13036.
Identificación Molecular
Las colonias presuntivas de Salmonella spp. fueron resuspendidas en caldo nutritivo y llevadas a incubación a 37°C/24h, para la posterior extracción del DNA. Una vez pasado el tiempo de incubación se tomó 1 ml del caldo y se centrifugó durante 3 min a 13000xg, al pellet se le realizaron dos lavados con 500μl de TAE 1X, se centrifugó 3 min a 13000x g, finalmente el botón de sedimento se resuspendió en 200 μl de agua ultra pura, se dejó en baño serológico por 8 minutos a 100°C y se almacenó a -20°C hasta su uso18.
Al total de las muestras presuntivas de Salmonella spp. se les realizó identificación molecular por medio del kit comercial de PCR (CorpoGen® BM-00007), para evaluar la presencia de un fragmento de 289 pares de bases específico del gen invA de Salmonella spp.
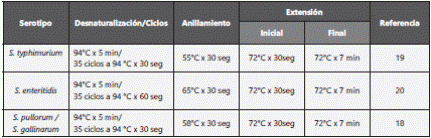
Los cebadores específicos para la identificación de los serovares S. typhimurium, S. enteritidis y S. pullorum y S. gallinarum fueron respectivamente: fliC [(5´-CGGTGTTGCCCAGGTTGGTAAT-3´) - (5´- ACTGGTAAAGATGGCT-3´)]; SEFA [(5´-GCAGCGGTTACTATTGCAGC-3´) - (5´-TGTGACAGGGACATTTAGCG-3´)] y fliC [(5´-CTGGTGATGACGGTAATGGT-3´) - (5´-CAGAAAGTTTCGCACTCTCG-3´)]. En cada una de las reacciones de PCR se trabajó con un blanco y un control positivo (cepas de referencia ATCC), para lo cual se prepararon reacciones con 3 μl de DNA, 0,5 μl de cada cebador, 12,5 μl de master mix Promega® (50 unidades/ml taqDNA polimerasa (pH 8.5), 400μm dATP, dGTP, dCTP, dTTP, 3Mm MgCl2) y 8,5 μl de agua grado molecular para un volumen final de 25 μl. La amplificación de cada reacción se realizó usando el termociclador T100 Biorad®.
La amplificación de los productos para S. Typhimurium se realizó siguiendo la metodología descrita por Das Chagas et al. (2013), para S. Enteritidis lo reportado por Akbarmehr (2011) y para S. Gallinarum y S. Pullorum lo referenciado por Paiva et al. (2009)18,19,20(tabla 2).
Adicionalmente, para la diferenciación entre los serovares S. Gallinarum y S. Pullorum se realizó análisis de restricción enzimática (REA) con la enzima Hinp1l (New England, Biolabs), según lo descrito por Paiva et al. (2009): se tomaron 5 μl del producto de la PCR, 1 μl de Hinp Buffer 10X, 0,1 μl de la enzima y 3,9 μl de agua grado molecular, esto se llevó a incubación a 37°C por 1 hora18.
Las electroforesis de los productos de amplificación se realizaron en geles de agarosa al 1,5% teñidos con SYBR®safe (Invitrogen), para la visualización de los productos de restricción enzimática el gel de agarosa usado fue de 3%. Finalmente, para la identificación de los aislamientos obtenidos, los productos de PCR fueron enviados a Macrogen para secuenciación.
Resultados
Aislamiento e Identificación Microbiológica
Se determinó una prevalencia de 29.2% (n=21) de Salmonella spp. en carne de pollo para los establecimientos muestreados en las 4 localidades de Bogotá, de los cuales 11 correspondieron a tiendas de barrio y 10 a plazas de mercado, detectándose un mayor porcentaje para la localidad de Usaquén, seguida de Fontibón y Mártires.
La identificación preliminar con las galerías Rapid One® confirmó la presencia de Salmonella spp., siendo Usaquén y Fontibón las localidades de mayor porcentaje con 28,5% y 14,3%, respectivamente; adicionalmente se detectó S. Pullorum en un 14,3% en estas dos localidades; cabe destacar la localidad de Mártires en la que se encontró Salmonella spp, S. gallinarum, S. pullorum y S. paratyphi, en un 4,8% para cada una.
Identificación molecular
Todos los aislamientos presuntivos (n=21) fueron identificados como Salmonella spp. con el estuche comercial de PCR (CorpoGen® BM-00007), mediante la visualización del fragmento de 284pb en gel de electroforesis (fig. 1); de éstas, solo en una (4,8%) se observó amplificación para el serovar S. Gallinarum (fig. 2), en el 95,2% restante no se obtuvieron productos de amplificación con los cebadores específicos para S. typhimurium, S. gallinarum, S. pullorum y S. enteritidis observándose únicamente la banda correspondiente al control positivo lo que permitió la validación de la prueba.
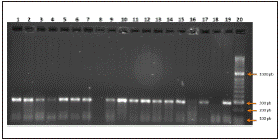
Figura 1 Electroforesis de muestras de pollo positivas por el estuche comercial de PCR (CorpoGen BM-00007). (1-17: Muestras. 18: Control negativo. 19: Control Positivo. 20: Marcador Hyperladder II.)
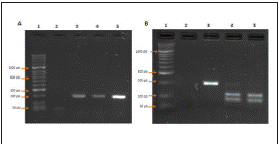
Figura 2 A. Electroforesis para identificación del gen fliC para S. Pullorum y S. Gallinarum: 1. Marcador Hyperladder II, 2. Blanco, 3. Control positivo S. Pullorum, 4. Control positivo S. Gallinarum, 5. Muestra. B. Electroforesis de la restricción con la enzima Hinp1l: 1. Marcador Hyperladder II, 2. Blanco, 3. Control positivo S. Pullorum, 4. Control positivo S. Gallinarum, 5. Muestra.
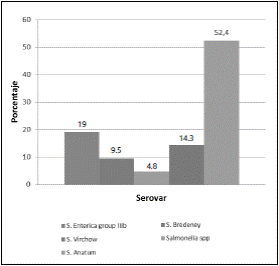
Teniendo en cuenta los resultados anteriormente mencionado se realizó secuenciación a todas las muestras, obteniendo que el 52,4% de los aislamientos fueron identificadas como Salmonella spp., el 19% restante como Salmonella enterica group IIIb, el 9,5% como S. virchow, el 14.3% S. bredeney y el 4,8% como S. anatum (fig. 3).
Discusión
La prevalencia de Salmonella spp. en carne de pollo para los establecimientos muestreados en las 4 localidades de Bogotá, determinó resultados similares con los reportados por otros autores en Colombia, quienes reportan prevalencias del 27%21; prevalencias similares se han reportado en países como Irán 33%, Bélgica 36.5%, España 35%, Argentina 20%, Brasil 11,8% y Venezuela 20%13,22,23,24,25,26. Por otra parte en países como Australia, China, Tailandia, Vietnam, Camboya y Portugal se evidenciaron altas prevalencias con valores del 47,7%, 52,2%, 57%, 45,9%, 88,2% y 60% respectivamente27-32, a diferencia de lo observado en países como Nueva Zelanda, Reino Unido y Estados Unidos, los cuales tienen prevalencias bajas de 3%, 4% y 4,2% respectivamente33-35.
Aunque la prevalencia encontrada en este estudio, no es una de las más altas reportadas si se compara con otros países, ésta demuestra la presencia del microrganismo en la carne de pollo destinada para el consumo humano, lo cual puede representar un impacto negativo en la salud pública de los habitantes de Bogotá. Estos hallazgos pueden estar asociados con un inadecuado manejo del producto en diferentes puntos que pueden afectar la calidad del mismo, como son las granjas donde las aves se pueden contaminar por inadecuada aplicación de las medidas básicas de bioseguridad que deben estar implementadas en cada una de ellas; las plantas de beneficio en las que los operarios, los utensilios o los puntos de procesamiento de la carne pueden ser una posible vía de contaminación y no menos importante, los establecimientos comerciales donde se distribuye la carne con inadecuado manejo en la cadena de frío, lo que conlleva a fluctuaciones en la temperatura que posibilitan la proliferación del microorganismo5,36. En el presente estudio es difícil evidenciar en qué momento ocurrió la contaminación de la carne ya que no se realizó seguimiento en cada uno de los posibles puntos donde esto puede ocurrir, por lo que no es posible atribuirla únicamente al mal manejo del producto en los establecimientos y plazas de mercado evaluados.
En estudios similares se reportan los serovares S. typhimurium y S. enteritidis como los más comúnmente encontrados en carne pollo con prevalencias de 27,1% y 47,8% respectivamente13,24, siendo estos dos serovares los responsables de la salmonelosis humana en todo el mundo37; sin embargo en el presente estudio se identificaron otros serovares como S. anatum, S. virchow y S. bredeney, los cuales han sido reportados por otros autores a nivel mundial con prevalencias muy bajas en carne de pollo. S. anatum ha sido reportada en países como Francia, Hungría, Bélgica, Holanda, España y algunos países latinoamericanos con prevalencias entre 0,2% y 8%11 valores cercanos a los encontrados en el presente estudio; por su parte S. virchow se ha encontrado en Australia, Holanda, Chipre, Reino Unido, Bélgica, Polonia y Australia, también con prevalencias bajas (3,3% a 12,4%), lo que coincide con lo observado en este estudio11, finalmente S. bredeney fue reportada en Grecia, Irlanda, Italia y Hungría con prevalencias del 5,3%, 0,28%, 4,6% y 0,7% respectivamente11, valores bajos comparados con la prevalencia determinada en este estudio. Algunas variaciones en las prevalencias de los serovares encontrados y con los reportados por la literatura pueden estar dadas por las diferentes condiciones de manejo establecidas por cada una de las granjas y/o países, adicionalmente las condiciones climáticas y geográficas pueden favorecer más la proliferación de unos microorganismos que de otros.
De acuerdo con los resultados obtenidos, es importante tener en cuenta que dada la poca confiabilidad de las pruebas bioquímicas para la identificación del serovar de Salmonella, es necesaria la realización de pruebas más específicas como la serología y/o la secuenciación para poder identificar con mayor precisión el serovar presente en las muestras analizadas. Finalmente es importante recalcar en la necesidad de realizar más estudios donde se establezca la prevalencia general de Salmonella spp. en piezas de pollo destinadas para el consumo humano y así determinar la situación real frente a este patógeno, lo cual permitirá a las entidades reguladoras el establecimiento de las medidas necesarias para disminuir la afectación en salud pública por este agente.