Introducción
El virus de Epstein-Barr (EBV, por sus siglas en ingles), reportado por primera vez en 1964 por M.A Epstein, Y.M Barr y B.G Achong, en pacientes africanos con linfoma de Burkitt, es uno de los siete virus oncogénicos actualmente conocidos que infectan humanos1. Pertenece a la familia Herpesviridae, subfamilia gammaherpesvirinae; presenta ADN de doble cadena de aproximadamente 180 kilobases; una estructura formada por proteínas, entre la nucleocapside y la envoltura, llamada tegumento; además, posee tropismo hacia células B, aunque también puede infectar células epiteliales, y de forma menos habitual, otro tipo de células como linfocitos T y células dendríticas2,3.
Clasificado por la Agencia Internacional para la Investigación del Cáncer (IARC) como carcinógeno del grupo 1, es ubicuo en la población mundial, presentándose una prevalencia cercana al 95% en la población adulta4. Diversos estudios reportan que el virus presenta un patrón bimodal en la edad de primoinfección: en los países en desarrollo, sucede en los primeros años de vida; y en los desarrollados, el contagio tiene lugar en la adolescencia, entre los 13 y 17 años. En estos últimos, entre el 50 al 70% desarrollan mononucleosis infecciosa5,6,7. Sin embargo, la prevalencia varía, principalmente, de acuerdo con las características sociodemográficas y cambios culturales entre países y dentro de estos8.
La principal ruta de transmisión del EBV es vía oral, a través de la saliva y menos frecuentemente por medio del contacto con sangre, trasplante de células hematopoyéticas u órganos sólidos. Una vez el virus entra a la cavidad oral, este infecta y se replica en las células epiteliales adyacentes al anillo de Waldeyer; en donde, seguidamente, infecta los linfocitos B donde puede entrar en latencia o diseminarse por todo el cuerpo por el torrente sanguíneo4,9. Se calcula que pueden haber hasta un millón de células infectadas en el anillo de Waldeyer, en las cuales el virus puede reactivar su replicación y aumentar su número de partículas virales periódicamente, siendo liberado a la saliva9,10. Se ha propuesto que el mecanismo biológico para explicar la liberación de las partículas virales a la saliva es a través de las células B infectadas que se diferencian en células plasmáticas. Las partículas virales liberadas infectan las células epiteliales adyacentes a las amígdalas, donde ocurren varios ciclos de replicación viral antes de ser secretadas a la saliva11. Por lo tanto, el virus solo será detectable en la saliva posiblemente cuando hay reactivación de partículas virales en las células B10.
El EBV es el principal causante de la mononucleosis aguda infecciosa (MI), síndrome común caracterizado por fiebre, garganta irritada, fatiga extrema y glándulas linfáticas inflamadas. Aproximadamente el 80% de los casos de MI que ocurren durante la adolescencia es causada por este agente4. Además, la infeccion del EBV se ha relacionado con una amplia variedad de patologías, como el cáncer de cuello y cabeza, desordenes linfoproliferativos postransplantes, linfomas de células B y T, carcinoma nasofaríngeo, cáncer gástrico, cáncer de sistema nervioso central, leucoplasia vellosa oral, linfoma de burkitt y el linfoma de Hodking, en el 40% de los casos12,13,14,15e incluso con esclerosis múltiple16. Según la organización mundial de la salud, en Colombia, para el año 2012, se presentaron cerca de 430 casos de pacientes con linfoma de Hodgkin, reportándose 0,9 casos por cada 100.000 habitantes, y cerca de 135 pacientes fallecieron por cuenta de esta enfermedad17.
En el presente estudio se realizó la detección del EBV en la cavidad oral en una población aparentemente sana de estudiantes de secundaria de la ciudad de Cali, Colombia; y su evaluó si su presencia se relaciona con la edad, sexo y el grado escolar de los participantes.
Métodos
Tipo de estudio
Este es un estudio de tipo retrospectivo de corte transversal en donde se analizaron muestras previamente recolectadas, caracterizadas y almacenadas; cada una con información sobre características demográficas y factores de riesgo de los participantes que fue recolectada mediante encuestas de auto-diligenciamiento.
Población de estudio
De acuerdo al cálculo del tamaño muestral, con un nivel se confianza del 95%, una frecuencia anticipada del 50% y un poder del 80%, se tomaron al azar 400 muestras de enjuague bucal del biobanco del Registro Poblacional de Cáncer de Cali (RPCC) de la Universidad del Valle, recolectadas durante el periodo septiembre 2015-abril 2016 en 21 colegios de la ciudad de Cali, del proyecto “Efecto de la vacunación contra la infección oral por el VPH16 en estudiantes de 14 a 17 años de edad en colegios de secundaria de la ciudad de Cali” con acta de propiedad intelectual del comité institucional de ética para la investigación con humanos de la facultad de salud de la Universidad del Valle con número de aprobación 011-014, del año 2014. Para la toma de las muestras, los estudiantes realizaron un enjuague bucal con agua destilada durante 30 segundos: 15 segundos realizando gárgaras y 15 realizando buches. Lo anterior con el fin de obtener células de la cavidad oral y de la orofaringe, que de acuerdo al Instituto Nacional de Cáncer (INC)18 de los estados unidos, la primera comprende, además de la saliva, los labios, el revestimiento interior de las mejillas y los labios, los dos tercios anteriores de la lengua, las encías superior e inferior, el piso de la boca debajo de la lengua, la parte ósea del paladar y el área pequeña detrás de las muelas del juicio; y la segunda (la orofaringe) comprende el tercio posterior de la lengua, el paladar blando, las paredes laterales y posteriores de la garganta, y las amígdalas. Los enjuagues realizados se dispusieron en tubos Falcon de 50 mL y dos viales fueron almacenados a 70°C sin conservantes hasta su procesamiento.
Extracción, pureza, calidad e integridad del ADN
El ADN de las muestras de enjuague bucal se extrajo usando el kit de extracción “PrepMan® Ultra Sample Preparation Reagent” de applied Biosystems™, siguiendo las instrucciones del fabricante. Brevemente, las muestras se centrifugaron a 4000 rpm por 5 min, se descartó el sobrenadante y se realizaron entre dos a tres lavados con suero fisiológico. A continuación, se adicionaron 50 µL del reactivo PrepManTM Ultra y se incubaron por 20 min a 100°C. Posteriormente, se centrifugaron a 13500 rpm por 2 min y el sobrenadante con los ácidos nucleicos se almaceno en tubos Eppendorf. La concentración y pureza del ADN se evaluó usando un espectrofotómetro Nanodrop 2000 UV-Vis (TermoFisher Scientific). El ADN se almacenó a -20°C hasta análisis posteriores.
Para evaluar la presencia de inhibidores de la PCR y la degradación del ADN se realizó la amplificación de un fragmento de 110 pb del gen β-globina, usando los cebadores PCO3; 5’-ACACA ACTGT GTTCA CTAGC-3’ y PCO4; 5’-CAACT TCATCCACGT TCACC-3’. La reacción de la PCR convencional se realizó en un volumen final de 20 μL utilizando, en concentraciones fnales: buffer Green GoTaq 1X, 1,5 mM MgCl2, 0,3 mM dNTP’s, 0,5 μM de cada cebador, 1 U de Taq polimerasa (BioTaq, Bioline) y agregando 1 μL (~50 ng/uL) de ADN. La amplificación se realizó en un termociclador Swift TM MiniPro Thermal Cyclers, usando las siguientes condiciones: desnaturalización inicial a 95°C por 4 min, seguido de 40 ciclos de 95°C por 1 min, 52°C por 1 min y 72°C por 2 min; con una extensión fnal de 5 min a 72°C. El producto amplificado se corrió en un gel de agarosa al 1% con una concentración de 1:10000X del intercalante EZ-Vision®, mediante electroforesis por 40 min a 100 voltios, usando como buffer de corrida TBE 1X. El gel se visualizó mediante un transiluminador UV.
Detección del EBV por PCR convencional
La detección del ADN viral se realizó usando los cebadores EBV-F; 5’-CCT GGT CAT CCT TTG CCA-3’ y EBV-R; 5’-TGC TTC GTT ATA GCC GTA GT-3’ propuestos por Kato et al.19 La reacción de PCR convencional amplifico un fragmento de 95 pb y se llevó a cabo en un volumen final de 20 μL con las siguientes concentraciones fnales: buffer Green GoTaq 1X, 1,9 mM MgCl2, 0,2 mM dNTP’s, 0,25 μM de cada cebador, 1 U de Taq polimerasa (BioTaq, Bioline) y agregando 1 μL (~50 ng/uL) de ADN. La amplificación se realizó en un termiciclador Swift TM MiniPro Thermal Cyclers, empleando las siguientes condiciones: desnaturalización inicial a 95°C por 2 min seguido de 40 ciclos de 95°C por 15 seg, 60°C por 15 seg y 72°C por 30 seg; con una extensión final por 2 min a 72°C. El producto amplificado se corrió en gel de agarosa al 3%, con una concentración de 1:10000X del intercalante EZVision®, mediante electroforesis por 50 min a 100 voltios, usando buffer de corrida TBE 1X. El gel se visualizó mediante un transiluminador UV. Para el control negativo se adicionó agua miliQ en lugar de ADN. El límite de detección mínimo de la PCR convencional se evaluó realizando una serie de diluciones (10-1, 10-2, 10-3, 10-4) de un control positivo para EBV que previamente había sido cuantificado y validado por secuenciación directa con el método de sanger y un análisis de porcentajes de identidad mediante el algoritmo BLASTn mediante el alineamiento con secuencias de referencia de EBV almacenadas en los repositorios del National Center for Biotechnology Information (https://www.ncbi.nlm.nih.gov/taxonomy/?term=EBV).
Detección del EBV por PCR en tiempo real
Las muestras de ADN con un resultado negativo para el análisis por PCR convencional, se evaluaron nuevamente por PCR en tiempo real con los mismos cebadores y las condiciones descritas por Kato et al.19, usando un termociclador CFX96 Touch™ Real-Time PCR (Bio-Rad): desnaturalización inicial a 95°C por 10 seg, seguido de 40 ciclos 95°C por 5 seg y 60°C por 30 seg, con una extensión fnal de 72°C por 5 min. La reacción se realizó en un volumen fnal de 20 μL conteniendo 10 μL de SYBR Green master Mix (por recomendación del fabricante, Bio-Rad), 0,4 μM de cada cebador y 1 μL (~50 ng/uL) de ADN. La especificidad de la amplificación se confirmó mediante el análisis de las curvas de disociación (Melting) de las muestras. Para esta prueba igual se evaluó el límite de detección mínimo de la PCR en tiempo real con una serie de diluciones (10-1, 10-2, 10-3, 10-4) del control positivo.
Análisis de datos
Se realizó posterior a la obtención de los resultados de detección del EBV (presencia-ausencia). Los resultados de la detección del EBV fueron correlacionados con la información brindada por los estudiantes sobre sexo, edad, y grado escolar. Las estimaciones de los porcentajes de presencia del EBV fueron reportadas y la significancia estadística entre las categorías se realizó mediante el test exacto de Fisher con una significancia estadística del 5%. Los cálculos de Razones de Oportunidad (ODD, por sus siglas en inglés) se midieron con intervalos de confianza (IC) del 95%. La variable dependiente del estudio fue la detección del EBV.
Consideraciones éticas
El presente estudio tiene aprobación del comité institucional de ética para la investigación con humanos de la facultad de salud de la Universidad del Valle, número de aprobación 008-017, del año 2017.
Resultados
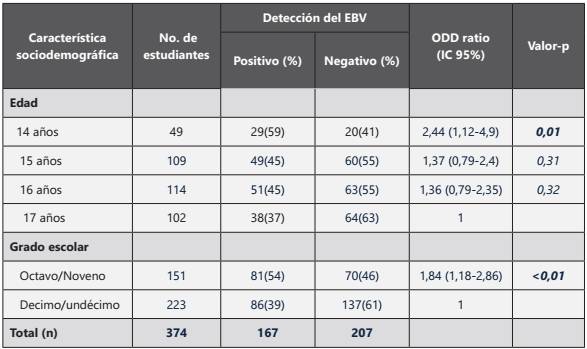
De las 400 muestras, se excluyeron 26 del estudio, 15 por dar un resultado negativo en la amplificación del gen β-globina (Fig. 1) y 11 por presentar encuestas incompletas. La distribución de los escolares por sexo, edad y grado escolar se muestra en la tabla 1. Mediante la técnica de PCR convencional (Fig. 2a), el porcentaje de detección del EBV fue del 26% (96/374). Con la técnica de PCR tiempo real (Fig. 2b) se detectó el ADN viral en 71 muestras que con la PCR convencional dieron un resultado negativo (167/374). El coeficiente Kappa en el análisis de concordancia de los resultados para las técnicas fue igual a 0,42.
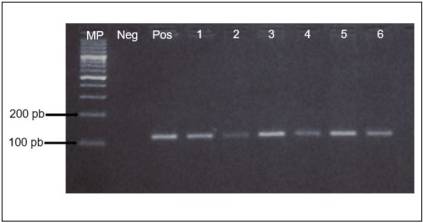
Figura 1 Resultados del análisis de β-globina. MP: marcador de peso molecular de 100 pb, Pos: control positivo, Neg: control negativo.
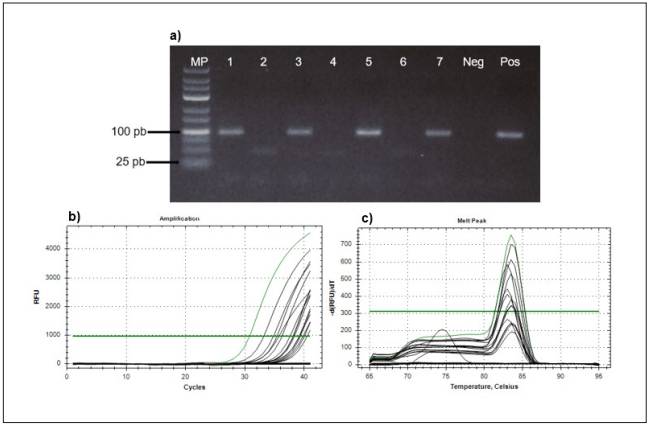
Figura 2 Resultados de: a) PCR convencional, b) PCR tiempo real, control positivo en color verde. El negativo no se observa y c) la curva de disociación (melting) de la PCR tiempo real, mostrando el pico del melting de los amplificados entre 83 y 83,5°C. Las curvas por debajo del umbral de fluorescencia corresponden a las muestras que amplificaron en los ciclos tardíos. MP: marcador de peso de 25 pb, Pos: control positivo, Neg: control negativo.
En los resultados obtenidos con la técnica de PCR en tiempo real se consideró como positivo para la presencia del EBV si la curva de melting generada en la detección estaba presente entre los 83 y 83,5°C (Fig. 2c).
El control positivo del estudio presentaba una concentración de 26,6 ng/µL de ADN; a partir de las diluciones de este, el límite mínimo de detección de la PCR convencional se estableció en 26,6 x 10-2 ng/µL de ADN (Fig. 3a). En contraste, la PCR en tiempo real presentó un límite de detección más bajo, 26,6 x 10-3 ng/µL (Fig. 3 b), lo que permitió una detección mayor del ADN viral.
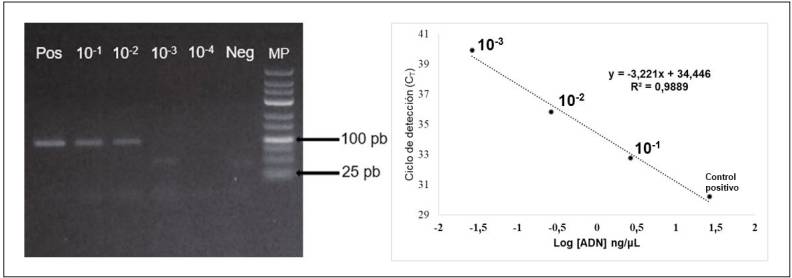
Figura 3 Curva de detección mínima de: a) PCR convencional y b) PCR en tiempo real. Pos: control positivo, 26.6 ng/µL de ADN, Neg: control negativo, MP: marcador de peso de 25 pb, 10-1: 26,6 x 10-1 ng/µL, 10-2: 26,6 x 10-2 ng/µL, 10-3: 26,6 x 10-3 ng/µL, 10-4: 26,6 x 10-4 de ADN.
Los hombres presentaron un mayor número de casos positivos en comparación con las mujeres; sin embargo, estas diferencias no fueron estadísticamente significativas (tabla 1). Al observar la proporción de estudiantes positivos por la variable edad, se puede evidenciar que los estudiantes de 14 años son los que presentaron un mayor porcentaje de casos positivos para EBV (tabla 1).
Tabla 1 Características sociodemográficas de la población analizada en el presente estudio, indicando los resultados de las pruebas estadísticas para cada una.
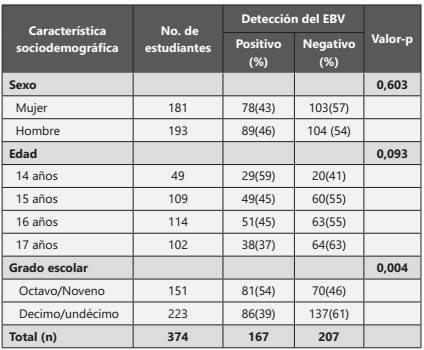
En el grado escolar se agruparon los grados octavo y noveno, y decimo con undécimo, encontrando que el primer grupo presentaba el mayor porcentaje de casos positivos (54%). Se encontró una diferencia estadísticamente significativa en cuanto a la detección del virus entre los dos grupos de grados escolares (tabla 1, p=0,004).
El análisis de razón de oportunidades se realizó con las variables edad y grado escolar debido a que mostraron una tendencia a la diferencia entre grupos y una diferenciación estadísticamente significativa, respectivamente. Los estudiantes de 17 años se tomaron como grupo de referencia para el cálculo de los ODD. Se encontró que los estudiantes de 14 años tienen un riesgo de 2,4 veces más para la detección del virus con un valor de p igual a 0,01 (tabla 2). Para el análisis del grado escolar, se tomó como grupo de referencia al grupo conformado por los grados decimo y undécimo, encontrando que el grupo de grados escolares menos avanzados presentan 1,8 veces más riesgo de detección del EBV, con un valor de p < 0,01 (tabla 2).
Discusión
Existen pocos estudios alrededor del mundo que hayan determinado la infección del EBV en población aparentemente sana en cavidad oral mediante técnicas molecular como la PCR, al contrario, la mayoría reportan seroprevalencias del virus que están por encima del 76%. En Latinoamérica, por ejemplo en Chile, la seroprevalencia del EBV es del 76,7%20 y en Brasil, mayor al 80%21. Para Colombia se reportó en 1990 una seroprevalencia para el virus del 94%22, en una población aparentemente sana, en un estudio realizado con 129 escolares de primaria y una edad promedio de 6 años. Igualmente, en algunos de estos estudios han reportado una disminución en la seroprevalencia del virus23. En Japón se reportó para la ciudad de Tokio que, durante 1990, en niños entre 5 y 7 años superaba el 80%, disminuyendo al 59% entre el periodo 1999-2000, y luego a menos del 50% para el año 20068. En Estados Unidos, en personas sanas entre los 6 y 19 años, durante el periodo 2003-2004, era del 72%, declinando al 65% entre el 2009 y el 201024. De acuerdo con el estudio realizado en los niños japoneses, la disminución de la prevalencia ocasionaría un cambio en la incidencia de las patologías asociadas al EBV8. Adicionalmente a esto, en Francia la primoinfección, entre 2001 y 2007 era en promedio a los 13 años, aumentando a los 15 años para el periodo 2008-201523. Según este estudio, el retraso en la edad de primoinfección, tendría un efecto directo en la población, debido a que una mayor parte de esta presentaría la sintomatología asociada a la MI23.
En la presente investigación no se realizó la evaluación de la seroprevalencia de los virus en los escolares debido a que el objetivo principal del estudio era identificar factores de riesgo relacionados con la transmisión de las partículas virales vía oral, sin embargo, el porcentaje de detección del EBV empleando la técnica molecular de la PCR en tiempo real fue del 45%, mucho menor a lo reportado por Ossa et al.22. Aunque ambos resultados no se pueden comparar por proceder de técnicas diferentes, cabe mencionar que el porcentaje de positividad para el virus por las técnicas de PCR puede estar afectado por el número de partículas virales presentas en la muestra biológica. Una prueba de lo anterior la hallamos al calcular el índice de concordancia entra la técnica de PCR convencional con la PCR en tiempo real, cuyo valor kappa fue de 0,42, lo que indica una concordancia baja entre ambas técnicas. Para la técnica de PCR en tiempo real el límite mínimo de detección fue de 26,6 x 10-3 ng/uL de ADN, diez veces menor al compararlo con el obtenido para la PCR convencional (Fig. 3). Igualmente, el porcentaje de detección puede ser afectado por la dinámica de infección del EBV y si está en fase de latencia o lítica. Evidencia de lo anterior se observa en un estudio de Hadinoto et al., 2009 sobre la dinámica de secreción del EBV a la saliva11, en donde durante un periodo de os años se realizaron repetidas pruebas de detección para EBV por PCR en tiempo real en participantes positivos para el virus, reportando en ocho ocasiones la no presencia del virus.
Pese a las limitaciones que pueda tener el uso de la PCR en tiempo real para el diagnóstico molecular del EBV, es una técnica no invasiva y económica para la toma de muestra y análisis del EBV en cavidad oral, que permite realizar estudios de ciencia básica y vigilancia epidemiológica en población aparentemente sana. Por ejemplo, en un estudio donde analizaron 233 niños asintomáticos con anemia de células falciforme y a sus madres de Uganda, mediante PCR en tiempo real, encontraron que el ADN viral se detectó en la saliva del 90% de los niños y en el 79% de las madres. Por otro lado, en la sangre, se detectó en el 86% de los niños y en el 72% de las madres; concluyendo que había una correlación positiva en la detección del EBV en estos dos tipos de muestras25.
En cuanto a las características sociodemográficas y la detección del EBV, se encontró que había diferencias entre el grado escolar y una tendencia en la edad. Al realizar el análisis de razón de oportunidades (ODD), el grupo conformado por los grados menos avanzados presentó un riesgo de 1,8 veces más de detección del virus. Por otro lado, se encontró que a los 14 años hay un riesgo de 2,4 veces más de detectar el virus en comparación con los estudiantes de 17 años. De acuerdo a Crawford et al.26 (2006), los individuos de menor edad son más susceptibles a la infección del EBV, en parte, porque el anillo de Waldeyer es un conjunto de estructuras que tienden a involucionar: la amígdala nasofaríngea y tubaria a los 9 años y la amígdala palatina a los 14 años; razón por la cual, los autores sugieren que la infección se puede dar más fácilmente en individuos de menor edad al necesitar una carga viral menor; y lo cual podría explicar, en parte, los resultados del presente estudio tanto para la edad como posiblemente para el grado escolar, debido a que el grupo de los grados octavo y noveno coinciden estar conformados por los estudiantes de menor edad (entre 14 y 15 años).
En conclusión, En el presente estudio se evidencio la exposición del VEB en la cavidad oral de estudiantes de secundaria, lo cual hace necesario que se tomen acciones de vigilancia que permitan monitorear las implicaciones de estos hallazgos en la salud de los escolares. Igualmente son importantes realizar estudios de seguimiento en poblaciones aparentemente sanas empleando tanto técnicas serológicas como moleculares para comprobar si efectivamente la prevalencia de EBV en el país sigue una tendencia a disminuir como lo han venido reportando algunos estudios a nivel mundial; para así poder enfocar o incentivar programas de salud pública hacia este agente patogénico.