Introducción
El dengue es una infección causada por cuatro serotipos del virus dengue (DEN 1 a 4), transmitida por la picadura de los mosquitos hembras del género Aedes; principalmente de las especies Aedes aegypti y A. Albopictus. Las manifestaciones generadas por la enfermedad tienen un amplio espectro que va desde infecciones asintomáticas, pasando por episodios clínicos con y sin signos de alarma, hasta cuadros graves y fatales1 . En Colombia en el año 2017, se notificaron 25.284 casos de dengue, de los cuales 6.689 (27,2%) fueron confirmados por laboratorio y 22 fueron fatales2 . Actualmente, la sospecha clínica de dengue se basa en el algoritmo propuesto por la OMS en 2009, el cual permite identificar los pacientes que se encuentran en riesgo de desarrollar la forma de dengue grave y se enfoca en el manejo de los casos de dengue, pero no fue desarrollado con fines de diagnóstico3 . Las pruebas rápidas son usadas en el diagnóstico de dengue, permitiendo detectar simultáneamente antígenos y anticuerpos; sin embargo, estas pruebas no se recomiendan en el diagnóstico de rutina sino en vigilancia y casos atípicos4 . A pesar de esto, las pruebas rápidas de dengue se utilizan en los servicios de salud puesto que las pruebas de referencia, que incluyen ELISA para la detección de anticuerpos IgM e IgG y del antígeno NS1; reacción de cadena de la polimerasa de transcripción reversa (RT-PCR); y aislamiento del virus en cultivos celulares, no están disponibles en los servicios de salud5 .
Un estudio que combinó la prueba rápida con el algoritmo de OMS 2009 para el diagnóstico de dengue obtuvo una sensibilidad del 91,2% (IC95% 85,5%-94,8%) y especificidad del 94% (IC95% 83,8%-97,9%)6 ; indicando que las pruebas rápidas de diagnóstico de dengue podrían ser útiles para aumentar la sensibilidad y/o especificidad del diagnóstico clínico de acuerdo con su interpretación, ya sea realizados en serie (primero el diagnóstico clínico y después la prueba) o en paralelo (simultáneamente diagnóstico clínico y prueba). Sin embargo, los resultados no son consistentes, pues otros reportan que la prueba rápida mejoró el rendimiento aumentando la especificidad del diagnóstico clínico de OMS 2009 a 98,2% (IC95% 94,9%-99,6%) mientras que la sensibilidad de la combinación (diagnóstico clínico y prueba rápida) no superó el 40,6% (IC95% 32,3-49,3%)7 . Estos estudios realizados en otros países no serían necesariamente extrapolables a Colombia donde el rendimiento, tanto de la prueba rápida como del diagnóstico clínico, podría ser diferente. El presente estudio describe el desempeño de la prueba rápida NS1 e IgM solas y de su uso combinado (en paralelo y simultáneo) con el diagnóstico clínico de dengue en pacientes de un área endémica en Colombia antes de la emergencia del virus Zika.
Pacientes y métodos
Diseño y población de estudio
Se realizó un estudio de pruebas diagnósticas con diseño transversal en la ciudad de Cali, ubicada al suroccidente de Colombia con 2´420.114 habitantes8 , que entre los años 2010 y 2015 (antes de la epidemia de Zika) presentó un promedio anual de 203,5 y entre 2016 y 2017 (post zika) un promedio de 129,3 casos de dengue por 100.000 habitantes. El estudio se realizó a partir de la base de datos de un estudio clínico aleatorizado de la validez e impacto de pruebas diagnósticas de dengue, con sujetos que buscaron atención médica entre febrero y diciembre de 2012 en 14 instituciones de salud de una aseguradora en el Valle del Cauca, a quienes el médico tratante solicitó una prueba diagnóstica de dengue y fueron aleatorizados a prueba rápida IgM/IgG o NS1/IgM/ IgG (ambas de Standard Diagnostics Inc.). Para el presente estudio se incluyeron hombres y mujeres de cualquier edad y se excluyeron a quienes tenían resultados incompletos en las pruebas estándar de oro de dengue (combinación de pruebas de dengue ELISA NS1, ELISA IgM, RT-PCR) y resultados de pruebas rápidas realizadas en más de una ocasión para el mismo episodio. El tamaño de la muestra se estimó en 410 sujetos con base en la diferencia en sensibilidad y especificidad entre uso en paralelo (95% y 80%, respectivamente) y en serie (85% y 90%, respectivamente) del uso combinado del diagnóstico clínico y la prueba rápida. El estudio fue aprobado por el Comité Institucional de Revisión de Ética Humana de la Universidad del Valle.
Procedimientos y pruebas de laboratorio
Las muestras de sangre para realizar la prueba rápida de dengue fueron procesadas según la rutina por el laboratorio central de las instituciones de salud. Una alícuota del mismo suero fue refrigerado y enviado al laboratorio VIREM de la Universidad del Valle para su almacenamiento a -70oC hasta su procesamiento por ELISA Dengue IgG Capture, Dengue IgM Capture; Dengue Early, de la marca Standard Diagnostics Inc; y RT-PCR Anidada por una persona experta9,10. La prueba rápida es una prueba inmunocromatográfica, que detecta de forma cualitativa la presencia del antígeno NS1 y los anticuerpos IgM e IgG del virus del dengue en suero o plasma humano. La prueba está conformada por dos compartimientos uno para detectar el antígeno NS1 y otro para detectar los anticuerpos IgM e IgG. En el compartimiento antígeno NS1 se agregan 3 gotas o 100μL de muestra (suero o plasma) en el pozo de muestra, en el compartimiento de los anticuerpos IgM/IgG se agregan 10 μL de muestra en el pozo de muestra y posteriormente se agregan 4 gotas de diluyente, los resultados se interpretan 20 minutos después, ambos compartimientos tiene una línea de control que debe ser positiva para garantizar que los resultados sean válidos. Se realizó control de calidad de la prueba rápida con 3 muestras enmascaradas cuyos resultados fueron idénticos al del laboratorio de referencia. No se realizó entrenamiento del personal para el uso de la prueba rápida diferente a la información provista por el fabricante. Para el diagnóstico clínico se tomó el realizado por el médico tratante al momento de solicitar la prueba rápida y registrado en la historia clínica según el Código Internacional de Enfermedades - CIE10 (Dengue A90X y dengue grave A91X).
Manejo y análisis de datos
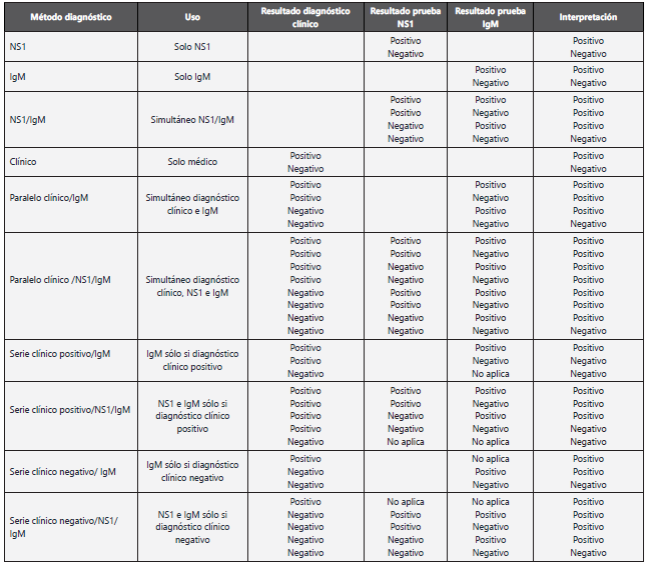
Los resultados de la prueba rápida realizada en la institución de salud y las pruebas de referencia se consignaron en una base de datos en Excel luego exportada a STATA 14. Se realizó un análisis descriptivo de la distribución por edad, sexo, y serotipos de dengue. Se estimaron la sensibilidad, especificidad, valores predictivos positivo y negativo y razones de verosimilitud (Likelihood ratios) positivo y negativo con sus intervalos de confianza al 95% de la prueba rápida realizada en la institución de salud y el diagnóstico clínico dado por el médico tratante cada uno por separado y combinados en serie y en paralelo utilizando como prueba de referencia la combinación de ELISAs NS1 e IgM y RT-PCR. (Tabla 1) Los resultados positivos en ELISA NS1 o RT-PCR se consideraron como dengue confirmado y los resultados positivos en IgM ELISA como dengue probables, los demás se consideraron como no dengue. Para los análisis se consideró dengue probable como dengue. Los resultados equívocos en las pruebas rápidas y de referencia se repitieron una vez y si continuaron equívocos no fueron incluidos en los análisis. La diferencia estadística en la sensibilidad y especificidad de los diagnósticos por separado y combinados se estableció con las pruebas Q de Cochran y McNemar para datos pareados, se consideró un valor de P<0,05 como estadísticamente significativo.
Resultados
Flujograma y características de los participantes
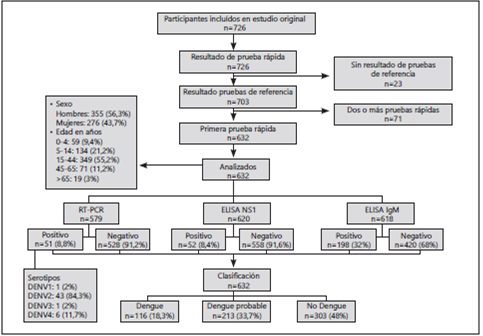
Del total de 726 participantes incluidos en el estudio original, 632 cumplieron con los criterios de elegibilidad y fueron clasificados por las pruebas de referencia como: dengue 116 (18,3%), dengue probable 210 (33,7%) y 303 (48%) como no dengue. La mayoría de los participantes fueron hombres (355/631, 56,3%) con una mediana de edad de 21,2 años (rango 0,6 a 83,5), dengue no grave (287/632, 45,4%) y predominio del serotipo DENV 2 (43/51, 84,3%). (Figura 1)
Rendimiento de diagnóstico clínico y pruebas rápidas por separado
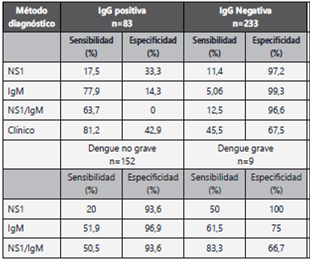
A todos los participantes se les realizó prueba rápida IgM mientras que el resultado de NS1 estuvo disponible para 318 sujetos. La sensibilidad del diagnóstico clínico (61,4%, IC95% 56%-66,7%) fue superior a la de las pruebas rápidas aun cuando se comparó con la detección simultánea de NS1 e IgM (positivo si cualquiera de las dos pruebas positivas) que alcanzó sensibilidad del 37% (IC95% 29,6%-44,7%) (p<0,001). Sin embargo, las razones de verosimilitud del diagnóstico clínico fueron de 1,82 (IC95% 1,52-2,18) para el LR+ y de 0,58 (IC95% 0,5-0,68) para el LR-. Mientras que, el LR+ de la prueba rápida IgM fue superior a 10 (14,4 IC95% 7,2-21,6), el LR- fue cercano a 1 (0,64, IC95% 0,58-0,69). (Tabla 2) Todos los métodos diagnósticos tuvieron una sensibilidad mayor en infecciones secundarias (IgG positiva) y en dengue grave. (Tabla 3) Para evaluar el efecto de la prueba de referencia en los resultados se estimó la sensibilidad excluyendo los dengues probables. La prueba NS1 detectó correctamente 23/50 dengues confirmados (46% IC95% 31,8%-60,7%), IgM 56/116 (48,3% IC95% 39%-57,7%), NS1/IgM 33/50 (66% IC95% 51,2%-78,8%), y el diagnóstico clínico 87/116 (75% IC95% 66,1%-82,6%).
Tabla 2 Parámetros de rendimiento del diagnóstico clínico y pruebas rápidas para dengue solos y combinados en serie y paralelo

VPP: valor predictivo positivo, VPN: valor predictivo negativo, LR+ likelihood ratio positivo, LR- likelihood ratio negativo.
Rendimiento de diagnóstico clínico y pruebas rápidas combinados
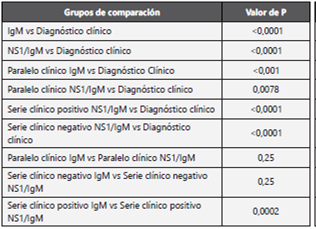
En el uso combinado del diagnóstico clínico con las pruebas rápidas, la sensibilidad más alta (79,5% IC95% 74,1%-84,3%) se observó con el uso en serie del diagnóstico clínico negativo con la detección simultánea de NS1/IgM. Por su parte, el uso en serie clínico positivo tanto con IgM como con NS1/ IgM tuvieron especificidades de 98,7% y 97,3%, respectivamente. En consecuencia, las razones de verosimilitud positivas de éstas fueron superiores a 10. Sin embargo, las razones de verosimilitud negativas fueron cercanas a 1 en todas las combinaciones. (Tabla 2) Tanto las combinaciones en paralelo como la combinación en serie cuando el diagnóstico clínico fue negativo tuvieron sensibilidades superiores al diagnóstico clínico solo, siendo las diferencias estadísticamente significativas en todas las comparaciones, excepto entre el uso paralelo clínico IgM vs paralelo clínico NS1/IgM y serie clínico negativo IgM vs serie clínico negativo NS1/IgM. (Tabla 4) Si bien, realizar una prueba rápida NS1/IgM a quienes tuvieron diagnóstico clínico negativo incrementó la sensibilidad diagnóstica, el incremento neto fue de 8 casos que fueron considerados por el médico tratante como no dengue y resultaron positivos a NS1 o IgM. De estos 8 casos, 4 fueron clasificados como dengue y 4 como no dengue por las pruebas de referencia. Por su parte, realizar una prueba rápida IgM o NS1/IgM a quienes tuvieron diagnóstico clínico positivo incrementó la especificidad pero se perdió en sensibilidad (32,2% y 34,5%, respectivamente) puesto que 53 pacientes con diagnóstico clínico positivo y prueba rápida NS1/IgM negativa fueron clasificados como dengue por las pruebas de referencia.
Discusion
Este estudio evaluó el desempeño del diagnóstico clínico y las pruebas rápidas de dengue solos y en su uso combinado en simultáneo y paralelo en condiciones reales de los servicios de salud en un área endémica, en el periodo anterior a la emergencia del virus zika en Colombia. Se observó una baja sensibilidad de las pruebas rápidas NS1 e IgM (<40%) similar a la reportada en Medellín-Colombia (30,8%)11 y cercana a 57,8% en Camboya12 pero inferior a la reportada en otros estudios 72% en Sri Lanka13, 76% en Brasil14 y 91,8% en Singapur6 . La baja sensibilidad observada de las pruebas rápidas NS1 e IgM podría ser explicada por un predominio del serotipo DENV2 que se conoce afecta la sensibilidad de la detección de NS115-17. El tiempo transcurrido desde el inicio de fiebre hasta la realización de las pruebas es también otro factor que afecta su sensibilidad puesto que NS1 se detecta principalmente en los primeros días e IgM con mayor frecuencia después del día quinto4 . A pesar de esto, el efecto del día en que se realiza la prueba diagnóstica se minimiza al detectar simultáneamente NS1 e IgM por lo cual consideramos que no sería la principal causa de baja sensibilidad de las pruebas rápidas16,18,19. En el estudio no tuvimos la información de días de fiebre para estratificar por esta variable y detectar si ella podría explicar el incremento en la sensibilidad de la prueba IgM en infecciones secundarias. De otro lado, los resultados confirmaron que las pruebas rápidas de dengue tienen una alta especificidad (superior al 90%) similar a la reportada en otros estudios de 98,3% en Brasil14 y 92% en Singapur6 . La introducción del virus zika, a partir del 2016 en las áreas endémicas para dengue, obliga a evaluar la especificidad actual de las pruebas rápidas de dengue debido a las reacciones cruzadas que disminuirían potencialmente su especificidad y así la capacidad de las pruebas rápidas para confirmar casos de dengue particularmente en la detección de anticuerpos20 y menos con la detección de NS121. Estos estudios requieren de pruebas de referencia que permitan diferenciar claramente IgM de dengue y de zika y que aún se encuentran en desarrollo.
El diagnóstico clínico dado por el médico tratante tuvo mayor sensibilidad (61,4%) que las pruebas rápidas y fue aún mayor en infecciones secundarias (81,2%), lo cual podría ser explicado por el entrenamiento del personal de salud en el reconocimiento de casos de dengue y en el mayor valor diagnóstico de los signos y síntomas de dengue grave. Sin embargo, existe un sesgo de selección debido a que en el estudio se incluyeron solo aquellos casos en que el médico tratante solicitó la prueba rápida de dengue por lo que no es posible conocer si la sensibilidad se incrementa o se disminuye al incluir los pacientes a quienes no se les solicitan pruebas rápidas. Para esto sería necesario realizar pruebas de referencia de dengue en forma consecutiva o aleatoria a pacientes febriles que asisten a las instituciones de salud lo que demanda mayores recursos. Con base en la sensibilidad del diagnóstico clínico utilizando la definición de OMS 2009 reportada por otros entre pacientes consecutivos en áreas endémicas de 87,1% (80,3%-92,1%)7 y 86,6% (83,2-89,5%)22 es posible que la sensibilidad del diagnóstico clínico sea aún mayor. Sin embargo, la introducción reciente de los virus chikungunya y zika, cuyos síntomas se sobreponen a los del dengue, podrían afectar la sensibilidad y la especificidad actual del diagnóstico clínico por lo que se requieren estudios dirigidos a mejorar la capacidad de diferenciar clínicamente dengue de éstas y otras enfermedades febriles prevalentes en las mismas áreas endémicas y mantener los programas de entrenamiento y educación continua en las instituciones de salud. En estas línea, se ha reportado que el hemograma (leucocitos y plaquetas) contribuye a una mejor capacidad del diagnóstico clínico recomendando su uso rutinario en pacientes febriles en áreas endémicas para arbovirus23. Las razones de verosimilitud tanto positiva como negativa fueron cercanas a 1 (LR+ 1,82 y LR- 0,58) por lo que el diagnóstico clínico por sí solo no permite confirmar ni descartar dengue. En este caso es necesario explorar la contribución del uso combinado del diagnóstico clínico con pruebas rápidas de dengue.
El uso en paralelo del diagnóstico clínico con las pruebas rápidas IgM o NS1/IgM, y en serie cuando el diagnóstico clínico es negativo para dengue aumentó significativamente la sensibilidad del diagnóstico clínico (entre 67,2% y 79,5%). A pesar de esto, ninguna de las combinaciones evaluadas logró tener la capacidad para descartar casos de dengue (LR- cercanos a 1). El incremento en la sensibilidad no alcanzó los niveles observados en otras regiones probablemente por la menor sensibilidad de cada componente (diagnóstico clínico y pruebas rápidas) en nuestro estudio6 . Por el contrario, el uso en serie de pruebas rápidas IgM o NS1/IgM cuando el diagnóstico clínico es positivo aumentó la especificidad del diagnóstico clínico (de 66,3% a 98,7% y 97,3%, respectivamente) siendo útil para confirmar dengue (LR+ mayores a 10). Sin embargo, la sensibilidad de esta combinación es inferior al 35% por lo cual un resultado negativo en las pruebas rápidas NS1 e IgM en pacientes con diagnóstico clínico de dengue no lo descartan7 . Este impacto en disminución de la sensibilidad podría tener repercusiones en la atención de salud debido a posibles errores en la clasificación de pacientes con dengue descartados por pruebas rápidas negativas cuando tenían ya un diagnóstico clínico positivo. Por lo tanto, se requiere evaluar no solo la certeza diagnóstica de las pruebas rápidas junto con el diagnóstico clínico sino el impacto que tienen sus resultados en la toma de decisiones clínicas, el pronóstico de los pacientes y en los otros usos potenciales de las pruebas diagnósticas en áreas endémicas de arbovirosis24.
En el presente estudio se utilizaron pruebas de referencia aceptadas para clasificar los pacientes como dengue y no dengue (ELISA NS1, ELISA IgM y RT-PCR) en una sola muestra, siendo confirmadas como dengue cuando se obtiene un resultado positivo en ELISA NS1 o RT-PCR lo que se logró en 116/632 (18,3%) de los casos analizados. Sin embargo, no se tuvo acceso a muestras pareadas con el fin de identificar seroconversión o aumento de 4 veces los títulos en anticuerpos específicos para dengue IgM e IgG que confirmarían dengue. Por lo tanto, se puede tener mala clasificación de casos de no dengue que podrían ser en realidad dengue lo que subestimaría la especificidad de los métodos diagnósticos evaluados. A pesar de esto, las especificidades observadas fueron relativamente altas y consistentes con otros estudios por lo que su impacto en los resultados podría ser bajo. Por esta misma razón, y por reacciones cruzadas con vacunación reciente para fiebre amarilla y comorbilidades algunos casos de dengue probable podrían ser mal clasificados como dengue cuando en realidad no lo son. En esta situación, se espera una subestimación de la sensibilidad, fue así que al considerar solo los casos de dengue confirmados la sensibilidad, tanto de las pruebas rápidas como del diagnóstico clínico, aumentó. A pesar de esto, los resultados muestran la misma tendencia que cuando se incluyen los dengues probables con una mayor sensibilidad del diagnóstico clínico. Aproximaciones de análisis que consideran pruebas de referencia imperfectas serian útiles para el abordaje metodológico en evaluación de pruebas diagnósticas en dengue25. El diseño permitió la evaluación enmascarada del diagnóstico clínico, pruebas rápidas y de referencia controlando el sesgo de verificación, y el hecho de no incluir el diagnóstico clínico o de las pruebas rápidas en la prueba de referencia evitó el sesgo de incorporación. Incluir en forma consecutiva pacientes que consultan a los servicios de salud contribuyó a disminuir el sesgo del espectro en la evaluación de pruebas diagnósticas de dengue. El personal de salud en el Valle del Cauca ha sido entrenado en la clasificación de dengue de la OMS pero no se obtuvo información de signos y síntomas para verificar qué criterios clínicos fueron los utilizados.
En conclusión, el diagnóstico clínico tiene una mayor sensibilidad que las pruebas rápidas, pero por si solo no es suficiente para confirmar o descartar dengue. Un resultado positivo en pruebas rápidas en pacientes con diagnóstico clínico de dengue es útil para confirmarlo, pero un resultado negativo no lo descarta. Se necesitan herramientas de diagnóstico clínico y de laboratorio de dengue que sean útiles en zonas endémicas donde circulan además otros arbovirus como chikungunya y zika y donde son prevalentes otras enfermedades febriles importantes en el diagnóstico diferencial para brindar atención adecuada a los pacientes.