Introducción
La enfermedad por VIH representa un problema de salud pública en Colombia de grandes proporciones. De acuerdo con los organismos del Ministerio de la protección social2 a enero 31 de 2016 se reportaron 73.465 personas diagnosticadas con VIH afiliadas al Sistema General de Seguridad Social en Salud, y la prevalencia, aunque menor del 1% en población general sigue siendo mayor del 5% en poblaciones clave como hombres que tienen sexo con hombres, usuarios de drogas endovenosas y trabajadores sexuales; la enfermedad sigue siendo más prevalente en hombres en que en mujeres para todos los grupos de edad (casos nuevo 78% versus 22%) mujeres especialmente en edades comprendidas entre los 25 y 49 años de edad donde la prevalencia es de 0,3% (63,3% de los casos nuevos) e importante en el grupo de mayores de 50 años con una prevalencia de 0,15%.
Con respecto al estado de los pacientes diagnosticados, el conteo de CD4 al momento del diagnóstico está en su mayoría por debajo de 500 celulas/mm3 y la indicación para iniciar terapia antirretroviral en la mayoría de los pacientes iniciaron para 2016 fue la presentación clinica (30,25%), seguida por el conteo absoluto de células CD4 (34,19%); sin embargo, en un 11% de la población no se dispone de datos que revelen el motivo para iniciar y un 5,51% no han iniciado tratamiento antirretroviral.
La carga viral fue el motivo para iniciar el tratamiento en 2015 para 5,48% de los casis y en 2016 en el 6,17%, y el porcentaje de pacientes indetectables a las 48 semanas o más de tratamiento para 2015 fue de 55% para 2016 de 61,2%, sin embargo los datos sobre el valor de la carga viral al momento del diagnóstico al ser escasos, se ha considerado como no calculable.
Hasta hace poco las guías recomendaban iniciar el tratamiento antirretroviral (TAR) en pacientes VIH positivos asintomáticos, de acuerdo con los conteos de células CD4+. Con la aparición de estudios como el (Strategic Timing of Antiretroviral Therapy) START3, y el (Trial of Early Antiretrovirals and Isoniazid Preventive Therapy in Africa) TEMPRANO ANRS 121364, donde se demostró el beneficio de tratar a todos los pacientes, independiente del valor de células CD4+, hoy en día se indica iniciar TAR en todos los pacientes asintomáticos; sin embargo, debido a que estos cambios en las guias, son relativamente recientes, aún existen pacientes con enfermedad por VIH que no han iniciado TAR.
En las guías actuales5,6, se indica TAR para todos los pacientes con enfermedad por VIH-1 diagnosticada, sintomáticos o no, y sin tener en cuenta la carga viral y las células CD4+; la Guía Colombiana de práctica clínica para la atención de la infección por VIH / Sida en adolescentes y adultos, tiene en cuenta el valor de las celulas CD4+ (menores de 500 celulas/ mm3)1, pues para el año de su revisión (2013) no había suficiente información al respecto; sin embargo no limita o contraindica el inicio de terapia en pacientes asintomáticos. Estas recomendaciones se enfocan al tratamiento de los pacientes que evolucionan de forma habitual o progresores típicos, pero existe poca información sobre los pacientes considerados controladores, en quienes la enfermedad evoluciona de forma diferente a la mayoría, y mantienen cargas virales bajas o por debajo del límite de detección y recuentos de células CD4+ estables sin tratamiento.
La función de los medicamentos antirretrovirales es evitar la infección de nuevas células CD4+, mediante la inhibición de la replicación viral, o mediante mecanismos que bloqueen la infección, disminuyendo la cantidad de copias del virus en suero. Poco se sabe sobre la necesidad de tratar individuos, en quienes la carga viral permanece por debajo de los límites de detección, en ausencia de tratamiento antirretroviral, y si el suministro de tratamiento a estos pacientes sobrepasa el riesgo de toxicidad de los fármacos. Tampoco se conoce si los fármacos usualmente empleados en primera línea serian o no los más indicados.
La mayoría de los medicos que trabajan con pacientes VIH positivos, han enfrentado alguno de esos pacientes y quienes llevan más tiempo en la práctica de la medicina de VIH, probablemente los han seguido por años sin iniciar TAR, pues aun cuando existe información que sugiere que estos pacientes se hospitalizan con mayor frecuencia7, no hay evidencia para soportar adecuadamente una decisión a favor del inicio de terapia con fines terapéuticos.
Tampoco se ha evaluado en los estudios de inicio temprano, si tratar los controladores, disminuye la trasmisión de la enfermedad en parejas discordantes8; así que suponemos que son pacientes con un bajo potencial de contagio y no existen suficientes argumentos a favor de tratarlos con ese propósito.
En las guías actuales de tratamiento los inhibidores de integrasa son un componente de las primeras líneas de terapia en todos los esquemas recomendados5,6. La Guía Colombiana de práctica clínica para la atención de la infección por VIH / Sida en adolescentes y adultos, incluye únicamente el Raltegravir como inhibidor de integrasa en las primeras opciones de tratamiento1; pues para la fecha de su revisión se incluyó únicamente los medicamentos que estaban aprobados en el país.
Se desconoce si existe una ventaja demostrada entre uno u otro fármaco, y no hay evidencia que compare las terapias combinadas de tres fármacos usualmente recomendadas, con otras posibilidades, incluidas las estrategias de bi-terapia o monoterapia. (uso de solo dos o un fármaco para el tratamiento, estrategia generalmente empleada en simplificación de tratamientos combinados, una vez se controla la enfermedad).
Por otro lado, cuando se toma la decisión de iniciar un tratamiento antirretroviral en un CE, no tenemos elementos para elegir la aproximación terapéutica más apropiada, y desconocemos la forma adecuada para hacer un seguimiento de su evolución.
No tenemos datos sobre el porcentaje de pacientes en Colombia que pudieran ser clasificados como controladores, suponemos que el número de pacientes en esa condición en Colombia sería muy reducido y similar a la prevalencia global, pero dado lo importante de la decisión terapéutica en estos casos la presente revisión contribuirá a aportar información actualizada precisando conceptos y acercando al clínico la información más reciente.
Materiales y métodos
La información se obtuvo mediante el motor de búsqueda PubMed, y la base de datos MEDLINE de los términos: << HIV elite controllers>>, << HIV elite suppressors>> y <<long term non progressor HIV >> y << HIV tipical progressors,>> (controladores elite HIV, supresores elite HIV, no progresores a largo plazo, y hiv progresores típicos) así como los términos: <<viremic controllers>>, <<non viremic controllers;>> <<HIV elite treatment>> (controladores virémicos, controladores no virémicos, VIH elite tratamiento) publicadas desde 1990 a Febrero de 2017, también se hizo una búsqueda las mismas bases y en Google academy de los términos: <<guideines HIV,>> y <<guidelines AIDS>> (guias VIH y guias SIDA) desde 2013 a 2017 y de los términos <<HIV elite controllers>> y <<HIV elite suppressors>> (VIH controladores elite, VIH supresores) desde 1990 a 2017.
Una vez listados y comparados los trabajos relevantes, se hizo una relación de los hallazgos y los aspectos básicos como la definición de los pacientes no progresores o progresores lentos, controladores y controladores elite; la forma en que evoluciona la enfermedad en ellos y la respuesta a los tratamientos, de forma que permita al lector tener un conocimiento más claro sobre el tema, y al final del texto se plantea una discusión basada en la información obtenida.
Definición de no progresores a largo plazo y controladores elite
De acuerdo con el comportamiento de la enfermedad a nivel virológico, se ha propuesto la existencia de dos grupos de pacientes:9 Los progresores normales, o progresores típicos (typical progressors) y los no-progresores a largo plazo (long term non progresors). En el grupo de los no-progresores a largo plazo, se debe establecer la diferencia entre controladores virémicos (viremic controllers) que serían pacientes que pueden tener cargas detectables bajas y los verdaderos controladores elite (CE) (elite controllers) que son los controladores con cargas virales indetectables.
Durante la infección aguda, la carga viral es muy elevada llegando hasta millones de copias, se ha demostrado que después de la infección y sin tratamiento, la presencia de cargas virales de 169.824 copias por mm3 (rango 74.131 - 398.107 copias mm3) en el día 5 hasta de 1.548.816 copias por mm3 (rango 602.559 - 3.890.451 copias por mm3) el día 1210; posteriormente los valores disminuyen de forma gradual y se estabilizan en números por debajo de 50.000 copias por mm3;11 en ese periodo se desencadena una respuesta especifica de linfocitos CD8+, que contribuye al control de la viremia y a establecer el llamado valor <set point> o punto fijo de la carga viral12; el tiempo para el establecimiento del <set point> estaría alrededor de 4 semanas13,14, tanto en mediciones de carga viral VIH-1 RNA en suero, como de VIH- ADN integrado a las células mono-nucleares periféricas, pero se ha definido, como el valor de la carga viral RNA en suero, una vez termina el proceso de infección aguda.
La fase crónica tiene una duración muy variable que puede ir desde tres a 20 años dependiendo de la velocidad de progresión de cada individuo, y a factores tan complejos como la genética viral13. La Figura 1 describe la secuencia de eventos que ocurren durante la infección. En la evolución típica, durante esta fase ocurren los fenómenos de inflamación y activación inmune, responsables del incremento en el riesgo cardiovascular y los eventos asociados a envejecimiento prematuro, hoy en día considerado entre 4 y 12 años sumados a la edad cronológica de los individuos15.
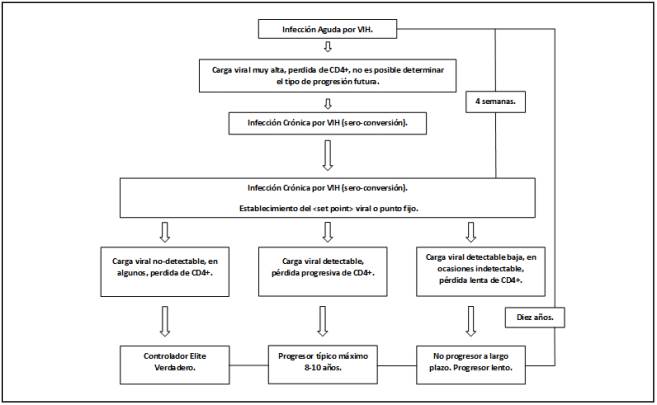
Figura 1 Evolución de la enfermedad sin tratamiento. En la evolución típica de la enfermedad, ésta pasa por dos etapas; la infección aguda y la infección denominada establecida o crónica. En la infección aguda no hay anticuerpos detectables, la carga viral es elevada y se detecta antígeno p24; 2 a 6 semanas después
En el periodo de infección crónica, se establece la infección de los reservorios, gradualmente la carga viral se estabiliza, alcanzando su <set point> al igual que los recuentos de células CD4+ y en ese momento se define el tipo de progresor.
Dado que hoy en día se recomienda iniciar tratamiento en todos los casos, independiente de los conteos de células CD4+ y carga viral1,6,5; si los pacientes se diagnostican en la etapa de infección aguda, no sería concebible esperar que pase ese periodo, para determinar si van a evolucionar como CE.
La progresión usual sin tratamiento (progresión típica) hasta el periodo sintomático, se ha estimado en múltiples estudios entre ocho y diez años16,17,18; no obstante, una progresión más rápida depende de múltiples factores que reflejan en realidad la forma en que interactúa el virus con el huésped y este a su vez con el virus y que incluyen, entre otros, la edad al momento de la infección19, sin embargo de todos estos, uno de los predictores más contundentes de la velocidad de progresión de la enfermedad es el <set point> de la carga viral20,21.
Los no progresores a largo plazo (long term non progresors), son individuos en quienes una vez establecida la enfermedad, permanecen asintomáticos por periodos de tiempo prolongados sin tratamiento antirretroviral y su conteo de células CD4+ permanece alto11. Esta definición agrupa los pacientes que permanecen estables en sus células CD4+ pero también incluye los que tienen cargas virales detectables por lo general en valores bajos.
Es necesario establecer entonces una definición más clara para diferenciar estos pacientes no progresores a largo plazo de los verdaderos CE. En ese sentido, diferentes estudios han empleado definiciones propias y se estima que empleando la definición: individuos asintomáticos sin terapia por más de ocho años con recuentos de células CD4+ de más de 500 células, hasta un 9% de la población podría ser considerada como no progresor a largo plazo12. Sin embargo, para comprender la gran diferencia que se genera cuando los criterios de clasificación son tan diversos, basta observar que en estudios similares en los que se hizo seguimientos más cortos la prevalencia fue de solo un 5,02%22.
En un estudio publicado en 2009 por Sophie Grabar9 que incluyó 46.880 pacientes VIH-1 positivos, seguidos en 2005 se describió pacientes evaluados en 2005, que habían estado infectados por más de 8 años, sin tratamiento previo y asintomáticos, se categorizó estos pacientes en cuatro grupos, (Tabla 1) en la columna “n” de la Tabla 1; se evidencia la frecuencia tan escasa de cada grupo a medida que la definición se hace más estricta.
Tabla 1 Clasifcación de los controladores.

Fuente: adaptado de: 9Agence Nationale de Recherches sur le SIDA et les h\u00e9patites virales (ANRS Grabar S, Selinger-Leneman H, Abgrall S, Pialoux G, Weiss L, Costagliola D. Prevalence and comparative characteristics of long-term nonprogressors and HIV controller patients in the French Hospital Database on HIV. Aids. 2009;23(9):1163-1169.
Podemos observar como en una clasificación tan minuciosa como esta, los casos de verdaderos CE son escasos (0.15%) y si en la definición de no progresor a largo plazo se suma estabilidad de los CD4+ como requisito, los números son mucho menores llegando solo al 0,2%.23
Otro concepto muy importante es que la no progresión a largo plazo parece ser un estado no permanente en esos pacientes, es decir que eventualmente todos los individuos con excepción de los verdaderos CE, van a progresar si permanecen sin terapia antirretroviral (TAR)23.
Información reciente ha ido mostrando como una carga viral DNA basal alta, predice una perdida más rápida de la condición de no progresor; lo que sugiere que en realidad estos son individuos en quienes hay una replicación viral muy baja, incluso por debajo de los límites de detección de las pruebas comerciales, pero el grado esta replicación baja, resulta tener un impacto definitivo en la evolución de la enfermedad22.
Algunas publicaciones han separado estos pacientes en solo dos grupos mediante definiciones más amplias y sencillas; uno, el de los verdaderos controladores elite (CE), que son el foco de investigación más interesante, y que comprende los pacientes que permanecen indetectables sin tratamiento antirretroviral; pacientes en quienes las cargas virales son indetectables con algunas cargas detectables a lo largo del tiempo pero de máximo 1000 copias por mililitro y el otro, los controladores virémicos que serían aquellos en los cuales las cargas virales estarían en rangos del hasta 2000 copias por mililitro22. Esta definición no contempla diferentes tipos de controladores virémicos simplificando las cosas, pero incluye como controladores elite aquellos pacientes con cargas virales detectables.
La cohorte Francesa, Primary Infection Cohort (PRIMO), sugiere que ambos estados, el de CE y el de controlador virémico, se alcanzan y establecen en promedio al año de la seroconversión; también se observó que los CE verdaderos, muestran un aumento de las células CD4+ inicial seguido de estabilización mientras los controladores virémicos experimentan pérdida de sus células CD4+24.
En un estudio de 90 CE, la presencia de una viremia de alrededor de las dos copias por mililitro predijo una pérdida de CD4+ en estos individuos, comparado con los que no la tenían25. Otros estudios muestran que los pacientes que experimentan blips virales, (definidos como rebotes de la carga viral de máximo 500 copias/mL y que retornan a la condición de indetectabilidad), llegan a desarrollar progresión de la enfermedad, sea esta clínica o inmunológica26.
De esta forma, los no progresores a largo plazo (long term non progresors), que son pacientes virémicos, simplemente vendrían a ser individuos en los cuales la enfermedad progresa de todas maneras, aunque lo hace de forma mucho más lenta, y el hecho de que sean tan pocos individuos en las cohortes, es sólo evidencia sugestiva de que son en realidad, sujetos que se encuentran en los extremos de una distribución estadística normal pero no serían un grupo especial de pacientes. Bajo esta premisa la definición de no progresores a largo plazo o controladores virémicos, no estaría delimitando un grupo diferente de pacientes sino individuos en quienes la enfermedad evoluciona de una forma más lenta pero que llegarán a ser sintomáticos con el tiempo.
Curiosamente unos hallazgos recientes en un paciente dados a conocer en la Conference on Retroviruses and Opportunistic Infections CROI 201727 demuestran como los controladores virémicos aun cuando son similares a los progresores típicos, parecen desarrollar anticuerpos ampliamente neutralizantes (de mucho interés en la investigación de vacunas para el VIH), comportándose así, de forma algo diferente a los individuos progresores típicos por lo menos desde el punto de vista de la producción de anticuerpos.
Para entender la forma en que evoluciona la carga viral en estos pacientes, se ha comparado la disminución de la carga viral en los individuos controladores con los progresores típicos una vez iniciada la TAR. La evolución normal del paciente se ha tipificado en tres fases: una fase de respuesta rápida inicial, una segunda fase con una pendiente menos pronunciada y finalmente una tercera fase que es más lenta y prolongada que las anteriores. El trabajo citado abajo en la bibliografía y que se publicó en AIDS 201628 ilustra con bastante claridad este concepto si el lector desea profundizar al respecto.
Cuando se comparó los progresores lentos o No Elite (pacientes virémicos) con los pacientes con progresión típica, se encontró que responden de forma bastante similar. Información dada a conocer recientemente en la Conference on Retroviruses and Opportunistic Infections (CROI) 201729 comparó la caída de carga viral en estos pacientes (controladores no elite) con pacientes con progresión típica; (información, obtenida del estudio ACTG A5308) que es un estudio abierto y prospectivo en dos grupos: pacientes con carga viral menor de 400 copias/mL en un periodo de un año a los que se suministró Tenofovir /Emtricitabina/Rilpivirina, el primer grupo con un promedio de carga viral de 81 copias/mL y el segundo con un promedio de 56.550 copias/mL) evidenciando que, en la fase inicial, la perdida de carga viral es similar en ambos grupos y solo se pudo observar una diferencia en la segunda fase de caída de la carga viral que fue más corta en los controladores al compararlos con los progresores típicos. (adicionalmente se midió factores inflamatorios solubles, encontrando que no había diferencia entre ellos).
Establecido entonces que existen unos pacientes con viremias muy bajas o un poco más altas en quienes la enfermedad va a progresar lentamente y unos controladores que llamaríamos verdaderos (CE) o controladores no-virémicos, es necesario tratar de definirlos con más claridad y encontramos en la literatura dos definiciones para ellos:
La definición de controladores de la Agence nationale de recherches sur le sida et les hépatites virales (ANRS) empleada en el estudio de Madec:30 Pacientes con un mínimo de 5 cargas virales medidas por debajo de 400 copias/mL por un mínimo de 5 años, sin haber recibió terapia antirretroviral.
Y una definición que permite incluir pacientes previamente tratados, pero más estricta en el nivel de viremia, que denominaríamos American elite controller por ser la empleada en los estudios Americanos como los de Florencia Pereyra y Goujard31,25: Pacientes con al menos tres cargas virales por debajo del límite de detección, (generalmente 50 copias/mL) separadas más de 12 meses entre si y en ausencia de terapia antirretroviral por un año, antes y durante el periodo de control virológico.
Ambas definiciones de CE (verdaderos controladores) incluyen a los pacientes con cargas virales mayormente indetectables durante años y permiten solo de manera ocasional, el hallazgo de viremias, pero muy bajas.
¿Cómo se comporta la enfermedad a nivel inmunológico en los controladores elite?
Hasta este punto en la bibliografía citada, no hemos considerado incluir criterios inmunológicos para definir estos pacientes, si bien sabemos que algunos CE muestran perdida de células CD4+ a lo largo del tiempo, no se han tipificado como un grupo de interés aparte, aunque al menos una de las guías sugiere que se inicie tratamiento si este fenómeno se presenta6.
En una publicación de 200632, la mayoría de los CE no experimentaron cambios en los conteos de células CD4+ durante 10 años de seguimiento, y solo algunos pacientes mostraron disminución no significativa de los mismos, lo que sugiere que la perdida real de células CD4+ en los CE es un fenómeno poco frecuente.
Sabemos que en los pacientes en los que la enfermedad progresa, la disminución en los recuentos de células CD4+ se acompaña usualmente de un incremento de células CD8+ causando así que el total de células CD3+ permanezca estable, este fenómeno se conoce desde los años 90 y se ha descrito como homeostasis ciega de las células T33. Sin embargo en los últimos años el conteo de células CD8+ no se mide durante el seguimiento clínico de forma rutinaria, y las guías internacionales y Colombianas tampoco siguieren que se haga61,6o lo consideran opcional5, lo que hace difícil el análisis de la evolución de estos grupos celulares en estudios observacionales; sin embargo en el estudio de Sedaghat32 no se observó ninguna tendencia en las células CD4+ al incremento o a la disminución a lo largo del tiempo, (aunque hubo diferencias significativas entre los pacientes) y de todas maneras hay que tener en cuenta que el estudio se hizo con un número reducido de sujetos.
Si en cambio se comparan los CE con los no progresores a largo plazo, estos últimos tienden a presentar una pérdida de células CD4+ con el tiempo que parece ser inevitable34.
El fenómeno de la translocación microbiana y el daño inmune al tubo digestivo en los CE es un factor importante que contribuye a la inflamación crónica; este fenómeno desencadena incrementos en plasma de Lipopolisacáridos y marcadores de activación de macrófagos y monocitos (scd414), aumento de los niveles de IL-6 y de dimero-D, que son factores asociados a la aparición de condiciones serias no asociadas a SIDA en los sujetos VIH positivos. Los datos presentados en Conference on Retroviruses and Opportunistic Infections (CROI) 201335 evidencian la importancia de esos marcadores
Los CE parecen tener unas estructuras linfoides intestinales anormales como consecuencia de la enfermedad, con aumento de fibrosis y colágeno, lo que sugiere que en efecto existe en ellos un daño de órgano blanco y activación inmune36; la información sugiere que estos factores se relacionan con el daño vascular y finalmente tendrían relación con la enfermedad coronaria en estos pacientes37.
Información recientemente dada a conocer en Conference on Retroviruses and Opportunistic Infections CROI 201738 demuestra como la microbiota intestinal de los controladores elite difiere de los progresores típicos y que esta flora tiene por lo tanto un perfil metabólico diferente, algo que podría tener un impacto también en la inflamación crónica y sobre lo cual no existen datos más amplios a la fecha.
Con respecto a la relación CD4+/CD8, el trabajo de Serrano- Villar39 en 2014 sugiere que la presencia de cambios en la relación de células CD4+/CD8+ se asocia a un incremento de estos eventos y los datos presentados en la Conference on Retroviruses and Opportunistic Infections (CROI) en 2016, muestran también la asociación entre una relación CD4+/ CD8+ y la incidencia de eventos no asociados a SIDA40
No se encontró en la búsqueda información que sugieran el uso del conteo de células CD4+ o CD8+ ni la relación CD4+/ CD8+ deba incluirse en la definición de los controladores elite, aunque algunos de ellos muestren disminución en los conteos celulares.
¿Existe evidencia de que los no progresores a largo plazo y los controladores elite evolucionen clínicamente de forma diferente a los progresores típicos?
Los verdaderos CE mantienen una viremia indetectable sin tratamiento; sin embargo, hay evidencia de inflamación crónica en ellos y un mayor número de eventos serios no asociados a SIDA. En un estudio reciente41, se evaluó en 149 pacientes si los pronósticos clínicos difieren entre los CE sin terapia antirretroviral (TAR) y los pacientes con viremia controlada como resultado de TAR; la evaluación retrospectiva comparó las hospitalizaciones en estos grupos desde 2005 a 2011 mostrando un claro aumento en los ingresos hospitalarios de los pacientes controladores elite comparados con los suprimidos por la TAR y curiosamente estas se debieron en gran número a problemas cardiovasculares como dolor precordial, enfermedad arterial coronaria y falla cardiaca que fueron responsables del 31.1% de las hospitalizaciones de los CE, comparado con un 13,5% del grupo general, algo estrechamente relacionado con los hallazgos del estudio de Pereyra mencionado arriba37
En ese mismo estudio41, hubo también un hallazgo muy interesante que fue el alto número de hospitalizaciones por motivos psiquiátricos en los CE comparado con el grupo de control; este hallazgo sugiere para los autores, una mayor frecuencia de condiciones coexistentes en ellos, como el abuso de sustancias psicoactivas, pero también plantea la posibilidad de que un nivel bajo de replicación viral esté ocurriendo en reservorios como el sistema nervioso central con la consecuente aparición de alteraciones neuro-cognitivas posteriores. Por otro lado existe la posibilidad de que pacientes que calificamos como controladores no-virémicos o verdaderos CE, tengan en realidad, periodos de viremia que pasan inadvertidos; esto sería muy importante dado que estudios como el Strategies for Management of Antiretroviral Therapy (SMART)42, han demostrado que las células CD4+ caen durante estos periodos de viremia por cortos que sean y dado que los CE se evalúan de forma menos frecuente que los pacientes virémicos, es posible que estos períodos con caídas en los conteos de células CD4+ no sean incluidos en las observaciones e incluso que haya un sub-registro de sus hospitalizaciones. En el SMART42, la definición de controlador elite empleada fue: pacientes con tres o más cargas virales consecutivas por debajo del límite de detección en un periodo de 12 meses o más en ausencia de tratamiento antirretroviral, (la misma definición empleada en algunos estudios previos)43 en los que también se demostró, como la viremia residual por debajo de los límites de detección por métodos comerciales fluctúa, en los pacientes controladores elite a lo largo del tiempo.
Hay entonces información que indica que los CE si sufren cambios debido a activación inmune y tienen un mayor número de hospitalizaciones que los pacientes controlados con terapia antirretroviral (TAR).
La información sugiere que los CE sufren unos fenómenos de activación inmune y un aumento de los riesgos asociados y no asociados a SIDA, desproporcionados para los valores de carga virales que presentan, estos aumentos son comparables a los de los suprimidos por la TAR.
¿Responden diferente al tratamiento los controladores elite y existe beneficio en tratarlos?
Se ha demostrado que el tratamiento disminuye la producción de virus con capacidad replicativa en los reservorios de los CE; el estudio de Chun44 mostró cómo el tamaño del pool de células CD4+ que contienen virus potencialmente infecciosos disminuye durante TAR y rebota a la línea de base al interrumpir el tratamiento; evidencia que sugiere una replicación viral baja no detectable en el plasma por las pruebas convencionales.
La respuesta al tratamiento en el conteo de células CD4+ ha demostrado ser variable en los estudios publicados, mostrando aumento discreto45 como ausencia de respuesta44 y adicionalmente hay que tener en cuenta que es posible que en los CE, transcurra más tiempo entre la infección y el diagnostico e incluso entre la infección y el inicio de TAR como ya se ha observado45. En el reporte de Sedaghat32 que siguió durante 10 años la evolución de las células CD4+ en CE (definidos como aquellos que mantienen cargas virales por debajo de 50 copias/mL sin tratamiento), uno de los pacientes fue iniciado en un régimen basado en Tenofovir Emtricitabina y Efavirenz debido a una disminución progresiva de sus células CD4+ y curiosamente no se observó en ese paciente beneficio en el conteo de células CD4+, pero si hubo una marcada disminución en el porcentaje de células CD8+ y en los marcadores de activación inmune.
En este momento, la información disponible sobre los beneficios de tratar pacientes CE es muy limitada, en gran parte debido a la baja frecuencia con que se presentan los casos. Hasta ahora hemos mostrado como la replicación viral de bajo nivel, tanto en suero como en reservorios anatómicos parece ser la responsable del posterior desarrollo de alteraciones neuro-cognitivas, activación inmune y posiblemente la disminución en los conteos de células CD4+ que se presentan en algunos CE.
Respecto a la carga viral, los hallazgos al medir los valores por debajo de los limites de detección en pruebas comerciales, muestran que las cargas virales de los CE son similares a los pacientes controlados con TAR. 46 esto sugiere que los mecanismos que mantienen una replicación viral baja en pacientes tratados podrían ser similares a los de los CE.
En un reporte46 donde se comparó las cargas virales por debajo del límite de detección de 14 CE con las de 15 pacientes controlados con TAR, se encontró que los CE tenían cargas que oscilaban desde 1 hasta 87 copias/mL pero más de la mitad no tenían virus detectable, mientras que en los controlados las cagas oscilaban debajo de 4 copias/mL con un promedio de 2 copias/mL, esta diferencia, aunque no significativa, sugiere que la carga viral por debajo de los límites de detección oscila más en los CE que en los pacientes controlados con TAR.
Con la información expuesta arriba, no podríamos sustentar un beneficio real derivado del inicio de tratamiento en todos los pacientes CE, las guías que consideran iniciar TAR en pacientes CE, sugieren que se haga en aquellos con perdida de células CD4+ durante el seguimiento o con complicaciones, pero esta afirmación no se basa en información suficiente6. Sin embargo, una posible indicación para iniciar TAR en los CE, sería en los que la disminución de la activación inmune, obtenida por el tratamiento, pudiese tener un beneficio, pero dada los escases de datos en el momento esa indicación tampoco está soportada. No tenemos datos con seguimientos a largo plazo, ni evidencia de que los cambios observados en los recuentos celulares45 y en los indicadores inflamatorios47 tengan una consecuencia significativa en los CE tratados. Por otro lado, en los estudios en que se observa disminución de la carga viral medida por debajo de los límites de detección estándar, esta no se acompañó de una normalización de los niveles de activación de las células CD4+ y CD8+,47 lo que sugiere que existen otros factores asociados a inflamación en los CE además de la carga viral.
¿Cuál sería el tratamiento apropiado?
Con respecto a la elección de un tratamiento para los CE, estaríamos enfrentados a un paciente que se encuentra asintomático, a quien vamos a proporcionar un tratamiento antirretroviral cuya consistencia en el tiempo sea la mejor, pero en estos pacientes esperaríamos que logre por lo menos el control de la viremia que tienen por debajo de los límites de detección43, mediante el uso de fármacos con buena penetración al sistema nervioso central y a los reservorios donde se supone la existencia de células CD4+ portadoras de VIH potencialmente infeccioso44. Considerando su toxicidad potencial, el tratamiento debe tener mejor balance riesgo beneficio. Surgen entonces preguntas: si las indicaciones actuales para elección de terapias de primera línea se podrían aplicar en ellos; si se requiere de combinaciones diferentes, terapias con combinaciones inusuales, o si podrían ser útiles incluso, terapias con solo uno o dos fármacos antirretrovirales.
Referente al tratamiento, no existe experiencia en grandes grupos de pacientes, sin embargo, la mayoría de la información disponible en CE tratados, es sobre el uso de primeras líneas, que son similares a las indicadas tanto en las guías Colombianas1 como internacionales6, 5y por lo tanto incluyeron los Inhibidores de la transcriptasa Tenofovir Emtricitabina y Efavirenz y el único inhibidor de Integrasa usado fue el Raltegravir. A pesar de que en las guías europeas5 y del panel de los Estados Unidos6, se indica el uso en primera línea de otros inhibidores de integrasa, no existe información sobre Dolutegravir y Elvitegravir en estos pacientes, posiblemente por el poco tiempo que han permanecido disponibles; por otro lado, en los estudios en los cuales no se describió la combinación antirretroviral empleada, no se incluyeron inhibidores de la integrasa.
La información recopilada sobre tratamiento en pacientes CE es muy escasa, la Tabla 2, muestra un comparativo de los aspectos más notorios de los estudios revisados; hace evidente que la diversidad de definiciones y nuevamente el número tan reducido de las muestras, que dificulta comparar de forma homogénea los datos.
Tabla 2
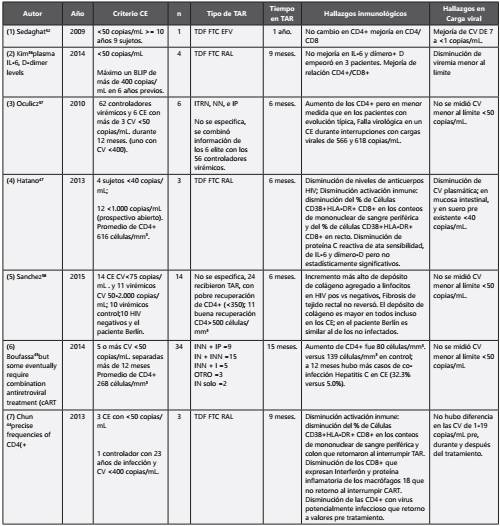
La columna “n” se refere únicamente a sujetos que recibieron TAR. CE= Controlador elite; INN + IP = inhibidor no nucleósido + Inhibidor de proteasa; IN + INN = inhibidor nucleósido + no nucleósido; INN + I = inhibidor no nucleósido + inhibidor de integrasa; TDF=Tenofovir; FTC=Emtricitabina; RAL=Raltegravir; EFV= Efavirenz; CV= Carga viral; TAR= Terapia antirretroviral (1):32 8 sujetos por 10 años, uno fue tratado con TDF FTC EFV (Mujer HLA-B*5701+) que progresó por una pérdida progresiva de las células CD4+ por un periodo de nueve años, se trató sin mejoría de CD4+ pero la relación CD4+/CD8+ si aumentó. (2):36plasma IL-6, D-dimer levels Cuatro CE; se permitió máximo un BLIP de más de 400 copias/mL, tratados tres y un control con TDF/FTC RAL durante 9 meses y después interrumpido, pacientes con un promedio de 18 años de enfermedad documentada y de 60 años de edad promedio, la relación CD4+/CD8+ mejoró signifcativamente durante un curso corto de terapia y los eventos de replicación viral baja, pero no hubo mejoría en los niveles en plasma de IL-6 y dímero+D que estaban elevados e incluso estos se incrementaron en tres cuartos de los participantes pero la relación CD4+:CD8+ mejoró. (3):57 62 pacientes (6 elite verdaderos y 56 virémicos alcanzaron mejoría estadísticamente signifcativa en el promedio de CD4+ pero la mejoría fue inferior en los CE comparados con los virémicos. (4):47 Los pacientes tenían una media de CD4+ más altos que en el estudio Boufassa.45 (5):58 Pacientes del estudio SCOPE (Observational Study of the Consequences of the Protease Inhibitor Era) en curso desde septiembre de 2005 y planeado hasta 2019. Aumento del depósito de colágeno LA en tejido rectal en todos los grupos, CE, controladores virémicos y pacientes con evolución típica (no controladores) se revisó muestras de tejido del paciente Berlín y se encontró en ellas niveles de colágeno LA similares a los de individuos sanos, sin embargo, hay que tener en cuenta que este paciente recibió otros tratamientos (como radiación yquimioterapia) que pueden influir en los resultados encontrados en las muestras. (6):45,60 Mostró mejoría en los CD4 que fue relativamente lento comparado con los virémicos, sin embargo, el tiempo transcurrido entre el diagnóstico y el inicio de terapia, fue más largo en los CE y la frecuencia de co-infección con hepatitis C fue más frecuente (32.3% versus 5.0%); la hepatitis C se ha asociado a más lenta recuperación de células CD4+ en unos estudios61 y no asociada en otros.62 (7):44 3 sujetos con CV<50 copias/mL; entre 5 y 14 años de infección y un controlador no elite.
Con respecto a la replicación viral en reservorios anatómicos, la penetración al sistema nervioso central del fármaco y la posibilidad de suprimir la replicación en ese y otros espacios; hay que tener en cuenta que se trata de pacientes, cuya probabilidad de haber tenido una enfermedad previa del sistema nervioso central y por lo tanto una disrupción de la barrera hemato-encefálica es muy baja, así que suponemos que en ellos la penetración de estos medicamentos sería similar a la de individuos no portadores, asi que la indicación se inclinaría al uso de Raltegravir que posee características ventajosas en ese sentido48, con el 50% de las muestras de LCR excediendo el IC95 y alcanzando concentraciones inhibitorias locales en LCR en la mayoría de los pacientes. Además, se sabe que su penetración no está ligada a factores del paciente como la fármaco-genomica49. No obstante, un estudio, el ING11607050 mostro hallazgos similares con el uso de Dolutegravir pero la experiencia sobre penetración al sistema nervioso central, con este fármaco, al igual que con Elvitegravir es muy limitada51.
Desde luego hay que tener en cuenta que una alta concentración del medicamento en LCR, también puede relacionarse con la potencial toxicidad sobre el sistema nervioso central, y además debemos considerar la posibilidad de intolerancia de un fármaco u otro en una indicación tan especial como la de los CE.
Con respecto a la tolerabilidad de los inhibidores de integrasa, un estudio publicado en HIV Medicine50 mostró interrupciones en 62 de 387 pacientes (16,0%) debido a problemas de tolerancia y revela una importante diferencia entre los dos inhibidores de integrasa más usados en Colombia. La más alta frecuencia de abandonos de Dolutegravir, comparado con Raltegravir se soporta también, en información publicada más recientemente,52 que de nuevo muestra una preocupante asociación entre el uso de Dolutegravir y abandonos por eventos adversos (EA) y efectos neuro-psiquiátricos, (en este estudio se evaluó 1950 pacientes que iniciaron tratamiento con inhibidores de integrasa, encontrando EA, que llevaron a la interrupción del fármaco en los primeros 12 meses en 7,6% de los pacientes para Dolutegravir; en 7,6% de los pacientes para Elvitegravir y 3,3% para Raltegravir). En los hallazgos desfavorables para Dolutegravir comparado con Raltegravir, fueron más notorios el insomnio y problemas de sueño, concentración, vértigo, dolor de cabeza y depresión. Es de notar que en seis pacientes en quienes se interrumpió Dolutegravir por efectos neuro-psiquiátricos, estos reaparecieron al volver al medicamento. Las descontinuaciones en este estudio, que mostro más eventos adversos en mujeres y pacientes de más edad, superaron incluso las de los estudios clásicos de inicio de terapia con inhibidores de integrasa como los SPRING-153, SPRING-254, y FLAMINGO56. En la actualidad la mayor parte de la información disponible con respecto a eventos adversos compara Dolutegravir con inhibidores de proteasa, pero no con Raltegravir o Elitegravir.
Dado que se trata de pacientes asintomáticos, en ellos es aún más importante elegir un fármaco con la menor probabilidad de generar molestias al paciente. En Colombia están disponibles los tres inhibidores de integrasa, pero la experiencia por más años ha sido con Raltegravir, que está disponible desde 2008.
Discusión
La evolución de la caída de carga viral entre los controladores virémicos y los pacientes con evolución típica, solo parece ser distinta en la segunda fase de la evolución de la enfermedad29, lo que hace pensar que se trata de pacientes que no difieren mucho entre sí.
Por otro lado, los CE verdaderos, son un grupo específico de sujetos con cargas virales indetectables, la mayoría de los cuales no mostrarán perdida de CD4+ a lo largo de los años32. Para los verdaderos controladores elite, no se ha demostrado que el tratamiento tenga beneficio sobre su riesgo de transmisión a las parejas, los estudios más extensos donde se ha evaluado la TAR como prevención no se enfocan a los CE,8 lo que elimina este factor como una posibilidad para inclinar la balanza hacia el inicio de TAR en ellos.
Esta revisión aclara la diferencia entre los pacientes controlados con medicación al compararlos con los CE, en aspectos como morbilidad y frecuencia de hospitalizaciones derivadas de eventos no asociados a SIDA como enfermedad mental y coronaria41, soportando la evidencia de una mayor activación inmune en ellos, pero no encontramos información que sustente el que una terapia temprana disminuya ese riesgo.
Los CE tienen cargas virales en suero, por debajo de los límites de detección de los métodos comerciales46; la replicación viral podría estar ocurriendo en ellos de forma subrepticia en mayor número en el sistema nervioso central donde no se mide de forma sistemática, generando daños a largo plazo, cuyo pronóstico teóricamente podría ser mejorado con el inicio de una TAR con buena penetración, no obstante este concepto no puede ser probado pues no hay estudios que evalúen la carga viral en líquido cefalorraquídeo en CE.
Cuando iniciamos tratamiento antirretroviral en pacientes con evolución típica, los fenómenos de activación inmune e inflamación continúan de forma residual y esto parece ser similar en los CE tratados. (Tabla 2) Hay problemas adicionales como que la mayoría de los CE son pacientes que no quieren iniciar tratamiento antirretroviral pues han sido evaluados por años y se les ha dicho que no requieren terapia, lo que hace que en el momento en que se decida iniciar TAR, se genere un reto para la adherencia inmediata y futura, que implica para el médico, una decisión más crítica en la búsqueda de fármacos con la menor probabilidad de abandono por intolerancia y eventos adversos.
Las guías del departamento de salud de los Estados Unidos consideran en uno de sus apartes, el inicio de la terapia antirretroviral en los CE cuando se presente caída en los recuentos de CD4, y el monitoreo estrecho de los casos estables6, sin embargo, las guías Europeas (EACS) no hacen una recomendación puntual respecto a esto excepto la afirmación de que estos casos podría ser la excepción para iniciar TAR5 pero ninguna de las dos guías, hace una recomendación específica sobre el tratamiento a utilizar. Los medicamentos indicados en las guías más recientes incluyen inhibidores de integrasa, sin embargo, en los estudios revisados, el único inhibidor de integrasa utilizado fue Raltegravir (Tabla 2) y dado que no existen recomendaciones específicas para estos casos, es posible que lo prudente, sea seguir las indicaciones para pacientes típicos, es decir con la presencia en primera línea de un inhibidor de integrasa y considerando tres factores adicionales: la penetración al sistema nervioso central del medicamento, la experiencia publicada y la mejor tolerabilidad esperada.
Por otro lado, es necesario hacer consideraciones adicionales de elementos que son difíciles de medir dado el bajo número de casos, como costos del tratamiento y el seguimiento clínico y de laboratorio necesariamente asociados a la TAR.
Resultados
Los pacientes virémicos que tradicionalmente venían siendo consideraros como controladores, progresan a enfermedad avanzada en ausencia de tratamiento aunque de forma más lenta que los progresores típicos; la información consultada sugiere que se considere estos pacientes, es decir los llamados controladores virémicos o controladores no elite o no progresores a largo plazo, como pacientes que simplemente tienen una enfermedad que en ellos progresa más lento que en los pacientes típicos pero que deben ser tratados con las mismas indicaciones que cualquier otro paciente.
Con respecto al tratamiento, si bien es posible que otros inhibidores puedan ser empleados, no hay experiencia con ellos en CE, y de acuerdo con esta búsqueda, el pronóstico más favorable a nivel de eventos adversos y efectos neuro-psiquiátricos en todos los casos, pero especialmente en las mujeres y pacientes de más edad, favorece al Raltegravir sobre el Dolutegravir y Elvitegravir50, con la ventaja adicional de que está incluido en las guías oficiales de Colombia1.
Es posible que un análisis juicioso con la participación del paciente, sobre las terapias disponibles actualmente y la escasa evidencia sobre el beneficio de tratar, vinculando la información publicada sobre tolerancia y eventos adversos, sería lo más prudente antes de tratar o no; mientras se revela más información que permita tomar decisiones más fundamentadas. Los pacientes CE están por lo general más dispuestos a iniciar un tratamiento experimental, sea temporal o permanente, que una terapia antirretroviral convencional pues algunos han sido evaluados en consulta por años, y la mayoría están apropiados del concepto basado en las guías de años anteriores, de que tienen una condición clinica especial que en cierta forma los hace invulnerables al daño producido por ella, por lo que la educación sobre la condición de CE es de gran importancia.
Factores adicionales como una disminución de la relación CD4:CD8, la edad del paciente, el riesgo cardiovascular, otros problemas metabólicos y asociados a envejecimiento, así como su disposición a iniciar TAR, pueden ayudar al clínico a tomar una decisión sobre iniciar o no en los CE mientras se dispone de más información al respecto.














