Introduccion
Los Virus del Papiloma Humano (VPH) son un grupo de oncovirus sin envoltura, cuyo genoma es una molécula de ADN de doble cadena circular. Infectan epitelio estratificado cutáneo y mucoso en donde induce lesiones proliferativas benignas que en algunos casos pueden progresar a cáncer1,2. Hasta la fecha se han identificado más de 40 tipos mucoso trópicos, los cuales han sido clasificados de alto riesgo (AR) o bajo riesgo (BR) de acuerdo a su potencial carcinogénico. Según la Agencia Internacional para la Investigación del Cáncer (IARC, siglas en inglés) el grupo de AR se compone de 14 genotipos de VPH: VPH-16, -18, -31, -33, -35, -39, -45, -51, -52, -56, -58,-59, -68, y 82; un grupo de posible riesgo oncológico incluye siete genotipos: VPH-26, -53, -66, -67, -70, -73, y -72; y un grupo de BR en el que se encuentran el VPH-6 y -113,4. Las infecciones por este agente viral pueden ser únicas o múltiples con infección simultánea por más de un genotipo de VPH, siendo estas últimas asociadas con grados severos alteración histológica e incremento de la persistencia de la infección5-7.
El cáncer cervical (CC) es el cuarto tipo de cáncer más común alrededor del mundo en población femenina8, y estudios epidemiológicos han identificado al VPH como el principal agente causal necesario3,9,10. El CC está precedido generalmente por una serie de cambios histológicos que se caracterizan microscópicamente por manifestaciones que van de la atipia celular a diversos grados de displasia o de Neoplasia Intraepitelial Cervical (NIC) antes de progresar a carcinoma invasor11. No existen síntomas específicos ni características clínicas que indiquen la presencia de displasia cervical, razón por la cual métodos de tamización como la citología cérvicouterina han permitido la identificación oportuna de lesiones potencialmente malignas, mediante un examen microscópico de las células cervicales denominado prueba de Papanicolau. Sin embargo, el diagnóstico final de NIC se establece mediante un examen histopatológico de biopsia cervical. Este procedimiento permite determinar la presencia y grado de la neoplasia en función de la diferenciación, maduración y estratificación celular11,12. Actualmente el sistema Bethesda, nomenclatura histopatológica propuesta en 1988 por el Instituto Nacional de Cáncer de los Estados Unidos13 incorporó nuevos conceptos citológicos para unificar la terminología empleada en el diagnóstico final de NIC. Este sistema propone la utilización del término de Lesiones Escamosas Intraepiteliales (LEI) con dos grados: LEI de bajo grado (LEI-BG) y LEI de alto grado (LEI-AG). Esta clasificación ubica a NIC 1 en la categoría LEIBG; mientras la categoría LEI-AG abarca NIC 2 y NIC 313.
Con relación a la prevención primaria del CC, hay actualmente tres vacunas comerciales que dan protección en contra del VPH: Cervarix, Gardasil_4 y Gardasil_914-16. Estas vacunas protegen contra los genotipos VPH-16 y -18 responsables del 70% de los CC. Además, la vacuna Gardasil_4 protege contra los genotipos de VPH-6 y -11. Igualmente, la vacuna Gardasil_9 ayuda a prevenir la infección por los cuatro genotipos del VPH previamente mencionados más otros cinco genotipos de alto riesgo: VPH-31, -33, -45, -52 y -58, los cuales son los responsables de un 20% adicional de CC14 por lo que se sugiere que la vacuna Gardasil 9 podría evitar un 90% de los CC. En Colombia, desde el 2012 el Ministerio de Salud y Protección Social de Colombia en equipo con los Programas Ampliados de Inmunización (PAI) de las secretarías de salud empezaron a implementar la vacunación gratuita contra VPH con la vacuna Gardasil_4, la cual se administrada a niñas escolarizadas de sexto a once grados y no escolarizadas entre los 9 a 17 años, con un esquema de vacunación de 0 y 6 meses17,18.
En el 2014 el Ministerio de Salud y Protección social de Colombia presento una nueva guía de práctica clínica para la prevención secundaria del CC mediante la detección y manejo de lesiones potencialmente malignas de cuello uterino con algoritmos que se aplican según la edad de la paciente19. Para mujeres de 30 años o más, el algoritmo propone que se realice la tamización primaria con prueba ADN-VPH (Figura 1), si la prueba tiene un resultado negativo, la mujer podrá hacerse el cribado nuevamente con prueba ADN-VPH transcurrido 5 años. En oposición, si la prueba ADN-VPH es positiva, la mujer debe realizarse la prueba de citología. A continuación, si la prueba citológica tiene un resultado positivo, a la paciente se le debe realizar una prueba colposcópica, y según el hallazgo histopatológico, se le debe dar manejo a la lesión precancerosa. En el caso contrario, si el resultado de la citología es negativo, la mujer podrá hacerse el tamizaje con prueba ADN-VPH transcurrido 18 meses, tiempo suficiente para saber si el sistema inmune pudo resolver la infección por VPH en la región cervical y eliminarlo o en caso contrario que la infección persista, la paciente se le debe realizar la prueba colposcópica sin necesidad de citología (Figura 1). Para mujeres entre 25 a 30 años de edad, el algoritmo propone una citología cérvico-uterina anual como principal estrategia de tamización primaria. Si se encuentra alguna anormalidad celular, la paciente continúa con la prueba de ADN-VPH, y seguir dependiendo de los resultados con los pasos que propone la guía. Para mujeres menores de 25 años se propone realizarse la citología anual después de 3 años de inicio de vida sexual o bajo criterio medico de población en riesgo.
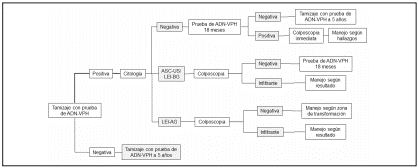
Figura 1. Pasos para tamizaje y diagnóstico de lesiones precancerosas de cuello uterino en mujeres de 30 años o más, según la nueva Guía Práctica del Ministerio de Salud y Protección Social de Colombia. Para mujeres entre 25 a 30 años de edad, la guía propone un tamizaje por citología cérvico-uterina anual y si la mujer es menor de 25 años se propone realizarse la citología anual después de 3 años de inicio de vida sexual o bajo criterio médico. La figura fue tomada y modificada de la Guía de práctica clínica para la detección y manejo de lesiones precancerosas de cuello uterino, Guía No. 44, Anexo 1, algoritmo 2 (19)
En la presente investigación se determinaron los porcentajes de las lesiones precancerosas de cuello uterino en un grupo de mujeres que previamente habían sido diagnosticadas positivas por la prueba ADN-VPH, siguiendo los pasos de la Guía Práctica Clínica para la detección y manejo de lesiones precancerosas de cuello uterino del Ministerio de Salud y Protección Social de Colombia del 2014.
Metodos
Tipo de estudio
El presente estudio es un análisis exploratorio descriptivo transversal de una base de datos de la unidad de patología cervical de la Red de Salud Ladera E.S.E. de la secretaría de Salud del Municipio de Santiago de Cali, Colombia. Ésta contenía información sobre los resultados de las pruebas de ADN-VPH (genotipo y tipo de infección), citología y colposcopia, realizadas en 58 mujeres no vacunadas de 30 años o más para el periodo de octubre del 2018 a febrero del 2019, pertenecientes al régimen subsidiado. Para el análisis solo fueron incluidos los registros de las mujeres que habían autorizado el uso de sus resultados clínicos mediante lectura y firma de un consentimiento informado, el cual explicaba la finalidad del estudio.
Procedencia de la información de la base de datos
Las pruebas de ADN-VPH, citología cervical, y colposcopia fueron realizadas siguiendo el orden del algoritmo propuesto en la guía de práctica clínica para la prevención secundaria del CC para mujeres de 30 años o más (Figura 1). Personal asistencial y el medico patólogo de la red Ladera tomaron las muestras cervicales según los resultados obtenidos en cada prueba.
Las muestras fueron enviadas a laboratorios clínicos autorizados por la secretaria de salud del municipio del Santiago de Cali mediante convenios para la realización de la prueba ADN-VPH; y las lecturas cito-histológicas y patológicas.
La prueba de ADN-VPH fue realizada utilizando el sistema BD Onclarity™ HPV Assay y la plataforma BD Viper™ LT system (Becton, Dickinson and Company, Nueva Jersey, Estados Unidos). El BD Viper™ LT system integra los procesos de extracción, amplificación y detección automatizada de material genético de VPH utilizando el BD Onclarity™ HPV Assay, que permite la detección cualitativa de 14 genotipos de AR y de posible riesgo oncológico a partir de muestras cervicales de forma simultánea, mediante la amplificación de la región E6/ E7 del genoma viral y posterior hibridación con sondas específicas. Esta prueba informa a cerca de la presencia de seis genotipos de forma individual (VPH-16, -18, -31, -45, -51 y -52) y los ocho genotipos restantes en tres pequeños grupos: (-33, -58), (-35, -38, -68) y (-56, -59, -66). Para verificar la calidad de las muestras, el ensayo realiza la amplificación de una región del gen de β-globina humana como control interno.
La información de los resultados de las pruebas fue entregada en un archivo digital de hoja Excel, el cual contenía información la edad del paciente, los resultados de la prueba ADN-VPH (genotipo y tipo de infección), el resultado de la citología cervicouterina, y el diagnóstico de la colposcopia utilizando la clasificación de la Federación Internacional de Patología Cervical y Colposcopia (IFCPC) aceptada en el Congreso Mundial de Rio en el 2011.
Análisis estadístico
Las medidas de asociación entre los hallazgos de las pruebas clínicas de tamizaje y diagnóstico, y los genotipos que cubren las vacunas contra el VPH fueron evaluadas mediante la prueba chi cuadrado para los análisis 2x2 y con la prueba exacta de Fisher para los análisis 2 x R. El nivel de significación estadística fue establecido en 0,05. Los análisis estadísticos se realizaron con el programa STATA14 (Copyright 1985-2015 StataCorp LP).
Para el análisis, los resultados de la prueba de citología cervical fueron clasificados en positivos y negativos, y los resultados de la prueba de colposcopia en negativos para LEI, LEI-BG y LEI-AG. Para la clasificación del tipo de infección, los grupos de genotipos (-33, -58), (-35, -38, -68) y (-56, -59, -66), fueron clasificados como una infección múltiple sólo cuando se acompañaban de un genotipo o grupo de genotipos adicional, si se presentaban solo, la clasificación era indeterminada.
Resultados
En la figura 2, se grafican los porcentajes de los resultados de las pruebas de citología y colposcopia. De las 58 mujeres positivas para la prueba ADN-VPH, 33 fueron positivas para la prueba citológica cervical, para un 57%. De este grupo de mujeres, el examen de colposcopia diagnosticó siete negativas para LEI para un 21%; 11 con LEI-BG para un 33%; y 15 con LEI-AG para un 45%.
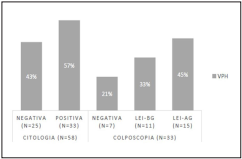
Figura 2. Porcentajes de lesiones precancerosas de cuello uterino diagnosticadas en mujeres de 30 años o más, de la ciudad de Cali, Colombia, entre octubre de 2018 y febrero de 2019. De las 58 mujeres positivas para la prueba ADN-VPH, 33 fueron positivas para la prueba citológica cervical. De estas 33 mujeres, el examen de colposcopia diagnóstico siete negativas para LEI , 11 con LEI-BG; y 15 con LEI-AG.
En la tabla 1, se observa los resultados de la prueba de ADNVPH, y la distribución de los genotipos y el tipo de infección del virus según el diagnostico histopatológico. En un 25,9 (n=15) se detectó un grupo de genotipos compuesto por el VPH-56, -59, y -66, siendo este porcentaje el mayor encontrado, seguido por el VPH-16 en un 19% (n=11). Con relación al tipo de infección del VPH, un 38% (n=22) de mujeres presentaron infecciones únicas; un 20% (n=12) presentaron infecciones múltiples; y en 24 mujeres no fue posible determinar el tipo de infección.
Tabla 1. Genotipos de los VPH de AR detectados en mujeres de la ciudad de Cali-Colombia, según el tipo de infección y el diagnostico histopatológico, entre octubre de 2018 y febrero de 2019.
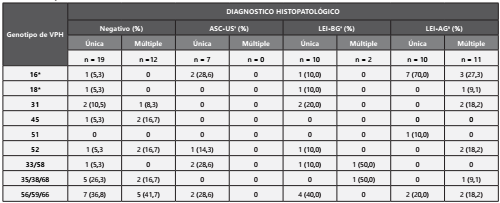
Los genotipos de VPH en negrita corresponden a los que actualmente protegen las vacunas comerciales de Gardasil.
* Genotipos de VPH que protege solo la vacuna Gardasil 4.
† atipias en células escamosas de significado indeterminado
‡ Lesiones Escamosas Intraepiteliales de Bajo Grado
§ Lesiones Escamosas Intraepiteliales de Alto Grado
El VPH-16 fue el genotipo de AR predominante respecto al diagnóstico histopatológico de LEI-AG, en un 46,7% en infección única, alcanzando al 66,7% en infecciones múltiples. En contraste, este mismo genotipo solo se detectó en un 8% de mujeres que no presentaron ningún tipo anormalidad celular cervicouterina. La distribución del grupo de genotipos con mayor detección para la prueba ADN-VPH, VPH-56, -59, y -66, con respeto al tamizaje de citología fueron del 28 % en las negativas o normales y en las positivas del 24,2 %. Dentro de la clasificación histopatología, según el resultado de la prueba de colposcopia, este grupo fue identificado en el 28,6% para ASC-US, 36,4% para LEI-BG y del 13,3% en las LEI-AG. Al comparar la distribución de detección del VPH- 16 con el grupo de genotipos VPH-56, -59, y -66, según los resultados histopatológicos se encontraron diferencias estadísticamente significativas, valor de p = 0,028.
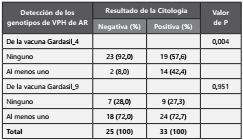
En la Tabla 2, se compara la distribución de los genotipos de VPH de AR para los cuales las vacunas comerciales de Gardasil_4 y _9 protegen, según los resultados de la prueba de citología. Se presento un bajo porcentaje de presencia de los genotipos de VPH de AR para los cuales la vacuna Gardasil_4 protege en las mujeres con resultados negativos de citología (8%) en comparación con las mujeres con citología positiva (42,4%). Esta diferencia fue estadísticamente significativa, valor de p = 0,004. Con relación a los genotipos de VPH de AR para los cuales la vacuna Gardasil_9 protege, tanto en mujeres con citología negativa como positiva, mostraron porcentajes similares y mayores al 70%.
Tabla 2. Distribución de los genotipos de VPH de alto riesgo (AR) para los cuales las vacunas de Gardasil protegen según los resultados de la prueba de citología cervical en mujeres de la ciudad de Cali, Colombia, entre octubre de 2018 y febrero de 2019
En la Tabla 3, se observa la distribución de los genotipos de VPH-AR que las vacunas comerciales de Gardasil_4 y _9 protege según los resultados de la colposcopia. Se presentó un alto porcentaje de presencia de los genotipos de VPH de AR para los cuales la vacuna Gardasil_4 brinda protección en las mujeres con resultados de LEI-BG, en un 66,7% en comparación con las mujeres con resultado negativo o con LEI-BG, 28,6% y 18,9%, respectivamente. Esta diferencia fue estadísticamente significativa, valor de p = 0,033. Con relación a los genotipos de VPH de AR para los cuales la vacuna Gardasil_9 protege, las mujeres mostraron porcentajes similares en sus resultados de colposcopia, siendo estos mayores al 60 por ciento.
Tabla 3. Distribución de los genotipos de VPH de alto riesgo (AR) para los cuales las vacunas de Gardasil protegen según los resultados de la prueba de colposcopia cervical en mujeres de la ciudad de Cali, Colombia, entre octubre de 2018 y febrero de 2019
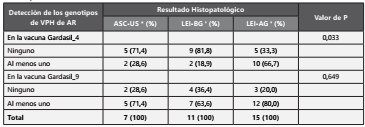
* atipias en células escamosas de significado indeterminado
† Lesiones Escamosas Intraepiteliales de Bajo Grado
‡ Lesiones Escamosas Intraepiteliales de Alto Grado
Discusión
Desde 1999 se identificó la infección por el VPH como una causa necesaria para el desarrollo de cáncer cervical y lesiones precancerosas20. Actualmente, se sabe que el 80% de las mujeres sexualmente activas adquirirán una infección por VPH durante su vida; pero solo una pequeña proporción progresará y desarrollará LEI -BG y LEI-AG y finalmente cáncer invasivo1. Una serie de genotipos han sido detectados de forma más prevalente en todos los estadios de lesión cervical21, algunos de los cuales han sido cubiertos por algunas de las vacunas profilácticas contra el VPH licenciadas a la fecha, con lo cual se espera disminuir a mediano y largo plazo la incidencia de cáncer cervical a nivel mundial22.
En Colombia, para el 2018 la tasa de incidencia de CC fue del 15.3 por cada 100.000 mujeres, ubicándose como la cuarta causa de muerte por cáncer en población femenina23. A nivel nacional, el Valle del Cauca presentó una tasa cruda de incidencia de 23.2 por 100.000 mujeres en el periodo 2007 a 2011, y en 2018, el registro poblacional de Cáncer de Cali, reportó una tasa cruda de incidencia del 17.7, mostrando un claro descenso, probablemente a causa de la implementación de los programas de prevención y diagnóstico temprano, iniciados en los años sesenta con la citología cérvico-uterina como técnica de tamización primaria. Actualmente, el país ha avanzado en la implementación de nuevas alternativas para lograr disminuir la incidencia y mortalidad de CC, como la prueba de ADN-VPH y técnicas de inspección visual.
La guía de práctica clínica para la detección y manejo de lesiones precancerosas de cuello uterino, publicada en 2014 por el Ministerio de Salud y Protección, acoge estas estrategias y plantea nuevas recomendaciones de tamización, clasificación diagnóstica y manejo clínico de población femenina entre los 25 a 65 años. No obstante, el impacto de su implementación sobre el diagnóstico oportuno del CC y lesiones precancerosas, es desconocido e investigaciones al respecto, permitirían establecer el desenlace de las recomendaciones planteadas en la guía.
En el presente estudio, se evaluó la concordancia entre la presencia de lesiones cérvico-uterinas identificadas mediante citología y colposcopia, y los resultados de genotipificación de la prueba de ADN-VPH de 68 pacientes de 30 años o más, no vacunadas, diagnosticadas de acuerdo al algoritmo de prevención de CC propuesto por la guía en mención (Imagen 1), y sus implicaciones sobre las estrategias de prevención primaria del CC. Este grupo de mujeres fue atendido en la Red de Salud de Ladera - E.S.E, que brinda cobertura a las comunas: 1, 3, 17, 18, 19 y 20, que comprenden un aproximado 636.177 habitantes, el 26% del total de la población caleña24. Según el último informe de la Secretaría de Salud Municipal, esta Empresa Social del Estado, está a cargo de aproximadamente el 12% de las lecturas citológicas del municipio de Santiago de Cali25.
En el presente estudio, el porcentaje de citologías positivas o anormales fue del 57% y lesiones de alto y bajo grado fueron identificados mediante colposcopia en un 33 y 45%, respectivamente, en mujeres previamente positivas para la prueba ADN-VPH; lo que evidencia una concordancia en la detección de VPH a partir de ambos tipos de muestras, comprobando la utilidad de la detección molecular de VPH a partir de muestras citológicas como primera estrategia de tamizaje como lo plantea el algoritmo empleado19.
Respecto a los genotipos identificados, se observó alta frecuencia del VPH-16 y el grupo VPH-56, -59, -66; lo que en parte concuerda con estudios a nivel mundial que han reportado al VPH-16 como el genotipo más prevalente en todos los estadios de displasia cervical con tasas de detección que varían entre el 19,3% a 45,1%26,27. A nivel nacional, según el reporte sobre el VPH y enfermedades relacionadas para Colombia del Centro de Información sobre VPH y Cáncer ICO/IARC, el VPH-16 sigue siendo el genotipo más prevalente (41-43%) en LEI-BG y LEI-AG; mientras que los VPH-56 y -66 muestran una prevalencia acumulada de 25% y 6% en LEIBG y LEI-AG respectivamente28. Resultados similares fueron publicados por Trujillo y col., tras el análisis de muestras de colposcopia de pacientes con anormalidad citológica en la ciudad de Bogotá. En este estudio, el grupo VPH-56, -59, y -66 tuvo una tasa de detección del 24%29, confirmando su circulación en población colombiana con lesión cervical. Respecto a su significancia clínica, los genotipos en cuestión fueron detectados mayoritariamente en citologías negativas, ASC-US y lesiones de bajo grado, razón por la cual su constante detección debe ser analizada con detenimiento. Estudios de seguimiento permitirían identificar los tipos de infección establecidas por estos genotipos y las estrategias de manejo medico más adecuadas.
Infecciones múltiples por VPH han sido documentadas en una serie de estudios epidemiológicos, aunque su frecuencia varía ampliamente de acuerdo a la población estudiada30,31. Si bien el significado de las infecciones múltiples no ha sido bien establecido, se ha planteado una asociación con el desarrollo y progresión de neoplasia cervical, sugiriendo una interacción sinérgica entre los genotipos co-infectantes5-7. En nuestro estudio, fueron identificadas infecciones múltiples en el 20% de las muestras analizadas, resultados que concuerdan con estudios previos realizados en mujeres con anormalidad citológica cuya frecuencia fue reportada entre el 19 al 49,8%29,32,33.
La prevención primaria del CC realizada mediante la vacunación profiláctica, brinda protección frente a la infección por genotipos específicos. En Colombia es distribuida de forma gratuita la vacuna 4-valente, que protege frente a la infección por los genotipos -6, -11, -16 y -18, a niñas y adolescentes entre los 9 a 18 años de edad. Una nueva vacuna, licenciada por la FDA desde el año 2014, incluye cinco genotipos adicionales asociados al CC, sin embargo, hasta la fecha no han sido realizados estudios de costo-efectividad para su implementación en los programas locales de vacunación. Nuestro estudio encontró una alta tasa de detección de genotipos cubiertos por la vacuna 4-valente en muestras de citologías anormales y biopsia guiada por colposcopia respecto a los genotipos incluidos en la vacuna 9-valente, siendo esta diferencia significativa. Poniendo en evidencia que, a nivel nacional, las mujeres con lesiones cervicales presentan con mayor frecuencia infecciones por los VPH-16 y -18, cubiertos por la vacunación actual.
En el 2013 fue publicado un estudio del instituto nacional de cancerología sobre las barreras para la implementación de la prueba ADN-VPH como técnica de tamización primaria para cáncer de cuello uterino en un área demostrativa en Colombia34, donde se identificaron las siguientes: 1) la infección por VPH se asocia a una enfermedad venérea; 2) barreras epidemiológicas: la ausencia de un adecuado registro de diagnóstico definitivo de lesiones preneoplásicas; 3) barreras del comportamiento del sistema, tales como la no centralización de la lectura de citologías, laboratorios no habilitados que prestan servicios y la no estandarización de la colposcopia ni el tratamiento; 4) barreras educacionales: los profesionales de la salud sobreestiman la sensibilidad de la citología y les preocupa demasiado la infección por VPH en mujeres menores de 30 años, y 5) barreras administrativas de acceso a la colposcopia y a la biopsia de lesiones preneoplásicas. En el presente estudio las pacientes asistieron a la unidad de patología cervical de la Red de Salud Ladera E.S.E. de la secretaría de Salud del Municipio de Santiago de Cali, la cual cuenta con un programa de tamización y diagnostico estandarizado, en donde las muestras son enviadas a laboratorios clínicos autorizados por la secretaria de salud del municipio del Santiago de Cali, con el fin de prestar un servicio centralizado para las pruebas de VPH-ADN, de lecturas de citología y colposcopia. Sin embargo, aún se presenta las barreras educacionales, en donde los profesionales de la salud aun sobreestiman la sensibilidad de la citología y no remiten la prueba de ADN-VPH a mujeres mayores de 30 años o en riesgo de presentar una lesión cervico-uterina.
Entre las limitaciones del análisis
En conclusión, el presente estudio, mostró evidencia sobre la utilidad de la implementación de algoritmo diagnóstico para mujeres de 30 años o más de la Guía de Práctica Clínica para la detección y manejo de lesiones precancerosas, demostrando la utilidad de la detección de VPH a partir de muestras citológicas como primera estrategia de tamización y la genotipificación como herramienta clave en la evaluación de las estrategias de prevención primaria empleadas actualmente en relación a los genotipos circulantes en la población colombiana. Finalmente, el análisis de un mayor tamaño poblacional, permitiría una mejor evaluación de las variables estudiadas, así como determinar la necesidad de implementar una nueva estrategia de prevención primaria acorde a las dinámicas epidemiológicas de nuestro país.














