Introducción
La infección por el virus Zika (ZIKV) es una enfermedad causada por un arbovirus identificado por primera vez en 1947 en el valle de Zika, Uganda1 perteneciente al género flavivirus. La infección por virus Zika es una enfermedad caracterizada por fiebre, erupción cutánea, malestar general y cefalea, que suele concluir en 7 días, siendo en su mayoría asintomática2.
La razón por la cual la Organización Mundial de la Salud (OMS) lo declaró una emergencia de salud pública de preocupación internacional en febrero de 2016 se debe principalmente a su asociación con defectos congénitos en forma de microcefalia primaria o congénita; definida como aquel perímetro cefálico menor para la edad y sexo del niño en cuestión, cuya disminución en el tamaño del encéfalo está asociado a un pobre desarrollo cerebral.
Debido a un aumento de casos de microcefalia asociado a infección por Zika, el estudio de esta enfermedad cobra valor epidemiológico, siendo Colombia el segundo país con el mayor número de casos de Zika reportados en toda Latinoamérica3. Solo en el año 2016 se han reportado 8.826 casos confirmados y 94.112 sospechados por clínica. En el año 2017, se notificaron 2.130 casos de enfermedad por virus Zika de los cuales 1693 casos fueron confirmados por clínica (79,5%), 57 casos fueron confirmados por laboratorio (2,7%) y 380 casos sospechosos (17,8%). La notificación de casos disminuyó en un 97,6% comparado con la notificación del año 2016. Según el Instituto Nacional de Salud (Colombia), al periodo epidemiológico XIII del año 2018, se notificaron 857 casos de enfermedad por virus Zika, de los cuales 601 casos fueron confirmados por clínica (70.1%), 6 confirmado por laboratorio (0.7%), 250 casos sospechosos (29.2%). En el año 2019 (semana epidemiológica 1 a la semana 29) se han reportado 284 casos de infección por Zika, de los cuales el 76.4 % (217) fueron confirmados por clínica, 1.4 %4 confirmados por laboratorio y el 22.2% (63) sospechosos4.
Aunque Colombia no se encuentra actualmente en estado de epidemia para ZIKV, se ha vuelto endémica con transmisión continua. En este sentido, los departamentos que cuentan con la mayoría de casos reportados en los últimos años son Valle del Cauca, Santander, Tolima, Cundinamarca y Meta, seguido de Atlántico, Córdoba y el Distrito de Cartagena5. Así mismo de la semana 01 de 2016 a la semana 52 de 2018 se han confirmado 359 casos de microcefalia y otros defectos congénitos del Sistema Nervioso Central asociados a virus Zika4. En este artículo se reporta el caso de un recién nacido el cual presenta microcefalia, en el contexto de madre con antecedente de enfermedad por virus Zika durante el embarazo. El respaldo del diagnóstico en este caso está basado en elementos clínicos, radiológicos y moleculares.
Caso Clínico
Se presenta un recién nacido, sexo masculino, de 20 días de nacido, procedente de un barrio de la zona sur de Cartagena, Colombia. Nacido con 40 semanas de gestación, con un peso al nacer de 3.350 gramos. Ingresa con cuadro clínico de 5 días de evolución consistente en rinorrea hialina escasa y fiebre de 38° C, por lo que se decide hospitalizar para iniciar manejo.
Al examen físico se encuentra perímetro cefálico de 33 cm (-2,93), evaluación neurológica con funciones motoras y sensitivas sin déficit aparente. FC 122/min, FR 32/min, peso 4210 gramos, una talla de 51 cm sin ningún otro hallazgo patológico. Se le ordena administrar ampicilina 210 mg IV cada 8 horas, amikacina 60 mg IV cada 24 horas, acetaminofén 2 cc cada 6 horas y lactancia materna exclusiva.
Al siguiente día el cultivo de sangre que fue positivo para Cocos Gram Positivos, posteriormente confirmado como Staphylococcus aureus, y un urocultivo negativo. El TAC de cráneo simple reportó lo siguiente: diámetros cefálicos disminuidos, finas calcificaciones residuales en región frontalparietal, y cambios atróficos cerebrales subcorticales, reportándose microcefalia, calcificaciones cerebrales e hipoplasia del cuerpo calloso. Los resultados de IgG e IgM para Toxoplasma y Rubeola negativo, VDRL no reactivo, serología y PCR positiva para Zika. Al quinto día, oftalmología da como resultado al examen físico apreciación de córnea y cristalino claro en ambos ojos, sin evidencia de alteración de macula.
Finalmente, al sexto día, el paciente presenta mejoría del cuadro clínico y hemodinamicamente estable. Se decide dar el alta médica con diagnósticos de Sepsis Neonatal Tardía y Microcefalia Congénita, con controles periódicos por pediatría, neurología pediátrica e infectología pediátrica. La revisión de la historia clínica contó con la autorización y aval del Hospital Infantil Napoleon Franco Pareja de la Ciudad de Cartagena (Colombia), siguiendo las normas de la Resolución 008430 de 1993 y la Resolución 2378 de 2008 del Ministerio de Salud y Protección Social.
Discusión
La pregunta que ha surgido después del brote ocurrido entre 2014 a 2016 sería: ¿Por qué ZIKV solo en el brote de los últimos años comenzó a causar microcefalia a pesar de que ha existido por muchos años? Una de las teorías aceptadas, es que el virus probablemente evolucionó del linaje africano a través de mutaciones genéticas virales que condujo a una patogenicidad viral aumentada. Un ejemplo es la cepa brasileña, la cual contiene mutaciones en tres de las proteínas traducidas de su ARN, las cuales participan en los mecanismos de evasión de la respuesta inmune2.
Al igual que otros flavivirus, es probable que el ZIKV ingrese en las células huésped a través de la endocitosis iniciada por la interacción de glicoproteínas de la envoltura del virus con los receptores de la superficie celular, incluida la familia TAM de los receptores de tirosina quinasas (TYRO3, AXL y MER) facilitando la entrada del flavivirus2,6 (Figura 1).
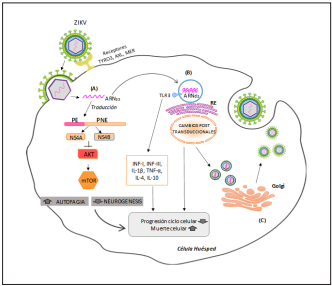
Figura 1 Aspectos moleculares de la Infección por Zika y Microcefalia. (A). Las partículas del virus se fusionan con la membrana endosomal liberando el ARN genómico en el citoplasma de la célula huésped. El genoma de ZIKV (ARNss) codifica una poliproteína única, la cual es escindida después de la traducción por el huésped y las proteasas virales en tres proteínas estructurales (Cápside [C], Premembrana [prM] y Envoltura [E]) y siete proteínas no estructurales (NS1, NS2A, NS2B, NS3, NS4A, NS4B y NS5). La NS4A y NS4B inhiben la via Akt-Mtor. (B). La replicación viral en la superficie del RE, da como resultado un genoma de ARNds sintetizado a partir del ARNss genómico, este ARN es detectado por el receptor endosomal TLR3, activando la producción de INF-I e INF-III, perturbando la neurogénesis y las vías apoptóticas, así como moléculas del sistema inmune. El genoma de ARNds se transcribe y se replica posteriormente, dando como resultado genomas virales ARNss adicionales. (C). Las partículas de virus inmaduros se ensamblan dentro del ER, se transportan a través de la red trans-Golgi y luego las nuevas partículas del virus se liberan en el entorno extracelular, donde pasan a un nuevo ciclo de vida infeccioso. ZIKV: virus Zika. ARNss: ARN de cadena sencilla. ARNds: ARN de doble cadena. PE: proteínas estructurales. PNE: proteínas no estructurales. Fuente: Elaborada por autores con la Herramienta Motifolio Inc.
Estos receptores candidatos para la infección por ZIKV, son muy expresados en células neuronales, permitiendo la fusión de las membranas viral y endosomal y la liberación de ARN viral (ARNv) en el citoplasma. El ARNv se traduce en una poliproteína, que se procesa de forma conjunta y posterior a la traducción por las proteasas virales y del huésped en proteínas estructurales y no estructurales6. Estudios recientes demuestran la capacidad de NS4A y NS4B (proteínas no estructurales) específicamente para inducir autofagia en células progenitoras neurales (NPCs), disminuyendo la fosforilación de Akt y posteriormente inhibe la actividad de mTOR promoviendo autofagia. La vía Akt-mTOR es necesaria para el crecimiento y la proliferación de las células madre adultas, específicamente las células madre neurales6.
Otra de las causas descritas en la literatura es que el ZIKV tiene la capacidad de activar al receptor TLR3 (Toll-like-Receptor 3), perteneciente a una clase de receptores endosómicos que reconoce el ARNds (ARN de doble cadena) en las células infectadas7. En un estudio realizado por Jason Dang y col8, el ZIKV disminuye los progenitores neurales en los organoides cerebrales humanos mediante la activación del receptor inmunitario innato TLR3. El análisis de la ruta de los cambios en la expresión génica durante la activación de TLR3 destacó 41 genes también relacionados con el desarrollo neuronal, lo que sugiere una conexión mecánica con la neurogénesis alterada8. Además, por medio de este receptor el virus provoca respuestas inmunitarias innatas que conducen a liberaciones de IFN tipo I y tipo III, que junto con otros mediadores inmunitarios proinflamatorios como el TNF-α, IL-4, IL-10, IL- 1β (Figura 1), desencadenan una respuesta inmune agresiva, que tiene el potencial de causar daño cerebral al aumentar la muerte neuronal y generar anomalías vasculares6,7.
En conjunto, el ZIKV infecta las NPCs in vivo y afecta el desarrollo del cerebro que resulta en la detención del ciclo celular, la apoptosis celular, la inhibición de la diferenciación, el adelgazamiento cortical y finalmente la microcefalia cuya severidad incrementaría en infecciones durante la gestación en el primer trimestre. No obstante, las anomalías congénitas podrían presentarse en infecciones durante el 3er trimestre del embarazo, como ocurrió en este caso, donde son más infrecuentes y asociados a procesos infecciosos en el feto7. Para la detección oportuna se recomienda sospechar de infección por ZIKV en una mujer embarazada, cuando está presente un exantema maculopapular, independientemente de la edad gestacional y después de haber descartado otras causas infecciosas y no infecciosas. La confirmación diagnóstica se realizará mediante serología por muestra tomada entre 3 a 5 días del inicio de los síntomas9. Los síntomas del síndrome ZIKV congénito detectables por ecografía incluyen: atrofia cerebral, calcificaciones intracraneales, disgenesia del cuerpo calloso, que fueron evidentes en este caso, así como cisterna magna agrandadas y hemisferios cerebrales asimétricos9.
Consecuentemente, esta entidad potencialmente catastrófica no cuenta con un tratamiento en específico, lo que significa que los programas de promoción y prevención cobran aún más importancia. El diagnóstico oportuno ante una sospecha clínica en la mujer embarazada o el neonato, el seguimiento estricto y el control preciso del neurodesarrollo y de las facultades cognitivas del individuo son el pilar de un tratamiento multifacético10. Por lo tanto, es necesario anteponer el diagnóstico oportuno como la terapia más efectiva para salvar en la medida de lo posible, un daño que aparenta ser irreversible.
Lugar donde se llevó a cabo el trabajo: Hospital Infantil Napoleón Franco Pareja (Cartagena, Colombia)














