Introducción
Las enfermedades infecciosas aparecen entre los motivos de consulta más frecuentes a los servicios de salud1 ; en los servicios de urgencias dichas patologías requieren la instauración de medidas terapéuticas eficaces y oportunas, para restablecer la salud de los pacientes. Algunos de los fármacos prescritos con este objetivo son los antimicrobianos, siendo el segundo grupo más frecuentemente formulado en este servicio2 . Dado que los resultados de los estudios microbiológicos pueden tardar entre 24 y 72 horas, en la mayoría de ocasiones el tratamiento antibiótico debe iniciarse de manera empírica, teniendo en cuenta la severidad del paciente, el foco de la infección, los microorganismos posiblemente implicados y, de estar disponible, el perfil de susceptibilidad local3 .
La prescripción inadecuada de antimicrobianos en el servicio de urgencias incrementa las tasas de mortalidad, exposición a reacciones adversas, los costos asociados a la atención en salud, y la selección de patógenos resistentes, aumentando la tasa de desenlaces adversos para los pacientes y la transmisión de microorganismos resistentes4,5.
Los programas de optimización de antimicrobianos (PROA) contribuyen al uso apropiado de los antibióticos, evitando los efectos indeseados de la prescripción inadecuada, enumerados previamente6-8. Uno de los elementos fundamentales para el funcionamiento de estos programas, es el conocimiento de la epidemiología local de la resistencia antimicrobiana, lo que permite la elaboración de guías institucionales que direccionen los tratamientos empíricos9 . Dado que la resistencia antibiótica presenta importantes variaciones geográficas y temporales, extrapolar datos epidemiológicos de unidades de cuidado intensivo (UCI) y hospitalización para generar recomendaciones terapéuticas en el servicio de urgencias resulta inadecuado, debido a que sobreestiman la resistencia de este último, por lo que se justifica la elaboración de perfiles microbiológicos propios de cada servicio10,11.
En el año 2017, se conformó el Grupo de Resistencia Antibiótica de Manizales (GRAM), ante la necesidad de generar actividades propias de educación, investigación y vigilancia en resistencia antimicrobiana en el departamento de Caldas; a través de este esfuerzo interinstitucional y multidisciplinario se han realizado, entre otras, actividades de acompañamiento y construcción de informes de resistencia antimicrobiana en diferentes centros de salud regionales. El objetivo del presente artículo es describir el perfil microbiológico y la resistencia antibiótica de los microorganismos más frecuentes en los aislamientos urinarios obtenidos de adultos en los servicios de urgencias de 7 instituciones de tercer nivel de la ciudad de Manizales, durante el año 2018.
Materiales y métodos
Este es un estudio descriptivo, de corte transversal de datos obtenidos a través de la Dirección Territorial de Salud de Caldas (DTSC) entre enero y noviembre del 2018. Se recolectaron los resultados de las pruebas de susceptibilidad a los antimicrobianos obtenidos de cultivos de muestras clínicas de pacientes adultos que consultaron al servicio de urgencias de 7 instituciones de tercer nivel de Manizales.
La información fue exportada desde los equipos automatizados de los laboratorios de microbiología a Excel®, posteriormente se analizaron mediante el software WHONET 5.6 de la OMS, siguiendo los lineamientos para el control de calidad de las bases de datos de resistencia bacteriana de la Alcaldía mayor de Bogotá12, las instrucciones del Instituto Nacional de Salud y los puntos de corte establecidos por el Instituto de Estándares Clínicos de Laboratorio (CLSI) M100-S28 de 2018 para la realización de pruebas de susceptibilidad antimicrobiana13,14. Se analizó únicamente el primer aislamiento de cada paciente, se establecieron las muestras prevalentes, y se determinaron las tasas de resistencia de los microorganismos aislados, en aquellos casos en que se obtuvieron 30 o más aislamientos.
Según la resolución 8430 de del 4 de octubre de 1993 el estudio se clasificó como una investigación sin riesgo y no requirió consentimiento informado ni aval por comité de ética; el manejo de los datos se llevó a cabo según lo establecido en el convenio de confidencialidad firmado entre la DTSC y GRAM.
Resultados
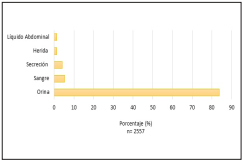
Desde enero hasta noviembre de 2018 se obtuvieron 2557 aislamientos microbiológicos de los servicios de urgencias de las instituciones analizadas, la muestra más frecuente fue orina con 1991 aislamientos (78%), seguido por secreción con 138 aislamientos (5%) y sangre con 122 aislamientos (5%) (Gráfica 1). Únicamente los microorganismos de las muestras de orina alcanzaron un número significativo de aislamientos para analizar las tasas de resistencia.
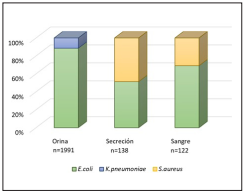
El microorganismo más frecuentemente aislado fue E. coli con un 62%, seguido de K. pneumoniae (8%), P. mirabilis (5%) y P. aeruginosa (4%) (Gráfica 2). Los aislamientos de E. coli y K. pneumoniae presentaron un porcentaje de betalactamasas de espectro extendido (BLEE) del 8%, con una resistencia promedio a cefalosporinas de tercera generación (C3G) del 14% y 22%, respectivamente. En el caso de E. coli para cefazolina la resistencia fue del 17% y de 35% para la cefalotina; en K. pneumoniae el número de datos para cefazolina fue insuficiente, y la resistencia a cefalotina fue del 29%. La resistencia a ampicilina/sulbactam fue del 33% y 36%, a ciprofloxacina del 26 y 19% y a trimetoprim/sulfametoxazol del 42% y 27%, para E. coli y K. pneumoniae, respectivamente.
La resistencia a piperacilina/tazobactam fue del 2% para E. coli, mientras que para K. pneumoniae la resistencia fue del 14%. En cuanto a carbapenémicos, en E. coli se evidenció un porcentaje de resistencia menor al 1%, y K. pneumoniae presentó una resistencia del 9% para imipenem y meropenem, y del 5% para ertapenem%.
La resistencia de E. coli para nitrofurantoína fue del 4%, y para fosfomicina del 0%; mientras K. pneumoniae presentó resistencia a nitrofurantoína del 33 %La resistencia de E. coli y K. pneumoniae para amikacina fue del 1% y para gentamicina fue del 15% y el 8%, respectivamente. (Tabla 1).
Tabla 1 Tasas de resistencia en aislamientos de orina de urgencias adultos 2018
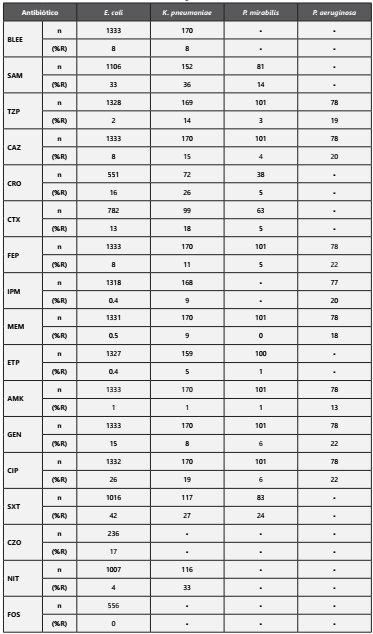
BLEE: Betalactamasa de espectro extendido; SAM: Ampicilina/Sulbactam; TZP: Piperacilina/Tazobactam; CAZ: Ceftazidima; CRO: Ceftriaxona; CTX: Cefotaxima; FEP: Cefepime; IPM: Imipenem; MEM: Meropenem; ETP: Ertapenem; AMK: Amikacina; GEN: Gentamicina; CIP: Ciprofloxacina; SXT: Trimetropim/Sulfametoxazol; CZO: Cefazolina; NIT: Nitrofurantoina; FOS: Fosfomicina
En los aislamientos de P. mirabilis no se pudo determinar el porcentaje de BLEE por número insuficiente de datos, sin embargo, se encontró un promedio de resistencia a C3G del 5%. Para trimetoprim/sulfametoxazol, ampicilina/sulbactam y ciprofloxacina la resistencia fue del 24%, 14%, y 6%, respectivamente. La resistencia a carbapenémicos fue menor al 1%. (Tabla 1).
En cuanto a P. aeruginosa el 75% de los aislamientos fueron obtenidos de mayores de 65 años. La resistencia a piperacilina/tazobactam fue del 19%, a ceftazidima y cefepime mayor al 20% y para imipenem y meropenem fue en promedio del 19%. Para ciprofloxacina, la alternativa oral, se presentó una resistencia del 22% y para amikacina y gentamicina fue del 13 y 22%, respectivamente. (Tabla 1)
En los aislamientos de P. mirabilis no se pudo determinar el porcentaje de BLEE por número insuficiente de datos, sin embargo, se encontró un promedio de resistencia a C3G del 5%. Para trimetoprim/sulfametoxazol, ampicilina/sulbactam y ciprofloxacina la resistencia fue del 24%, 14%, y 6%, respectivamente. La resistencia a carbapenémicos fue menor al 1%. (Tabla 1)
En cuanto a P. aeruginosa el 75% de los aislamientos fueron obtenidos de mayores de 65 años. La resistencia a piperacilina/tazobactam fue del 19%, a ceftazidima y cefepime mayor al 20% y para imipenem y meropenem fue en promedio del 19%. Para ciprofloxacina, la alternativa oral, se presentó una resistencia del 22% y para amikacina y gentamicina fue del 13 y 22%, respectivamente. (Tabla 1)
Discusión
Al igual que en otras ciudades, los aislamientos de orina constituyeron la muestra más representativa de los servicios de urgencias de Manizales durante el 2018. La bacteriuria asintomática, la presencia de sondas y los cuadros clínicos inespecíficos, dificultan el diagnóstico de infecciones del tracto urinario (ITU), por lo que los PROA deben vigilar la adherencia a las indicaciones para realizar urocultivo y definir la pertinencia de uso de antibióticos15,16.
Debido a que E. coli y K. pneumoniae representaron el 75% de los aislamientos urinarios, y dadas las tasas de resistencia reportadas frente a ampicilina/sulbactam, trimetoprim/ sulfametoxazol y ciprofloxacina, su uso empírico puede relacionarse con fallos terapéuticos y su papel debería limitarse a la terapia dirigida, teniendo en cuenta el contexto del paciente17. Respecto a las cefalosporinas de primera generación (C1G), el CLSI recomienda el tamizaje de cefazolina en aislamientos urinarios para predecir eficacia de sus equivalentes orales, sin embargo, para E. coli se evaluó sólo en el 18% de los aislamientos y en 11% de los casos de K. pneumoniae; por el contrario, la cefalotina se probó en una proporción significativa de ambos microorganismos, a pesar de haber sido eliminado por el CLSI desde el 2010 por sobreestimar la resistencia 18. Por lo tanto, su uso debería restringirse para casos en los que sea reportada susceptibilidad en el antibiograma y se recomienda incluir la cefazolina en los paneles urinarios de la ciudad, atendiendo a las recomendaciones internacionales.
Existe discrepancia entre los resultados de BLEE y resistencia a C3G, siendo mayores las tasas de resistencia a estas últimas, lo que se puede explicar por la presencia de falsos negativos en las pruebas de BLEE, circulación de otros mecanismos de resistencia como AmpC plasmídicos, y la presencia de carbapenemasas. El puntaje de Tumbarello, ha sido validado en nuestro medio, en especial para descartar la presencia de BLEE, y debería ser utilizado para direccionar el manejo empírico en los diferentes servicios19,20.
Se evidenció una baja resistencia a piperacilina/tazobactam en los aislamientos de E. coli, K. pneumoniae y P. mirabilis, cabe resaltar que, la concentración inhibitoria mínima (CIM) de más del 90% de los aislamientos sensibles fue ≥16 µg/ml, lo que genera inquietud respecto a su uso, dado que algunos estudios han reportado fallas terapéuticas en infecciones por gérmenes productores de BLEE con CIM ≥ 8 µg/ml, especialmente en bacteriemias21,22, y la Asociación Panamericana de Infectología desaconseja su uso como terapia definitiva en infecciones de este tipo23, restringiendo el uso de piperacilina/tazobactam para aquellos aislamientos de E. coli con CIM <8 µg/ml. En los aislamientos de K. pneumoniae productora de BLEE o resistente a ceftriaxona se debe evitar su uso, ante la ausencia de datos clínicos sobre su eficacia23. En E. coli la resistencia a nitrofurantoína y fosfomicina se mantuvo menor al 4%, lo que respalda la recomendación como primera línea de manejo en las ITU bajas, no complicadas17. Se debe tener en cuenta que el método para determinar la CIM de la fosfomicina es el agar-dilución14, no la microdilución en caldo, y sus resultados no se pueden extrapolar a la eficacia de la fosfomicina/trometamol.
Finalmente en P. aeruginosa la resistencia a ceftazidima, cefepime, imipenem y meropenem fue mayor al promedio nacional, cabe recordar que la mayoría de estos aislamientos provenían de pacientes ancianos, en los que la exposición a tratamientos antibióticos y la manipulación de la vía urinaria, aunado a los múltiples mecanismos que posee esta especie podrían explicar las altas tasas de resistencia24,25. Por lo tanto, es necesario conocer el papel que pueden tener nuevas moléculas como ceftolozano/tazobactam, en el manejo de infecciones donde se sospeche P. aeruginosa multidrogoresistente (MDR)26 y ceftazidima/avibactam ante la presencia de serin-carbapenemasas26,27, por lo que, ambos antibióticos deberían incluirse en los paneles automatizados.
Conclusiones
Los servicios de urgencias poseen particularidades, que suponen que tener un perfil microbiológico propio sea una necesidad de primer orden. Los niveles de resistencia antimicrobiana evidenciados limitan el uso de ciertos antibióticos en el manejo empírico, como, por ejemplo, ampicilina/sulbactam, cefalosporinas de primera generación, trimetoprim/ sulfametoxazol y quinolonas en ITU; mientras antibióticos como la nitrofurantoína y la fosfomicina continúan siendo primera línea en ITU baja no complicada. Es importante individualizar los tratamientos, considerando la estratificación por severidad de la ITU, factores de riesgo para bacterias MDR, el uso de herramientas como el puntaje de Tumbarello, que, sumados a los hallazgos del presente trabajo, pueden contribuir a instaurar manejos empíricos más precisos. El uso de piperacilina/tazobactam en el manejo empírico de ITU complicada sigue siendo controversial, y debe estar sujeto a la severidad de la infección, la epidemiología local y el contexto de cada paciente.
Se requiere seguir vigilando la resistencia antimicrobiana local para conocer la tendencia de este fenómeno, y el diseño de un PROA en cada institución que permita la implementación de medidas de control de infecciones y resistencia antimicrobiana específicas para la ciudad.
Limitaciones
Entre de las limitaciones del trabajo se encuentran, que la base de datos no incluyó el método de recolección las muestras, tampoco datos clínicos de los pacientes, ni el recuento de unidades formadoras de colonias, impidiendo la diferenciación entre colonización, bacteriuria asintomática e ITU. Respecto a los antibiogramas, el tamizaje de fosfomicina por método automatizado y el uso de cefalotina para tamizar la resistencia a las C1G, limitan la confiabilidad de los resulta dos, por lo que se deben estandarizar los métodos en las instituciones participantes.