Introducción
La isoniazida (H) es un medicamento antituberculosis de primera línea de tratamiento, con potente actividad bactericida que inhibe la enoil-ACP reductasa, enzima requerida para la síntesis del ácido micólico1,2. La resistencia de Mycobacterium tuberculosis a este medicamento se relaciona principalmente con mutaciones en los genes kat G, inh A, ndh y ethA, que codifican las enzimas catalasa-peroxidasa, enoil-ACP reductasa, NADH deshidrogenasa y la monooxigenasa, respectivamente1,3.
Según la Organización Mundial de la Salud (OMS), la tuberculosis (TB) con resistencia a la isoniazida (Hr-TB) se refiere a las cepas de M. tuberculosis con resistencia a la H y susceptibilidad a la rifampicina confirmada in vitro4,5. Los promedios globales de Hr-TB fueron del 7,1% (IC 95%: 6,2-8,0%) en los casos nuevos de TB y del 7,9% (IC 95%: 5,9-10%) en los casos de TB tratados previamente6 . En Colombia, se realizó un estudio de vigilancia a la resistencia de M. tuberculosis a los fármacos antituberculosis entre los años 2004 y 2005, que mostró una prevalencia de 2,3% (IC 95%: 1,49-3,45) para HrTB en casos nuevos y 1,9% (IC 95%: 0,81-4,36) para casos previamente tratados7 .
A pesar que la distribución geográfica de la Hr-TB es heterogénea a nivel mundial, aproximadamente uno de cada siete casos incidentes de TB tiene resistencia a este importante medicamento de primera línea8 . Diversos estudios han demostrado que la Hr-TB compromete los resultados al tratamiento de la TB9, sin embargo en nuestro contexto la información de Hr-TB es limitada. El objetivo de este estudio fue describir las características clínicas y los desenlaces al tratamiento de los pacientes con diagnóstico de Hr-TB, atendidos en una institución del suroccidente colombiano entre el 2006 y 2018.
Materiales y métodos
Diseño del estudio y selección de pacientes
Se realizó un estudio observacional retrospectivo en la Fundación Valle del Lili (FVL), un hospital universitario de nivel IV sin ánimo de lucro que sirve como centro de salud de referencia para el suroccidente de Colombia.
Se revisó el "Registro Institucional de Micobacterias", que recolecta de manera ambispectiva todos los casos de TB y micobacterias no TB de la institución, y analiza variables sociodemográficas, clínicas, microbiológicas, de laboratorio clínico y resultados al tratamiento. Esta información fue complementada con la revisión de historias clínicas y las bases de datos del comité de vigilancia epidemiológica y del laboratorio de microbiología institucional. Los pacientes con diagnóstico de Hr-TB fueron incluidos. Los criterios de exclusión fueron pacientes sin pruebas de aislamiento microbiológico o casos sin pruebas de susceptibilidad convencional a fármacos anti-tuberculosis.
Definiciones y variables de desenlace
Las definiciones de caso de TB se realizaron de acuerdo a las definiciones establecidas por la OMS10 y los lineamientos técnicos y operativos del programa nacional de TB adoptados por el Ministerio de Salud y Protección Social de Colombia11.
Clasificación basada en localización anatómica. |
Se definió como paciente con diagnóstico confirmado de TB, a los casos con identificación de la micobacteria a través de cultivo o una prueba de reacción de cadena a la polimerasa (PCR) positiva para M. tuberculosis. Los casos con compromiso del parénquima pulmonar o el árbol laringotraqueobronquial, se clasificaron como TB pulmonar. Los casos con evidencia de infección en órganos diferentes al pulmón se clasificaron como TB extrapulmonar. La TB miliar y la TB extrapulmonar con compromiso pulmonar se clasificaron como TB pulmonar |
Clasificación basada en la historia de tratamiento previo de TB. |
Los casos fueron clasificados como paciente nuevo y previamente tratado. La primera categoría incluye los casos que nunca han sido tratados por TB o que ha recibido medicamentos antituberculosos por menos de un mes; en cambio, la segunda los casos que han recibido 1 mes o más de los medicamentos antituberculosos en el pasado, esta categoría además clasifica por los resultados de su más reciente ciclo de tratamiento (recaída, fracaso, recuperado tras pérdida del seguimiento y otros pacientes previamente tratados). Recaída incluye los pacientes que han sido previamente tratado por TB que fueron declarados como curado o con tratamiento terminado al final de su último ciclo de tratamiento y ahora se le diagnostica con un episodio recurrente de TB (ya sea por una verdadera recaída o un nuevo episodio de tuberculosis causado por reinfección). Recuperado tras pérdida de seguimiento son aquellos casos que habían sido tratados previamente por TB y fue declarado perdido en el seguimiento realizado al final de su tratamiento más reciente. Otros pacientes previamente tratados son aquellos que han sido previamente tratados por TB, pero cuyo resultado después del tratamiento más reciente es desconocido o no se ha documentado. Las otras definiciones se encuentran en el siguiente apartado. |
Resultados al tratamiento antituberculosis. |
Los casos se clasificaron como curado, tratamiento terminado, fracaso, fallecido, pérdida en el seguimiento, no evaluado y tratamiento exitoso. Se definió como tratamiento exitoso aquellos casos que completaron el esquema de tratamiento anti-tuberculosis sin evidencia de fracaso, pero sin constancia de estudios en el último mes de tratamiento y al menos en una ocasión anterior fueron negativos, ya sea porque no se hicieron o porque los resultados no estaban disponibles (tratamiento terminado) y que presentaron cura, es decir, con estudios de baciloscopia o cultivo negativo en el último mes del tratamiento y al menos en una ocasión anterior con por lo menos un mes de diferencia. Respecto a los casos que presentaron persistencia de las baciloscopias o cultivo positivo al mes cuatro o posterior durante el tratamiento, se clasificaron como fracaso. Si el paciente murió por cualquier razón antes de comenzar el tratamiento o durante su curso, se clasificó como fallecido. Se definió perdida en el seguimiento a los casos que no iniciaron tratamiento o interrumpieron el tratamiento durante 1 mes o más. Los casos no evaluados correspondieron a aquellos que no se les ha asignado un resultado de tratamiento, incluye transferencia a otra institución y también los casos cuyo resultado al tratamiento es desconocido por la institución que reporta el dato. |
Clasificación de la resistencia a H. |
Los casos fueron clasificados como Hr-TB de alto o bajo nivel, de acuerdo a las definiciones de la OMS12. Se determinó como Hr-TB de alto nivel, aquellos casos con presencia de mutaciones tanto en kat G como en inh A; la mutación exclusiva en kat G puede conferir por si misma resistencia de alto nivel, en ausencia de una mutación en inh A. En cambio, se determinó como Hr-TB de bajo nivel, los casos con presencia de una mutación limitada solo al área promotora de inh A. |
Otras definiciones. Aquellos pacientes en que se diagnosticó la TB después de 30 días de iniciarse los síntomas, se clasificaron como retraso diagnóstico13.
Manejo programático de la TB. |
En Colombia se ha establecido que el tratamiento estándar para TB es directamente observado y consta de una fase inicial de 56 dosis de rifampicina (R), H, etambutol (E), pirazinamida (Z), seguido de una segunda fase interdiaria de 56 dosis de rifampicina e isoniazida14,15. El Comité de Vigilancia Epidemiológica de la institución evaluó todos los casos de mortalidad |
Pruebas de laboratorio
Los estudios microbiológicos se realizaron mediante baciloscopia, cultivo o pruebas de biología molecular, según los lineamientos nacionales11. Los estudios en TB pulmonar se realizaron a partir de esputo, esputo inducido o muestras bronquiales y alveolares. Para los casos de TB extrapulmonar, los estudios se realizaron a partir de las muestras de tejido o líquido según el órgano afectado.
Los cultivos fueron por medio BD BACTEC™ MGIT™ 960 (Becton Dickinson Diagnostic Instrument System, Inc.) o por medio de Löwenstein-Jensen. Las pruebas moleculares utilizadas para determinar la Hr-TB fueron: Genotype® MTBDRplus (Hain Lifescience GmbH, Nehren, Germany) o GeneXpert MTB/RIF® (Cepheid, Sunnyvale, CA, United States). Las pruebas de susceptibilidad a fármacos (PSF) se realizaron mediante el método de las proporciones múltiples recomendado por la OMS16.
Consideraciones éticas
El protocolo para este estudio fue aprobado por el Comité de Ética en Investigación Biomédica de la FVL (Protocolo No. 566), siguiendo los principios éticos para la investigación médica descritos en la Declaración de Helsinki17 y los reglamentos de la Resolución 8430 de 1993 del Ministerio de Salud de Colombia18. Como se trata de un estudio retrospectivo, no se requirió el consentimiento informado del paciente.
Análisis Estadístico
La información fue almacenada en una base de datos electrónica. Para evaluar la distribución de las variables cuantitativas, se aplicó la prueba de Shapiro-Wilk. Los datos se resumieron usando el promedio y la desviación estándar o mediana y rango intercuartílico, según la prueba de normalidad. Las variables cualitativas se resumieron como proporciones. La prevalencia de Hr-TB se calculó como el cociente entre el número de casos de Hr-TB sobre todo los casos de TB en la institución en ese mismo periodo de tiempo. El análisis de las variables recolectadas se realizó a través del paquete estadístico STATA® versión 14 (StataCorp, College Station, TX).
Resultados
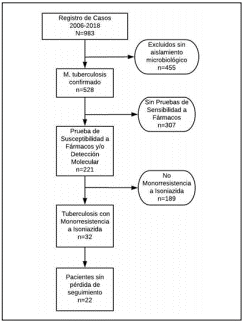
Entre enero del 2006 y diciembre del 2018 se incluyeron en el estudio 32 pacientes con Hr-TB, de un total de 528 casos de infección por M. tuberculosis confirmado (6%). El 78% (n=25) fueron clasificados como casos nuevos (sin exposición previa a medicamentos anti-TB, resistencia primaria) y el 22% (n=7) correspondió a casos previamente tratados (resistencia adquirida). Todos los casos con antecedente de TB recibieron tratamiento anti-TB completo. La selección de los pacientes se representa en la figura 1.
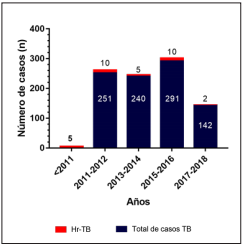
La distribución de los casos por año se presenta en la figura 2. La mediana de edad fue de 36 años (RIC=27-56 años) y el 61% fue de sexo masculino (n=20). El 50% de los pacientes residían en Cali (n=16). La comorbilidad más frecuente fue la infección por VIH (n=9). Ningún paciente tuvo como antecedente infección por virus de la hepatitis C. Las características demográficas y clínicas de los pacientes se presentan en la tabla I.
Tabla I Características demográficas y clínicas de pacientes con Hr-TB (n=32).
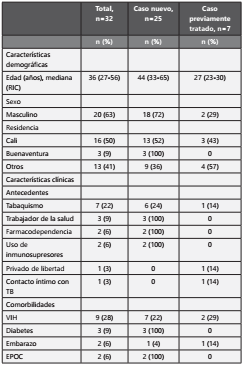
EPOC: enfermedad pulmonar obstructiva crónica; TB: tuberculosis; VIH: virus de la inmunodeficiencia humana.
La mayoría tuvo un retardo diagnóstico mayor a 90 días (n=18). Los síntomas más frecuentes fueron pérdida de peso (n=21), fiebre (n=19) y tos (n=17).
La presentación de los casos fue principalmente TB pulmonar (n=25). Los hallazgos radiológicos en la TB pulmonar fueron: infiltrados intersticiales (n=10), infiltrados reticulonodulares (n=9), cavidades (n=7), tractos fibrosos (n=3), derrame pleural (n=3), granulomas (n=2), adenopatías mediastinales (n=2); el compromiso pulmonar fue bilateral (n=10) y unilateral (n=9). Solo hubo 6 casos con radiografías sin alteraciones. La presentación de TB extrapulmonar tuvo la siguiente distribución: ganglionar (n=4), peritoneal (n=1), pleural (n=1) y vertebral (n=1). En las pruebas de anatomía patológica se visualizaron granulomas en 10 pacientes, de los cuales 9 estaban asociados a hallazgos de necrosis.
El nivel de Hr-TB tuvo la siguiente distribución: 23 casos con Hr-TB de alto nivel, 4 de bajo nivel y 5 casos con alto/bajo nivel. En las pruebas de susceptibilidad utilizadas para la evaluación de casos, se realizó la Prueba de Proporciones Múltiples en 12 casos, Genotype® MDRTBPlus en 11 casos y en 9 casos se realizaron de manera conjunta. En las Pruebas de Proporciones Múltiples, se evidenció resistencia cruzada en 6 casos de H con etionamida que presentaban resistencia de bajo nivel a H.
Respecto al tratamiento de los pacientes con Hr-TB, se encontraron 24 esquemas diferentes de prescripción. Estas fueron agrupadas según duración del tratamiento y la presencia de RZE y de la terapia con fluoroquinolonas o H. La tabla II presenta los tratamientos. Un total de 21 pacientes (65%) recibieron RZE, y de estos 11 casos recibieron tratamiento completo con esta prescripción y el resto solo durante la primera fase. El tratamiento se extendió a más de 12 meses en 6 casos.
Tabla 2 Régimen de tratamiento en las fases intensiva y de continuación de los pacientes con Hr-TB (n=32).
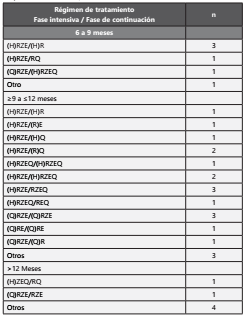
H: isoniazida; R: rifampicina; Z: pirazinamida; E: etionamida; Q: quinolona.
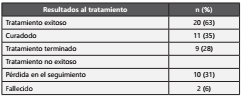
Los resultados al tratamiento se presentan en la tabla III. Al final del tratamiento, el 63% (n=20) tuvo tratamiento exitoso. Por otro lado, se reportaron 2 casos fallecidos, las cuales fueron relacionadas a TB meníngea.
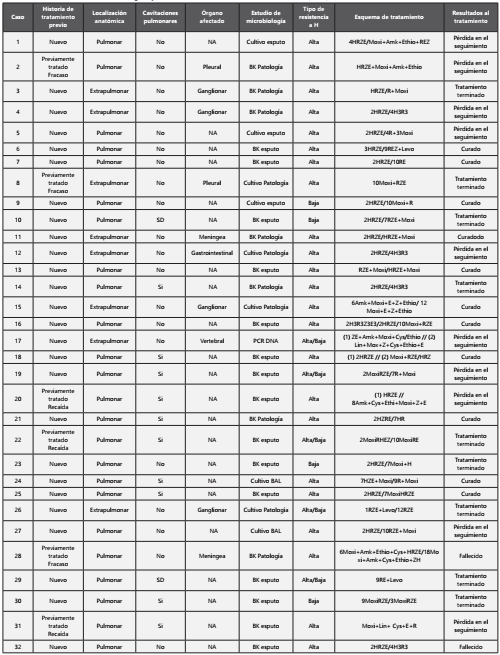
La tabla IV presenta todos los casos de Hr-TB con sus características clínicas, microbiológicas, esquema de tratamiento y resultados al tratamiento antituberculosis.
Discusión
Para nuestro conocimiento, este es el primer estudio realizado en Colombia sobre la Hr-TB. En nuestra institución, la Hr-TB fue una condición frecuente (32/528, 6%), siendo superior a lo referenciado en las estadísticas nacionales tanto para casos nuevos como para casos previamente tratados7. La mayoría de nuestros casos fueron nuevos y presentaron como comorbilidad la coinfección con VIH; sin embargo, lo más alarmante fue la evidencia de 24 esquemas de tratamiento diferentes para esta condición. Es necesario en nuestro contexto, en primer lugar, establecer un manejo formal basado en guías de práctica clínica de acuerdo con las recomendaciones internacionales y, en segundo lugar, considerar en estos grupos poblacionales la realización temprana de pruebas moleculares que evalúen la resistencia a la H y no solo a la R, con el fin dar un tratamiento óptimo y mejorar los desenlaces al tratamiento en esta población. En este sentido, es necesario fortalecer el programa nacional de TB en cuanto a las directrices de tratamiento para Hr-TB y la realización de las pruebas de susceptibilidad convencional en todos los pacientes con tuberculosis.
La frecuencia de casos identificados con Hr-TB es llamativa, dado que estudios previos en este campo han mostrado una menor proporción de casos con Hr-TB. Por un lado, el estudio realizado por el Instituto Nacional de Salud en Colombia, sobre la vigilancia de resistencia de M. tuberculosis a fármacos antituberculosos entre 2004-2005, evidenció que la Hr-TB, excluyendo la tuberculosis multidrogoresistente (MDR-TB), corresponde al 2,27% (IC 95%: 1,49-3,45) para casos nuevos y 1,89% (IC 95%: 0,81-4,39) para casos previamente tratados7. Por otro lado, en Bogotá entre 1995-2006 se llevó a cabo un estudio que tipificó molecularmente los asilamientos microbiológicos de M. tuberculosis en la ciudad, donde encontraron que el 9.4% de los aislamientos pertenecía a una cepa monoresistente y de este grupo, el 4.3% (IC 95% 0.17%-5.1%) era Hr-TB19. Esta situación puede ser explicada principalmente porque nuestra institución atiende pacientes remitidos por centros de mediana y baja complejidad, donde una proporción considerable corresponde a casos previamente tratados, con retraso diagnóstico y fallas al tratamiento.
Existen pruebas convencionales de susceptibilidad a medicamentos como el medio sólido Löwenstein-Jensen y el sistema de tubo indicador de crecimiento micobacteriano (MGIT), pero la primera requiere mucho tiempo y la segunda es sensible pero costosa. Los métodos moleculares basados en la amplificación de ácidos nucleicos tienen ventajas considerables para la ampliación del manejo programático y la vigilancia de la TB resistente a los medicamentos, ofreciendo un diagnóstico más rápido, pruebas estandarizadas y el potencial de alto rendimiento20. En nuestro estudio, se realizó principalmente la Prueba de Proporciones Múltiples, seguido del Genotype® MDRTBPlus. El Genotype® MDRTBPlus es una prueba rápida con un buen rendimiento para el diagnóstico de TB y detección de resistencia a medicamentos antituberculosis de segunda línea, incluyendo H y rifampicina21. Por lo que un aspecto para mejorar en las instituciones, debe ser la implementación y el uso de pruebas de biología molecular, tanto para el diagnóstico como para determinar la multidrogoresistencia (TB-MDR) en los pacientes con TB.
Los dos casos de muerte fueron relacionados con TB pulmonar y meníngea. Uno de los casos correspondió a una paciente trabajadora del área de la salud, con síntomas de fiebre y pérdida de peso progresiva, asociado a una desnutrición severa y estado confusional. Es manejada en la Unidad Cuidado Intensivo, donde se realizó GeneXpert MTB/RIF® en lavado broncoalveolar, el cual fue positivo, por lo que se inició manejo estándar asociado con fluoroquinolona y aminoglucósido más esteroide. Sin embargo, la paciente no responde adecuadamente al tratamiento y fallece a los 13 días posterior al diagnóstico. El segundo caso correspondió a un paciente privado de la libertad, diagnosticado con TB pulmonar quien recibía manejo antituberculosis estándar, durante la segunda fase de tratamiento presentó cefalea con alteración súbita del estado de consciencia y signos de hipertensión endocraneana, recibió manejo antituberculoso de categoría IV (linezolid, meropenem, moxifloxacino, amikacina, HRZE), sin embargo, fallece a los 3 meses de hospitalización.
De acuerdo con las estadísticas nacionales, en el año 2017 se registraron 1439 casos de muerte y la tasa de mortalidad a nivel nacional fue de 2,99 casos por 100.000 habitantes, siendo los departamentos de Valle del Cauca y Antioquia los que aportan mayor número de casos22. Sin embargo, en los últimos años la mortalidad ha disminuido de forma constante entre 2007 y 2015, y se proyecta como meta de impacto, la reducción de al menos el 35% de la letalidad por TB a 2025 (247 muertes), en comparación con el 2015 (987 muertes)15. Desafortunadamente, no se encuentran datos disponibles en Colombia sobre la mortalidad relacionada a Hr-TB, a pesar de que es conocida la relación de la resistencia a H frente a los desenlaces al tratamiento antituberculosis23.
Estudios sobre pacientes con TB meníngea han reportado que la resistencia a H está asociada a mayor mortalidad durante el tratamiento de la TB. Un estudio de cohorte retrospectiva, realizado en EE.UU., que incluyó 1.896 pacientes mostró un OR=1.61 (IC 95% 1.08-2.40) no ajustado entre la resistencia inicial a H y la muerte posterior24. En este sentido, la TB meníngea continúa siendo una emergencia médica que requiere atención por parte de los profesionales de la salud y más en el contexto de la resistencia a H. A pesar de que existen terapias farmacológicas que han mejorado las estadísticas de mortalidad en la población, la letalidad en TB meníngea es elevada, principalmente por el retraso diagnóstico.
Respecto a la coinfección TB/VIH, se ha demostrado que en los pacientes coinfectados la TB presenta un comportamiento distinto que las personas VIH negativa. La TB es la causa de muerte de una de cada tres personas con SIDA en el mundo y la coinfección representa el 26% de todas las muertes por TB25. Asimismo, esta condición se relaciona con resultados al tratamiento antituberculosis desfavorables. En nuestra serie, hubo 9 casos de coinfección y la presentación de la TB fue principalmente pulmonar sin presencia de lesiones cavitadas pulmonares. Los desenlaces al tratamiento en el grupo de pacientes con TB/VIH fueron favorables, pues todos presentaron éxito al tratamiento. Este resultado es un llamado a los países de medianos y bajos ingresos como Colombia, donde las estadísticas nacionales reportaron para el 2016 la tasa de éxito al tratamiento del 38%26. En el caso de Hr-TB y coinfección por VIH, un estudio realizado en menores de 15 años sobre el comportamiento de la TB pulmonar y extrapulmonar entre 2001-2009, mostró que la coinfección representó el 3.3% de los casos con Hr-TB27, lo cual fue inferior a nuestros hallazgos. A partir de lo anterior, se requieren medidas intersectoriales en salud para la vigilancia, el seguimiento, evaluación, orientación e implementación de tratamientos es este grupo de personas 82, con el objetivo de evitar desenlaces adversos en esta población.
El tratamiento de la Hr-TB continúa siendo controversial. Por un lado, la OMS, la International Union Against Tuberculosis and Lung Disease y la American Thoracic Society recomiendan de forma condicional una pauta basada en RZE y levofloxacina por 6 meses, y no recomiendan agregar al manejo agentes inyectables4,5,28,29; no obstante, existen limitaciones en dicha recomendación, pues la evidencia no es fuerte. Por otro lado, un meta-análisis realizado por Gegia et al.30) mostró que con medicamentos de primera línea se produjeron resultados subóptimos, lo que apoya la necesidad de mejores regímenes terapéuticos. Actualmente, no hay ensayos clínicos controlados que permitan validar las recomendaciones dadas por la OMS y las diferentes sociedades científicas, sin embargo, estas directrices deben considerarse para estandarizar las pautas terapéuticas y mejorar los resultados al tratamiento.
En nuestro estudio se encontraron 24 esquemas de tratamiento diferentes, lo cual es semejante a los hallazgos descritos por Romanowski et al.31 en una serie de 165 casos con Hr-TB, donde reportaron 32 esquemas de tratamiento diferentes. Esta situación podría ser atribuible principalmente a la frecuencia de reacciones adversas secundarias a la pauta farmacológica de los pacientes y la resistencia a otros medicamentos antituberculosos, lo que lleva a la prescripción de tratamientos individualizados a los pacientes. Además, en nuestro estudio encontramos que varios de los casos procedían de una región geográfica lejana o de difícil acceso, con alta prevalencia de MDR-TB, por lo que los esquemas incluían cobertura empírica contra MDR-TB. En este sentido, es necesario que los tomadores de decisiones en salud pública fortalezcan la farmacovigilancia en el tratamiento de los pacientes con TB, pues es evidente que existe poca adherencia a las guías de práctica clínica establecidas tanto por la OMS, como por las sociedades científicas internacionales.
Limitaciones
Nuestro estudio tiene sus limitaciones, y nuestras descripciones deben interpretarse en el contexto del diseño del estudio. Reconocemos las debilidades del estudio, especialmente relacionadas a que nuestra institución por ser un centro de referencia para el manejo de pacientes complejos del suroccidente colombiano pudo presentarse un sesgo de selección en la población. El “Registro Institucional de Micobacterias” incluye casos desde el año 2011, por lo que los casos previos a esta fecha fueron obtenidos directamente de la base de datos del comité de vigilancia epidemiológica y de las fichas de notificación obligatoria del Sistema Nacional de Vigilancia en Salud Pública (SIVIGILA) para TB. Por otro lado, nuestra institución no forma parte de un programa local de TB, por lo que el seguimiento de los pacientes no se logró en algunos casos y desconocemos los desenlaces al tratamiento en ellos. A partir de lo anterior, surge la importancia de realizar estudios de contactos a los pacientes con infección por cepas Hr-TB, debido a que los contactos de pacientes con Hr-TB tienen una razón de riesgo ajustada de 1.17% (IC 95% 0.02 a 1.26) y hasta el 80.8% de los contactos al año están infectados por cepas Hr-TB32. A pesar de nuestras limitaciones, nuestra descripción es un llamado a la acción para promover una mayor investigación operativa e innovación sobre este tema, de acuerdo con la Estrategia Fin a la TB establecida por la OMS.
En conclusión, este estudio caracterizó la Hr-TB en pacientes atendidos en un centro de referencia del suroccidente colombiano. En esta institución se ha logrado un resultado satisfactorio en la mayor parte de los pacientes tratados por Hr-TB a pesar de que los estudios muestran que esta situación constituye un incremento en los resultados adversos; no obstante, llama la atención de que a pesar de que existen lineamientos y guías que precisan en las indicaciones de las PSF en la infección por TB, aún existe gran dificultad en la realización de las mismas y en especial con la población VIH, que son los que tienen un mayor riesgo.
La Hr-TB es un problema subestimado que supone un reto para todos los actores del sistema de salud y la salud pública, y es la labor del clínico conocerla para enfrentarla adecuadamente. Con este estudio se presenta un panorama de una situación poco estudiada en nuestro país y, en consecuencia, se requieren mayores medidas para la vigilancia, el seguimiento, evaluación, orientación e implementación de tratamientos es estos pacientes.