Introducción
La infección por gérmenes multidrogoresistentes (MDR) y extensivamente resistente (XDR) es un problema de salud pública mundial con alta mortalidad1 . Los antimicrobianos son el pilar de tratamiento para infecciones bacterianas, pero cada vez las bacterias se hacen más resistentes a estos2 . Principalmente las bacterias gram negativas entre ellas Pseudomonas y Acinetobacter, que son las que mayor resistencia bacteriana han desarrollado y son la principal causa de mortalidad en los hospitales3 . La definición MDR se refiere a la no susceptibilidad adquirida a al menos un agente en tres o más categorías antimicrobianas. Las bacterias que solo son sensibles a 1 ó 2 familias de antimicrobianos se consideran como XDR y las que son resistentes a todos los antimicrobianos de todas las familias disponibles se consideran panresistentes (PDR) (4 .
La colistina es un antimicrobiano que se une al lípido A del lipopolisacárido de la membrana celular externa bacteriana y desplaza a los cationes divalentes Ca y mg de los grupos fosfatos, que son los responsables de la estabilización de la membrana externa; esto lleva a la disrupción de la membrana celular causando la muerte bacteriana. Diversos estudios han demostrado que la colistina es efectiva contra bacterias gram negativas MDR y XDR5,6.
Existen pocos estudios que evalúen la mortalidad, respuesta clínica, microbiológica y seguridad de colistina. Siendo los resultados de los estudios variables en relación a mortalidad, respuesta clínica y seguridad7 . Por otro lado, colistina puede administrarse asociada a otro antimicrobiano, pero no se ha logrado determinar cuál es la mejor asociación y además esto podría variar en función del foco de infección8,9. Según su farmacocinética, se debería administrar una dosis de carga de colistina, aunque existe controversia acerca de la dosis de colistina, esta podría verse influenciada por el peso ideal y depuración renal del paciente. Los efectos adversos de colistina fueron un problema en el pasado y debido a ello no se usaba con frecuencia; sin embargo, reportes actuales revelan que la nefrotoxicidad es el efecto adverso más importante, pero su incidencia variable en los diferentes reportes; esto al parecer relacionado a la edad, depuración renal inicial y dosis total administrada de colistina10,11.
Debido que la colistina es la principal alternativa para combatir a las bacterias gram negativas XDR; resulta pertinente describir la respuesta clínica, mortalidad, forma de administración y efectos adversos del uso de la colistina en pacientes con infecciones por Pseudomonas y Acinetobacter XDR.
Materiales y métodos
Diseño de estudio y contexto
El estudio es observacional, descriptivo y retrospectivo. Se llevó a cabo en el Hospital Nacional Arzobispo Loayza (HNAL), Lima, Perú. Los datos fueron tomados de la base de datos del servicio de Infectología del HNAL. Todos los pacientes incluidos estuvieron hospitalizados durante el periodo de junio del 2014 a junio del 2016.
El HNAL es un hospital de tercer nivel de atención, centro de referencia nacional del Perú, ubicado en Lima. Aquí se atienden todo tipo de pacientes con comorbilidades y patologías complejas. Cuenta con aproximadamente 1000 camas de hospitalización distribuidas entre las especialidades de medicina interna, cirugía, ginecología, pediatría, unidad de cuidados intensivos, traumatología y otras especialidades.
En el HNAL, el servicio de infectología es el único encargado de la autorización del uso antimicrobianos para los pacientes hospitalizados que tengan infección debido a una bacteria resistente, entre estos antimicrobianos se encuentra colistina. Para administrar colistina a los pacientes hospitalizados en el HNAL, se necesita de un cuadro clínico compatible con un proceso infeccioso, factores de riesgo de resistencia bacteriana y un cultivo positivo de Pseudomonas XDR o Acinetobacter XDR. En algunos casos se suele administrar colistina a pacientes con alta sospecha de tener una bacteria XDR (Pseudomonas o Acinetobacter) aún cuando el cultivo ha sido negativo. Las pautas de manejo fueron realizadas en base a la guía de práctica clínica del HNAL para el manejo de infecciones bacterianas multirresistentes12.
Población
Se incluyeron todos los registros de los pacientes mayores de 18 años que fueron hospitalizados en el HNAL entre junio del 2014 y junio del 2016, que tuvieron el diagnóstico de un proceso infeccioso, el cual fue determinado por un médico infectologo del HNAL con experiencia mínima de 5 años. Asimismo, se determinó que la infección fue debida a Pseudomonas aeruginosa XDR o Acinetobacter baumannii XDR, si es que se obtenía un cultivo positivo con antibio grama para estas bacterias (el tipo y la resistencia bacteriana fue determinado por un resultado de cultivo positivo llevado a cabo por el sistema de cultivo de disco o automatizado Vitek que fue realizado en el laboratorio central del HNAL o en el laboratorio San Marcos) y si se tenía una alta sospecha de una infección por una bacteria resistente.
Además, todos los pacientes debieron haber recibido colistina como tratamiento de base por un tiempo mínimo de 3 días, y esto además asociado a otro tratamiento antimicrobiano como parte de la terapia combinada para estas bacterias XDR.
Definición de términos
Los desenlaces evaluados fueron: Se consideró que un paciente tuvo una respuesta clínica favorable luego de la desaparición de los síntomas, signos y hallazgos de laboratorio relacionados a la infección al final del tratamiento con colistina, asimismo se registró el día en el que el paciente consiguió tal respuesta. Por otro lado, se consideró como respuesta clínica desfavorable, si los pacientes persistieron con síntomas o signos o hallazgos de laboratorio relacionados a la infección, o si los pacientes fallecieron producto de la infección. La respuesta clínica fue evaluada por el médico infectologo con experiencia en el manejo de infecciones por bacterias XDR.
Mortalidad intrahospitalaria a los 30 días: Fueron todas las muertes registradas dentro del hospital en los siguientes 30 días luego del inicio del tratamiento con colistina.
Nefrotoxicidad: definida como un aumento de la creatinina por encima del 50% del basal, medido con una separación mínima de 1 día.
Objetivos
El objetivo principal del estudio fue describir la respuesta clínica y la mortalidad general intrahospitalaria a los 30 días de los pacientes con infección por Pseudomonas aeruginosa XDR o Acinetobacter baumannii XDR con el uso de Colistina en combinación con otro antimicrobiano.
Los objetivos secundarios fueron describir la incidencia de nefrotoxicidad, otros efectos adversos y describir los factores asociados a mortalidad general.
Recolección de Datos
El servicio de infectología del HNAL cuenta con una base de datos, donde se registran todos los casos de los pacientes hospitalizados que fueron diagnosticados con infección y que tuvieron un cultivo positivo para Pseudomonas aeruginosa XDR o Acinetobacter baumannii XDR, y que recibieron colistina como tratamiento principal. Una vez identificado un paciente con las características antes señaladas en la base de datos, se procedió a la revisión de la historia clínica para confirmar el caso y extraer otros datos que fueron importante para el estudio. Se excluyeron a los casos que no contaban con los datos necesarios para el análisis y cuyas historias clínicas no fueron encontradas.
Cálculo de la potencia estadística: Tomando en cuenta nuestra muestra de 56 pacientes, y asumiendo una frecuencia hipotética del desenlace principal (respuesta clínica) del 60% versus un 30% de respuesta sin la colistina, y asumiendo un nivel de confianza del 95%; se obtiene un potencia de 99%
Procesamiento Estadístico
Se realizó un análisis univariado de las características generales de los pacientes seleccionados; si la variable fue cualitativa se describió la variable mediante una tabla de frecuencia o proporciones, y si la variable fue cuantitativa fue normal, se presentaron los resultados con media y desviación estándar, en su defecto la variable fue presentada con mediana y rango intercuartílico. Para describir la respuesta clínica de Colistina y la mortalidad intrahospitalaria a los 30 días se usaron tablas de frecuencia y porcentajes. Además se realizó un análisis bivariado para describir los factores asociados a mortalidad en nuestros pacientes. Cuando se analizaron dos variables cualitativas se usó la prueba de Chi2, cuando se trató de una variable categórica y otra cuantitativa se usó una prueba de t de student si la variable cuantitativa fue normal, o en su defecto se usó una prueba de U de Mann Whitney. Para las variables cualitativas con 3 o más categorías y la otra cuantitativa se usó la prueba de ANOVA o Kruskal Wallis si es la variable cuantitativa tuvo o no una distribución normal. Por otro lado, para describir los factores asociados a mayor mortalidad se calculó el Riesgo Relativo (RR) crudos para las covariables que por fisiopatología pudieran influir en la mortalidad. Se tomó como nivel de significancia estadística un valor p<0,05 y un nivel de confianza del 95%.
Consideraciones éticas
El presente es un análisis de datos que fueron extraídos de la base de datos del servicio de infectología y de las historias clínicas; por lo que no se tuvo ningún tipo de contacto con los pacientes. En tal sentido, los posibles riesgos para los sujetos del análisis son mínimos, y fueron relacionados principalmente a una brecha en la confidencialidad.
Resultados
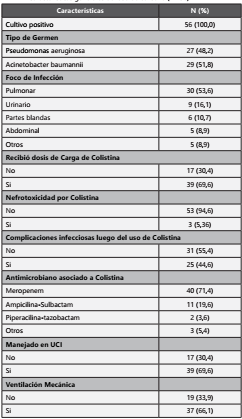
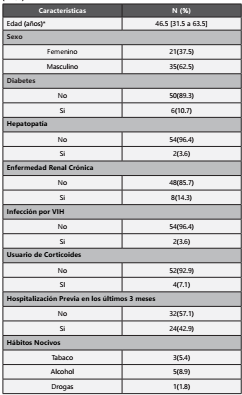
Se incluyeron los datos de 56 pacientes. La mediana de la edad fue 46,5 [RI: 31,5 a 63,5], siendo la gran parte < 60 años (66,1%) y el 62,5% fueron hombres. En relación a los antecedentes patológicos un 14,3 % tuvieron enfermedad renal crónica, diabetes un 10,7%, hepatopatía crónica un 3,6 % e infección por VIH un 3,6%. Todos los pacientes que entraron en el estudio habían recibido algún antibiótico en los últimos 3 meses, el 42,9% de los pacientes tenían el antecedente de hospitalización previa en los últimos 3 meses y el 51,8% tuvo una infección en el último mes antes del inicio de colistina. Los pacientes hospitalizados en UCI fueron 69,6% y los que estuvieron en ventilación mecánica fueron 66,1%. (Tabla 1)
Tabla 1 Características generales de los pacientes tratados con colistina (N=56)
* Mediana y rango intercuartílico
(Tabla 2)
Tabla 2 Características Clínico Laboratorial basales de los pacientes que iniciaron colistina (N=56) * Mediana y rango intercuartílico (RI)
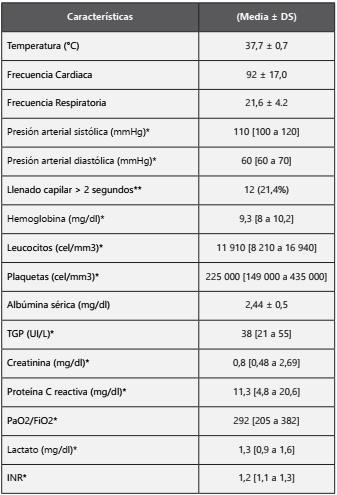
* Mediana y rango intercuartílico (RI)
** Frecuencia y porcentaje
El 69,6% de los pacientes recibieron dosis de carga con colistina (dosis de carga 300 mg y dosis de mantenimiento 150 mg cada 12 horas). Todos los pacientes recibieron otro antimicrobiano además de colistina. El meropenem se usó en el 71,4% de los casos, a una dosis de 2 gr en infusión extendida de 3 horas cada 8 horas. La ampicilina-sulbactam fue usado en el 19,6% de los pacientes a una dosis de 2 gr de ampicilina más 1 gr de sulbactam y fue administrado cuando la infección fue por Acinetobacter. El 92,6% de los pacientes infectados con Pseudomonas recibió meropenem como antibiótico asociado, mientras que el 51,7% de los pacientes con Acinetobacter recibieron meropenem. (Tabla 3)
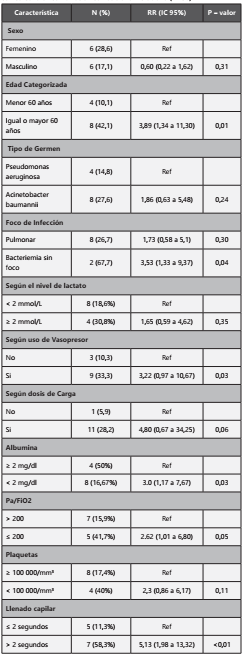
Los pacientes que recibieron colistina combinada con otro antimicrobiano debido a una infección por Pseudomonas aeruginosa XDR y Acinetobacter baumannii XDR, tuvieron una respuesta clínica favorable a los 15 días de 85,7%; y a los 30 días la respuesta clínica fue de 78,6%. La mediana de la respuesta clínica fue 7 días del inicio del tratamiento antimicrobiano. (Tabla 4)
En relación a los hallazgos de laboratorio, más del 50% de los pacientes cumplieron los criterios del Sistema Inflamatorio de Respuesta Sistémica (SIRS). Además, la gran mayoría de pacientes presentó anemia y leucocitosis con predominio neutrofílico al momento del diagnóstico de la infección. El 93,6% de los pacientes presentó hipoalbuminemia al inicio del tratamiento y hasta el 63,8% de los casos fue severa. (Tabla 2)
Todos los pacientes iniciaron terapia con cultivos positivos, de estos fueron positivos para Pseudomonas aeruginosa XDR un 48,2% y para Acinetobacter baumannii XDR el 51,8%. El foco de infección más frecuente fue pulmonar con 53,6%, seguido del urinario 16,1%. La mediana de la duración del tratamiento fue 10,5 días. Todas las infecciones tratadas con colistinas fueron intrahospitalarias y todos los pacientes habían recibido algún tipo de antibiótico previo al uso de colistina (meropenem: 57,1% y vancomicina: 69,6%). En relación a los efectos adverso, la nefropatía fue la más frecuente (5,4%) y todos los casos ocurrieron en UCI, y esta fue desarrollada entre el día 4 y 5 del inicio del tratamiento. Entre las complicaciones infecciosas reportadas, el 44,6% de los pacientes tratados con colistina se volvió a infectar por otro agente microbiano durante esa misma hospitalización.
El 69,6% de los pacientes recibieron dosis de carga con colistina (dosis de carga 300 mg y dosis de mantenimiento 150 mg cada 12 horas). Todos los pacientes recibieron otro antimicrobiano además de colistina. El meropenem se usó en el 71,4% de los casos, a una dosis de 2 gr en infusión extendida de 3 horas cada 8 horas. La ampicilina-sulbactam fue usado en el 19,6% de los pacientes a una dosis de 2 gr de ampicilina más 1 gr de sulbactam y fue administrado cuando la infección fue por Acinetobacter. El 92,6% de los pacientes infectados con Pseudomonas recibió meropenem como antibiótico asociado, mientras que el 51,7% de los pacientes con Acinetobacter recibieron meropenem. (Tabla 3)
Los pacientes que recibieron colistina combinada con otro antimicrobiano debido a una infección por Pseudomonas aeruginosa XDR y Acinetobacter baumannii XDR, tuvieron una respuesta clínica favorable a los 15 días de 85,7%; y a los 30 días la respuesta clínica fue de 78,6%. La mediana de la respuesta clínica fue 7 días del inicio del tratamiento antimicrobiano. (Tabla 4)
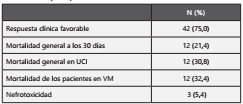
La mortalidad general de los pacientes que recibieron tratamiento con cultivo positivo ya sea para Acinetobacter baumannii XDR o Pseudomonas aeruginosa XDR fue 21,4%. La mortalidad de los pacientes cuyo cultivo fue positivo para Pseudomonas fue de 14,8%, mientras que los pacientes cuyo cultivo fue positivo para Acinetobacter fue de 27,6 %. Todos los casos de muertes se presentaron en UCI (mortalidad en UCI fue de 30,8%), no se reportaron casos de muertes cuando la infección fue identificada en hospitalización. Además, en los pacientes que estuvieron en ventilación mecánica la mortalidad fue de 32,4%. Se evaluaron si existían algunos factores basales que pudieran estar relacionados a la mortalidad. Se encontró que los pacientes mayores de 60 años tuvieron un RR: 3,89 (IC 95%: 1,34 a 11,30); pacientes con bacteriemia pero sin un foco identificado, tuvieron un RR: 3,53 (1,33 a 9,37); pacientes que usaron vasopresor tuvieron un RR: 3,22 (0,97 a 10,67); pacientes con llenador capilar > 2 segundos tuvieron un RR: 5,13 (1,98 a 13,32); y los pacientes con albumina < 2 mg/dl, tuvieron un RR: 3,0 (1,17 a 7,67); los pacientes con un Pa/FiO2 ≤ 200 tuvieron un RR: 2,62 (1,01 a 6,80). El resto de los factores no se asociaron a una mayor mortalidad. (Tabla 5)
Discusion
En nuestro estudio la respuesta clínica con uso de colistina en combinación con otro antimicrobiano, para tratar Pseudomonas aeruginosa XDR y Acinetobacter baumannii XDR, fue buena, superior a lo reportado en estudios previos; pero la respuesta clínica en UCI donde ocurrieron todas las muertes fue menor y similar a lo reportado en otras latitudes. Falagas et al. en un estudio retrospectivo encontró una tasa de curación de 79,1% y una sobrevida hospitalaria de 65,1%7,9. Además, encontró que los pacientes cuyo origen de la infección era pulmonar, abdominal o tenían bacteremia tuvieron una mayor mortalidad, pero no encontró diferencias en relación al tipo de germen. En nuestro estudio el 86% de los fallecidos tuvieron como sitio de la infección el pulmón o una bacteriemia; sin embargo, no se encontró una relación con la mortalidad, esto tal vez al poco tamaño de muestra para evaluar este sub grupo. Asimismo, Mical Paul et al. encontró que la mortalidad fue de 44%, y la falla microbiológica fue de 33%, pero la gran mayoría de pacientes estuvieron infectados con Acinetobacter y el 25% fueron post-operados, y al parecer los participantes tuvieron un mayor nivel de severidad de infección que en nuestro estudio13.
En nuestro estudio, el 70% de los pacientes estuvieron en Unidad de Cuidados Intensivos (UCI), y de estos el 95% estuvieron en ventilación mecánica; y un 30% fueron manejados en salas de hospitalización. La mortalidad fuera de UCI fue 0%, esto se explica por la menor severidad de la infección. Además, la mortalidad fue mayor en el grupo de pacientes con lactato elevado y en los que usaron algún vasopresor, esto es semejante a lo encontrado en estudios sepsis donde se evidenció que los pacientes con lactato mayor de 2 mmol/L y que necesitaron usar vasopresores para mantener una PAM ≥ 65 mmHg fueron los que tuvieron la mayor tasa de mortalidad. Nuestros datos de mortalidad en UCI son semejantes a los encontrados en otros estudios realizados en UCI, esto probablemente se deba a la mayor severidad de la infección y a las comorbilidades asociadas8,14,15.
Se encontraron que ciertos factores pudieron relacionarse a una mayor mortalidad. Los pacientes con edad > 60 años tuvieron una mayor mortalidad; en otros estudios se ha encontrado que la edad avanzada es un factor de riesgo de muerte. Asimismo, la mayoría de los pacientes fueron varones, pero las mujeres tuvieron una mayor mortalidad; pero este hallazgo se podría explicar porque la mayoría de las mujeres estuvieron en UCI. Cabe destacar que casi todos los pacientes registraron niveles de albúmina bajo y la gran parte de ellos presentaron hipoalbuminemia severa, esto posiblemente relacionado al estado catabólico y severidad de la enfermedad; y además esto se relacionó a una mayor mortalidad8,9,13,15.
Con respecto al agente etiológico, los pacientes con infección por Acinetobacter tuvieron una mayor mortalidad que los pacientes con infección por Pseudomonas, pero esta diferencia no fue significativa, resultados semejantes se han encontrado en otros estudios, donde al parecer el agente etiológico no influiría en la mortalidad. En relación al foco de la infección, se encontró que los pacientes con bacteriemia pero sin foco especifico fueron los que tuvieron mayor mortalidad, y los focos específicos no se asociaron a una mayor mortalidad; tal vez debido al tamaño de muestra de nuestro estudio. Otros estudios han encontrado resultados contradictorios en relación al foco de infección y la mortalidad16,17.
En nuestro estudio el 69,6% de los pacientes recibió dosis de carga de colistina, pero esto no mostró un impacto positivo o negativo en la mortalidad como se ha reportado en otros estudios. Estudios previos han evidenciado que la colistina podría demorar hasta casi 6 días en alcanzar la dosis terapéutica adecuada, y esto tener repercusión en la mortalidad; algo que no encontramos nosotros. Casi la totalidad de los pacientes recibió dosis plena de mantenimiento y esto no se relacionó una mayor respuesta clínica, ni con mayor nefrotoxicidad; tampoco la administración de dosis corregida se correlacionó a una mayor mortalidad ni nefrotoxicidad9,18.
Todos los pacientes de nuestro estudio recibieron terapia combinada con otro antimicrobiano. En todos los casos se usó la combinación de ampicilina-sulbactam o meropenem para tratar al Acinetobacter, mientras que en el caso de Pseudomona 2/3 recibieron meropenem como terapia adyuvante. Como en estudios previos ningún antimicrobiano en combinación mostró una mejor respuesta clínica o una menor mortalidad, ya sea que la infección haya sido causada por Pseudomonas o Acinetobacter. Probablemente elegir un antimicrobiano como combinación basado en la actividad de este sobre el patógeno a tratar, sea la mejor alternativa; puesto que no se evidenció que existan diferencias en respuesta clínica ni mortalidad con el uso de un antimicrobiano combinado especifico19,20.
La nefropatía fue el efecto adverso más frecuente. Estudios previos reportaron incidencias de nefropatías entre un 10 a 60%, pero últimos años se han reportado incidencias de nefrotoxicidad mucho menores, alrededor del 10%; además se ha determinado que existen ciertos factores favorecedores de toxicidad renal como edad avanzada, injuria renal actual o previa, uso de alguna droga nefrotóxica. En nuestro estudio se reportaron pocos casos de nefrotoxicidad; los casos presentados no se relacionaron a la edad avanzada, al nivel previo de creatinina, ni al uso de nefrotóxicos21,22.
El presente estudio tiene limitaciones por el pequeño número de pacientes, al ser un trabajo retrospectivo la calidad de los datos pudiera no ser la óptima, pero es útil para poder comprender y confirmar la respuesta clínica y seguridad de colistina en nuestra población. Nuestro estudio es descriptivo por lo tanto no pretende encontrar relaciones causales o asociaciones sino tratar de identificar posibles factores que deberían estudiar en el futuro y confirmar su influencia la mortalidad o respuesta clínica del tratamiento con colistina.
En conclusión, nuestro estudio encontró que en pacientes con infección por Pseudomonas aeruginosa XDR o Acinetobacter baumannii XDR, el uso de colistina combinado con otro antimicrobiano tuvo una respuesta clínica y mortalidad aceptables, además una toxicidad renal mínima.