Introducción
Las infecciones del tracto urinario (ITU) son frecuentes, tanto en el ambiente hospitalario como en el comunitario1. Los bacilos Gram negativos se consideran los principales patógenos urinarios, seguidos de cocos Gram positivos; no obstante, se ha encontrado un incremento reciente en las infecciones por Candida spp, este hallazgo se ha atribuido a varios factores entre los cuales se incluye la estancia hospitalaria prolongada, el uso de catéteres, el uso indiscriminado de antibióticos y la colonización vaginal.
En el paciente hospitalizado con infección urinaria complicada, sonda urinaria y antibioticoterapia previa, Candida spp. es un patógeno frecuente. El diagnóstico de las infecciones urinarias por Candida spp. es muy importante, ya que la presencia de esta en la orina puede ser el primer signo de infección sistémica según Voss y col2 y Gonzales-Pedraza y col.3
Un factor de riesgo importante para el desarrollo de infecciones urinarias por Candida spp. es la diabetes, presentándose entre el 10 y 15% en este tipo de pacientes4; otros factores de riesgo son la edad avanzada, la enfermedad genitourinaria de base, el uso de catéteres o sondas vesicales y las inmunosupresiones, donde las más frecuentes son las malignidades hematológicas y renales.4,5
Teniendo en cuenta la epidemiología, se observa que la especie aislada con mayor frecuencia a partir de muestras de orina es Candida albicans. Sin embargo, en diversos estudios se ha documentado que múltiples especies de este género como Candida glabrata, Candida parapsilosis, Candida krusei y Candida tropicalis, están presentando frecuencias de aislamiento importantes, con variación en los perfiles de sensibilidad entre estas especies, lo cual es importante para la instauración de un tratamiento adecuado.4-7. En la actualidad, debido al diferente patrón y grado de sensibilidad de las distintas especies de Candida y al aumento del índice de resistencias a los antimicóticos registrado, es mandatoria la identificación a nivel de especie en las levaduras aisladas de muestras clínicas que procedan de sitios estériles, de biopsias o de sangre. También se sugiere identificar las recuperadas de muestras genitales, y se excluyen las de origen respiratorio como esputos y lavados broncoalveolares debido a que su presencia puede deberse a la infección o colonización orofaríngea.
Actualmente, cuando el agente causal es C. albicans, el antimicótico de elección es fluconazol (FCZ). Para las otras especies del género, se sugieren otros azoles como voriconazol (VCZ), itraconazol (ITZ), anfotericina B (AmB) y flucitosina.2,5Sin embargo, en un estudio realizado en 2016 por Tonery col.6 hallaron 6% de C. albicans resistente aFCZ, y para las especies C. no-albicans 27% de resistencia aFCZ, 73% a ITZy 25% aVCZ.
Por lo anterior, en este estudio se evaluaron mediante identificación fenotípica y análisis de las secuencia y filogenética ITS1-5.8S-ITS2 los aislamientos de Candida spp. Recuperados de urocultivos de pacientes en la ciudad de Medellín, esto con el fin de estimar la frecuencia de cada una de las especies aisladas y observar los patrones de sensibilidad existentes en la población, junto con las condiciones del paciente (sexo, edad, uso de sonda vesical y estancia en hospitalización).
Materiales y métodos
Aislamientos de Candida spp.
Se realizó un estudio descriptivo de corte transversal. Mediante un muestreo no probabilístico a conveniencia; se recolectaron 78 aislamientos de Candida spp. provenientes de urocultivos de pacientes que consultaron en varias sedes de Dinámica IPS Medellín (Industriales, Clínica las Vegas, Clínica Bolivariana entre otros), entre enero 2016 y noviembre 2017. Como criterios de inclusión se tuvo en cuenta los pacientes que tuvieron disponibilidad de información para las variables edad, sexo, uso de sonda vesical, recuento de levaduras igual o mayor a 100.000 UFC/mL, identificación fenotípica de la especie de Candida spp. aislada y su perfil de sensibilidad.
Identificación fenotípica.
La identificación de las especies y su perfil de sensibilidad se confirmaron con el sistema comercial Vitek 2® (BioMérieux, Inc.), el cual permite identificar un gran número de microorganismos a través de la medición de su actividad metabólica en diversos sustratos. En el presente trabajo, la identificación de las especies de Candida se realizó mediante la tarjeta YST (BioMérieux, Inc.) y para la determinación de sensibilidad se empleó la tarjeta AST (BioMérieux, Inc.) (AST-YS08 Lote: 2430716103), siguiendo las instrucciones del fabricante y estableciendo como puntos de corte los criterios del CLSI M27-S4 (2012). Si bien las equinocandinas no se incluyen dentro de los antimicóticos de primera línea para el tratamiento de las infecciones del tracto genitourinario por especies de Candida, en este estudio se presentan los resultados por estar disponibles en las tarjetas empleadas, no se incluyó la Anfotericina B entre los antimicóticos evaluados. Únicamente los aislamientos que presentaron baja discriminación en la identificación fueron confirmados por el método comercial semiautomatizado API 20C AUX ® (BioMérieux, Inc.), siguiendo las instrucciones del fabricante. El CHROMagar, un método para identificación preliminar de especies de Candida, no fue empleado en este estudio por sus limitaciones en la tipificación de especies no frecuentes.
Extracción de ADN.
El ADN total fue purificado a partir de las levaduras con el juego de reactivos DNeasy® Blood & Tissue Kit (QIAGEN) siguiendo las instrucciones del fabricante. La calidad del ADN purificado fue evaluada en un Nanodrop 2000 (Thermo Scientific).
Amplificación y secuenciación.
La región ITS1-5.8S-ITS2 se amplificó por PCR utilizando los iniciadores ITS1 e ITS47, en termociclador T100™ (BIO-RAD). La reacción se hizo en un volumen final de 50 μL, conteniendo 3 mM MgCl2, 0.5 μM de cada cebador, 1 U de Taq DNA polimerasa (ThermoScientific), 0.5 μM de dNTPs y 30 ng de DNA genómico. Los parámetros para el corrido de la PCR fueron: desnaturalización inicial a 94°C por 5 min, 35 ciclos de 94°C por 5 min, 60°C por 1 min, 72°C por 15 min y una extensión final de 72°C por 5 min. Para confirmar la amplificación se hizo una electroforesis en geles de agarosa al 1% con 10 μL del producto de PCR en presencia de GelRed 1X (Biotium). Los productos de PCR (20 μL de cada uno) fueron enviados a secuenciar por el método de Sanger (Macrogen, Korea) y se obtuvieron las secuencias de las dos cadenas de ADN.
Análisis de secuencia y filogenética.
Los electroferogramas se cargaron en el programa Geneious (Biomatter), donde fueron alineados para su control de calidad y la obtención de la secuencia consenso. Para la identificación molecular de los aislamientos, con las secuencias consenso se hizo una búsqueda Blastn en las bases de datos nr y ref_RNA del NCBI. Para la reconstrucción filogenética se hizo un alineamiento con MAFFT de las secuencias del marcador ITS, utilizando algunos aislamientos de referencia de Candida spp. y Schizosaccharomyces pombe BY 10 como grupo externo. Los alineamientos fueron cargados en Geneious donde se hicieron ajustes manuales. El programa IQtree fue utilizado para escoger el mejor modelo evolutivo y hacer la reconstrucción filogenética por máxima verosimilitud (ML). El soporte estadístico de las ramas se hizo con un ultrafastboopstrap de 10.000 réplicas y el árbol filogenético fue visualizado utilizando el programa Tree Graph2.
Análisis estadístico.
Se creó una base de datos en el programa Excel y con SPSS v 23 se realizaron los análisis estadísticos. Para evaluar el supuesto de normalidad se utilizó el test Shapiro-Wilk. Para las variables sexo, uso de sonda vesical, identificación fenotípica y perfil de sensibilidad, se halló frecuencia relativa y absoluta y para la variable edad, mediana y rango. Posteriormente, se realizó la prueba de chi-cuadrado de independencia con el fin de determinar posibles relaciones con la especie de Candida aislada, el perfil de sensibilidad y las condiciones del paciente.
Consideraciones éticas.
De acuerdo con la resolución 8430 de 1993 del Ministerio de Salud y Protección Social de Colombia, esta investigación se considera sin riesgo ya que no hay ninguna intervención sobre el paciente, por lo que no fue necesario realizar consentimiento informado. Se contó con el permiso institucional y se garantizó la confidencialidad de la información.
Resultados
Aspectos epidemiológicos de los aislamientos de Candida spp.
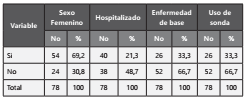
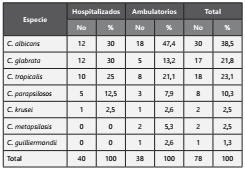
Dentro del estudio se analizaron 78 aislamientos de Candida spp. provenientes de urocultivos (recuento igual o mayor a 100.000 UFC/ml), pertenecientes a 78 pacientes de la ciudad de Medellín, entre los 0 y los 93 años; con una mediana de edad de 67 [0.5-93] años. De estos, el 69,2 % (54) eran mujeres, y el 30,8 % (24) hombres la población hospitalizada fue de 51,3% (40), de los cuales el 33,4% (26) presentaban sonda vesical. En el 33,4% (26) de los pacientes se conoció que presentaron enfermedad de base (26). (Tabla 1). Las enfermedades de base fueron: ITU 29%, seguida de cancer, diabetes, peritonitis,enfermedades hematologícas, cirugías con 12% cada una de ellas y con un 6% neumonía y ulcera de piel. Las frecuencias de Candida spp. a nivel de especie identificadas con las herramientas moleculares descritas fueron: 38,5% (30 aislamientos) correspondieron a C. albicans, 23,1% (18) a C. tropicalis, 21,8% (17) a C. glabrata, 10,3% (8) a C. parapsilosis, 2,5% (2) a C. metapsilosis, 2,5% (2) a C. krusei y1,3% (1) a C. guilliermondii. En los pacientes hospitalizados las frecuencias de Candida spp. fueron C.albicans 30% y C.no-albicans 70%; a nivel de especie C. albicans y C. glabrata 30% cada una, C. tropicalis 25%, C. parapsilosis 12,5%y C. krusei 2,5%, mientras que para los pacientes ambulatorios la distribución fue C. albicans 47,4% y no C.albicans 52,6 % (Tabla 2).
En cuanto al perfil de sensibilidad a los antimicóticos, la mayoría de aislamientos presentaron sensibilidad a fluconazol (93,6%), la resistencia encontrada fue de 3,8 % (3 aislamientos) y la sensibilidad intermedia se presentó en 2,6% (2 aislamientos). El 97,4 % del total de aislamientos presentaron sensibilidad al voriconazol, mientras que un aislamiento de C. glabrata fue resistente y uno de C. tropicalis presentó sensibilidad intermedia. La sensibilidad para caspofungina y micafungina fue del 100% (Tabla 3).
Tabla 3.
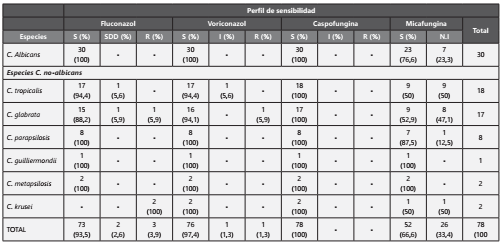
S. Sensible. I. Sensibilidad intermedia. SDD. Sensible Dosis Dependiente. R. Resistente. N.I. No Informa.
*Los puntos de corte utilizados son los sugeridos por el CLSI M27-S4 82012)
A nivel de especie, todos los aislamientos de C. albicans, C. parapsilosis, C. guilliermondii y C. metapsilosis fueron sensibles a los cuatro antimicóticos evaluados. Para C. tropicalis el perfil de sensibilidad para FCZ y VRZ fue del 94,4% (17) y100% para caspofungina y micafungina. C. glabrata fue resistente a FCZ y VRZ con un 5,9% cada uno y 100% sensible para caspofungina y micafungina. C. krusei presentó una resistencia del 100% al fluconazol y sensibilidad de 100% para voriconazol y caspofungina (Tabla 3)
Reconstrucción filogenética.
Los aislamientos de Candida spp. se agruparon con sus respectivas cepas de referencia en el árbol filogenético inferido a partir del marcador ITS. En la filogenia las cepas de referencia de C. guilliermondii y C. krusei aparecen con el nombre del sinanamorfo con el que fueron reportadas en las bases de datos. La especie C. tropicalis mostró una posición basal en la filogenia. La especie C. albicans se agrupó en un clado con C. krusei; a pesar de que C. albicans tiene el mayor número de aislamientos se observó baja variabilidad intraespecífica. En los aislamientos del complejo C. parapsilosis (C. parapsilosis, C. orthopsilosis y C. metapsilosis) se observó la mayor variabilidad genética, donde se soportó la monofilia (>70% de ultrafastbooptrap) en 4 grupos de C. parapsilosis: un primer grupo basal conformado por los aislamientos C. parapsilosis 3, 58 y 76; un segundo grupo en el que se encuentran C. parapsilosis 4, 16 y 54; un tercer grupo constituido por las cepas de referencia C. parapsilosis CBS 2193 y C. parapsilosis d40b; y finalmente un grupo conformado por los aislamientos de C. metapsilosis, como una especie que divergió recientemente. Los aislamientos de C. glabrata y C. guilliermondii se muestran como especies hermanas que tienen como grupo externo a C. parapsilosis (Figura 1).
Comparación de métodos de identificación fenotípica y molecular.
De los 30 aislamientos identificados como C. albicans por métodos moleculares se observó concordancia con el fenotipo en 28 de ellos (93,3%), los dos restantes fueron identificados como C. guillermondi y C. lusitaniae. De los 17 aislamientos identificados como C. glabrata por métodos moleculares hubo concordancia con el fenotipo en 16 de ellos (94,1 %), el otro aislamiento fue identificado como C. albicans. De los 18 aislamientos identificados como C. tropicalis por métodos moleculares se observó concordancia con el fenotipo en 15 de ellos (83,3%), los 3 aislamientos restantes fueron identificados como C. albicans. De los 8 aislamientos identificados por métodos moleculares como C. parapsilosis se observó concordancia con el fenotipo en de ellos 6 (75%). De los 2 aislamientos identificados por métodos moleculares como C. metapsilosis no se observó concordancia en ninguno de ellos, un aislamiento fue identificado como Debaryozyma hansenii (Candida famata) y el otro como C. parapsilosis. La concordancia en la identificación por ambos métodos fue del 100% para C. guilliermondii y C. krusei (Tabla 4).
Discusión
En este estudio, en un periodo de 22 meses, se lograron obtener 78 aislamientos de Candida spp. lo que demuestra la frecuencia significativa que tienen las infecciones de tracto urinario por este agente en la ciudad de Medellín.
Entre los datos demográficos, la mayoría de aislamientos provenían de mujeres (67,9%), esto es consistente con lo reportado por Falahti et al. (2016)8 quien realizó un estudio similar con pacientes diabéticos, con lo informado por Alfouzan y col. (2017)9 y Tonery col. (2016)6 quienes encontraron que el sexo femenino es un factor de riesgo para desarrollar infecciones del tracto urinario por Candida spp.
En cuanto a la edad, los datos fueron muy variables, encontrándose una mediana de edad de 67,9 años y un rango amplio de 6 meses a 93 años, lo cual es similar a lo reportado por Gabardiy col. (2016)10, en su estudio encontró que la población estudiada tenía una media de edad de 60 años y consideró que la edad es otro factor de riesgo asociado a infección urinaria por Candida spp.
En nuestro análisis observamos que el 48,7 % de los pacientes fueron atendidos por consulta externa, y de estos, el 90% no usaban sonda vesical; en ellos el aislamiento en cultivo de C. albicans fue 47.3%. y C. no-albicans 52,7%. La diabetes es considerada un factor de riesgo para el desarrollo de infecciones urinarias por Candida11,12, no obstante, en la población incluida en este estudio únicamente en dos pacientes se conoció que eran diabéticos, por lo que no es posible descartar que esta patología haya afectado a otros de los participantes.
Con respecto a la población hospitalizada (51,28%) las especies más frecuentemente recuperadas de urocultivos fueron C. no-albicans con el 70%, superior a la frecuencia encontrada por Jacobsy col. (2017)13, en dicho estudio realizado en muestras de orina de pacientes hospitalizados, el 54,4% de aislamientos correspondieron a especies no-albicans.
Al comparar las especies aisladas, se obtuvo que C. albicans fue la más frecuente con un 38,5%, seguida por C. tropicalis (23,1%) y C. glabrata (21,8%), estos resultados son similares a un estudio español de Garcíay col. (2015)14quienes incluyeron 266 urocultivos positivos para Candida spp. , en este estudio la identificación de especie fue realizada mediante el sistema ID32C® (BioMérieux, Francia), los autores encontraron una frecuencia de 9% de aislamientos de C. albicans, seguido por C. glabrata (19,5%) y C. tropicalis (17,7%).
La frecuencia del 47,5% para la especie C. albicans es similar al reportado por Esmailzadehy col. (2017)11, quienes realizaron su estudio en una población de diabéticos tipo 2 y para la identificación emplearon el MALDI-TOF. En cuanto a las especies C. no-albicans, nuestros resultados de C. krusei (2,6 %) se asemejan al 5% reportado por estos mismos autores, sin embargo, nuestro hallazgo de 21,8% de C. glabrata difiere del 37,5% encontrado en la población de diabéticos, lo que pudo deberse al tamaño de la muestra y la población estudiada. Recientes estudios reportan una incidencia de 43,8% de la especie multirresistente C. auris en ITU15, en nuestro estudio no se encontró ningún aislamiento compatible con esta especie. Sin embargo es importante considerar que esta especie podría estar involucrada como agente causal de ITU en nuestra población dado el incremento del número de pacientes inmunosuprimidos y la colonización en ambientes hospitalarios.
En cuanto al perfil de sensibilidad, el 100% de los aislamientos de C. albicans fueron sensibles a fluconazol (FCZ), lo cual es cercano a lo observado por Tonery col. (2016)6, el 93% de los aislamientos de C. albicans provenientes de muestras de orina fueron sensibles a este antimicótico, 1,4% presentaron sensibilidad intermedia y 5,8% fueron resistentes. En un estudio realizado en Colombia por Zuluaga (2010)16 con aislamientos de Candida spp. en muestras estériles también expone la alta sensibilidad de C. albicans al FCZ (95,2%) lo que demuestra que este antimicótico sigue siendo una buena alternativa de tratamiento.
La resistencia a FCZ presentada por las especies C. glabrata (5,9%)y C. krusei (100%), se asemeja con la reportada por Ozhaky col. (2012)17en estudio realizado en Turquía en pacientes hospitalizados que presentaban infección urinaria , en dicho estudio encontraron una resistencia del 12,5% para estas especies. En el presente estudio ningún asilamiento de C. krusei fue sensible al FCZ, lo cual corrobora la resistencia intrínseca del hongo a este antimicótico.
En la especie C. glabrata se ha descrito tanto resistencia adquirida (genes CDR1 y CDR2, mutación en ERG11) como intrínseca.13,17 12,18En este estudio el 88,2% de C. glabrata fueron sensibles a FCZ, 5,9% intermedias y 5,9% resistentes; además, es interesante que la cepa resistente a FCZ, también fue resistente a voriconazol (VCZ), posiblemente por la expresión concomitante de bombas de eflujo y mutación en el gen ERG11 como lo explica Pfallery col. (2012)18 Se debe tener en cuenta que el fluconazol no se recomienda como alternativa de tratamiento frente a C. glabrata.
Referente a la respuesta a VCZ, para todas las especies en nuestro estudio la sensibilidad fue del 93,5%, resultado que difiere del 72,7% descrito por Yashavanthy col. (2013)19 quienes documentaron resistencia a este antimicótico en cepas de C. albicans, C. tropicalis y C. krusei. Estas diferencias se deben posiblemente al tamaño muestral (33 asilamientos) y que el 100% de la población estudiada por Yashavanth se encontraba hospitalizada.
Finalmente para caspofungina se observó una sensibilidad del 100% para todas las especies aisladas, difiriendo con lo reportado por Mahmoudabadiy col. (2015)20 quienes reportaron una resistencia del 5% a caspofungina por C. albicans y C. glabrata. Con relación a la micafungina se dispuso de información en un 76.6% de C. albicans y en un 66.6% de las especies C.no-albicans, todos estos aislamientos fueron 100% sensibles.
En este estudio no fue posible establecer una clara relación entre los perfiles de sensibilidad a los antimicóticos y la distribución filogenética de los aislamientos de Candida spp. Esto se debe a que los mecanismos evolutivos por los cuales los aislamientos adquieren resistencia pueden ser diversos. Por ejemplo, los aislamientos de C. krusei tienen resistencia intrínseca al fluconazol, la cual puede deberse a mutaciones puntuales en la 14α-esterol demetilasa que disminuyen la susceptibilidad de esta enzima al antifúngico21. Adicionalmente, las bombas de eflujo ABC122 y la sobreexpresión del gen ERG 11 han sido mecanismos asociados a la resistencia de C. krusei al fluconazol23. Interesantemente, en nuestra filogenia la especie C. albicans, la cual mostró un 100% de los aislamientos sensibles al fluconazol, tiene como especie hermana a C. krusei la cual presenta resistencia intrínseca a este fármaco. Sin embargo, han sido ampliamente reportados aislamientos de C. albicans con algunos de los tres mecanismos que expresa C. krusei. Esto sugiere que C. krusei evolucionó acumulando estos tres mecanismos de resistencia a fluconazol, mientras que C. albicans puede adquirir alguno de los tipos de resistencia de su especie hermana y la presión selectiva con los medicamentos pueden generar que se seleccionen poblaciones de C. albicans resistentes.
La concordancia en la identificación de C. albicans por Vitek2 y molecular en el presente estudio fue del 93,3% y C. glabrata 94,1%, menor que el 98,3 %, reportado por Ochiuzzi (2014).24
Considerando el incremento en la resistencia antimicótica y la aparición de infecciones ocasionadas por especie no clásicas, así como la posibilidad de encontrar la especie multirresistente C. auris, es importante considerar aplicar pruebas de sensibilidad a los aislamientos urinarios, principalmente cuando se evidencia falla en el tratamiento, aislamiento de especies no-albicans o sospecha de C. auris.
En conclusión, los aislamientos de Candida spp. fueron más frecuentes en los urocultivos de pacientes mayores de 50 años y en población femenina. Hubo una frecuencia muy importante en las especies C.no-albicans representando el 61,5% de las cepas, C. albicans presentó un 38,5%. Todos los asilamientos de C. albicans fueron sensibles a los cuatro antimicóticos evaluados, por otra parte, las especies C.noalbicans presentaron el 6,4% de resistencia a fluconazol %y el 2,6% a voriconazol. Se evidencia la importancia de incrementar la población a través de un estudio multi-institucional para generar un tamizaje más amplio de las cepas que afectan a los pacientes de la ciudad de Medellín. Limitaciones del estudio fueron que los antifungicos no se tamizaron con el método de referencia para levaduras CLSI, sino con método automatizado, además no se tiene dato de la Anfotericina B.