Introducción
La endocarditis infecciosa (IE; por sus siglas en inglés) fúngica es una enfermedad agresiva e infrecuente, considerada una emergencia en los servicios hospitalarios siendo una complicación grave de las infecciones endovasculares. La mortalidad de endocarditis infecciosa por Candida spp., consta alrededor del 50-80% 1. Se ha estimado una incidencia de 0-12% del total de las admisiones pediátricas por IE (promedio 1.1%) alrededor del mundo2,3, y aproximadamente 1.5-4 casos por 10 millones de niños4. La Candida spp., es responsable de la segunda o la tercera parte de las endocarditis fúngicas y es una complicación rara y escasamente comprendida de la fungemia. Históricamente, la C. albicans ha sido el patógeno aislado más frecuente de las infecciones fúngicas5, seguida por especies como C. parapsilosis6-10. No obstante, algunos autores han reportado a C. parapsilosis como el principal agente causal aproximadamente en un 61.3% en los niños11.
La C. lusitaniae fue descrita inicialmente en 1979, por afectar a pacientes inmunocomprometidos y siendo responsable del 5% de todas las infecciones fúngicas invasivas por Candida12. Además, se ha relacionado como agente etiológico en infecciones como: meningitis, osteomielitis y peritonitis, sin embargo, la presentación más común es la fungemia en pacientes sometidos a quimioterapia. La endocarditis se caracteriza por ser extremadamente inusual y severa constituyendo ser la complicación más representativa de la enfermedad fúngica invasiva13. La Candida spp., por lo general, produce vegetaciones extensas en las válvulas cardiacas, con una tendencia a embolizar y convertirse potencialmente en un evento con alta morbimortalidad. Los factores de riesgo que favorecen su aparición son: cirugía de válvula prostética previa (54%), uso prolongado de antibióticos (48%), enfermedad cardiaca reumática (24%), otras cirugías cardiacas (23%), líneas vasculares (18%), tratamiento inmunosupresor (17%) y uso de drogas intravenosas; especialmente, terapia antimicrobiana prolongada (13%)14. El tratamiento es complejo, en algunos casos requiere abordaje quirúrgico de las válvulas afectadas cuando la vegetación es extensa y; por consiguiente, uso prolongado de terapia antifúngica15. Según la Sociedad Americana del Corazón en 201516 y, la Sociedad Americana de Cirugía Torácica se consideran candidatos a tratamiento quirúrgico los pacientes adultos con: lesión con un tamaño de 10 mm o mayor, disfunción valvular con repercusión hemodinámica que resulta en falla cardiaca, endocarditis infecciosa del lado izquierdo por Staphylococcus aureus o microorganismos multirresistentes, IE complicada por bloqueo cardiaco, absceso aórtico o anular, lesiones penetrantes obstructivas, evidencia de infección persistente entre 5 y 7 días después de la iniciación apropiada de la terapia antibiótica17. En el caso presentado, exponemos una endocarditis infecciosa por Candida lusitaniae secundaria a cirugía cardiaca indicada por transposición de los grandes vasos.
Descripción del caso
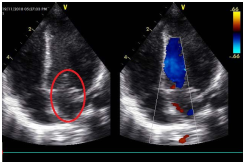
Paciente de 3 meses de edad, contrarremitido de institución hospitalaria de cuarto nivel con los diagnósticos de: Ductus Arterioso Persistente, Hipogammaglobulinemia no familiar, choque cardiogénico, quilotórax, sepsis neonatal, desnutrición proteico-calórica moderada, hipertensión pulmonar secundaria a fistula arteriovenosa de vasos pulmonares y postoperatorio satisfactorio de cirugía por transposición de grandes vasos. En los antecedentes farmacológicos, manejado con captopril 0.3 gr cada 12 horas, furosemida 3 mg cada mg cada 12 horas, espironolactona 15 mg cada 12 horas. En los antecedentes complementarios; producto de embarazo a término, parto vía cesárea, peso al nacer 2900 gramos, talla 45 cm, vacunas completas para la edad. A su ingreso con signos vitales con una frecuencia cardiaca 153 latidos por minuto, frecuencia respiratoria 39 respiraciones por minuto, saturación del 92% por cánula nasal a 2 litros por minuto, T 36.8° C, peso 3240 gramos, talla 60 cm, valoración nutricional Z-score P/E -2 DE, P/L -2 DE, P/T -2 DE, percentil 3. A la exploración física, tórax; normoexpansible, emaciación visible, no tirajes, cardiorrespiratorio; murmullo vesicular conservado, roncus escasos en bases pulmonares y sistema cardiaco; ruidos rítmicos, soplo holosistólico, intensidad leve II/VI, extremidades: hipotróficas. El resto del examen físico bajo la normalidad. En los paraclínicos de ingreso hemograma con anemia leve sin leucocitosis, se realiza hemocultivo y urocultivo que son negativos. Función hepática y renal conservada. El resto de exámenes dentro de los parámetros normales (ver Tabla 1). Se toma ecocardiograma que evidencia falla cardiaca con fracción de eyección disminuida motivo por el cual se traslada a Unidad de Cuidado Intensivo Pediátrico (UCIP) para soporte inotrópico con milrinone. Al sexto día de estancia presenta deterioro clínico del estado general y hemodinámico, con presencia de signos de respuesta inflamatoria sistémica, evidencia pico febril de foco desconocido por el cual se toman hemocultivos y se indica manejo con Vancomicina más Meropenem más Caspofungina cubriendo foco bacteriano y fúngico. Posteriormente se realiza ecocardiograma de control por patología cardiaca de base que demuestra de forma incidental en aurícula derecha siembras micóticas con alto grado de embolización, con un tamaño de 3 mm de diámetro, sin criterios de abordaje quirúrgico (Figura 1). En los hemocultivos tomados a través de catéter venoso central, se obtiene el aislamiento de Candida lusitaniae con perfil de sensibilidad a azoles y equinocandinas; mediante método automatizado con sistema Phoenix 100 (Figura 2). Se interconsulta al servicio de Infectología Pediátrica que indica rotación de terapia antifúngica a fluconazol 45 mg cada 24 horas por 42 días de tratamiento. En días posteriores, el paciente con resolución favorable, en el ecocardiograma de control a los 5 días se observa ausencia de siembras micóticas (Figura 3). Adicionalmente, se toman hemocultivos de control sin aislamiento. Paciente quien debido a comorbilidades de base que le condicionan estancia hospitalaria prolongada, alrededor de 3 meses. Se da egreso a su domicilio con control con el servicio de Cardiología Pediátrica para seguimiento de su patología de base en el Hospital Infantil Los Ángeles, sin embargo; lamentablemente en días recientes, se produce su deceso secundario a desnutrición severa y complicaciones de sus múltiples comorbilidades.
Tabla 1 Laboratorios en el servicio de Urgencias del Hospital Infantil, Los Ángeles.
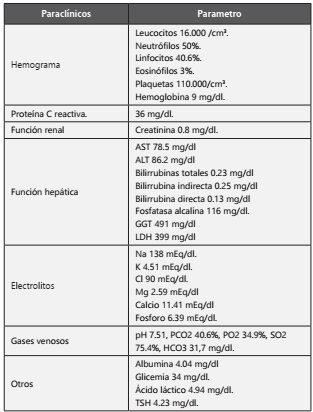
GGT: gamma glutamiltranferasa. LDH: lactato deshidrogenasa.
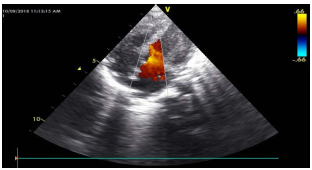
Figura 1 Ecocardiograma de control que evidencia defecto septal interatrial residual de 3 mm, neoaorta estenótica, insuficiencia tricuspídea ligeramoderada, presión de la arteria pulmonar de 45 mmHg y fracción de eyección de 45%, se observan lesiones micóticas en aurícula derecha de aproximadamente 3 mm de diámetro. Fuente: Archivo del servicio de Cardiología, Hospital Infantil, Los Angeles.

Figura 2 Reporte de hemocultivo que confirma C. lusitaniae. Fuente: Archivo del servicio de Laboratorio Clínico y Microbiología, Hospital Infantil, Los Angeles.
Discusión
Las prevalencia de endocarditis fúngica representa menos del 2% en todos los casos por endocarditis según reportes en naciones como; Italia, Francia y Estados Unidos18. Los datos en la literatura de endocarditis infecciosa por C. lusitaniae en el mundo son escasos, en un estudio reportado por Kara et al10, encontraron en una población pediátrica solamente el 2% y en un trabajo realizado por Martínez et al19, no se presentó ningún caso por C. lusitaniae. Amish et al20 encontraron una endocarditis en válvula aortica asociada a isquemia aguda del miembro inferior y Ross et al21 evidenciaron una endocarditis de válvula protésica por C. lusitaniae. En ese entendido, son muy exiguos los casos reportados en la literatura por C. lusitaniae, de los cuales solo uno fue una endocarditis de válvula nativa22-23. En ambos casos de endocarditis valvular protésica se observó un resultado fatal, mientras que el paciente de endocarditis valvular nativa tuvo un buen desempeño luego de la cirugía de reemplazo valvular y terapia antifúngica supresora de por vida 22-23. No obtuvimos resultados de endocarditis infecciosa por Cándida lusitaniae secundaria a cirugía por transposición de grandes vasos. En Colombia; de igual forma, no existen datos al respecto de endocarditis por C. lusitaniae. Es importante comprender que predomina en los pacientes inmunocomprometidos, con uso de dispositivos intravasculares y administración de terapia antimicrobiana de amplio espectro. A continuación, se expone las especies de formas fúngicas más sobresalientes que causan endocarditis infecciosa (Tabla 2). Es necesario contemplar, que a pesar de la severidad que representa la endocarditis infecciosa como resultado del alta carga micótica de la candidiasis invasiva, no fue necesario la intervención quirúrgica en el caso presentado, según los criterios expuestos por la Sociedad Americana del Corazón y la Sociedad Americana de Cirugía Torácica que consisten en disfunción valvular con repercusión hemodinámica que resulta en falla cardiaca, endocarditis infecciosa del lado izquierdo por Staphylococcus aureus o microorganismos multirresistentes, IE complicada por bloqueo cardiaco, absceso aórtico o anular, lesiones penetrantes obstructivas, evidencia de infección persistente entre 5 y 7 días después de la iniciación apropiada de la terapia antibiótica16,17. Con respecto al tratamiento de la IE por Candida, se describen en el paciente pediátrico los regímenes basados en Anfotericina B más intervención quirúrgica, seguidos por fluconazol para supresión prolongada de acuerdo al contexto clínico24. Asimismo, la alternativa es equinocandina, cuando hay toxicidad a Anfotericina B, que ha demostrado buena respuesta farmacológica25. A pesar de la terapia antifúngica y quirúrgica, se ha visto una mortalidad alrededor del 30-80%26-33. En nuestro caso, inicialmente se instauró equinocandina por ser el medicamento disponible en la institución, y posteriormente se continuó con fluconazol como la terapia de supresión por 42 días.
Conclusiones
En el presente reporte de caso, se expone una endocarditis infecciosa por Candida lusitaniae, suceso infrecuente en el escenario clínico, con las características de invasión fúngica definidas en la literatura mundial. Ocurre principalmente en pacientes inmunocomprometidos, con acceso venoso crónico y el empleo de antibióticos de amplio espectro como en el caso presentado. Es imprescindible la detección temprana y una intervención terapéutica vertiginosa, puesto que la infección latente, la resistencia antimicótica y el retraso en el diagnóstico conllevan a un pronóstico desfavorable y amenazante para la vida del paciente, incluso; con resultado fatal como ocurrió en el caso presentado.