Introducción
La pandemia por SARS-CoV-2 corresponde a un agente viral nuevo para el hombre y por lo tanto ha sido necesario el desarrollo de pruebas diagnósticas de emergencia1 . Las primeras que se desarrollaron, fueron las que detectaban el material genético del virus en muestras de secreciones respiratorias las cuales se convirtieron en el estándar de oro para el diagnóstico2 . En la web de la Organización Mundial de la Salud (OMS) se recogen los protocolos diagnósticos recomendados3 . La oficina de medicamentos y alimentos de Estados Unidos (FDA) ha lanzado una serie de políticas no vinculantes, para autorizar la comercialización de emergencia de productos diagnósticos que sirven como guía para los laboratorios clínicos, industriales y el personal de la FDA4 . La Sociedad Americana de Microbiología (ASM) también ha presentado unas recomendaciones para evaluación de pruebas diagnósticas5 . Frente a esta situación de necesidades urgentes para contar con pruebas diagnósticas, es crucial contar con lineamientos claros que definan los estándares de oro frente a los cuales se deben establecer los valores de sensibilidad y especificidad de los productos diagnósticos que están siendo comercializados en Colombia y de esta manera evitar que se inviertan recursos escasos en pruebas que con desempeño subóptimo6 . Por esta razón la Asociación Colombiana de Infectología (ACIN) y la Asociación Colombiana de Virología (ACV) crearon un grupo de trabajo con el fin de plantear lo que se considera una posición de expertos para la evaluación y el control de calidad de las pruebas diagnósticas serológicas y moleculares. Dichas pruebas diagnósticas incluyen tanto estuches comerciales como las recomendaciones de secuencias de iniciadores (primers) que se ofertan en paquete por algunos proveedores de reactivos para pruebas moleculares. También se discute el protocolo casero (in-house) del Instituto de Virología Charité de Berlín, el cual estandarizó en Colombia el Instituto Nacional de Salud (INS). Conocer la información adecuada en este aspecto, tiene profundas implicaciones dado que las medidas de salud pública, las decisiones de manejo de pacientes críticos, de la evolución de los casos en tratamiento y conductas de aislamiento tienen como base pruebas de diagnóstico que deben cumplir con los más altos estándares de calidad. El presente documento es un consenso informal de recomendaciones por expertos sobre cuáles deben ser los criterios de evaluación, validación y control externo para las pruebas diagnósticas de infección por SARS CoV-2 y está dirigido a los productores de pruebas, a los laboratorios que las realizan y a los evaluadores de organismos reguladores de los gobiernos a nivel nacional. En la sección 2 se precisan las indicaciones de los diferentes tipos de pruebas disponibles y en la sección 3 se plantean las recomendaciones de criterios de evaluación y control de calidad externo. Teniendo en cuenta que la pandemia por SARS CoV-2 es una situación dinámica y que la evidencia científica se esta generando en forma permanente, este documento estará sujeto a actualizaciones y ajustes en la medida en que aparezca nueva información.
Definición del ámbito de aplicación de las pruebas
Las pruebas de diagnóstico (Figura 1) para la infección por SARS-CoV-2 pueden tener como objetivo:
Detección del ARN viral
Detección de nucleoproteína viral (antígeno)
Detección de anticuerpos específicos tipo IgM, IgG o IgA o pruebas que detectan simultáneamente anticuerpos IgG/IgM
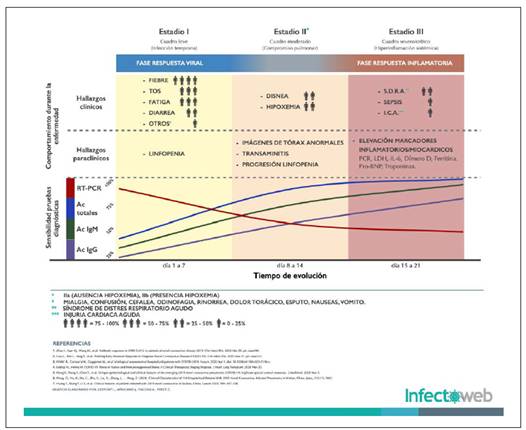
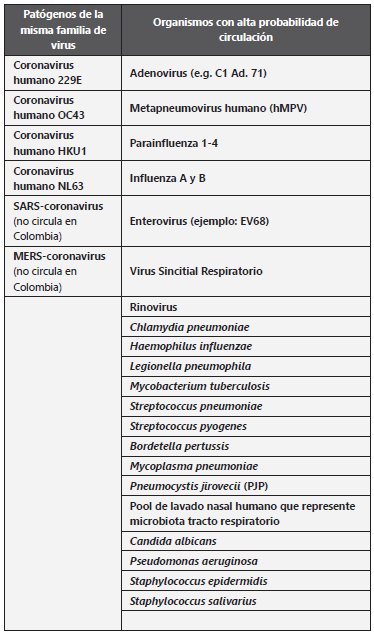
Figura 1 Comportamiento clínico, paraclínico y pruebas diagnosticas en COVID19. Imagen cedida gentilmente por el grupo Infectoweb de Bogotá. Autores: Luis Pablo Lesport, Javier Africano, Álvaro A. Faccini-Martínez y Carlos Eduardo Pérez.
Cada una tiene principios y detectan analitos diferentes (ácidos nucleicos o proteínas del virus o anticuerpos producidos por el hospedero como parte de su respuesta inmune) por lo tanto no es correcto realizar comparaciones de sensibilidad y especificidad entre ellas. Por esa misma razón su utilidad y aplicación debería tener lugar en contextos específicos de diagnóstico clínico, de tamizaje poblacional y de salud ocupacional. Adicionalmente las propiedades de sensibilidad y especificidad pueden variar de una prueba a otra, por lo tanto, cuando se desean hacer recomendaciones basadas en cinética de anticuerpos en diferentes estadios de la infección, es necesario tener en cuenta que la cinética varía de acuerdo a la prueba, algunas pueden tener mayor sensibilidad en determinados momentos y por lo tanto cualquier inferencia sobre aparición de anticuerpos en diferentes momentos de la infección, debe tener en cuenta el método de detección. En la Figura 2 se pueden observar las curvas de evolución de sensibilidad y los intervalos de confianza 95% (IC95%) calculados a partir de varios estudios7-10) que han fundamentado indicaciones sobre el comportamiento y recomendaciones sobre la realización de pruebas en diferentes estadíos de infección11-13. No obstante, estos estudios tienen estimados muy amplios de IC 95%. Sólo uno de ellos presentó intervalos de confianza que permiten estimar la incertidumbre de las recomendaciones. Esto hace urgente establecer tamaños de muestra suficientes para poder definir recomendaciones sobre qué pruebas y en qué momentos deben hacerse.
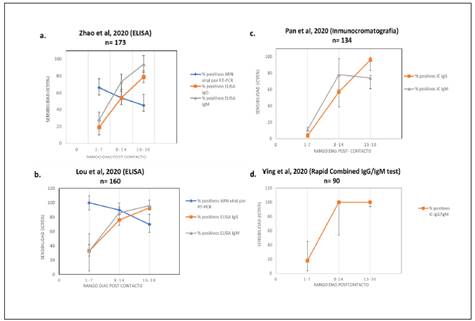
Figura 2 Se calcularon los intervalos de confianza 95% de los valores de sensibilidad de cuatro estudios(7-10) que han fundamentado la mayoría de descripciones de cinética de anticuerpos. Sólo el estudio de Zhao et al (a) calculó los intervalos de confianza, los demás valores (b, c, d) fueron calculados por los miembros de este consenso a partir de los datos presentados por los autores. Se observa que los valores de confianza son muy amplios y no permiten definir con certeza, por ejemplo, si la detección de IgM o IgG es más sensible una con respecto a otra en los primeros 8 días de la infección.
Aplicaciones para detección del genoma viral del SARS CoV-2 por reacción en cadena de la polimerasa por transcriptasa reversa (RT-PCR)
La prueba de detección del ARN del SARS-CoV-2 requiere una prueba RT- qPCR y su interés es:
Detectar contactos de casos confirmados sintomáticos o asintomáticos
Realizar seguimiento a los casos positivos, y evaluar o confirmar casos sospechosos y definir conductas de aislamiento, o en la confirmación de casos negativos iniciales
Diagnóstico diferencial con otras infecciones respiratorias o detectar coinfecciones usando paneles para múltiples patógenos respiratorios
En principio esta prueba debe tener especificidad del 100%, pero su sensibilidad varía dependiendo de factores críticos como el diseño de los genes diana en la amplificación, la duración del seguimiento de los casos negativos, y factores en el procesamiento de la muestra, por lo cual su negatividad no descarta una infección en inicio14-16.
Pruebas que detectan antígeno viral
Existen pruebas inmunocromatográficas que detectan proteínas del virus, sus aplicaciones serían similares a las que detectan el ARN. Sin embargo, está por establecer en qué momento son positivas y las características operativas de estas pruebas. En este consenso no serán discutidas dada la escasa información existente sobre ellas.
Aplicaciones de las pruebas serológicas para detección de anticuerpos IgG o de pruebas combinadas IgG/IgM
Existen diferentes métodos para la detección de IgG tales como la inmunocromatografía, la inmunofluorescencia indirecta (IFI) y ELISA, esta última parece ser más sensible que las otras17,18. Las posibles aplicaciones de este tipo de pruebas son:
Tamizaje poblacional para saber el porcentaje de población expuesto y tomar decisiones sobre levantamientos parciales o definitivos de cuarentena o medidas de contención
Seleccionar población que puede regresar al trabajo al identificar aquellos con prueba de anticuerpos positivos. Sobre este punto es necesario esperar los resultados de evaluación basada en evidencia de la calidad de protección de los anticuerpos19.
Estudios de seroprevalencia para determinar variables epidemiológicas de interés en salud pública, especialmente en estudios de carga y costos de la enfermedad, como la tasa de ataque y el factor de expansión.
Aplicaciones de las pruebas serológicas para detección de anticuerpos IgM
Detección de pacientes con infección reciente
Clasificación del estado de infección en conjunto con la medición de IgG específicos en agudo o convaleciente20.
Recomendaciones de criterios para evaluación de pruebas
Para las pruebas de RT-qPCR SARS CoV 2
El grupo considera se pueden tomar como recomendaciones de base los criterios de FDA con las siguientes precisiones:
Límite de detección (LoD):. Para establecer esta se debe inocular ARN artificial (sintetizado) o ARN de espécimen biológico, cuantificados, en una muestra de pacientes (lavado broncoalveolar o esputo) o en medio de transporte viral. Se recomienda realizar diluciones 1:2 seriadas con tres replicas por dilución y luego confirmar la amplificación final con 20 réplicas. La LoD es la concentración más baja en la cual el replicado 19/20 es positivo5.
Sensibilidad analítica:. Se deben realizar análisis in silico de las secuencias de los cebadores y sondas
Reactividad cruzada (especificidad analítica):. Se debe verificar la lista de organismos según la Tabla 1, los cuales se deben analizar in silico y en lo posible in vitro.
Análisis de interferencia microbiana:. Si el análisis in silico muestra homología ≥ 80% con otros microorganismos se deben realizar estudios de interferencia con sondas para el microorganismo con el cual hay homología. Se deben hacer mínimo tres replicados de un inoculo 3x de la concentración LoD de SARS-CoV-2 y con alto nivel de interferencia del microorganismo completo o ácido nucleico.
Análisis de interferencia con sustancias endógenas: . Se recomienda método de Boom y métodos de extracción basados en columna 21.
Utilización de muestras clínicas:. Se recomienda realizar pruebas con por lo menos 30 muestras clínicas reactivas y 30 no-reactivas seleccionadas de manera aleatoria enmascarada. Las muestras se pueden fabricar utilizando matrices clínicas limpias y contaminadas artificialmente con ARN sintético. Se deben informar los resultados de LoD con diluciones seriadas en base 2.
Estuches para extracción de ARN Viral.. La obtención de ARN viral de calidad es un paso crítico en la prueba de qRT-PCR. Existen diferentes métodos de extracción que pueden ser manuales o automatizados, con perlas magnéticas, diferentes tipos de columnas o con adición de tampón de lisis que libere el ácido nucleico. Cualquiera que sea el método de extracción, es recomendable que sean evaluados y optimizados para la extracción de SARS-CoV-2 en diferentes tipos de muestras.
Recomendaciones para la evaluación de pruebas serológicas para IgG, IgM o IgA
Las pruebas de anticuerpos buscan detectar la respuesta inmune humoral de los pacientes cuyos títulos aumentan según avanza la infección9,17. Ofrecen la posibilidad de detectar enfermedad activa de varios días de evolución, pero no excluyen la posibilidad de continuar transmitiendo el virus17,22. Los datos sobre el curso de la infección, han mostrado que los anticuerpos comienzan a producirse a partir del 6º día del inicio de los síntomas y que simultáneamente se presenta un descenso en la carga viral9,23,24. Aunque la prueba estándar de oro debería llevarse a cabo con pruebas de reducción de placas por neutralización (PRNT) esta requiere del virus SARS CoV-2 aislado y cultivo viral17. Dada la limitación para cultivar este virus, este grupo considera que un estándar de oro alterno sería realizar validación con los siguientes grupos de sueros y estimando tamaños de muestra suficientes para establecer la aplicabilidad de la prueba en diferentes condiciones:
Criterios de selección de sueros para establecer sensibilidad de la prueba: Toda prueba debe tener una evaluación de sensibilidad utilizando muestras de sueros, en igual proporción de casos sintomáticos y asintomáticos y de rangos de edad y género, similares a lo que se encuentra en la población general. Los sueros deben corresponder a personas con infección confirmada por RT-qPCR y se deben especificar los días post exposición, según los siguientes grupos: día 1 a 8, día 9 a 15 y día 16 a 30, después de contacto estimado con caso positivos para SARS-CoV-2.
Criterios de selección de sueros para establecer especificidad: Toda prueba deber establecer su especificidad con sueros de la misma población previos al informe de inicio de casos en el país. Los sueros deben corresponder a las características de la población en la cual se van a aplicar las pruebas.
Tamaño de muestra para establecer sensibilidad y especificidad: Los ensayos se deben realizar con un número de muestras de verdaderos positivos y verdaderos negativos estimados a partir de una prueba unilateral, para lo cual se requeriría estimar los falsos positivos probables en esa prueba y la prevalencia esperada en la muestra estructurada por el investigador25-27. Se debe elegir un valor de razones de verosimilitud o likelihood ratios (LR) positivo contemplando el nivel de errores alfa y beta que se considere adecuado25. Los reportes de sensibilidad y especificidad deben incluir los valores de IC95% de cada uno de ellos27.
Programas de control de calidad para las pruebas diagnósticas de infección por SARS CoV-2
Programa de control de calidad para las pruebas de detección de SARS CoV- 2 por RT-PCR prueba detección de SARS-CoV-2
Se deben realizar controles de calidad internos y externos por el laboratorio nacional de referencia en las instituciones que están realizando pruebas de RT-PCR caseras, al menos cada 200 pruebas con un panel de muestras inoculadas artificialmente con plásmido control conteniendo inserto del producto a amplificar. Las matrices comerciales para control de calidad externo podrían utilizarse una vez estén validadas y disponibles.
Programa de control de calidad para pruebas serológicas
Todas las pruebas serológicas se deben realizar con controles internos, positivos y negativos en cada montaje. Se deben realizar controles de calidad externos con muestras positivas y negativas enviadas a cada laboratorio que realiza pruebas de diagnóstico serológico. El control externo se puede hacer mensual si hay alto volumen, bimensual o trimestral si es bajo el volumen de muestras.
Conclusiones
El diagnóstico de la infección por SARS CoV-2 es la piedra angular para la toma de decisiones adecuadas en el manejo y control de la pandemia. Las pruebas de amplificación de ARN viral (RT-qPCR) y detección de anticuerpos contra el virus, tienen diferentes alcances y su implementación e interpretación deberá estar ajustado al contexto clínico o epidemiológico. La validación, verificación y control de calidad de pruebas “in house” y pruebas diagnósticas comerciales, es mandatorio para garantizar resultados confiables y oportunos. Para pruebas de amplificación molecular deben seguirse las recomendaciones de la FDA y para las pruebas serológicas, las validaciones se realizarán con sueros que cumplan con criterios de sensibilidad, especificidad y un tamaño de muestra adecuado que permita calcular adecuadamente el rendimiento de la prueba.
La OMS el 8 de abril de 2020 realizó una declaración de posición, por su grupo de expertos, a la luz de la evidencia disponible en el momento, sobre las pruebas rápidas y las serológicas, incluyendo ELISA y estableció que estas pruebas por ahora sólo se deben utilizar en contexto de investigación, según afirma esta declaración: “Estas pruebas no deben ser usadas para decisiones clínicas, hasta que exista una evidencia disponible para las indicaciones específicas” (28. El 13 de abril el Ministerio de Salud de Colombia emitió lineamientos sobre el uso de pruebas diagnósticas en Colombia en el mismo sentido de la OMS, recomendando el uso de pruebas serológicas sólo para estudios epidemiológicos y no para decisiones clínicas29. Por ello, las recomendaciones que hemos hecho en este consenso buscan justamente dar orientación para que se pueda obtener la información requerida y tener pruebas de diagnóstico clínico de alta calidad.











 text in
text in