Introducción
Con base en nueva evidencia con importantes implicaciones en las recomendaciones el Comité del Consenso decidió llevar a cabo sesión de análisis, discusión y votación de actualización el 27 de Junio de 2020 para las siguientes recomendaciones las cuales serán incorporadas a la nueva versión del consenso:
GRUPO III CLASIFICACIÓN
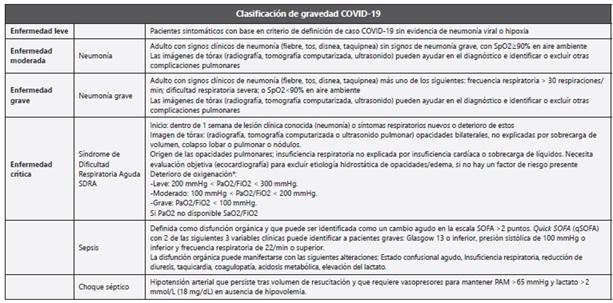
III.2. ¿Cuáles son las categorías clínicas de la infección por SARS-CoV-2/COVID-19 de acuerdo con la gravedad?
Los posibles síndromes que se han identificado en el paciente con infección por SARS-CoV-2/COVID-19 han sido adaptados por parte de la OMS del documento Gestión clínica de la infección respiratoria aguda grave cuando se sospecha de infección por SARS-CoV (OMS, 2020)1 , los cuales se describen a continuación:
Recomendaciones
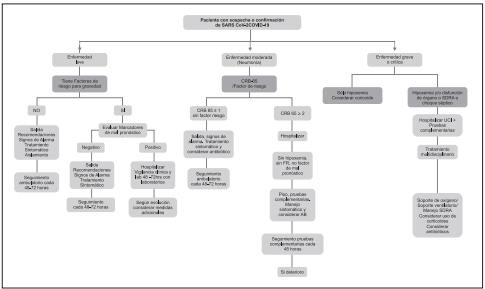
Se recomienda la clasificación de la infección por SARSCoV-2/COVID-19 de acuerdo con la gravedad en todos los escenarios de atención en salud.
Fuerte a favor
Se recomienda la clasificación por nivel de gravedad que incluye los siguientes tipos: enfermedad leve, moderada, grave y crítica. Para el caso de pacientes críticos se deberá seleccionar la clasificación con mayor gravedad (Síndrome de Dificultad Respiratoria Aguda, sepsis y choque séptico)
Fuerte a favor
Referencias
1. World Health Organization. Clinical management of COVID-19: interim guidance 27 may 2020
GRUPO IV. DIAGNÓSTICO
IV.1 ¿Cuáles son las pruebas diagnósticas para establecer caso confirmado por SARS-CoV-2/ COVID-19?
Se recomienda la realización de RT-PCR de SARS-CoV-2/ COVID-19 a muestras de esputo, aspirado nasofaríngeo, orofaríngeo, aspirado traqueal o hisopado nasofaríngeo u orofaríngeo, o dos muestras de hisopado según disponibilidad de hisopos.
Fuerte a favor
Puntos de buena práctica:
Se considera que la mejor muestra es el aspirado traqueal seguido de nasofaringe
En caso de tomar dos muestras de hisopado, usar hisopos independientes, los hisopos deben ir embalados en un solo medio de transporte.
En caso de tomar hisopado nasofaríngeo hacerlo por ambas fosas nasales.
IV.1 ¿Cuándo se deberían usar los paneles respiratorios de detección molecular que incluyen SARS-CoV-2 en pacientes con sospecha de infección por SARS-CoV-2/COVID-19?
Se recomienda realizar paneles respiratorios de detección molecular (Paneles de microorganismos respiratorios) que incluyen SARS-CoV-2 en pacientes hospitalizados con sospecha de infección por SARS-CoV-2/COVID-19 como alternativa diagnóstica, si está disponible y protocolizada en la institución de salud.
Fuerte a favor
IV.2 ¿Se deberían usar pruebas moleculares en el paciente asintomático con contacto positivo?
Se recomienda el empleo de pruebas moleculares para el estudio de contactos asintomáticos dentro de los 7 a 14 días del contacto.
Fuerte a favor
Recomendación que se retira
Se sugiere realizar pruebas serológicas IgG/IgM a personas asintomáticas con historia de contacto estrecho con casos sospechosos o confirmados de COVID-19, como mecanismo de gestión de riesgo, al cumplir los 14 días de aislamiento o cuarentena, donde estas se encuentren disponibles.
Débil a favor
Referencias
2. Zou L, Ruan F, Huang M, et al. SARS-CoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. N Engl J Med. 2020;382(12):1177-1179. doi:10.1056/NEJMc2001737
3. Touzard-Romo F , Tapé Ch, Lonks J. Co-infection With SARS-CoV-2 and Human Metapneumovirus. R I Med J (2013). 2020 Mar 19;103(2):75-76.
4. Echenique I, et al. Clinical characteristics and outcomes in hospitalized patients with respiratory viral co-infection during the 2009 H1N1 influenza pandemic. PLoS One. 2013 Apr 9;8(4).2.
5. Lai, C. C., Wang, C. Y., & Hsueh, P. R. (2020). Co-infections among patients with COVID-19: The need for combination therapy with non-anti-SARSCoV-2 agents?. Journal of microbiology, immunology, and infection = Wei mian yu gan ran za zhi, S1684-1182(20)30127-4. Advance online publication. https://doi.org/10.1016/j.jmii.2020.05.013
6. Lin D, et al. Co-infections of SARS-CoV-2 with multiple common respiratory pathogens in infected patients. Sci China Life Sci. 2020 Mar 5.3.
7. Attwood L, et al. Clinical evaluation of AusDiagnostics SARS-CoV-2 multiplex tandem PCR assay. Journal of Clinical Virology 128 (2020)104448
8. Vos LM, Bruning AHL, Reitsma JB, et al. Rapid Molecular Tests for Influenza, Respiratory Syncytial Virus, and Other Respiratory Viruses: A Systematic Review of Diagnostic Accuracy and Clinical Impact Studies. Clin Infect Dis. 2019;69(7):1243-1253. doi:10.1093/cid/ciz056
9. Lai CC, Liu YH, Wang CY, Wang YH, Hsueh SC, Yen MY, Ko WC, Hsueh PR. Asymptomatic carrier state, acute respiratory disease, and pneumonia due to severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2): Facts and myths. J Microbiol Immunol Infect. 2020 Mar 4. pii: S1684- 1182(20)30040-2. doi:10.1016/j.jmii.2020.02.012. [Epub ahead of print]
10. Guan WJ, Ni ZY, Hu Y, Laing WH, Ou CQ, He JX, et al. Clinical characteristics of 2019 novel coronavirus infection in China. medRxiv 2020 Feb 9. https://doi.org/10.1101/2020.02.06.20020974.
11. R. Li et al., Substantial undocumented infection facilitates the rapid dissemination of novel coronavirus (SARS-CoV2). Science 10.1126/science.abb3221 (2020).
12. Ferguson et al. (2020), Impact of non-pharmaceutical interventions (NPIs) to reduce COVID-19 mortality and healthcare demand.Imperial College COVID-19 Response Team.
13. Li P, Fu J-Bo, Li K-Feng, Chen Y, Wang H-Ling, Liu L-Jie, Liu J-Nan, Zhang Y-Li, Liu S-Lan, Tang A, Tong Z-Dong, Yan J-Bo, Transmission of COVID-19 in the terminal stage of incubation period: a familial cluster, International Journal of Infectious Diseases (2020), doi: https://doi.org/10.1016/j. ijid.2020.03.027
14. Staines H, et al. Dynamics of IgG seroconversion and pathophysiology of COVID:19 infections. medRxiv preprint https://doi.org/10.1101/2020.06.07.20124636
15. Quan-Xin L, et al. Clinical and immunological assessment of asymptomatic SARS-CoV-2 infections. Nature medicine 2020. 18 Jun. https://doi.org/10.1038/s41591-020-0965-6
16. Iwen P. Safety Considerations in the Laboratory Testing of Specimens Suspected or Known to Contain the Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2). Am J Clin Pathol 2020;XX:1-4 DOI: 10.1093/AJCP/AQAA047.
GRUPO V. MANEJO
V.A.1 ¿Cuáles son los medicamentos utilizados para infección por SARS-Cov-2/COVID-19?
Se sugiere evitar el uso de corticosteroides de manera rutinaria en pacientes con infección por SARS-CoV-2.
Débil en contra
Se recomienda el uso de dexametasona en pacientes con requerimiento de oxígeno o ventilación mecánica preferiblemente con más de 7 días desde el inicio de síntomas.
Fuerte a favor
Puntos de buena práctica uso corticoides:
Considerar el uso de corticoides con otras indicaciones diferentes a COVID-19 en las cuales se considere eficaz (exacerbación de EPOC, crisis asmática, shock séptico con uso de dosis altas de vasopresores, insuficiencia adrenal, etc.).
Para el uso de dexametasona se debe descartar infección por Influenza; en caso de que se documente esta, no se debe usar el medicamento.
En caso de no disponibilidad de dexametasona se pueden utilizar dosis equivalentes de metilprednisolona, hidrocortisona o prednisolona.
En pacientes que reciban esteroides se es deseable el uso de ivermectina para profilaxis de infección por Strongyloides stercolaris.
Tabla 2
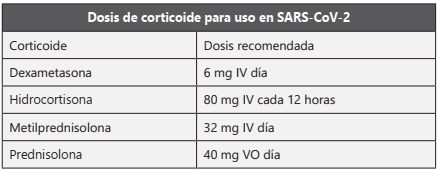
Se recomienda que la duración del tratamiento con corticoide sea hasta por 10 días. Los pacientes que reciban esta terapia deben ser desparasitados con ivermectina 1 gota/Kg dosis única vía oral. IV intravenoso. VO Vía oral.
Tocilizumab
Se sugiere el uso de tocilizumab en pacientes que no respondieron a esteroides o tienen contraindicación para su uso y en quienes se cumplan todos los siguientes criterios:
Más de 7 días de evolución de los síntomas.
Deterioro respiratorio (evidente requerimiento de soporte ventilatorio o aumento en requerimiento de parámetros ventilatorios, en pacientes que ya se encuentran en ventilación mecánica).
Niveles de interleuquina 6 > 40 pg/mL en donde estén disponibles o alternativamente niveles de dímero D mayores a 1500.
2 de 3 de los siguientes:
PCR > 100 mg/L o > 50 mg/L, si su valor se duplicó en las últimas 48 hrs.
LDH > 250 UI/ml.
Recuento absoluto de linfocitos < 600 cels/mm3
Haber descartado otros posibles focos de infección aparte del SARS-CoV-2.
Discusión del caso por parte de una Junta multidisciplinaria con al menos participación de 3 especialidades (hematología, infectología, medicina interna, pediatría, neumología, cuidado intensivo, reumatología, urgenciología, inmunología clínica).
Débil a favor
Puntos de buena práctica uso de tocilizumab:
Se deben tener en cuenta las contraindicaciones para el uso de tocilizumab: recuento absoluto de neutrófilos menor a 500 cel/ml, recuento plaquetario menor a 50.000cel/ml, diverticulitis activa, enfermedad inflamatoria intestinal u otra condición que predisponga a perforación intestinal, disfunción hematológica, renal o hepática severa y tuberculosis activa.
Dosis de Tocilizumab para uso en SARS-CoV-2
8 mg/kg (dosis máxima de 800 mg) IV, como máximo 3 dosis con intervalo de 8 a 12 hrs
Recomendaciones que se retiran
No se emite recomendación a favor o en contra para el uso de corticosteroides en casos de infección por SARSCoV-2.
No hay consenso para emitir una recomendación ni a favor ni en contra para el uso de tocilizumab en pacientes con infección por SARS-CoV-2/COVID-19.
Referencias nuevas para corticoides
17. Horby P, Lim WS, Emberson J, Mafham M, Bell J, Linsell L, et al. Effect of Dexamethasone in Hospitalized Patients with COVID-19: Preliminary Report. medRxiv [Internet]. 2020 Jan 1;2020.06.22.20137273. Available from: http://medrxiv.org/content/ear ly/2020/06/22/2020.06.22.20137273.abstract
Referencias nuevas para tocilizumab
18. Price CC, Altice FL, Shyr Y, Koff A, Pischel L, Goshua G, Azar MM, Mcmanus D, Chen SC, Gleeson SE, Britto CJ, Azmy V, Kaman K, Gaston DC, Davis M, Burrello T, Harris Z, Villanueva MS, Aoun-Barakat L, Kang I, Seropian S, Chupp G, Bucala R, Kaminski N, Lee AI, LoRusso PM, Topal JE, Dela Cruz C, Malinis M.Tocilizumab Treatment for Cytokine Release Syndrome in Hospitalized COVID-19 Patients: Survival and Clinical Outcomes Chest 2020 Jun 15;S0012-3692(20)31670-6
19. Guaraldi, G; Meschiari, M; Cozzi-Lepri, A; Milic, J; Tonelli, R; Menozzi, M; Franceschini, E; Cuomo, G; Orlando, G; Borghi, V; Santoro, A; Di Gaetano, M; Puzzolante, C; Carli, F; Bedini, A; Corradi, L; Fantini, R; Castaniere, I; Tabbì, L; Girardis, M; Tedeschi, S; Giannella, M; Bartoletti, M; Pascale, R; Dolci, G; Brugioni, L; Pietrangelo, A; Cossarizza, A; Pea, F; Clini, E; Salvarani, C; Massari, M; Viale, Pl; Mussini, C. Tocilizumab in patients with severe COVID-19: a retrospective cohort study. Lancet Rheumatol June 24, 2020 https://doi.org/10.1016/S2665-9913(20)30173-9
20. Eschenauer GA, Troost JP, Golob JL, Gandhi TN, Wang L, Zhou N, Petty LA, Baang JH, Dillman NO, Frame D, Gregg KS, Kaul DR, Nagel J, Patel TS, Zhou S, Lauring AS, Hanauer DA, Martin E, Sharma P, Fung CM, Pogue JM. Tocilizumab for Treatment of Mechanically Ventilated Patients With COVID-19 MedRxiv2020 Jun 3;2020.05.29.20117358.
VI. POBLACIONES ESPECIALES
VI.2. GESTANTES
VI.2.8 ¿Se debe realizar tamización para infección por SARS-CoV-2/COVID-19 en gestantes asintomáticas en trabajo de parto?
No se emite recomendación a favor o en contra de la tamización con pruebas diagnósticas en gestantes asintomáticas en trabajo de parto.
Punto de buena práctica:
VI.4. INMUNOSUPRIMIDOS
VI.4.15. ¿En qué casos debe modificarse o posponerse la indicación de trasplante de progenitores hematopoyético u órgano sólido?
Potenciales receptores de órganos sólidos
Punto de buena práctica:
En potenciales receptores de trasplante de órgano sólido de donante fallecido o vivo, y en donantes de trasplante de órgano solido vivo que son casos confirmados de infección por SARS-CoV-2/COVID-19, diferir el trasplante hasta que cumplan un periodo mínimo de aislamiento de dos (2) semanas desde el inicio de los síntomas o 14 días desde la realización del test diagnóstico para asintomáticos. Los donantes y receptores de trasplante de órgano sólido deben estar asintomáticos al momento de trasplante y deben tener al menos una RT-PCR negativa.
VI.4.16. ¿Qué pacientes adultos asintomáticos con tumores sólidos requieren tamización para SARSCoV-2/COVID-19 previo al inicio de tratamiento oncológico?
Se recomienda tamización en los pacientes con tumores sólidos que van a ser sometidos a terapia inmunosupresora, terapias biológicas de larga duración o inmunoterapia celular y en todos aquellos pacientes con cáncer que van a iniciar terapia activa que tienen factores de alto riesgo para complicaciones y mortalidad por SARSCoV-2/COVID-19
Fuerte a favor
VI.4.17. ¿Cuál es el método de elección para tamización de SARS-CoV-2/COVID-19 en pacientes asintomáticos con tumores sólidos o neoplasias hematológicas?
Se recomienda como método de tamización en pacientes asintomáticos con neoplasias hematológicas o tumores sólidos la RT-PCR SARS-CoV-2/COVID-19.
Fuerte a favor
VI.4.18. ¿Cómo debe realizarse el seguimiento en pacientes asintomáticos con cáncer que requieren cirugía, tratamiento oncológico o tratamiento para neoplasias hematológicas, sin contacto positivo y que cuentan con una RT PCR para SARS-CoV-2/ COVID-19 positiva previamente?
Fuerte en contra
Punto de buena práctica:
Se considerará resolución de la infección pasados 14 días desde la positividad de la prueba, siempre y cuando el paciente continúe asintomático sin contactos positivos. A partir de este momento se podrá iniciar tratamiento individualizando cada caso, según la urgencia del tratamiento y balance riesgo/beneficio.
VI.4.19. ¿Qué pacientes adultos con neoplasias hematológicas asintomáticos requieren tamización para SARS-CoV-2/COVID-19 previo al inicio de tratamiento de quimioterapia?
Se recomienda en los pacientes con neoplasias hematológicas la realización de pruebas para SARS-CoV-2/ COVID-19 con RT-PCR previo al inicio de cada ciclo de quimioterapia, haciendo una priorización según el riesgo de complicaciones.
Fuerte a favor
Punto de buena práctica:
Todos los pacientes que se hospitalicen en forma electiva para recibir tratamiento deberán tener una prueba de SARS-CoV-2/COVID-19 negativa, mínimo 72 horas antes de iniciar el tratamiento. El reporte de estos estudios debe estar disponible máximo 48-72 horas después de haber sido obtenida la muestra para ser oportuna en la toma de decisiones médicas. En caso de no tener disponible RT PCR, se podrá realizar la encuesta de salud estandarizada.
Definir la priorización según lo siguiente:
Prioridad 1:
Pacientes asintomáticos con diagnóstico reciente de leucemia aguda o síndrome mielodisplásico (SMD) de alto riesgo, que vayan a iniciar tratamiento mielo ablativo de inducción.
Pacientes asintomáticos con diagnóstico reciente de Linfoma de Burkitt y linfoblástico que requieren regímenes similares a los usados en leucemias agudas.
Pacientes asintomáticos con aplasia medular con indicación de terapia activa con trasplante o inmunosupresora.
Pacientes con neoplasias hematológicas que requieran hospitalización por complicaciones relacionadas con la quimioterapia, en especial quienes consultan con neutropenia febril.
Pacientes asintomáticos que vayan a recibir quimioterapias de consolidación para leucemias.
Los pacientes con alto riesgo por comorbilidades o edad >60 años, en quienes se esté planeando el inicio de quimioterapia mielosupresora.
Prioridad 2:
Mieloma múltiple/macroglobulinemia de Waldëstrom/ Leucemia Células plasmáticas/Amiloidosis de diagnóstico reciente o recaída que requiera protocolos altamente inmosupresores (dosis altas de esteroides).
Pacientes con linfomas agresivos o en recaída que requieran terapias con platinos o dosis altas de MTX y/o citarabina, altamente aplasiante
Prioridad 3:
Linfoma de Hodgkin ABVD o similares si han tenido contactos sospechosos.
Linfoma no Hodgkin CHOP o similares si han tenido contactos sospechosos.
SMD de bajo riesgo o Neoplasias Mieloproliferativas Crónicas (MPC) si han tenido contactos sospechosos.
VI.4.20. ¿Los pacientes y donantes adultos y pediátricos asintomáticos candidatos para trasplante de progenitores hematopoyéticos requieren tamización para SARS-CoV-2/COVID-19 previo al inicio de tratamiento del trasplante?
Se recomienda que todos los procedimientos de trasplante sean precedidos de una prueba RT-PCR negativa para el donante y el receptor de progenitores hematopoyéticos, con vigencia máxima de una semana antes de iniciar cualquier procedimiento de trasplante, asegurando que se hayan cumplido las condiciones de estricto aislamiento después de la toma de la muestra.
Fuerte a favor
VI.4.21. ¿Es necesaria la realización de tamización para SARS-CoV-2/COVID- 19 a los pacientes pediátricos con neoplasias que requieran quimioterapia y/o radioterapia?
No se genera recomendación a favor o en contra de la realización de la tamización en pacientes pediátricos asintomáticos.
Punto de buena práctica:
En cada centro se debe evaluar la relación riesgo-beneficio del retraso de la quimioterapia de acuerdo a la toma y reporte oportuno de la prueba. En caso de realizar tamización está indicado la toma de RT-PCR.
VI.4.22. ¿Es necesario realizar RT PCR para SARSCoV-2/COVID-19 en el estudio inicial de la neutropenia febril en los pacientes pediátricos con patología hemato-oncológica?
Se recomienda realizar RT PCR para SARS-CoV-2/COVID-19 a los pacientes pediátricos con patología hemato-oncológica que presenten neutropenia y fiebre, en quien durante la valoración inicial no se encuentre otra causa, independientemente si presentan síntomas respiratorios o no.
Fuerte a favor
Punto de buena práctica:
Se considera realizar RT PCR para SARS-CoV-2/COVID-19 a los pacientes pediátricos con patología hemato-oncológica que cumplan los criterios de caso sospechoso de paciente pediátrico.
VI.4.23. ¿Es necesario realizar RT PCR para SARS-CoV-2/ COVID-19 a los acompañantes asintomáticos de los pacientes pediátricos con neoplasias que requieran manejo con quimioterapia radioterapia y/o trasplante de progenitores hematopoyéticos?
No se emite recomendación a favor ni en contra, en cuanto a realizar tamización para SARS-CoV-2/COVID-19 con RT-PCR en acompañantes asintomáticos de los pacientes pediátricos que se hospitalicen en las unidades de hemato-oncológicas o de trasplante de progenitores hematopoyéticos.
Puntos de buena práctica:
En caso de considerar realizar la prueba, se debe tener en cuenta la oportunidad del resultado de la misma y la prevalencia de la infección por SARS-CoV-2/COVID-19.
En los casos a los que se realice prueba, si el resultado es negativo, dado que este resultado no descarta la infección, se deben continuar utilizando las medidas de protección personal definidAs por el Consenso Nacional.
Se aconseja que los acompañantes no sean de una edad >60 años o con comorbilidades asociadas, y deben seguirse de forma estricta las medidas de protección recomendadas por el consenso en la sección correspondiente.
Todos los acompañantes antes de ingresar al hospital deben realizar la encuesta Epidemiológica y de síntomas, con resultado negativo.
LA RECOMENDACIÓN QUE SE AJUSTÓ EN ESTE CONSENSO ES UNA DE LAS CORRESPONDIENTES A LA PREGUNTA VI.4.15. DE INMUNOSUPRIMIDOS,
Potenciales receptores de órganos sólidos
Se recomienda diferir el trasplante en un potencial receptor de trasplante de órgano solido con enfermedad activa por SARS-COV2/ COVID-19 por un periodo mínimo de 3 semanas. Para reingresar a lista de trasplante se debe encontrar asintomático, tener al menos una RT-PCR SARS-CoV-2 negativa y seroconversión de anticuerpos.
Fuerte a favor
Referencias
21. Sutton D, Fuchs K, D’Alton M, Goffman D. Universal Screening for SARSCoV-2 in Women Admitted for Delivery. N Engl J Med. 2020;382(22):2163- 2164. doi:10.1056/NEJMc2009316.
22. Bianco A, Buckley AB, Overbey J, et al. Testing of Patients and Support Persons for Coronavirus Disease 2019 (COVID-19) Infection Before Scheduled Deliveries [published online ahead of print, 2020 May 19]. Obstet Gynecol. 2020;10.1097/AOG.0000000000003985. doi:10.1097/AOG.0000000000003985.
23. Breslin N, Baptiste C, Gyamfi-Bannerman C, et al. COVID-19 infection among asymptomatic and symptomatic pregnant women: Two weeks of confirmed presentations to an affiliated pair of New York City hospitals [published online ahead of print, 2020 Apr 9]. Am J Obstet Gynecol MFM. 2020;2(2):100118. doi:10.1016/j.ajogmf.2020.100118.
24. Principles for the testing and triage of women seeking maternity care in hospital settings, during the COVID-19 pandemic. Royal College of Obstetricians and Gynaecologists. 29 May 2020.
25. Yu J, Ouyang W, Chua MLK, Xie C. SARS-CoV-2 Transmission in Patients With Cancer at a Tertiary Care Hospital in Wuhan, China. JAMA Oncol. 2020.
26. Rogado J, Obispo B, Pangua C. Covid-19 Transmission, Outcome and Associated Risk Factors in Cancer Patients at the First Month of the Pandemic in a Spanish Hospital in Madrid. Clin Transl Oncol. 2020.
27. Al-Shamsi HO, Coomes EA, Alrawi S. Screening for COVID-19 in Asymptomatic Patients With Cancer in a Hospital in the United Arab Emirates. JAMA Oncol. 2020.
28. Desai A, Sachdeva S, Parekh T, Desai R. COVID-19 and Cancer: Lessons From a Pooled Meta-Analysis. JCO Glob Oncol. 2020;6:557-9.
29. Emami A, Javanmardi F, Pirbonyeh N, Akbari A. Prevalence of Underlying Diseases in Hospitalized Patients with COVID-19: a Systematic Review and Meta-Analysis. Arch Acad Emerg Med. 2020;8(1):e35.
30. Montopoli M, Zumerle S, Vettor R, Rugge M, Zorzi M, Catapano CV, et al. Androgen-deprivation therapies for prostate cancer and risk of infection by SARS-CoV-2: a population-based study (N = 4532). Ann Oncol. 2020.
31. He W, Chen L, Yuan G, Fang Y, Chen W, Wu D, et al. COVID-19 in persons with haematological cancers. Leukemia. 2020;34(6):1637-45.
32. Zhang L, Zhu F, Xie L, Wang C, Wang J, Chen R, et al. Clinical characteristics of COVID-19-infected cancer patients: a retrospective case study in three hospitals within Wuhan, China. Ann Oncol. 2020.
33. Lee LYW, Cazier JB, Starkey T, Turnbull CD, Kerr R, Middleton G, et al. COVID-19 mortality in patients with cancer on chemotherapy or other anticancer treatments: a prospective cohort study. Lancet. 2020.
34. Hatzl S, Eisner F, Schilcher G, Kreuzer P, Gornicec M, Eller P, et al. Response to “COVID-19 in persons with haematological cancers”. Leukemia. 2020.
35. Aries JA, Davies JK, Auer RL, Hallam SL, Montoto S, Smith M, et al. Clinical outcome of coronavirus disease 2019 in haemato-oncology patients. Br J Haematol. 2020.
36. Venkatesulu BP, Chandrasekar VT, Girdhar P, Advani P, Sharma A, Elumalai T, et al. A systematic review and meta-analysis of cancer patients affected by a novel coronavirus. medRxiv. 2020.
37. Bouffet E, Challinor J, Sullivan M, Biondi A, Rodriguez-Galindo C, Pritchard-Jones K. Early advice on managing children with cancer during the COVID-19 pandemic and a call for sharing experiences. Pediatr Blood Cancer. 2020;67(7):e28327.
38. Dong Y, Mo X, Hu Y, Qi X, Jiang F, Jiang Z, et al. Epidemiology of COVID-19 Among Children in China. Pediatrics. 2020;145(6) .
39. González-Dambrauskas S, Vásquez-Hoyos P, Camporesi A, Díaz-Rubio F, Piñeres-Olave BE, Fernández-Sarmiento J, et al. Pediatric Critical Care and COVID19. Pediatrics. 2020.
40. Cruz AT, Zeichner SL. COVID-19 in Children: Initial Characterization of the Pediatric Disease. Pediatrics. 2020;145(6) .
41. Kotecha RS. Challenges posed by COVID-19 to children with cancer. Lancet Oncol. 2020;21(5):e235.
42. de Rojas T, Pérez-Martínez A, Cela E, Baragaño M, Galán V, Mata C, et al. COVID-19 infection in children and adolescents with cancer in Madrid. Pediatr Blood Cancer. 2020;67(7):e28397.
Hrusak O, Kalina T, Wolf J, Balduzzi A, Provenzi M, Rizzari C, et al. Flash survey on severe acute respiratory syndrome coronavirus-2 infections in paediatric patients on anticancer treatment. Eur J Cancer. 2020;132:11-6.
44. André N, Rouger-Gaudichon J, Brethon B, Phulpin A, Thébault É, Pertuisel S, et al. COVID-19 in pediatric oncology from French pediatric oncology and hematology centers: High risk of severe forms? Pediatr Blood Cancer. 2020;67(7):e28392.
45. Sullivan M, Bouffet E, Rodriguez-Galindo C, Luna-Fineman S, Khan MS, Kearns P, et al. The COVID-19 pandemic: A rapid global response for children with cancer from SIOP, COG, SIOP-E, SIOP-PODC, IPSO, PROS, CCI, and St Jude Global. Pediatr Blood Cancer. 2020;67(7):e28409.
46. ASCO SPECIAL REPORT: A GUIDE TO CANCER CARE DELIVERY DURING THE COVID-19 PANDEMIC MAY 19, 20202020.
47. ESMO Recommendiations: Cancer patient managment during COVID-19 pandemic. General Introduction. Slides sets [Internet]. 2020.
48. SEOM. Posicionamiento-Recomendaciones SEOM sobre el cribado serológico previo al inicio de una quimioterapia inmunosupresora durante la pandemia COVID19. Pacientes asintomáticos sin infección conocida. https://seom.org/images/Posicionamiento_TESTS_COVID_QUIMIO.pdf: SEOM 2020.
49. Actuación frente a covid19 en receptores de trasplante de progenitores hematopoyeticos y pacientes oncohematológicos. Versión 5. Abril 22 20202020.
50. Recomendaciones de actuación en cirugía oncológica esófago-gástrica durante la pandemia covid-19 (V3, 2-4- 2020)2020.
51. Cirujanos SdCdlAEd. Recomendaciones de actuación en cirugía oncológica del area hepatobiliopancreática durante la pandemia covid-19 2020.
52. Statement on COVID-19 from the European Cancer Organisation’s Board of Directors2020.
53. Roques T. Guidance on SARS-CoV-2 antigen testing for asymptomatic healthcare workers (HCW) and patients in non-surgical oncology in the UK2020.
54. Restivo A, De Luca R, Spolverato G, Delrio P, Lorenzon L, D’Ugo D, et al. The need of COVID19 free hospitals to maintain cancer care. Eur J Surg Oncol. 2020;46(6):1186-7.
55. CORONAVIRUS DISEASE COVID-19: EBMT RECOMMENDATIONS 2020; VERSION 8 - MAY 18, 2020.
56. EBMT. Coronavirus Disease EBMT Recommendations.2020; VERSION 8 - MAY 18, 2020.
57. Dong Y, Mo X, Hu Y, et al. Epidemiological characteristics of 2143 pediatric patients with 2019 coronavirus disease in China. Pediatrics. 2020; doi: 10.1542/peds.2020-0702.
58. De Rojas T, Pérez-Martínez A, Cela E, et al. COVID-19 infection in children and adolescents with cancer in Madrid. Pediatr Blood Cancer. 2020;67(7):e28397. doi:10.1002/pbc.28397.
59. He Y, Lin Z, Tang D, Yang Y, Wang T, Yang M. Strategic plan for management of COVID-19 in paediatric haematology and oncology departments. Lancet Haematol. 2020;7(5):e359‐e362. doi:10.1016/S2352-3026(20)30104-6.
60. Docherty AB, Harrison EM, Green CA, et al. Features of 20133 UK patients in hospital with covid-19 using the ISARIC WHO Clinical Characterisation Protocol: prospective observational cohort study. BMJ. 2020;369:m1985. Published 2020 May 22. doi:10.1136/bmj.m1985.
61. Kuderer NM, Choueiri TK, Shah DP, Shyr Y, Rubinstein SM, Rivera DR, et al. Clinical impact of COVID-19 on patients with cancer (CCC19): a cohort study. Lancet, mayo 28; 2020 https://doi.org/10.1016/ S0140-6736(20)31187-9.
62. Lee LYW, Cazier JP, Starkey T, Turnbull CD. UK Coronavirus Cancer Monitoring Project Team, Rachel Kerr, Gary Middleton. COVID-19 mortality in patients with cancer on chemotherapy or other anticancer treatments: a prospective cohort study. Lancet, mayo 28; 2020.
63. Williamson E, Walker AJ, Bhaskaran K, Bacon S, Bates Ch, Morton Ce, et al. OpenSAFELY: Factors associated with COVID-19-related hospital death in the linked electronic health records of 17 million adult NHS patients. The OpenSAFELY Collaborative. doi: https://doi. org/10.1101/2020.05.06.20092999 medRxiv preprint.
64. Hanson KE, Caliendo AM, Arias CA, Englund JA, Lee MJ, Loeb M. Infectious Diseases Society of America Guidelines on the Diagnosis of COVID-19. www.idsociety.org/COVID19guidelines/dx. Last updated: May 6, 2020. Version 1.0.1 Guidance of SRAS-CoV- 2 antigen testing for asymptomatic healthcare workers (HCW) and patients in non-surgical oncology in the UK. Junio 8 2020. www.rcr.ac.uk/covid19-clinical-oncology-resources.
65. Ferrari A, Zecca M, Rizzari C, et al. Children with cancer in the time of COVID-19: An 8-week report from the six pediatric onco-hematology centers in Lombardia, Italy [published online ahead of print, 2020 May 26]. Pediatr Blood Cancer. 2020;e28410. doi:10.1002/pbc.28410.
66. Han S.B., Shin J.A., Kim S.k., Lee J.W., Lee D.G., Chung N.G., Cho B., Jeong D.C., Kang J.H. Respiratory viral infections in children and adolescents with hematological malignancies. Mediterr J Hematol Infect Dis 2019, 11(1): e2019006.
67. Soudani N, Caniza M, Assaf‐Casals A et al. Prevalence and characteristics of acute respiratory virus infections in pediatric cancer patients J Med Virol. 2019;91:1191-1201.
68. Söderman M, Rhedin S, Tolfvenstam T, Rotzén-Östlund M, Albert J, Broliden K, et al. (2016) Frequent Respiratory Viral Infections in Children with Febrile Neutropenia - A Prospective Follow-Up Study. PLoS ONE 11(6): e0157398. doi:10.1371/journal.pone.0157398.
69. Prasad Meena J, Brijwal M, Seth R et al. Prevalence and clinical outcome of respiratory viral infections among children with cancer and febrile neutropenia. Pediatric Hematology and Oncology, 2019; 36 (6): 330-343. DOI: 10.1080/08880018.2019.1631920.
70. Santolaya M.E.; Alvarez A. M. Acuña M, et al. Efficacy and safety of withholding antimicrobial treatment in children with cancer, fever and neutropenia, with a demonstrated viral respiratory infection: a randomized clinical trial. Clinical Microbiology and Infection 2017; 23: 173 -178.
71. Rojas T, Cela E, Baragaño, M, et al COVID-19 infection in children and adolescents with cáncer in Madrid. Pediatric Blood and Cancer, 2020; e28397. https://doi.org/10.1002/pbc.28397.
72. Boulad F, Kamboj M, Bouvier N et al. COVID-19 in Children With Cancer in New York City. JAMA oncology May 13, 2020. doi:10.1001/jamaoncol.2020.2028.
73. PINDA, Chile. Recomendaciones frente a la infección por SARS-CoV-2 (COVID-19) en pacientes pediátricos con enfermedades oncológicas y Receptores de trasplante de progenitores hematopoyéticos. Actualización junio 2020. Santiago, Chile.
74. UK Guidance of SRAS-CoV- 2 antigen testing for asymptomatic healthcare workers (HCW) and patients in non-surgical oncology in the UK. Junio 8 2020. www.rcr.ac.uk/covid19-clinical-oncology-resources.
Recomendaciones sobre manejo de pacientes menopáusicas y posmenopáusicas durante la pandemia
¿En mujeres peri menopáusicas con diagnóstico o sospecha de infección por SARS-CoV-2/COVID-19 debería utilizarse la anticoncepción hormonal?
Se sugiere suspender la anticoncepción hormonal combinada, mientras presenta la enfermedad y se recupera en su totalidad, por el riesgo de desencadenar eventos trombóticos o tromboembólicos. Se recomienda utilizar un método alternativo hasta la resolución del proceso infeccioso
Débil a favor
Las pacientes con anticoncepción hormonal que incluya sólo gestágenos podrán continuar con el método anticonceptivo en caso de presentar infección por SARSCoV-2/COVID-19
Débil a favor
¿Debería utilizarse terapia hormonal de la menopausia en mujeres con diagnóstico o sospecha de infección por SARS-CoV-2/COVID-19?
Se sugiere que las pacientes en menopausia con diagnóstico o sospecha de infección por SARS-CoV-2/COVID-19 que utilicen terapia hormonal, la suspendan, durante la duración del cuadro clínico, dado el riesgo de desencadenar eventos trombóticos o tromboembólicos.
Débil a favor
Referencias
75. Giannis D, et al. Coagulation disorders in coronavirus infected patients: COVID-19, SARS-CoV-1, MERS-CoV and lessons from the past. J Clin Virol. 2020;127:104362.
76. Connors JM, Levy JH. COVID-19 and its implications for thrombosis and anticoagulation. Blood. 2020;blood.2020006000
77. Levi M, Thachil J, Iba T, Levy JH. Coagulation abnormalities and thrombosis in patients with COVID-19. Lancet Haematol. 2020;S2352-3026(20)30145- 9
78. Bikdeli B, et al. COVID-19 and Thrombotic or Thromboembolic Disease: Implications for Prevention, Antithrombotic Therapy, and Follow-up. J Am Coll Cardiol. 2020;S0735-1097(20)35008-7
79. Thachil J, et al. ISTH interim guidance on recognition and management of coagulopathy in COVID-19. J Thromb Haemost. 2020;18(5):1023‐1026
80. Klok FA, et al. Confirmation of the high cumulative incidence of thrombotic complications in critically ill ICU patients with COVID-19: An updated analysis. Thromb Res. 2020;191:148-150 S0049-3848(20)30157-2.
81. Espitia-De La Hoz FJ. Prevalence and characterization of sexual dysfunctions in women, in 12 Colombian cities, 2009-2016. Rev Colomb Obstet Ginecol. 2018; 69(1):9-21. https://doi.org/10.18597/rcog.3035.
82. Hall, K.S.; Trussell, J. Types of combined oral contraceptives used by US women . Contraception 2012; 86, 659-665.
83. Skouby, S.O. Contraceptive use and behavior in the 21st century: a comprehensive study across five European countries. Eur. J. Contracept. Reprod. Heal. Care 2010, 15, S42-S53.
84. Oliveira Da Silva, M.; Albrecht, J.; Olsen, J.; Karro, H.; Temmerman, M.; Gissler, M.; Bloemenkamp, K.; Hannaford, P.; Fronteira, I. The Reproductive Health Report: The state of sexual and reproductive health within the European Union. Eur. J. Contracept. Reprod. Heal. Care 2011, 16, S1-S70.
85. Ageno W, Squizzato A, Garcia D, Imberti D. Epidemiology and risk factors of venous thromboembolism. Semin Thromb Hemost. 2006;32(7):651- 658.
86. Dragoman MV, Tepper NK, Fu R, Curtis KM, Chou R, Gaffield ME. A systematic review and meta-analysis of venous thrombosis risk among users of combined oral contraception. Int J Gynaecol Obstet. 2018; 141(3):287-294.
87. Stegeman BH, de Bastos M, Rosendaal FR, et al. Different combined oral contraceptives and the risk of venous thrombosis: systematic review and network meta-analysis. BMJ. 2013; 347:f5298.
88. Committee on Gynecologic Practice. ACOG Committee Opinion Number 540: Risk of venous thromboembolism among users of drospirenonecontaining oral contraceptive pills. Obstet Gynecol. 2012;120(5):1239- 1242.
89. McLean K, Cushman M. Venous thromboembolism and stroke in pregnancy. Hematology Am Soc Hematol Educ Program. 2016; 2016(1):243-250.
90. Krattenmacher R, Knauthe R, Parczyk K, Walker A, Hilgenfeldt U, Fritzemeier KH. Estrogen action on hepatic synthesis of angiotensinogen and IGF-I: direct and indirect estrogen effects. J Steroid Biochem Mol Biol. 1994;48(2-3):207-214.
91. Cagnacci A. Hormonal contraception: venous and arterial disease. Eur J Contracept Reprod Health Care. 2017;22(3):191-199.
92. Fruzzetti F, De Negri F, Morale M, et al. Activation of coagulation in smoking and non-smoking women using a third-generation oral contraceptive containing desogestrel. Eur J Contracept Reprod Health Care. 1999;4(3):113-118.
93. Van Hylckama Vlieg A, Helmerhorst FM, Vandenbroucke JP, Doggen CJ, Rosendaal FR. The venous thrombotic risk of oral contraceptives, effects of oestrogen dose and progestogen type: results of the MEGA casecontrol study. BMJ. 2009;339:b2921.
94. Lidegaard Ø, Løkkegaard E, Svendsen AL, Agger C. Hormonal contraception and risk of venous thromboembolism: national follow-up study. BMJ. 2009;339:b2890.
95. Peragallo Urrutia R, Coeytaux RR, McBroom AJ, et al. Risk of acute thromboembolic events with oral contraceptive use: a systematic review and meta-analysis. Obstet Gynecol. 2013;122(2 Pt 1):380-389.
96. Lidegaard Ø, Nielsen LH, Skovlund CW, Skjeldestad FE, Løkkegaard E. Risk of venous thromboembolism from use of oral contraceptives containing different progestogens and oestrogen doses: Danish cohort study, 2001- 2009. BMJ. 2011;343:d6423.
97. Venous thromboembolic disease and combined oral contraceptives: results of international multicentre case-control study. World Health Organization Collaborative Study of Cardiovascular Disease and Steroid Hormone Contraception. Lancet. 1995;346(8990):1575-1582.
98. Jick H, Jick SS, Gurewich V, Myers MW, Vasilakis C. Risk of idiopathic cardiovascular death and nonfatal venous thromboembolism in women using oral contraceptives with differing progestagen components. Lancet. 1995;346(8990):1589-1593.
99. Spitzer WO, Lewis MA, Heinemann LA, Thorogood M, MacRae KD. Third generation oral contraceptives and risk of venous thromboembolic disorders: an international case-control study. Transnational Research Group on Oral Contraceptives and the Health of Young Women. BMJ. 1996;312(7023):83-88.
100. Tepper NK, Whiteman MK, Marchbanks PA, James AH, Curtis KM. Progestin-only contraception and thromboembolism: a systematic review. Contraception. 2016;94(6):678-700.
101. Kuhnz W, Gansau C, Mahler M. Pharmacokinetics of estradiol, free and total estrone, in young women following single intravenous and oral administration of 17 beta-estradiol. Arzneimittelforschung. 1993;43(9):966-973.
102. Kuhl H. Pharmacology of estrogens and progestogens: influence of different routes of administration. Climacteric. 2005;8(Suppl 1):3-63.
103. Weill A, Dalichampt M, Raguideau F, Ricordeau P, Blotiere PO, Rudant J, et al. Low dose oestrogen combined oral contraception and risk of pulmonary embolism, stroke, and myocardial infarction in five million French women: cohort study. Br Med J 2016; 353:i2002.
104. Sitruk-Ware R, Plu-Bureau G, Menard J, Conard J, Kumar S, Thalabard JC, et al. Effects of oral and transvaginal ethinyl estradiol on hemostatic factors and hepatic proteins in a randomized, crossover study. J Clin Endocrinol Metab 2007; 92:2074-9.
105. Klipping C, Duijkers I, Parke S, Mellinger U, Serrani M, Junge W. Hemostatic effects of a novel estradiol-based oral contraceptive: an open-label, randomized, crossover study of estradiol valerate/dienogest versus ethinylestradiol/levonorgestrel. Drugs R D 2011; 11:159-70.
106. Zeun S, Lu M, Uddin A, Zeiler B, Morrison D, Blode H. Pharmacokinetics of an oral contraceptive containing oestradiol valerate and dienogest. Eur J Contracept Reprod Health Care 2009; 14:221-32.
107. Jensen J. Evaluation of a new estradiol oral contraceptive: estradiol valerate and dienogest. Exp Opin Pharmacotherapy 2010; 11:1147-57.
108. Junge W, Mellinger U, Parke S, Serrani M. Metabolic and haemostatic effects of estradiol valerate/dienogest, a novel oral contraceptive: a randomized, open-label, single-centre study. Clin Drug Invest 2011; 31:573-84.
109. Middeldorp S, Meijers JC, van den Ende AE, et al: Effects on coagulation of levonorgestrel- and desogestrel-containing low dose oral contraceptives: a cross-over study. Thromb Haemost 2000; 84:4.
110. Harris GM, Stendt CL, Vollenhoven BJ, et al: Decreased plasma tissue factor pathway inhibitor in women taking combined oral contraceptives. Am J Hematol 1999; 60:175.
111. Tans G, Curvers J, Middeldorp S, et al: A randomized cross-over study on the effects of levonorgestrel- and desogestrel-containing oral contraceptives on the anticoagulant pathways. Thromb Haemost 2000; 84:15.
112. Koenen RR, Christella M, Thomassen LG, et al: Effect of oral contraceptives on the anticoagulant activity of protein S in plasma. Thromb Haemost 2005; 93:853.
113. Tchaikovski SN, Rosing J: Mechanisms of estrogen-induced venous thromboembolism. Thromb Res 2010; 126:537.
114. Rosing J, Hoekema L, Nicolaes GA, et al: Effects of protein S and factor Xa on peptide bond cleavages during inactivation of factor Va and factor VaR506Q by activated protein C. J Biol Chem 1995; 270:27852.
115. Vásquez Awad D, Palacios S. “Menopausia, una visión clínica”. Ed. Kimpres, Bogotá DC. 2016.
116. Schoemaker DA, et al. Int J epidemiol. 2014;43(5):1542-1562.
117. Sánchez J, Marrugo M, Castellanos J, y colaboradores. Estudio del climaterio en Colombia (ECCO): Evaluación del Síndrome Climatérico, riesgo cardiovascular y riesgo de fractura en mujeres en su periodo de transición 2011-2012. Rev. Col. De Menopausia 2014; 20 (3):176-192.
118. Sierra B, Echeverri M, Raigosa G. Prevalencia de síntomas menopáusicos, dislipidemias y problemas sexuales en mujeres menopáusicas de Medellin, Colombia. Rev. Col. De Menopausia 2016; 22 (3): 25-32.
119. The 2017 hormone therapy position statement of The North American Menopause Society. Menopause: The Journal of The North American Menopause Society. 2017;24 (7):728-753.
120. Salpeter SR, Cheng J, Thabane L, Buckley NS, Salpeter EE. Bayesian metaanalysis of hormone therapy and mortality in younger postmeno- pausal women. Am J Med 2009;12:1016-1022.
121. Boardman HM, Hartley L, Eisinga A, et al. Hormone therapy for preventing cardiovascular disease in post-menopausal women. Cochrane Database Syst Rev 2015;(3):CD002229.
122. R. J. Baber, N Panay, A. Fenton y el grupo colaborativo IMS. Recomendaciones 2016 de la IMS sobre salud de la mujer de edad mediana y terapia hormonal de la menopausia. Climateric 2016; 19:109- 50.
123. J.E. Blümel, P. Chedraui , G. Barón, Z. Benítez, D. Flores , M.T. Espinoza, G. Gomez, Collaborative Group for Research of the Climacteric in Latin America (REDLINC). A multicentric study regarding the use of hormone therapy during female mid-age (REDLINC VI). Climacteric 2014; 17: 433- 441.
124. Writing Group for the Women’s Health Initiative I. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women’s Health Initiative Randomized Controlled Trial. JAMA. 2002; 288(3):321-333.
125. Canonico M, Oger E, Plu-Bureau G, et al; Estrogen and Thromboembolism Risk (ESTHER) Study Group. Hormone therapy and venous thromboembolism among postmenopausal women: impact of the route of estrogen administration and progestogens: the ESTHER study. Circulation 2007; 115:840-845.
126. Canonico M, Plu-Bureau G, Lowe GD, Scarabin PY. Hormone replacement therapy and risk of venous thromboembolism in postmenopausal women: systematic review and meta-analysis. BMJ 2008; 336:1227-1231.
127. Renoux C, Dell’ Aniello S, Suissa S. Hormone replacement therapy and the risk of venous thromboembolism: a population-based study. J Thromb Haemost 2010; 8: 979-86.
128. Marjoribanks J, Farquhar C, Roberts H, Lethaby A, Lee J. Long-term hormone therapy for perimenopausal and postmenopausal women. Cochrane Database Syst Rev. 2017 Jan 17; 1(1):CD004143.
129. Gialeraki A, Valsami S, Pittaras T, Panayiotakopoulos G and Politou M. Oral Contraceptives and HRT Risk of Thrombosis. Clinical and Applied. Thrombosis/Hemostasis 2018, Vol. 24(2) 217-225.
130. Høibraaten E, Qvigstad E, Arnesen H, Larsen S, Wickstrøm E, Sandset PM. Increased risk of recurrent venous thromboembolism during hormone replacement therapy results of the randomized, double-blind, placebocontrolled Estrogen in Venous Thromboembolism Trial (EVTET). Thromb Haemost. 2000; 84(6): 961-967.
131. Gómez E. Trombosis y anticoagulación en la mujer. Revista Colombiana de Cardiología 2018; 25(1):132-138.
132. S. Vehkavaara, A. Silveira , T. Hakala-Ala-Pietila, et al. Effects of oral and transdermal estrogen replacement therapy on markers of coagulation, fibrinolysis, inflammation and serum lipids and lipoproteins in postmenopausal women. Thromb. Haemost., 85 (2001), pp. 619-625.
133. Canonico M, Alhenc-Gelas M, Plu-Bureau G, Olie ́ V, Scarabin PY. Activated protein C resistance among postmenopausal women using transdermal estrogens: importance of progestogen. Menopause 2010; 17:1122-1127.
134. Ockene JK, Barad DH, Cochrane BB, et al. Symptom experience after discontinuing use of estrogen plus progestin. JAMA 2005; 294: 183-193.
135. Brunner RL, Aragaki A, Barnabei V, et al. Menopausal symptom experience before and after stopping estrogen therapy in the Women’s Health Initiative randomized, placebo- controlled trial. Menopause 2010; 17:946- 954.
136. Newton KM, Reed SD, Nekhyludov L, et al. Factors associated with successful discontinuation of hormone therapy. J Womens Health (Larchmt). 2014; 23(5): 382-388.
137. Stephanie S Faubion, Casos de interés ¿Hasta cuándo la TH? Rev. Col. De Menopausia. 2017; 23 (4):47-49.
VII. PEDIATRÍA
Pediatría VII.3.3. ¿Qué tratamiento farmacológico se debe ofrecer a niños o adolescentes con enfermedad grave por SARS-CoV-2/COVID-19?
Recomendaciones
Se recomienda usar dexametasona en los pacientes con infección por SARS-CoV-2/COVID-19 que requieran oxigenoterapia, preferiblemente después de 7 días de inicio de los síntomas.
Fuerte a favor
Se recomienda no usar en la práctica clínica hidroxicloroquina o cloroquina en el manejo de pacientes con infección por SARS-CoV-2/COVID-19.
Fuerte en contra
Fuerte en contra
No se emite recomendación a favor o en contra de administración de otros medicamentos a los ya mencionados (ivermectina, tocilizumab, azitromicina) en pacientes con infección por SARS-CoV-2/COVID-19.
Puntos de buena práctica:
Los medicamentos diferentes a dexametasona que se vayan a usar en el tratamiento de la infección por SARSCoV-2/COVID-19 deberían administrarse dentro de un protocolo de investigación.
Se aconseja administrar ivermectina como desparasitante antes del uso mencionado de dexametasona.
Recomendación retirada
No se emite recomendación a favor o en contra de administración de medicamentos como hidroxicloroquina, cloroquina, lopinavir/ritonavir, azitromicina, ivermectina o tocilizumab en pacientes pediátricos con SARS CoV-2/COVID-19
Punto de buena práctica:
Se aconseja usar consentimiento informado del cuidador (para el uso de medicamentos como hidroxicloroquina, cloroquina, lopinavir/ritonavir, azitromicina, ivermectina o tocilizumab) e idealmente dentro de un protocolo de investigación
Adicionalmente, tras la revisión por el grupo de expertos de pediatría en tratamiento, se llega a la conclusión de que este cambio a la recomendación afecta la siguiente pregunta (VII.3.4.) y su respectiva recomendación ya que con el nuevo cambio, se hace una recomendación Fuerte a favor del uso de Dexametasona en pacientes que requieran oxigenoterapia, preferiblemente después de 7 días de inicio de los síntomas, quedando no concordante con la recomendación que sigue en la pregunta VII.3.4 como Débil a favor de “Individualizar la adición de corticosteroides según decisión de médico tratante”; razón por la cual el grupo de expertos propone eliminar la pregunta VII.3.4. que existe en el consenso publicado a la actualidad, así:
VII.3.4. ¿Qué tratamiento farmacológico adicional se puede ofrecer a niños o adolescentes con enfermedad crítica por SARS-CoV-2/COVID-19?
Recomendación
Débil a favor
Punto de buena práctica:
Nuevas preguntas y recomendaciones
Pediatría 1. ¿Cuáles son los signos y síntomas en los pacientes pediátricos con sospecha de infección por SARS-CoV-2 /COVID-19?
Se recomienda sospechar la infección por SARS-CoV-2/ COVID-19 en pediatría ante la presencia de signos o síntomas de infección respiratoria aguda, asociados o no a fiebre, síntomas sistémicos o manifestaciones gastrointestinales, como sugestivos de infección por SARSCoV-2/COVID-19 en pacientes pediátricos.
Fuerte a favor
Pediatría 2. ¿Cuáles son los signos y síntomas presuntivos del síndrome inflamatorio multisistémico temporalmente asociado a la infección por SARS-CoV-2/COVID-19 (SIMS-TAC)?
Se recomienda definir como signos y síntomas presuntivos de SIMS-TAC la fiebre persistente mayor de 72 horas, asociada a síntomas gastrointestinales (como diarrea, vómito y dolor abdominal), cambios en piel y mucosas e inyección conjuntival.
Fuerte a favor
Punto de buena práctica:
Los pacientes en edad pediátrica con sospecha de SIMSTAC pueden presentarse, en más de la mitad de los casos, con signos de choque, por lo cual considere realizar una evaluación cuidadosa de la perfusión periférica, tensión arterial y frecuencia cardiaca en el momento de la atención en el servicio de urgencias
Pediatría 3. ¿Cuáles son los criterios diagnósticos de un paciente con sospecha de síndrome inflamatorio multisistémico temporalmente asociado a la infección por SARS-CoV-2/COVID-19 (SIMS-TAC)?
Se recomienda que en paciente pediátrico con sospecha de SIMS-TAC, se establezca el diagnóstico usando los criterios dados por la Organización Mundial de la Salud (OMS): Niños de 0 a 19 años, con fiebre por más de 3 días y dos de las siguientes:
Rash o conjuntivitis bilateral no purulenta o signos de inflamación mucocutánea.
Hipotensión o choque.
Disfunción cardíaca, pericarditis, valvulitis o anomalías coronarias.
Evidencia de coagulopatía (TP, TTP, dímero D).
Afectación gastrointestinal aguda (diarrea, vómito o dolor abdominal) y:
Elevación de marcadores de inflamación PCR, velocidad de sedimentación, procalcitonina.
Ausencia de otras causas de inflamación microbiológica, incluidas sepsis y síndrome de choque tóxico estafilocócico o estreptocócico.
Evidencia de COVID-19 (RT- PCR, antígeno o serología positiva) o contacto probable con pacientes con COVID-19
Fuerte a favor
Pediatría 4. ¿Cuáles son las pruebas diagnósticas para realizar en un paciente con sospecha de síndrome inflamatorio multisistémico temporalmente asociado a la infección por SARSCoV-2/COVID-19 (SIMS-TAC)?
Se recomienda el uso de pruebas diagnósticas secuenciales en el paciente pediátrico con sospecha de SIMSTAC, de acuerdo con lo propuesto en el “Flujograma de diagnóstico en pediatría de SIMS-TAC asociado a la infección por SARS-coV-2/COVID-19.
Fuerte a favor
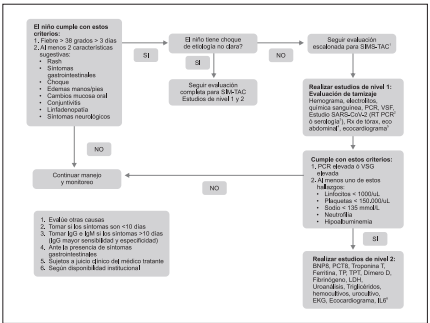
Figura 2 Flujograma de diagnóstico en pediatría de SIMS-TAC asociado a la infección por SARS-CoV-COVID-19
Pediatría 5. ¿Cuál es el tratamiento recomendado para el síndrome inflamatorio multisistémico temporalmente asociado a la infección por SARSCoV-2 /COVID-19 (SIMS-TAC)?
Se sugiere el uso de IgG a dosis de 2 g/k a todos los pacientes que cumplan criterios diagnósticos de SIMS-TAC. Débil a favor
Se sugiere aplicar una segunda dosis de IgG a dosis de 2 g/k en caso de no respuesta a las 36 horas de la primera dosis, con o sin esteroide a dosis baja (prednisolona por vía oral a máximo 1 mg/k/día o su equivalente intravenoso si hay intolerancia a la vía oral, según respuesta).
Débil a favor
Se sugiere, además del uso de IgG, la administración de pulsos de metilprednisolona a 30 mg/k/día por 3 días en caso de choque asociado a SIMS-TAC.
Débil a favor
Se recomienda el uso de aspirina a dosis antiinflamatorias (30 - 50 mg/K/día en 4 dosis) hasta control de la fiebre si no hay trombocitopenia, sangrado gastrointestinal, alteración de las pruebas de función hepática (hasta 5 veces los valores normales de transaminasas), asma no controlada, intolerancia a la vía oral o infección por virus de influenza A o B.
Fuerte a favor
Se recomienda el uso de aspirina a dosis antiagregante (3- 5 mg/k/día) una vez controlada la fiebre por más de 48 horas en caso de trombocitosis (≥ 450,000/𝜇L) o dilatación de las arterias coronarias hasta su resolución.
Fuerte a favor
Puntos de buena práctica:
Al terminar los pulsos de esteroides, se sugiere dejar una dosis baja de esteroides que se irá disminuyendo en el lapso de 2 a 3 semanas.
El uso de esteroides debe ir precedido por administración de manejo antiparasitario (albendazol o ivermectina)
El uso de otros medicamentos inmunomoduladores como tocilizumab para el manejo de pacientes que presenten falla al manejo con dos dosis altas de inmunoglobulina G endovenosa y ciclo de esteroides (metilprednisolona a 30 mg/k/día por 3 días). Dicho manejo debe ser discutido y aprobado por una junta interdisciplinaria citada para tal fin.
Pediatría 6. ¿Cuál es el seguimiento para los pacientes pediátricos con síndrome inflamatorio multisistémico temporalmente asociado a la infección por SARS-CoV-2/COVID-19 (SIMS-TAC)?
Puntos de buena práctica:
El seguimiento de los pacientes con SIMS-TAC requiere un equipo multidisciplinario con participación de pediatría, infectología, reumatología y de acuerdo con el compromiso otras especialidades como oftalmología, neurología, cardiología, nefrología, lo cual dependerá de las manifestaciones y complicaciones presentadas durante la hospitalización.
Es importante individualizar la condición de cada paciente a la hora de definir el seguimiento, teniendo en cuenta que no todos los pacientes con SIMS-TAC requieren hospitalización en unidad de cuidado intensivo.
Referencias
138. Liu W, Zhang Q, Chen J, Xiang R, Song H, Shu S, et al. Detection of Covid-19 in Children in Early January 2020 in Wuhan, China. N Engl J Med. 2020.
139. Bialek S, Gierke R, Hughes M, McNamara LA, Pilishvili T, Skoff T. Coronavirus disease 2019 in children - United States, February 12-April 2, 2020. Morb Mortal Wkly Rep [Internet]. 2020 Apr 10 [cited 2020 Jul 4];69(14):422-6. Available from: https://www.cdc.gov/mmwr/volumes/69/wr/mm6914e4.htm.
140. Chang T-H, Wu J-L, Chang L-Y. Clinical characteristics and diagnostic challenges of pediatric COVID-19: A systematic review and meta-analysis. J Formos Med Assoc. 2020 May;119(5):982-9.
141. Castagnoli R, Votto M, Licari A, Brambilla I, Bruno R, Perlini S, et al. Severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) infection in children and adolescents: a systematic review. 2020.
142. Hua C, Miao Z, Zheng J, Huang Q, Sun Q, Lu H, et al. Epidemiological features and viral shedding in children with SARS‐CoV‐2 infection. J Med Virol. 2020.
143. Zhang C, Gu J, Chen Q, Deng N, Li J, Huang L, et al. Clinical and epidemiological characteristics of pediatric SARS-CoV-2 infections in China: A multicenter case series. PLoS Med. 2020;17(6):e1003130.
144. Patel NA. Pediatric COVID-19: Systematic review of the literature. Am J Otolaryngol. 2020 Jun;41(5):102573.
145. Raba AA, Abobaker A, Elgenaidi IS, Daoud A. Novel Coronavirus Infection (COVID‐19) in Children Younger Than One Year: A Systematic Review of Symptoms, Management and Outcomes. Acta Paediatr. 2020.
146. Ma X, Liu S, Chen L, Zhuang L, Zhang J, Xin Y. The clinical characteristics of pediatric inpatients with SARS‐CoV‐2 infection: a meta‐analysis and systematic review. J Med Virol. 2020.
147. Mantovani A, Rinaldi E, Zusi C, Beatrice G, Saccomani MD, Dalbeni A. Coronavirus disease 2019 (COVID-19) in children and/or adolescents: a meta-analysis. Pediatr Res. 2020;1-6.
148. Zhang L, Peres TG, Silva MVF, Camargos P. What we know so far about Coronavirus Disease 2019 in children: A meta‐analysis of 551 laboratory‐ confirmed cases. Pediatr Pulmonol. 2020;
149. Assaker R, Colas A-E, Julien-Marsollier F, Bruneau B, Marsac L, Greff B, et al. Presenting symptoms of COVID-19 in children: a meta-analysis of published studies. BJA Br J Anaesth. 2020;
150. Ranabothu S, Onteddu S, Nalleballe K, Dandu V, Veerapaneni K, Veerapandiyan A. Spectrum of COVID‐19 in Children. Acta Paediatr. 2020;
151. Otto WR, Geoghegan S, Posch LC, Bell LM, Coffin SE, Sammons JS, et al. The Epidemiology of SARS-CoV-2 in a Pediatric Healthcare Network in the United States. J Pediatric Infect Dis Soc. 2020;
152. Stokes EK, Zambrano LD, Anderson KN, Marder EP, Raz KM, Felix SEB, et al. Coronavirus Disease 2019 Case Surveillance-United States, January 22-May 30, 2020. Morb Mortal Wkly Rep. 2020;69(24):759.
153. Whittaker E, Bamford A, Kenny J, Kaforou M, Jones CE, Shah P, et al. Clinical Characteristics of 58 Children With a Pediatric Inflammatory Multisystem Syndrome Temporally Associated With SARS-CoV-2. Jama. 2020;
154. Chiotos K, Bassiri H, Behrens EM, Blatz AM, Chang J, Diorio C, et al. Multisystem Inflammatory Syndrome in Children During the Coronavirus 2019 Pandemic: A Case Series. J Pediatric Infect Dis Soc. 2020;
155. Capone CA, Subramony A, Sweberg T, Schneider J, Shah S, Rubin L, et al. Characteristics, Cardiac involvement, and Outcomes of Multisystem Inflammatory Disease of Childhood (MIS-C) Associated with SARS-CoV-2 Infection. J Pediatr. 2020;
156. Kaushik S, Aydin SI, Derespina KR, Bansal PB, Kowalsky S, Trachtman R, et al. Multisystem Inflammatory Syndrome in Children (MIS-C) Associated with SARS-CoV-2 Infection: A Multi-institutional Study from New York City. J Pediatr. 2020;
157. Belot A, Antona D, Renolleau S, Javouhey E, Hentgen V, Angoulvant F, et al. SARS-CoV-2-related paediatric inflammatory multisystem syndrome, an epidemiological study, France, 1 March to 17 May 2020. Eurosurveillance. 2020;25(22):2001010.
158. Pouletty M, Borocco C, Ouldali N, Caseris M, Basmaci R, Lachaume N, et al. Paediatric multisystem inflammatory syndrome temporally associated with SARS-CoV-2 mimicking Kawasaki disease (Kawa-COVID-19): a multicentre cohort. Ann Rheum Dis. 2020;
159. Toubiana J, Poirault C, Corsia A, Bajolle F, Fourgeaud J, Angoulvant F, et al. Kawasaki-like multisystem inflammatory syndrome in children during the covid-19 pandemic in Paris, France: prospective observational study. bmj. 2020;369.
160. Ramcharan T, Nolan O, Lai CY, Prabhu N, Krishnamurthy R, Richter AG, et al. Paediatric Inflammatory Multisystem Syndrome: Temporally Associated with SARS-CoV-2 (PIMS-TS): Cardiac Features, Management and ShortTerm Outcomes at a UK Tertiary Paediatric Hospital. Pediatr Cardiol. 2020;1-11.
161. Miller J, Cantor A, Zachariah P, Ahn D, Martinez M, Margolis K. Gastrointestinal symptoms as a major presentation component of a novel multisystem inflammatory syndrome in children (MIS-C) that is related to COVID-19: a single center experience of 44 cases. Gastroenterology. 2020;
162. Royal College of, Paediatrics and Child Health. RCPCH Guidance: Paediatric multisystem inflammatory syndrome temporally associated with COVID-19 [Internet]. 2020. Available from: https://www.rcpch. ac.uk/sites/default/files/2020-05/COVID-19-Paediatric-multisystem-%20inflammatory%20syndrome-20200501.pdf.
163. CDC. Case Definition for Multisystem Inflammatory Syndrome in Children (MIS-C) [Internet]. 2020. Available from: https://emergency.cdc.gov/han/2020/han00432.asp.
164. WHO. Multisystem inflammatory syndrome in children and adolescents temporally related to COVID-19. Scientific Brief. [Internet]. 2020. Available from: https://www.who.int/news-room/commentaries/detail/multisysteminflammatory-syndrome-in-children-and-adolescents-with-covid-19.
165. Rodríguez Y, Novelli L, Rojas M, De Santis M, Acosta-Ampudia Y, Monsalve DM, et al. Autoinflammatory and autoimmune conditions at the crossroad of COVID-19. J Autoimmun. 2020 Jun;102506.
166. Perez-Toledo M, Faustini SE, Jossi SE, Shields A, Kanthimathinathan HK, Allen JD, et al. Serology confirms SARS-CoV-2 infection in PCR-negative children presenting with Paediatric Inflammatory Multi-System Syndrome. medRxiv. 2020 Jan 1;2020.06.05.20123117.
167. Son MBF. Pediatric inflammatory syndrome temporally related to covid-19. BMJ. 2020 Jun 3;m2123.
168. Deza Leon MP, Redzepi A, McGrath E, Abdel-Haq N, Shawaqfeh A, Sethuraman U, et al. COVID-19-Associated Pediatric Multisystem Inflammatory Syndrome. J Pediatr Infect Dis Soc [Internet]. 2020 May 22 [cited 2020 Jun 22]; Available from: https://academic.oup.com/jpids/advance-article/doi/10.1093/jpids/piaa061/5842067.
169. Belhadjer Z, Méot M, Bajolle F, Khraiche D, Legendre A, Abakka S, et al. Acute heart failure in multisystem inflammatory syndrome in children (MIS-C) in the context of global SARS-CoV-2 pandemic. Circulation[Internet]. 2020 May 17 [cited 2020 Jun 22]; Available from: https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.120.048360.
170. Hennon TR, Penque MD, Abdul-Aziz R, Alibrahim OS, McGreevy MB, Prout AJ, et al. COVID-19 associated Multisystem Inflammatory Syndrome in Children (MIS-C) guidelines; a Western New York approach. Prog Pediatr Cardiol. 2020 Jun;57:101232.
171. Dolinger MT, Person H, Smith R, Jarchin L, Pittman N, Dubinsky MC, et al. Pediatric Crohn’s Disease and Multisystem Inflammatory Syndrome in Children (MIS-C) and COVID-19 Treated with Infliximab. J Pediatr Gastroenterol Nutr [Internet]. 2020 May 22 [cited 2020 Jun 22]; Publish Ahead of Print. Available from: https://journals.lww.com/10.1097/MPG.0000000000002809.
172. Riphagen S, Gomez X, Gonzalez-Martinez C, Wilkinson N, Theocharis P. Hyperinflammatory shock in children during COVID-19 pandemic. Lancet Lond Engl. 2020 23;395(10237):1607-8.
173. Verdoni L, Mazza A, Gervasoni A, Martelli L, Ruggeri M, Ciuffreda M, et al. An outbreak of severe Kawasaki-like disease at the Italian epicentre of the SARS-CoV-2 epidemic: an observational cohort study. Lancet Lond Engl. 2020 06;395(10239):1771-8.
174. Dallan C, Romano F, Siebert J, Politi S, Lacroix L, Sahyoun C. Septic shock presentation in adolescents with COVID-19. Lancet Child Adolesc Health. 2020 Jul;4(7):e21-3.
175. Grimaud M, Starck J, Levy M, Marais C, Chareyre J, Khraiche D, et al. Acute myocarditis and multisystem inflammatory emerging disease following SARS-CoV-2 infection in critically ill children. Ann Intensive Care. 2020 Jun 1;10(1):69.
176. Waltuch T, Gill P, Zinns LE, Whitney R, Tokarski J, Tsung JW, et al. Features of COVID-19 post-infectious cytokine release syndrome in children presenting to the emergency department. Am J Emerg Med. 2020 May 23
177. Cheung EW, Zachariah P, Gorelik M, Boneparth A, Kernie SG, Orange JS, et al. Multisystem Inflammatory Syndrome Related to COVID-19 in Previously Healthy Children and Adolescents in New York City. JAMA [Internet]. 2020 Jun 8 [cited 2020 Jun 22]; Available from: https://jamanetwork.com/journals/jama/fullarticle/2767207.
178. McCrindle BW, Manlhiot C. SARS-CoV-2-Related Inflammatory Multisystem Syndrome in Children: Different or Shared Etiology and Pathophysiology as Kawasaki Disease? JAMA [Internet]. 2020 Jun 8 [cited 2020 Jun 22]; Available from: https://jamanetwork.com/journals/jama/fullarticle/2767205.
179. Cabrero-Hernández M, García-Salido A, Leoz-Gordillo I, Alonso-Cadenas JA, Gochi-Valdovinos A, González Brabin A, et al. Severe SARS-CoV-2 Infection in Children With Suspected Acute Abdomen: A Case Series From a Tertiary Hospital in Spain. Pediatr Infect Dis J [Internet]. 2020 May 26 [cited 2020 Jun 22];Publish Ahead of Print. Available from: https://journals.lww.com/10.1097/INF.0000000000002777.
180. Clinical Guidance for Pediatric Patients with Multisystem Inflammatory Syndrome in Children (MIS-C) Associated with SARS-CoV-2 and Hyperinflammation in COVID-19 [Internet]. [cited 2020 Jul 4]. Available from: https://www.rheumatology.org/Portals/0/Files/ACR-COVID-19-ClinicalGuidance-Summary-MIS-C-Hyperinflammation.pdf.
181. Hardy RS, Raza K, Cooper MS. Therapeutic glucocorticoids: mechanisms of actions in rheumatic diseases. Nat Rev Rheumatol. 2020;1-12.
182. Gotor JR, Alonso RB. Tocilizumab en artritis reumatoide. Reumatol clínica. 2011;6:29-32.
183. Zheng X, Yue P, Liu L, Tang C, Ma F, Zhang Y, et al. Efficacy between low and high dose aspirin for the initial treatment of Kawasaki disease: Current evidence based on a meta-analysis. PLoS One. 2019;14(5):e0217274.
184. Wang J, Chen H, Shi H, Zhang X, Shao Y, Hang B, et al. Effect of different doses of aspirin on the prognosis of Kawasaki disease. Pediatr Rheumatol. 2020;18(1):1-7.
SECCIÓN VIII. PREVENCIÓN
¿Cuál es la utilidad de las pruebas en el trabajador de la salud asintomático con contacto estrecho?
Se sugiere realizar pruebas serológicas IgG a personas con contacto estrecho con caso confirmado que tengan RT-PCR negativa o que se captan después del día 14 de contacto.
Débil a favor
¿Cuál es la conducta en el trabajador de la salud que tiene contacto estrecho y desarrolla síntomas?
En personas con contacto estrecho no protegido, que presentan síntomas durante los 14 días iniciales de cuarentena se recomienda seguir algoritmo diagnóstico e independiente del resultado mantener el aislamiento hasta que complete al menos 10 días contados desde el inicio de síntomas y 72 horas de resolución de la fiebre y mejoría de síntomas respiratorios.
Fuerte a favor
Se sugiere en personas con contacto estrecho no protegido que presenten síntomas y PCR negativa, considerar realizar pruebas de anticuerpos después de 11 a 14 días del inicio de síntomas para descartar el diagnóstico de infección por SARS-CoV-2/COVID-19.
Débil a favor
¿Cuál es la utilidad de las pruebas diagnósticas en el trabajador de la salud asintomático con contacto estrecho para reintegro laboral?
Punto de buena práctica:
No es necesario realizar control de detección de anticuerpos o prueba de RT PCR, como un requisito para reincorporarse al trabajo.
¿Se debe realizar tamización para infección por SARS-CoV-2/COVID-19 en población general?
No se recomienda el uso de pruebas diagnósticas (RT-PCR ni anticuerpos IgM/IgG) como estrategia de tamización a población general como estrategia de vigilancia activa.
Fuerte en contra
Punto de buena práctica:
El uso de pruebas de anticuerpos IgM/IgG en población general asintomática debe estar dirigido solamente a evaluar seroprevalencia de la enfermedad.
Se recomienda realizar búsqueda activa de individuos sintomáticos en la población general para identificar en quien realizar pruebas diagnósticas según el algoritmo diagnóstico y crear cercos epidemiológicos y análisis de campo.
Fuerte a favor
Punto de buena práctica:
Para realizar la búsqueda activa se deben implementar sistemas de información como cuestionarios telefónicos o aplicaciones (Apps) para identificación de pacientes sintomáticos.
¿Se debe realizar tamización para infección por SARS-CoV-2/COVID-19 en trabajadores de la salud asintomáticos?
Se sugiere NO realizar pruebas diagnósticas (RT-PCR o detección de anticuerpos IgM/IgG) como estrategia aislada de tamización en trabajadores de la salud asintomáticos.
Débil en contra
Se recomienda en trabajadores de la salud la implementación de programas de vigilancia enfocados en la identificación de aparición de síntomas, identificación de contactos estrechos no protegidos con casos sospechosos o confirmados, reporte de familiares sintomáticos o con sospecha o confirmación de infección por SARS-CoV-2/ COVID-19, para implementar cercos epidemiológicos dentro de un estudio de conglomerados o brotes, con el fin de establecer los individuos que se benefician de las pruebas diagnósticas (RT-PCR).
Fuerte a favor
Recomendaciones para cirugía
¿Cuál es la utilidad de las pruebas diagnósticas para SARS-CoV-2/COVID-19 como requisito para programación de cirugía?
Se recomienda no realizar pruebas diagnósticas para SARS-CoV-2/COVID-19 en pacientes asintomáticos previo a la realización de procedimientos quirúrgicos de emergencia, urgencia y cirugía electiva urgente dado que su resultado no afectará las decisiones quirúrgicas.
Fuerte en contra
Se recomienda no realizar pruebas para la detección de anticuerpos para tamización de pacientes previo a procedimientos quirúrgicos
Fuerte en contra
¿Cuál es la utilidad de las pruebas diagnósticas para SARS-CoV-2/COVID-19 como requisito para programación de cirugía electiva?
Se recomienda la tamización prequirúrgica de la infección por SARS-CoV-2/COVID-19 en cirugía electiva esencial con RT-PCR en pacientes asintomáticos y que cumplan con al menos una de las siguientes condiciones de riesgo: edad>70 años, ASA ≥3, cirugía electiva mayor o cirugía oncológica.
Fuerte a favor
Puntos de buena práctica:
Los pacientes que serán llevados a procedimientos quirúrgicos deben ser informados sobre los riesgos perioperatorios y sus implicaciones en caso de desarrollar infección por SARS-CoV-2/COVID 19, así como la necesidad de cuarentena 14 días antes de la cirugía y por 30 días en el período postoperatorio.
Se debe disponer de cama en Unidad de Cuidados Intensivos para el periodo postoperatorio inmediato.
En los escenarios que está indicada, la RT-PCR para SARSCoV-2/COVID-19 no debe aplicarse como única prueba para tamizar el riesgo; debe combinarse con una estrategia que involucre cuarentena prequirúrgica domiciliaria y la aplicación de un cuestionario de síntomas y de riesgo epidemiológico en varios momentos de la evaluación prequirúrgica.
Cuando la tamización con RT-PCR para SARS-CoV-2/COVID-19 esté indicada, se recomienda iniciar un periodo de cuarentena de 14 días y tomar la muestra de RT-PCR preferiblemente de forma domiciliaria para obtener el resultado en el momento más cercano al procedimiento quirúrgico, idealmente dentro de las 72 horas previas.
Es pertinente aplicar el cuestionario de evaluación de síntomas y riesgo epidemiológico en el momento de la programación quirúrgica (día 0 de la cuarentena), 48 horas antes del procedimiento y el día del procedimiento.
En los pacientes asintomáticos tamizados con RT-PCR positiva para SARS-CoV-2/COVID-19 y que persisten asintomáticos una vez cumplidos 14 días del aplazamiento, no se requerirá una prueba de RT-PCR de control negativa para realizar el procedimiento.
La tamización prequirúrgica con RT-PCR para SARS-CoV-2/ COVID-19 (en los escenarios que está indicada), obedece a la necesidad de optimizar los desenlaces clínicos del paciente, pero no tiene ninguna implicación en definir un estándar de bioseguridad para el trabajador de la salud. En el escenario pandémico, las precauciones para el manejo quirúrgico de pacientes son universales. Una prueba negativa no implica un cambio en el estándar de uso de elementos de protección personal en el quirófano.
¿Cuánto tiempo se debe mantener el aislamiento en pacientes infectados sintomáticos que requieren manejo ambulatorio con SARS-CoV-2/ COVID-19?
Se recomienda suspender el aislamiento cuando hayan pasado al menos 10 días desde el inicio de síntomas y 72 horas desde la recuperación definida como la resolución de la fiebre sin el uso de medicamentos antipiréticos y la mejoría de los síntomas respiratorios (tos y disnea).
Fuerte a favor
¿Cuánto tiempo se debe mantener el aislamiento en pacientes hospitalizados o institucionalizados infectados con SARS-CoV-2/COVID-19?
Se recomienda retirar el aislamiento, bajo cualquiera de las siguientes estrategias:
Estrategia basada en síntomas: Después de al menos 10 días desde el inicio de síntomas, al menos 72 horas de resolución de fiebre sin el uso de medicamentos antipiréticos y la mejoría de los síntomas respiratorios (tos y disnea).
Fuerte a favor
Estrategia basada en PCR: Después de al menos 10 días desde el inicio de síntomas, mejoría clínica al menos por 3 días y una PCR negativa tomada posterior al día 9 de inicio de síntomas.
Fuerte a favor
Punto de buena práctica:
En pacientes hemato-oncológicos, trasplantados, donantes de trasplante, hospitalizados en UCI, que se enviarán a institucionalización o privados de la libertad, se deberá preferir la estrategia basada en PCR.
En estrategia basada en PCR, en caso de tener una RT PCR de control positiva, deberá repetirse cada 7 días hasta que sea negativa.
¿Cuál es la mejor estrategia para seguir a una persona captada por medio de pruebas de detección de anticuerpos?
Se recomienda en las personas con resultado de las pruebas de anticuerpo con IgG positivo, asintomáticas, no realizar aislamiento y no realizar pruebas de PCR.
Fuerte a favor
Punto de buena práctica:
¿Cuál es la utilidad de las pruebas diagnósticas para SARS Cov 2 como requisito para programación de cirugía electiva? *
Se recomienda no realizar pruebas diagnósticas previo a la realización de procedimientos quirúrgicos dado su baja capacidad para diagnosticar infección por SARS CoV-2 en pacientes asintomáticos.
Fuerte en contra
¿Cuál es la utilidad de las pruebas (serológicas) en el paciente asintomático con contacto positivo?
No se recomienda la realización de las pruebas diagnósticas previo a la realización de procedimientos quirúrgicos dado que su rendimiento en pacientes asintomáticos no permite predecir el desarrollo de enfermedad
Fuerte en contra
¿Qué recomendaciones se deben tener durante el traslado aeromédico de pacientes con infección confirmada o sospechada por SARS CoV-2 / COVID19?