V. MANEJO DEL PACIENTE CON INFECCIÓN POR SARS-COV-2/COVID-19
V.A. MANEJO DEL PACIENTE CON INFECCIÓN POR SARS-COV-2/COVID-19
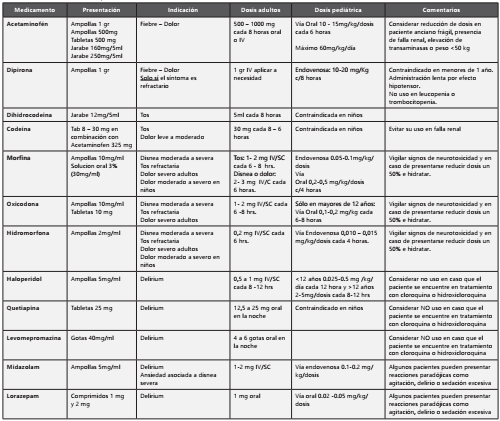
V.A.1 ¿Cuáles son los medicamentos utilizados para infección por SARS-Cov-2/COVID-19?
Cloroquina (CQ) e hidroxicloroquina (HCQ)
La cloroquina (CQ) e hidroxicloroquina (HCQ) son fármacos antimaláricos y antiinflamatorios indicados en enfermeda des como artritis reumatoidea y lupus eritematoso, se les ha documentado actividad in vitro contra SARS-CoV-21, dichas sustancias interfieren la entrada del virus a la célula y a los endosomas, produciendo alteraciones en la síntesis de ácido siálico, modificación post traslacional de proteínas y dismi nución de la liberación de citoquinas pro inflamatorias TNF alfa, IL-1 e IL-6 ; en especial sobre este virus genera altera ciones en la glicosilación del receptor ACE 2. En clínica se han reportado datos de eficacia en pacientes con neumonía con SARS-CoV-22.La hidroxicloroquina es más potente que la cloroquina y con mejor perfil de seguridad3. Cortegiani et al., presentan una revisión sistemática en la que incluyen 6 es tudios (revisiones narrativas, in vitro, consenso de expertos, y guías clínicas) y 23 estudios clínicos en curso encontrando evidencia preclínica y algunos datos clínicos de efectividad en COVID-194. En la actualidad se tienen varios estudios clínicos en hospitales de China y resultados preliminares para más de 100 pacientes muestran la superioridad de la cloro quina comparado con el manejo estándar en disminución de la duración de síntomas y aclaramiento viral5. Gautret et al., describen resultados de un estudio abierto no aleatorizado con pacientes adultos y diversos grados de severidad de la enfermedad (asintomáticos, infección respiratoria alta e in fección respiratoria baja); se mide como desenlace primarioel tiempo de eliminación viral a 6 días, y como secundarios re cuperación clínica y efectos adversos, 26 pacientes recibieron hidroxicloroquina a dosis de 600 mg día y 16 manejo están darel día 6 del inicio de la terapia 70% de los pacientes que recibieron hidroxicloroquina tenían supresión viral vs 12% en el grupo control histórico (p< 0.001) (6. La adición de azitromi cinaa hidroxicloroquina en 6 pacientes al parecer favoreció la eliminación viral en comparación de la terapia estándar o la monoterapia con hidroxicloroquina. Chen et al. publican resultados preliminares de un estudio clínico realizado en el Hospital de Renmin en Wuhan7; se incluyen 62 pacientes con diagnóstico confirmado de COVID-19: 31 recibieron trata miento con hidroxicloroquina 400 mg día durante 5 días; el grupo control recibió manejo estándar; en este estudio se ex cluyeron pacientes con formas severas de la enfermedad, re tinopatía, alteraciones en conducción cardíaca, enfermedad hepática severa y falla renal con tasas de filtración glomerular menores a 30 ml/min. El desenlace primario fue el tiempo de la recuperación clínica y cambios radiológicos al día 5. Los pacientes que recibieron hidroxicloroquina presentaron mejoría sintomática ligeramente más rápida (0.4 a 1.3 días según el síntoma) y describen también mejoría radiológica en aquellos con diagnóstico de neumonía (80 vs 54%). Como se ha anotado, son diversas las dosis de hidroxicloroquina utilizados en las diferentes series; Yao et al. realizaron un aná lisis farmacocinético y proyección de la dosis óptima para el manejo de la infección por SARS-Cov-2, documentaron ma yor potencia de la hidroxicloroquina vs cloroquina y basados en sus modelos farmacocinéticos usados para predecir las concentraciones pulmonares, se recomienda una dosis de 400 mg cada 12 horas el primer día, seguida de 200 mg cada 12 horas que resulto óptima y comparable a la dosis de 500 mg cada 12 horas de cloroquina3
Schluger et al. el pasado 6 de mayo presentaron los resulta dos de un estudio observacional en pacientes con neumonía por SARS-Cov-2 en el Hospital Presbiteriano en Nueva York. En esta institución las dosis sugeridas de hidroxicloroquina fueron 600 mg cada 12 horas el primer día, seguidas de 400 mg cada 12 horas por 4 días en pacientes con formas mode radas a severas definidas por saturaciones menores a 94%. La administración de azitromicina fue opcional; las recomenda ciones con este manejo fueron retiradas el 12 de abril, que dando sujetas a discreción del tratante. Se tuvo entonces un grupo de pacientes con hidroxicloroquina vs otro que no la recibió; se ajustaron las variables mediante índice de propen sión; el desenlace primario fue requerimiento de intubación o muerte. Se excluyeron pacientes que en las primeras 24 horas hubieran presentado alguno de los 2 eventos. En total 811 pacientes recibieron hidroxicloroquina y se compararon con 274 pacientes que no la recibieron; los autores no in formaron tiempo total de síntomas; el tratamiento se inició en 85.9% de los pacientes en las primeras 48 horas desde el ingreso. Los pacientes tratados con hidroxicloroquina tenían PAFI basal menor que los que no la recibieron (233 Vs 360) y 27 pacientes recibieron manejo compasivo con remdesi vir. Entre los 1376 pacientes incluidos para análisis 346 (25%) presentaron falla respiratoria (180 se entubaron, 166 no). Los análisis crudos muestran mayor probabilidad del desenlace primario en los que recibieron el fármaco HR 2.37 (IC 95% 1.84 a 3.02). En el análisis multivariado no se encontró asocia ción entre uso de hidroxicloroquina y el desenlace primario HR 1.04 (IC 95% 0.82 a 1.32) (8.
Rosenberg et al. reportan su experiencia con pacientes confir mados con neumonía por SARS-Cov-2 que ingresaron a hos pitalización en un período de 2 semanas. Se incluyeron 1438 pacientes para análisis, de los cuales 735 (51%) recibieron hidroxicloroquina+azitromicina, 271(18%) hidroxicloroquina, 211 (14.7%) azitromicina y 221 (15.4%) no recibieron ningún medicamento. El tiempo promedio de inicio de hidroxicloro quina fue 1 día, y de azitromicina 0 días. En esta cohorte los pacientes que recibieron algún tratamiento (principalmente hidroxicloroquina+azitromicina) tenían enfermedad más se vera en comparación a los que no recibieron ninguna terapia, esto por hallazgos respiratorios (placa de tórax, saturación y frecuencia respiratoria) y hepáticos (elevación de amino transferasas). El desenlace primario fue mortalidad, el cual fue del 20%. En los análisis no ajustados la frecuencia de muerte en pacientes que recibieron hidroxicloroquina y azitromicina fue 25%, hidroxicloroquina 19.9%, azitromicina 10% y 12.7% en los pacientes que no recibieron ningún medicamento. En los análisis ajustados a comorbilidades y severidad de la enfermedad no se encontraron diferencias entre los grupos al comparar con los que no recibieron ningún fármaco: los valores ajustados fueron HR hidroxicloroquina+azitromicina 1.35 (IC 95% 0.76-2.4), hidroxicloroquina HR 1.8 (IC 95% 0.63- 1.85), azitromicina HR 0.56 (IC 95%0.26-1.21). El evento adver so más frecuente fue electrocardiograma (EKG) anormal, en los pacientes que recibieron hidroxicloroquina+azitromicina e hidroxicloroquina sola, sin embrago no se documentaron diferencias al comparar con el grupo sin medicación. Es de anotar que un mayor número de pacientes que recibieron hidroxicloroquina + azitromicina presentaron parada cardíaca (15%) y anormalidades electrocardiográficas (27%) en com paración con los demás grupos. La rapidez con las que los pacientes ingresaron a UCI y requirieron ventilación mecáni ca, que coincidía con el inicio de la medicación en la mayoría de los casos, genera que los datos no sean adecuados para los análisis de eficacia, la mortalidad fue limitada al contex to intrahospitalario y algunos confusores como marcadores inflamatorios asociados a severidad en estudios previos no fueron medidos en el estudio9.
El 4 de Junio se emitió un comunicado por parte de investi gadores del Ensayo Clínico Aleatorizado Recovery, en el que informan el resultado de un análisis interino a solicitud de la Agencia Reguladora de Medicamentos y Productos Sani tarios del Reino Unido, en el cual encontraron que no hubo diferencias significativas en el objetivo primario de morta lidad a los 28 días (25.7% en el brazo de hidroxicloroquina contra 23.5% en el brazo de atención habitual; con una razón de riesgo 1.11 [IC 95% 0.98-1.26]; p = 0.10); y tampoco hubo disminución de la estancia hospitalaria u otros resultados, ra zón por la cual deciden cerrar el brazo de investigación con hidroxicloroquina al no documentarse ningún beneficio10
Durante el consenso se analizó el artículo presentado en la re vista Lancet el 22 de Mayo que cuestionaba la utilidad y seguri dad de la hidroxicloroquina sola o en combinación con macró lidos, no obstante no se consideró para las recomendaciones por la retractación del estudio por parte de los autores al no permitir acceso y auditoría de los datos completos.
En atención a la evidencia recientemente publicada el grupo de Consenso considera que la administración de terapia a base de hidroxicloroquina /cloroquina no ofrece beneficio en el tratamiento de la infección por COVID-19 y de hecho podría incrementar la mortalidad, además de efectos de tipo cardiovascular pro arrítmicos, por lo que se retira la reco mendación sobre su uso. De igual forma se tienen resultados similares para azitromicina, con incremento importante en la frecuencia de arritmias, por lo que se desaconseja su uso como antiviral .
Lopinavir/ritonavir (LPV/RTV)
El virus SARS-CoV-2 tiene homología entre 80 y 88% con el virus SARS. Es por esto qué, ante la ausencia de adecuados estudios clínicos, se han utilizado los datos de eficacia de antivirales en este último. En estudios clínicos y modelos animales de infección por MERS-Cov y SARS, se ha demos trado actividad antiviral de lopinavir/ritonavir, medicamento usado en pacientes con infección por VIH, que se encuentra fácilmente disponible en nuestro medio. La administración del ritonavir tiene como objetivo la inhibición del citocromo P450, lo que favorece el aumento en las concentraciones y vida media del lopinavir. En reportes de caso de infecciones por MERS CoV se sugiere que la terapia combinada con lopi navir/ritonavir y rivabirina o interferón alfa resultan en mejor supervivencia y aclaramiento viral. Chan et al. en 2003 eva luaron 75 pacientes con SARS y encontraron una reducción en la tasa de muerte e intubación 2.3% y 0%, al comparar con los controles, 15% y 11%, respectivamente (p<0.05); en este protocolo la medicación se inició tempranamente11. Con el virus MERS-CoV, estudios in vitro han demostrado activi dad superior de remdesivir e interferón beta en comparación con lopinavir y ritonavir, no se demostró mayor actividad cuando este último se asoció a IFNb12,13.En el estudio de Cao et al. abierto aleatorizado controlado en pacientes adultos hospitalizados con infección respiratoria por SARS-Cov-2, se incluyeron 199 pacientes; 99 se asignaron a tratamiento con lopinavir/ritonavir (LPV/RTV) y 100 a manejo estándar. El desenlace primario fue el tiempo a la mejoría clínica; no se encontraron diferencias significativas en el tiempo de recu peración HR: 1.24 (IC 95% 0.9-1.7) con mortalidades similares 19% para el grupo de lopinavir/ritonavir y 25% en el grupo control (mortalidad numéricamente menor incluso en el aná lisis por intención a tratar) ; también se informó mejoría en el estado de salud en el grupo intervenido (45% vs 30%): estos resultados fueron más evidentes en el grupo de pacientes que inicio la medicación en los primeros 12 días de iniciados los síntomas; los efectos secundarios gastrointestinales fue ron más frecuentes en el grupo intervenido. Se necesitan más datos sobre la eficacia de estos fármacos. En pacientes que usan LPV/RTV se ha reportado incremento en intervalo PR, bloqueo de segundo y tercer grado, así como prolongación del QT.; 14 a 24% de los pacientes experimentan diarrea y 2-16% náuseas.
Otros dos estudios aleatorizados no mostraron beneficio con el uso de LPV/RTV como monoterapia. En un estudio de pacientes con infección leve a moderada, en el que se alea torizó pacientes 2:2:1 a LPV/RTV (n=34), arbidol (n=35) y no tratamiento (n=17), Li et al, no encontraron diferencias en el tiempo a RT-PCR negativa en frotis faríngeo (9.0 días en el grupo con LPV/RTV, 9.1 con arbidol y 9.3 en el grupo control, P=0.981). resolución de síntomas ( fiebre y tos) y mejoría de la tomografía entre los dos brazos con antivirales compara dos con no tratamiento (p>0.05). Más pacientes en el grupo de LPV/RTV (35.3%) presentaron efectos adversos de tipo gastrointestinal que en el grupo de arbidol (14.3%) o en el grupo control (sin efectos adversos reportados)15. Por otro lado, Hung et al., aleatorizaron 2:1 pacientes hospitalizados con infección temprana por COVID-19 (< 7 días) y leve (me diana del puntaje NEWS2 basal = 2) a tratamiento por 14 días con terapia triple con LPVTV, ribavirina e interferón beta-1b (n=86) o monoterapia con LPV/RTV (n=41) como grupo con trol. La triple fue superior en el desenlace primario evaluados, tiempo a rtPCR negativa en hisopado nasofaríngeo, de 7 días en comparación a 12 días en el grupo control (HR 4·37 [95% IC 1·86-10·24], p=0·0010) al igual que en los objetivos secun darios de mejoría clínica completa definida por los tiempos de reducción a 0 de los puntajes de las escalas NEWS2 (4 días vs 8 días en el grupo control; HR 3.92 [95% IC 1.66-9.23], p<0·0001) y SOFA (3.0 días vs 8.0 días; HR 1·89 [1·03-3·49], p=0·041), al igual que en una menor estancia hospitalaria16.
El grupo del Consenso considera que a la fecha la evidencia disponible no permite emitir un concepto a favor o en contra para el uso de este fármaco como monoterapia, por lo que se modifica la recomendación previamente emitida.
Tocilizumab
El tocilizumab, inhibidor del receptor de IL-6 fue evaluado en 20 pacientes con infección por SARS-CoV-2 clasificada como severa o crítica, encontrando en el 75% disminuciónde sus requerimientos de O2, en el 90% disminución de los infiltrados pulmonares, disminución de la PCR y aumento en el recuento de linfocitos. 19 de estos pacientes fueron dados de alta aproximadamente 13.5 días tras haber terminado el tratamiento17. Alattar et al. reportaron 25 pacientes hospita lizados en UCI, se documentó disminución de los marcado res inflamatorios, mejoría radiológica en el 44% y disminu ción en el requerimiento de soporte ventilatorio en el 24% a los 7 días18. Luo et al. describieron 15 pacientes tratados con este medicamento, de los cuales 13 fueron catalogados como severos o críticos, sin embargo, la mayoría de estos solo recibieron 1 dosis, se observó mejoría clínica en 3 de 7 pacientes críticos y en 7 de 8 con enfermedad moderada o severa19. Toniati et al. reportaron los desenlaces en una serie prospectiva de 100 pacientes con SDRA, requiriendo soporte ventilatorio en un hospital de Brescia. Todos los pacientes recibieron 2 dosis de 8mg/kg con 12 horas de diferencia, con la opción de una tercera dosis según la respuesta clínica. De estos pacientes 57 se encontraban en hospitalización en sala general por falta de disponibilidad de camas en cuidados in tensivos, manejados con ventilación no invasiva, de estos el 65% tuvó mejoría y se logró retirar la ventilación no invasiva, el 12% permaneció estable y el 17% falleció. De 43 pacientes tratados en UCI, el 74% tuvió mejoría clínica y el 24% falleció (Todos ellos con score de Brescia >7 antes del inicio del toci lizumab)20. Klopfenstein et al. reportaron un estudio de ca sos y controles en un hospital en Francia, el protocolo de ma nejo de este centro incluía un equipo multidisciplinario para decidir el inicio de tocilizumab, compuesto por infectólogos, intensivistas, reumatólogos y químicos farmacéuticos, los criterios que usaron para iniciar el medicamento incluyeron infección confirmada por SARS-CoV-2, fracaso al tratamiento estándar, > 7 días desde el inicio de los síntomas, requeri miento de más de 5 Lts/min de oxígeno, compromiso de más del 25% del parénquima pulmonar en TAC y elevación de 2 o más parámetros inflamatorios como ferritina, PCR, dímero D, linfopenia y LDH. En el grupo de pacientes que recibió to cilizumab los pacientes más frecuentemente fueron mayores de 70 años y con índice de Charlson en promedio 5.3 vs 3.4 en quienes no lo recibieron. Los pacientes en el grupo están dar de tratamiento requirieron con más frecuencia ventila ción mecánica 32% vs 0%, aunque no se encontró diferencias para el desenlace de mortalidad entre los tratamientos(48% vs 25%, p=0.066) (21.
En un reporte de pacientes con dificultad respiratoria sin requerimiento de ventilación mecánica, Capra et al. presen taron resultados de 23 pacientes que recibieron atención estándar y 62 pacientes tratados adicionalmente con toci lizumab a una dosis única ≤ 400 mg IV o SC. Los pacientes que recibieron tocilizumab mostraron una tasa de supervi vencia significativamente mayor en comparación con los pa cientes del grupo control [(HR: 0.035; IC 95%: 0.004 a 0.347; p= 0.004), ajustado para las características clínicas basales]; dos de los 62 pacientes del grupo de tocilizumab y 11 de 23 en el grupo control murieron22. En contraste; Rimland et al. reportaron 11 pacientes críticos tratados con tocilizumab enChapel Hill, Carolina del Norte, 9 de los cuales estaban en ventilación mecánica, observaron disminución significativa de la PCR con el uso de tocilizumab con un incremento en los niveles de IL-6; solo 3 mostraron mejoría clínica, 5 con tinuaron críticos en la UCI y 3 fallecieron, sugiriendo que el uso de tocilizumab debe hacerse con precaución en pacien tes críticos con SDRA avanzada. En estos reportes observa cionales se describieron pocos efectos adversos e infecciones intercurrentes asociadas al uso de tocilizumab23. Sin embar go, Kimmig et al. mostraron que en 28 de 60 pacientes crí ticos con COVID-19 de Chicago, que recibieron tocilizumab, se observó una mayor incidencia de infecciones bacterianas secundarias, incluida neumonía asociada al ventilador (64.3% vs. 31.3% p = 0.010)24.
Price y colaboradores describieron 153 pacientes que reci bieron tocilizumab como parte de su protocolo institucio nal en el hospital de New Haven, encontrando estabilización en los requerimientos de ventilación mecánica, a pesar de aumento exponencial en el número de casos entre marzo y abril del 202025.
Guaraldi y colaboradores recientemente publicaron los re sultados de un estudio retrospectivo de cohortes que incluye 544 pacientes de diferentes centros en Italia. Se evaluó el requerimiento de ventilación mecánica y mortalidad de pa cientes que recibieron la terapia estándar en comparación con quienes recibieron tocilizumab endovenoso o subcutá neo (8 mg/kg en 2 dosis con 12 horas de diferencia); encon trando menor mortalidad del grupo que recibió tocilizumab (7 vs 20%, p<0.0001) y menor probabilidad de requerir venti lación mecánica tras ajustar los datos por sexo, edad, centro de reclutamiento, duración de síntomas y puntaje SOFA. El principal efecto adverso fue aumento en el riesgo de infec ción en quienes recibieron este medicamento (13 vs 4%)26.
Diferentes guías han recomendado el uso de este medica mento como alternativa en pacientes críticos refractarios al manejo. La sección de Lombardía de la sociedad italiana de enfermedades infecciosas recomienda considerar su uso en pacientes que estén cursando con la fase de hiperinflama ción de la enfermedad o tormenta de citoquinas. Como cri terios de inicio recomiendan: a) que se considere terminada la fase replicativa de la infección (más de 7 días de evolución de los síntomas o estar afebriles por más de 72 hrs); b) dete rioro respiratorio con requerimiento de ventilación mecánica o no invasiva; c) niveles en ascenso de marcadores inflama torios como PCR, ferritina, dímero D, fibrinógeno; d) niveles de IL-6 >40 pg/mL27. Otros expertos han recomendado el uso del llamado Score H como predictor de la posibilidad del síndrome de activación macrofágica, como una forma de objetivizar la posibilidad de la tormenta de citoquinas. El score original contiene 9 ítems que incluyen presencia o no de inmunosupresión, temperatura, presencia o no de visce romegalias, citopenias, niveles de fibrinógeno, triglicéridos, ferritina, AST y hemofagocitosis en biopsia de médula, consi derándose positivo con la media de 169, con sensibilidad de93% y especificidad del 86%28. En otra publicación en la cual no se realizó biopsia de médula este ítem fue retirado del puntaje, con lo cual la media disminuyó a 15129. Teniendo en cuenta que la solicitud de estudios de imagen se ha tratado de minimizar en busca de disminuir riesgos para el personal de la salud, en el consenso colombiano se considera que se podrían eliminar las visceromegalias como ítem en el score, con lo cual la nueva media sería de 132.
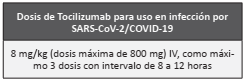
Diversos estudios, series de casos y un estudio de casos y controles, han propuesto el uso de tocilizumab intravenoso en dosis de 8 mg/kg (dosis máxima de 800 mg), como máxi mo 3 dosis con intervalo de 8 a 12 horas, en pacientes con diversos criterios que sugieren la presencia de la tormenta de citoquinas. En el consenso se discutió específicamente su uso en pacientes que no respondieron a terapia con corticoides o tienen contraindicación para su uso y que cumplan todos los siguientes criterios:
Más de 7 días de evolución de los síntomas
Deterioro respiratorio (evidente requerimiento de sopor te ventilatorio o aumento en requerimiento de paráme tros ventilatorios, en pacientes que ya se encuentran en ventilación mecánica).
Niveles de interleuquina 6 > 40 pg/mL en donde estén disponibles o alternativamente niveles de dimero D ma yores a 1500.
2 de 3 de los siguientes:
PCR > 100 mg/L o > 50 mg/L, si su valor se duplicó en las últimas 48 horas.
LDH > 250 UI/ml.
Recuento absoluto de linfocitos < 600 cels/mm3
Haber descartado otros posibles focos de infección apar te del SARS-CoV-2/COVID-19.
Revisión del caso por parte de una junta multidisciplina ria con participación de al menos 3 especialidades (he matología, infectología, medicina interna, pediatría, neu mología, cuidado intensivo, reumatología, urgenciología, inmunología clínica).
Remdesivir
El remdesivir es la prodroga de un análogo de adenosina, con amplio espectro contra varios virus ARN. Desde el inicio de la pandemia se propuso, por su efecto antiviral in vitro, como una posibilidad de tratamiento. En el momento, el medica mento no se encuentra disponible en el país, aunque ha sido propuesto en varios estudios clínicos, incluyendo el estudio Solidarity, patrocinado por la OMS. Existe aún controversia sobre el beneficio del uso de remedesivir debido a los resul tados disponibles en la literatura y que contrasta con la po sición tomada por la FDA, basada en los datos de un estudio clínico realizado en los EEUU, cuyos resultados no han sido publicados a la fecha. De acuerdo con esta organización, el 1 de mayo autorizó la utilización de este medicamento para ni ños y adultos con formas graves de la enfermedad, teniendo en cuenta una disminución en el tiempo de recuperación30.
El estudio clínico publicado de remdesivir a la fecha incluyó 237 pacientes y fue realizado en China. El estudio aleatori zó remdesivir vs placebo para el tratamiento en pacientes con infección por SARS-CoV-2 que fueran admitidos antes de 12 días de progresión de síntomas. El estudio tuvo una mortalidad entre 13 y 14% en los brazos aleatorizados, y no mostró diferencias significativas en ella, entre remdesivir y el placebo, así como tampoco mostró diferencias en ninguno de los desenlaces clínicos de interés como tiempo a mejoría o mejoría clínica a los 28 días. El remdesivir se asoció con retiro por efectos adversos en 18% de los pacientes (vs 5% de los que recibieron placebo) (30.
El 22 de mayo se publicó el estudio clínico ACTT-1, aleatori zado, doble ciego y controlado con placebo, 1063 pacientes fueron aleatorizados en una proporción 1:1 a remdesivir in travenoso (541 pacientes), dosis inicial de 200 mg seguido de 100 mg día de mantenimiento desde el día 2 hasta el día 10 (en algunos casos hasta el alta hospitalariao hasta el fa llecimiento), o placebo administrado en la misma forma (522 pacientes). El desenlace primario medido fue el tiempo a la recuperación (definido por categorías clínicas graduadas de 1 a 7, en donde 1 corresponde a paciente no hospitalizado sin limitación para sus actividades, hasta categoría 7 ventila ción mecánica o necesidad de ECMO y categoría 8 muerte). Otros desenlaces medidos fueron mortalidad al día 14 y al día 28 luego de la aleatorización, y eventos adversos grado 3 y grado 4. El promedio de edad de estos pacientes fue de 58.9 años, el tiempo promedio transcurrido entre el inicio de síntomas hasta la aleatorización fue 9 días; 88.7% de los pacientes tenían enfermedad severa al momento de la alea torización. Los pacientes que recibieron remdesivir tuvieron menor tiempo para la recuperación clínica (mediana de 11 días vs 15 días para el grupo placebo), con una razón de tasa de 1.32 (IC 95% de 1.12 a 1.55; p< 0.001); la razón de tasa de recuperación fue disminuyendo a medida que la enfermedad era más severa, con un valor de 0.95 (IC 95% de 0.64 a 1.42) en los pacientes con categoría 7 de la enfermedad. No hubo diferencias en la mortalidad entre los tratamientos, (HR: 0.7 IC 95% 0.47 a 1.04), la estimación de mortalidad a 14 días fue 7.1% para el grupo de remdesivir y 11.9% en el grupo placebo. Eventos adversos serios se reportaron en 21% de pacientes en el grupo de remdesivir y 27% en el grupo pla ceboCon estos resultados se consideró por parte del grupo de investigación retirar el cegamiento32. Los datos a la fecha parecen indicar cierto beneficio con esta nueva molécula, sin embargo, a la fecha no se cuenta con ella en el país, y faltan más datos que derivarán probablemente de nuevos ensayos clínicos controlados complementarios.
Interferón
Observaciones clínicas en animales y humanos muestran que las infecciones por MERS -CoV son mediadas tanto por la replicación viral como por las respuestas inflamatorias del huésped. Estos hallazgos condujeron a la exploración de te rapias combinadas incluyendo interferón tipo I y II, IFN betamostro la mejor eficacia en reducir la replicación del MERS CoV en cultivos celulares. En Arabia saudita se está llevando a cabo un estudio controlado aleatorizado (Estudio MIRACLE) (13 para determinar si la combinación de LPV/RTV e INF b podría mejorar desenlaces clínicos en este tipo de infección. A la fecha no se dispone de resultados concluyentes, y el perfil de seguridad de estas moléculas es bajo, con una alta frecuencia de efectos adversos de gran severidad o relevancia clínica.
Ivermectina
Respecto a la ivermectina en SARS-CoV-2, un estudio in vitro demostró que la ivermectina redujo el ARN viral 5000 veces en un curso de 48 horas y redujo en un 99.8% el RNA viral en comparación con los cultivos celulares tratados con Dimetil sulfóxido (DMSO) (33.
Durante el consenso se analizó el artículo presentado por Patel y colaboradores, y se consideró no tenerlo en cuen ta para las recomendaciones por la retractación del estudio por parte de los autores y recomendaciones de la Organi zación Panamericana de la Salud (OPS) (34. Hasta ahora no se han publicado ensayos clínicos aleatorizados que demues tren su eficacia en humanos con infección por SARS-CoV-2/ COVID-19 por lo que no existe suficiente evidencia para re comendar su uso.
Sin embargo, hasta ahora no se han publicado ensayos clí nicos aleatorizados que demuestren su eficacia en humanos con COVID-19 por lo que no existe suficiente evidencia para recomendar su uso.
Inhibidores de neuroaminidasa
Los inhibidores de neuroaminidasa no han mostrado activi dad in vitro frente a SARS-CoV-2, por lo que no está indicado su uso en esta patología35.
La alteración de las enzimas hepáticas no debe ser una con traindicación para el uso de terapias en investigación o fuera de indicación para SARS-CoV-2/COVID-19, a no ser que es tén elevadas más de 5 veces del valor normal y/o bilirrubina mayor a 2 - 3 mg/dl (por ejemplo, remdesivir, tocilizumab, cloroquina, hidroxicloroquina, estatinas). Se recomienda mo nitoreo estrecho (Cada 48-72 horas) del perfil hepático.
Corticoides
El uso de corticoides se sugiere con base en postulados fi siopatológicos de hiperinflamación en la enfermedad por coronavirus 2019 (SARS-CoV-2) que podría ser un factor de gravedad susceptible de intervenciones terapéuticas especí ficas36. La literatura reporta que la inflamación sistémica se asocia con desenlaces adversos y cómo su intervención con esteroides puede mitigar el daño de órganos. Un estudio, re cientemente publicado, incluyó 452 pacientes con COVID-19, demostró niveles séricos significativamente más altos deTNF-α, IL-1 e IL-6 en pacientes con COVID-19 grave vs. los pacientes no graves37. Además, en los casos graves se identi ficó reducción de las poblaciones de linfocitos T CD4 + y CD8 + y una disminución de las células T reguladoras, probable mente debido a la alta expresión de citoquinas proinflamato rias en este grupo de pacientes37.
Mehta et al. han sugerido que la gravedad de COVID-19 está asociada con un síndrome de tormenta de citoquinas seme jante a linfohistiocitosis hemofagocítica secundaria LHs38. Así como se observa en LHs, los factores ambientales pueden desencadenar o exacerbar una respuesta inmune innata y ad quirida aberrante, con síntesis masiva de citoquinas en sujetos genéticamente susceptibles39. Por ello proponen que todos los pacientes, con COVID-19 severo, deberían ser evaluados para definir o descartar una posible hiperinflamación con labora torios como ferritina, trombocitopenia, eritrosedimentación y plantean que realizar el HScore28 permitiría identificar el sub grupo de pacientes en quienes la terapia inmunosupresora podría mejorar la mortalidad. Fardet et al. demostraron, hace unos 6 años, que un puntaje HScore mayor que 169 era 93% sensible y 86% específico para LHs para recibir terapia inmu nosupresora (glucocorticoides, ciclosporina, azatioprina)28.
Durante el brote de SARS, años 2002 y 2003, pacientes con probable SARS (diagnosticados según los criterios de OMS), fueron tratados de acuerdo con un protocolo con antibacterianos, asociado a una combinación de ribavirina y metilprednisolona. La mayoría de los pacientes que recibieron metilprednisolona en dosis por pulsos y dosis por horario tuvieron bajo requerimiento de soporte ventilatorio y menor progresión a estado grave40.
La revisión sistemática publicada en PLOS medicine, incluyendo los estudios observacionales con uso de corticosteroides en pacientes con SARS no reportó beneficios de supervivencia y si posibles daños asociados (necrosis avascular, psicosis, diabetes y aclaramiento viral tardío)41. Dado que la presentación clínica de neumonía por SARS-CoV-2 es indistinguible del compromiso infeccioso y neumonía por influenza, es necesario tener en cuenta el uso de corticoides en este escenario42. Revisiones sistemáticas, recientemente publicadas43,44, que evalúan el uso de corticoides en neumonía por influenza son consistentes en documentar que la terapia con corticosteroides se asoció con un aumento de la mortalidad con un OR: 3.90 (IC 95%: 2.31 a 6.60). Se observó un aumento similar en el riesgo de mortalidad en un análisis estratificado de estudios que informaron estimaciones ajustadas OR 2.23(IC 95%: 1.54 a 3.24)41.
Cuarenta y seis pacientes en el Hospital de Wuhan, con neu monía grave por COVID-19 en enero de 2020, 26 de ellos recibieron metilprednisolona con dosis de 1-2 mg/kg/día durante 5-7 días vía intravenosa, y fueron comparados con pacientes que no recibieron corticoides. El número de días necesarios para alcanzar temperatura corporal en rango nor mal, fue significativamente más corto en pacientes con admi nistración de metilprednisolona en comparación con aque llos sin administración de metilprednisolona (2.06 ± 0.28 vs. 5.29 ± 0.70, p=0.010). Los pacientes con administración de metilprednisolona tuvieron una mejoría más rápida de SpO2, mientras que los pacientes sin administración de metilpred nisolona tuvieron un intervalo significativamente más largo de uso de oxigeno suplementario (8.2 días [RIQ 7.0-10.3] frente a 13.5 días (RIQ 10.3-16); p <0,001)45.
En otro estudio retrospectivo observacional en China, 10 pa cientes con COVID-19 recibieron corticosteroides con dosis a corto plazo (160 mg/día) asociado a inmunoglobulina (20 g/ día). Como respuesta al tratamiento combinado, el recuento de linfocitos (0,88 ± 0,34 frente a 0,59 ± 0,18, P <0,05), índice de oxigenación SPO2 (94,90 ± 2.51 vs 90.50 ± 5.91, P <0.05) y PaO2 / FiO2 (321.36 ± 136.91 vs 129.30 ± 64.97, P <0.05) presentaron mejoría significativa46.
En mayo de 2020 se publicó un estudio realizado en Esta dos Unidos, en el cual fueron incluidos pacientes mayores de 18 años, con infección confirmada por prueba positiva de transcriptasa inversa-reacción en cadena de la polimerasa (RT-PCR) para SARS-CoV-2/COVID-19 y evidencia radiográfi ca de opacidades pulmonares bilaterales y requerimiento de oxígeno por la cánula nasal, cánula nasal de alto flujo (HFNC) o ventilación mecánica47.
En el grupo de cuidado estándar, los pacientes con enferme dad moderada o grave fueron tratados inicialmente con o sin una combinación de lopinavir-ritonavir y ribavirina o hi droxicloroquina de acuerdo con una guía institucional, inclu yendo uso compasivo de remdesivir para pacientes elegibles con ventilación mecánica. El 17 de marzo de 2020, lopinavir-ritonavir con ribavirina se eliminó del protocolo institucional para infección por SARS-CoV-2/COVID-19.
En el grupo de intervención con corticosteroides de manera temprana, se justificó argumentando que los corticosteroi des lograrían contrarrestar la cascada inflamatoria que con duce a la insuficiencia respiratoria, incremento en la comple jidad de la atención en la UCI y requerimiento de ventilación mecánica. La decisión de prescribir hidroxicloroquina y corti costeroides tempranos fue a discreción del equipo médico47
Los pacientes con compromiso moderado se trataron con hidroxicloroquina 400 mg dos veces al día durante el día 1, seguido de 200 mg dos veces al día los días 2 a 5. Se definió que los pacientes con infección por SARS-CoV-2/COVID-19 moderado con dosis de 4 lt/min o más de oxígeno al ingre so, o requerimientos progresivamente más altos de oxígeno, recibieron metilprednisolona IV de 0.5 a 1 mg/kg/día en 2 dosis durante 3 días. Se recomendó a los pacientes que re quirieron ingreso a la UCI que recibieran el régimen anterior de hidroxicloroquina y metilprednisolona IV de 0.5 a 1 mg/ kg/día en 2 dosis divididas durante 3 a 7 días. Se consideró un desenlace compuesto: intensificación de la atención des de sala general hasta la UCI, mayor soporte en la ventilación mecánica y mortalidad47
Se incluyeron 213 sujetos, 81 (38%) en el grupo de manejo estándar y 132 (62%) en el grupo de manejo con corticos teroides. El criterio de valoración compuesto produjo una tasa significativamente menor en el grupo de corticosteroi des tempranos (34,9% frente a 54,3%, p = 0,005). Este efecto del tratamiento se observó dentro de cada componente de manera individual. También se observó una reducción signi ficativa en la mediana de duración de la estancia hospitalaria en el grupo de corticosteroides tempranos (5 frente a 8 días, p <0,001). El análisis de regresión logística demostró una re ducción independiente en el desenlace compuesto a los 14 días (OR: 0,41; IC 95% 0,22 a 0,77). Este estudio presenta va rias limitaciones, pacientes en el grupo de manejo estándar recibieron corticosteroides después del inicio del protocolo actualizado de tratamiento institucional para infección por SARS-CoV-2/COVID-19 y los esteroides en este grupo, se ini ciaron significativamente más tarde. Además, la adherencia a las guías en el grupo de corticosteroides tempranos no fue universal y puede haber estado sujeta a sesgos, además de una limitada ventana de tiempo de observación para el des enlace mortalidad.
En junio de 2020 se publicaron los resultados prelimina res48 de uno de los brazos del ensayo clínico del estudio RECOVERY, en el cual compararon 2.104 pacientes asignados al azar para recibir dexametasona vs. 4.321 pacientes asigna dos simultáneamente al tratamiento habitual. Los pacientes fueron asignados en una proporción de 2:1 al tratamiento estándar o habitual o al tratamiento habitual más 6 mg de dexametasona una vez al día (oral o intravenosa) durante un máximo de 10 días (o hasta el alta si es antes). 454 (21,6%) pacientes asignados a la intervención con dexametasona y 1.065 (24,6%) pacientes asignados al tratamiento habitual fallecieron a los 28 días (índice de frecuencia ajustada por edad; RR: 0,83 IC 95%: 0,74 a 0,92; P <0,001). Las reduccio nes de la tasa de mortalidad proporcional y absoluta variaron significativamente dependiendo del nivel de soporte respira torio en el momento de la aleatorización (p <0.001). El uso de dexametasona redujo la mortalidad a los 28 días en un 35%, en pacientes que recibieron ventilación mecánica invasiva (RR 0,65 IC 95% 0,51 a 0,82; p <0.001) y en un 20% en pacien tes que recibieron oxígeno sin ventilación mecánica invasiva (RR 0,80 [95 % CI 0,70 a 0,92]; p = 0,002), Sin embargo, no hubo evidencia de beneficio entre aquellos pacientes que no estaban recibiendo soporte respiratorio (RR: 1,22 IC 95% 0,93 a 1,61; p = 0,14). La evaluación de grupos específicos, definen beneficio de la intervención con dexametasona con pacien tes menores de 70 años (RR: 0,64 IC 95% 0,52−0,78), más de 7 días de síntomas (RR:0,68; IC 95% 0,58−0,80).
Si bien algunos desenlaces clínicos parecen beneficiarse del uso de corticosteroides sistémicos, específicamente metil prednisolona, por el momento no se cuenta con ensayos clínicos controlados que demuestren su beneficio claro. En cuanto al uso de dexametasona, se considera ante los resul tados del estudio RECOVERY el beneficio de uso en pacientes con requerimiento de ventilación mecánica o que requieran oxígeno idealmente con más de 7 días de sintomatología. No debe utilizarse en escenarios diferentes a los descritos.
Dada la falta de información derivada de estudios clínicos que documenten efectividad y el posible daño, los corticoi des deben evitarse de rutina, a menos que estén indicados por una razón específica.
Recomendaciones
Se sugiere no usar en la práctica clínica hidroxicloroquina o cloroquina en el manejo de pacientes con infección por SARS-CoV2/COVID-19.
Débil en contra
Punto de buena práctica:
El uso de hidroxicloroquina o cloroquina solo se conside rará en el escenario de un experimento clínico aprobado.
No se emite recomendación a favor o en contra para el uso de Lopinavir/Ritonavir en pacientes con infección por SARS-CoV2/COVID-19.
Punto de buena práctica:
El uso de Lopinavir/ritonavir solo se considerará en el es cenario de un experimento clínico aprobado.
Se recomienda no usar Azitromicina como antiviral sola o en combinación en pacientes con infección por SARS-CoV2/COVID-19.
Fuerte en contra
Se sugiere el uso de tocilizumab en pacientes que no res pondieron a esteroides o tienen contraindicación para su uso y en quienes se cumplan TODOS los siguientes criterios:
Más de 7 días de evolución de los síntomas.
Deterioro respiratorio (evidente requerimiento de soporte ventilatorio o aumento en requerimiento de parámetros ventilatorios, en pacientes que ya se en cuentran en ventilación mecánica).
Niveles de interleuquina 6 > 40 pg/mL en donde es tén disponibles o alternativamente niveles de dimero D mayores a 1500.
2 de 3 de los siguientes:
PCR > 100 mg/L o > 50 mg/L, si su valor se dupli có en las últimas 48 horas.
LDH > 250 UI/ml.
Recuento absoluto de linfocitos < 600 cels/mm3
Haber descartado otros posibles focos de infección aparte del SARS-CoV-2/COVID-19.
Discusión del caso por parte de una junta multidisci plinaria con la participación de al menos 3 especia lidades (hematología, infectología, medicina interna, pediatría, neumología, cuidado intensivo, reumatolo gía, urgenciología, inmunología clínica).
Débil a favor
Se sugiere que la terapia con interferón B como antivi ral en infección por SARS- CoV2/COVID-19 se considere solo en escenarios de experimentos clínicos aprobados.
Débil a favor
Se sugiere que el uso de Remdesivir como antiviral en infección por SARS-CoV2/COVID-19 se considere solo en escenarios de experimentos clínicos aprobados.
Débil a favor
Se sugiere que el uso de Ivermectina como antiviral en infección por SARS-CoV2/COVID-19 se considere solo en escenarios de experimentos clínicos aprobados.
Débil a favor
Se sugiere evitar el uso de corticosteriodes de manera rutinaria en pacientes con infección por SARS-CoV-2/CO VID-19.
Débil en contra
Se recomienda el uso de dexametasona en pacientes con requerimiento de oxígeno o ventilación mecánica preferi blemente con más de 7 días desde el inicio de síntomas.
Fuerte a favor
Puntos de buena práctica:
Considerar el uso de corticoides con otras indicaciones diferentes a infección por SARS-CoV-2/COVID-19 en las cuales se considere eficaz (exacerbación de EPOC, crisis asmática, shock séptico con uso de dosis altas de vaso presores, insuficiencia adrenal, etc.)
Para el uso de dexametasona se debe descartar infección por Influenza; en caso que se documente esta no se debe usar el medicamento.
En caso de no disponibilidad de dexametasona se pue den utilizar dosis equivalentes de metilprednisolona, hi drocortisona o prednisolona.
En pacientes que reciban esteroides se recomienda el uso de ivermectina para profilaxis de infección por Strongyloides.
Se recomienda no usar inhibidores de neuroaminidasa (oseltamivir) en infección por SARS-CoV-2 ya que no tie ne actividad frente a SARS-Cov-2/COVID-19
Fuerte en contra
Punto de buena práctica:
Si se sospecha infección por Influenza, o se tiene eviden cia de la misma está indicado el uso de oseltamivir.
Tabla3
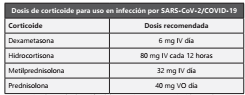
Se recomienda que la duración del tratamiento con corticoides sea hasta por 10 días. Los pacientes que reciban esta terapia deben ser desparasitados con ivermectina 1 gota/Kg dosis única vía oral. IV intravenoso. VO Vío oral
Las contraindicaciones para el uso de tocilizumab son: recuento absoluto de neutrófilos menor a 500 cel/ml, recuento plaquetario menor a 50.000cel/ml, diverticulitis activa, enfermedad inflamatoria intestinal u otra condición que predisponga a perforación intestinal, disfunción hematológica, renal o hepática severa y tuberculosis activa.
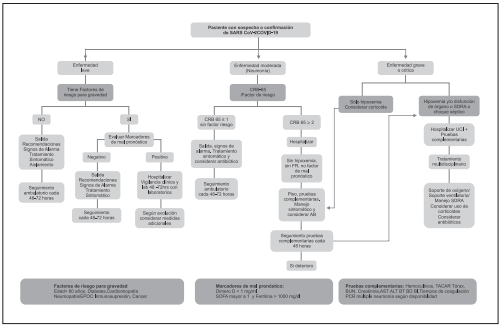
V.A.2 ¿Cuáles son las intervenciones terapéuticas a realizar de acuerdo a la clasificación de la infección por SARS-CoV-2/COVID-19?
A la fecha una de las cohortes publicada con más pacientes, es la de Zunyo49 con 72314 casos del centro para el control de enfermedades infecciosas en China. En ella se describe que el 81% de los casos fueron leves, 14% severos y 5% crí ticos, y una tasa de fatalidad del 2.3%. La mayoría de los pa cientes estaban en el grupo de 30 a 79 años (87%) y 3% eran mayores a 80. La mayor frecuencia de muerte se presentó en adultos mayores y con comorbilidades (cardiovascular, respi ratoria). A pesar de que no hay resultados clínicos favorables en términos de mortalidad, existe la expectativa de que el efecto antiviral documentado in vitro se traslade a un bene ficio en este sentido. En pacientes con formas leves algunos datos muestran disminución en tiempo para la recuperación de los síntomas6 y del aclaramiento viral. Sin embargo, te niendo en cuenta la alta mortalidad entre los pacientes en cuidado crítico se considera que en este grupo de pacientes un potencial beneficio podría superar los riesgos de adminis trar los medicamentos. Por otro lado, no es clara la frecuencia de coinfección, especialmente coinfección bacteriana en los pacientes con COVID-19. La evidencia de la gran cohorte de Nueva York, descrita en el punto anterior informa el no bene ficio y probablemente mayor riesgo del uso de hidroxicloro quina y cloroquina en pacientes con infección por COVID-19 por lo cual se desaconseja su uso De igual forma la evidencia sugiere que la monoterapia con lopinavir/ritonavir tampoco ofrece mayor beneficio por lo que no se emitió recomenda ción para el uso de los mismos en esta edición.
Guan et al. en su cohorte de 1099 pacientes reportan que de los pacientes que requirieron hospitalización con formas no severas, el 53% recibió terapia antibiótica y la frecuencia au mento a 80% en los que ingresaron a UCI. 35% recibió trata miento con oseltamivir y 18% con glucocorticoides, la frecuen cia de muerte fue del 1.4%50. Pacientes críticos reportados por Xiaobo et al. y que recibían terapias con lopinavir y ritonavir así como remdesivir, eran participantes de estudios clínicos que están activos a la fecha. Zhou et al. identificaron como factores de riesgo para muerte la edad, un índice SOFA elevado y dí mero D mayor a 1 ug/ml. Estos factores se deberían considerara la hora de definir los pacientes con mayor riesgo de desen laces adversos (mortalidad, estancia prolongada en UCI) y los que potencialmente se beneficiarían del tratamiento51.
En los pacientes con formas leves (rinosinusitis y faringitis) la ausencia de beneficio y los conocidos efectos adversos hacen que hasta no disponer de una mejor evidencia se re comiende únicamente el manejo sintomático. El tocilizumab se ha usado en pacientes con formas severas y críticas de infección por SARS-CoV-2/COVID-19, en pacientes con hi perinflamación, con más de 7 días de evolución de síntomas, deterioro respiratorio (requerimiento de soporte ventilatorio o aumento en requerimiento de oxígeno en pacientes que ya están ventilados), aumento de reactantes de fase aguda, Sco re H mayor a 132, niveles de interleuquina 6 mayor a 40 pg/ ml o dímero D elevado, siempre con exclusión de otro pro ceso infeccioso concomitante. Se esperará mayor evidencia para emitir recomendaciones sobre el uso con esta molécula.
Si bien algunos desenlaces clínicos parecen beneficiarse del uso de corticosteroides sistémicos, específicamente metil prednisolona, por el momento no contamos con ensayos clínicos controlados que demuestren su beneficio claro. En cuanto al uso de dexametasona, se considera ante los resul tados del estudio RECOVERY el beneficio de uso en pacientes con requerimiento de ventilación mecánica o que requieran oxígeno idealmente con más de 7 días de sintomatología correspondiendo este grupo de pacientes a los clasificados como formas graves o críticas de la enfermedad. No debe utilizarse en escenarios diferentes a los descritos.
Recomendaciones
Se recomienda tratamiento sintomático para los pacientes con formas leves de infección por SARS-CoV-2/COVID-19.
Fuerte a favor
Se recomienda que a los pacientes con infección leve por SARS-CoV-2/COVID-19 les sean indicados los signos alarma para acudir nuevamente al sistema de salud.
Fuerte a favor
Se recomienda la evaluación de comorbilidades y trata miento individualizado de las mismas.
Fuerte a favor
V.A.3 ¿Cuál es la utilidad de asociar antibióticos en pacientes con infección por SARS-CoV-2/ COVID-19?
La recomendación del uso de antibióticos está en función de la clínica y los resultados microbiológicos. Tradicionalmente, en la neumonía viral, se han identificado peores desenlaces en los pacientes con infección combinada (virus-bacteria). A la fecha, no se tienen datos precisos de la frecuencia de coinfección bacteriana (o ausencia de la misma) o con otros agentes en pacientes con SARS-CoV-2, si bien algunos auto reshan reportado coinfecciones con otros virus respiratorios (virus sincitial respiratorio, metaneumovirus, rinovirus, para influenza)52. En un análisis de 191 pacientes con formas seve ras de COVID-19 en unidad de cuidado intensivo, 50% de los pacientes que fallecieron cursaron con infección secundaria y 31% presentaron neumonía asociada a ventilación mecáni ca51. Se ha descrito, aunque con menor frecuencia, infección por hongos (Aspergillus), pero el tipo de muestra de la que fueron aisladas podría indicar contaminación. Los cultivos y las pruebas de biología molecular tipo PCR múltiple son una gran herramienta y pueden constituir un elemento clave en la estrategia para el adecuado uso de antibióticos y las instituciones que dispongan de este recurso deben propen der por su uso. En caso de no tener clara evidencia de coin fección bacteriana se debe suspender la terapia antibiótica. En 5.700 pacientes en USA que presentaban infección por SARS-CoV-2/COVID-19 y que requirieron hospitalización la frecuencia de otros aislamientos (principalmente virus respi ratorios documentados por Film array panel respiratorio fue del 2.1%. En hospitales de Nueva York se realizó un análi sis de cohorte histórica de 88.201 hemocultivos en 28.011 pacientes durante un mes. La tasa de bacteriemia fue me nor en pacientes con infección por SARS-CoV-2/COVID-19 (3.8% Vs 8% en pacientes sin infección por SARS-CoV-2/CO VID-19)49. La mitad de estos hemocultivos en pacientes con SARS-CoV-2/COVID-19 tenía aislamientos de flora comensal (Staphylococcus coagulasa negativo, Bacillus spp, Corynebac terium spp) registrando entonces solo 1.6% de hemocultivoscon significancia clínica con los siguientes microorganismos: Escherichia coli (16.7%), Staphylococcus aureus (13.3%), Kle bsiella pneumoniae (10.0%), y Enterobacter cloacae complex (8.3%; estos fueron positivos en su mayoría los primeros 4 días desde la toma54. El inicio tardío de antimicrobianos en sepsis bacteriana incrementa la mortalidad, por tanto, en pacientes con alta sospecha de neumonía, incertidumbre de coinfec ción y formas clínicas que impliquen hospitalización se debe iniciar terapia antibiótica, acorde a datos locales y guías na cionales o institucionales55.
Recomendaciones
Se recomienda terapia antibiótica empírica en los pacien tes con sospecha de neumonía bacteriana leve o mode rada acorde a guías nacionales o guías institucionales, como diagnóstico diferencial o de coinfección por SARS-CoV-2/COVID-19.
Fuerte a favor
Se recomienda terapia antibiótica empírica en los pacien tes con sospecha de neumonía bacteriana grave acorde a guías nacionales o institucionales para esta enfermedad cuando no estén disponibles pruebas diagnósticas de alta precisión (PCR múltiple) y diagnóstico diferencial o sospecha de coinfección por SARS-CoV-2/COVID-19.
Fuerte a favor
V.A.4 ¿Cuáles son las consideraciones a tener en cuenta, para el uso de suero convaleciente en el marco de la epidemia por SARS-CoV-2/COVID-19?
La terapia inmunológica pasiva con plasma de pacientes convalecientes, que se asume rico en anticuerpos específicos para infecciones virales, ha demostrado utilidad en algunas series de casos, entre ellas en la epidemia por influenza es pañola a principios del siglo pasado56, con una reducción de la mortalidad del 37% en el grupo control contra un 16% en el grupo que recibió producto sanguíneo57. En la epidemia de SARS en 2004, se evalúo de nuevo el uso de plasma de pacientes convalecientes en un estudio con 80 pacientes, en los cuales se evidenció que los que recibían plasma presen taban una tasa de alta hospitalaria antes del día 14 de 58.3% vs 15.6% p<0.001 y también de los pacientes con PCR posi tiva pero seronegativos para coronavirus al momento de la infusión del plasma de 66.7% vs 20% p=0.001. También se evidenció que una administración más temprana de plasma se asociaba con mejores desenlaces clínicos58. Una revisión sistemática con metaanálisis exploratorio en pacientes con SARS viral concluye que hay una reducción estadísticamente significativa en mortalidad comparado con no intervención (OR: 0,25; IC 95% 0,14 a 0,45; I2 = 0%). Sin embargo, es de mencionar, que los estudios fueron de baja calidad y carecían de un grupo control definido59.
Los reportes de casos específicamente en COVID-19 son es casos. Informes de prensa mencionan mejoría en 245 pacien tes, sin embargo, estos no han sido formalmente reportados en una revista científica60,62. El único reporte formalmente pu blicado en esta pandemia, corresponde a una serie de 5 pa cientes chinos, tratados además con esteroides y antivirales, de los cuales los 5 presentaron mejoría en los hallazgos de la tomografía y 4 lograron salir del soporte ventilatorio63. Es tos resultados, además de los reportes históricos, han hecho que se considere que habría un potencial beneficio de esta terapia en pacientes críticamente enfermos, tanto que la FDA la ha aprobado para el tratamiento de pacientes en ese es tado64. Sin embargo, existe una preocupación por la posibili dad de desarrollo de daño inflamatorio pulmonar severo que ha sido encontrado en un número pequeño de pacientes, en un proceso que se ha llamado ADE (Antibody-Dependent enhancement of disease) en estudios con anticuerpos mo noclonales (no con plasma), que han demostrado que el virus puede utilizar el anticuerpo como ruta de entrada a la célula. El ADE ocurre cuando el anticuerpo antiviral no puede neu tralizar completamente el virus. Por el contrario, el complejo virus-Anticuerpo se une al receptor Fc (FcR), permitiendo al virus ingresar a la célula por endocitosis infectando la célula blanco. El resultado de esto es el incremento en la replicación viral del virus y una mayor severidad de la enfermedad, otor gándole al virus una ruta adicional de ataque diferente al de la unión al receptor ACE265. El riesgo de infecciones a través de las transfusiones con los métodos modernos de banco de sangre es bajo hoy en día, sin embargo, si preocupa el ries go de desarrollo de TRALI (Transfusión Related Acute LungInjury), una reacción adversa que precisamente empeoraría el daño pulmonar, y que es más frecuente en pacientes en ventilación mecánica, con sepsis, transfundidos masivamen te, con enfermedad coronaria y falla hepática avanzada66.
Por lo que se considera que la terapia con plasma de conva lecientes podría ser una opción en pacientes con enfermedad critica que entran a Unidad de Cuidado Intensivo dada la alta tasa de letalidad de estos pacientes (50-65%), siempre en el marco de un estudio clínico, idealmente aleatorizado. Tener en cuenta que los centros que se involucren en este tipo de estudios deben contar con las siguientes 6 condiciones67:
Disponibilidad de una población suficientemente grande de pacientes recuperados de la enfermedad y que pue den ser donantes de suero por aféresis en forma segura para el paciente.
Un banco de sangre con la capacidad de procesar, alma cenar, congelar y trasportar, el suero obtenido por afére sis, con la calidad necesaria para garantizar la seguridad del donante y el paciente.
Posibilidad de realizar todas las entrevistas previas a la donación de sangre, y pruebas serológicas necesarias en cualquier donación de sangre, para prevenir la infección por otros virus de transmisión sanguínea.
Disponibilidad de un laboratorio con la capacidad de detectar SARS-CoV-2 en suero y ensayos virológicos de calidad para medir la neutralización viral
Laboratorio de inmunología con capacidad de realizar estudios que permitan determinar la respuesta inmune del donante y la respuesta inmune con la terapia.
Cumplir con todos los requerimientos regulatorios para un estudio clínico, incluyendo aprobación por un Comité de Ética, regulación del INVIMA, los lineamientos del Ins tituto Nacional de Salud y la firma de un Consentimiento Informado.
Los candidatos a recibir dicho tratamiento serían:
Pacientes con neumonía severa con progresión rápida y continua de la carga viral a pesar del tratamiento. Los pa cientes bajo ventilación mecánica pueden ser más suscepti bles a empeorar su cuadro clínico por el desarrollo de TRALI (Transfusión related acute lung injury) y ADE, además de ser los que probablemente se beneficien menos, es por eso que idealmente excluirse de los estudios clínicos.
Capacidad de firmar consentimiento informado.
En cuanto al procedimiento:
Las donaciones de aféresis: se debe extraer un volumen máximo de plasma del 15% de la volemia del donante. Como anticoagulante se utilizará ACD-A o similar. En los casos en que no se use compensación se recomienda no sobrepasar la extracción de 600 ml.
El intervalo entre dos sesiones de plasmaféresis debe ser mínimo 48 horas.
Recomendación
Se recomienda que la terapia con plasma convaleciente solo puede ser considerada en pacientes hospitalizados en UCI con neumonía grave, siempre en el marco de un experimento clínico.
Débil a favor
V.A.5. ¿Cuáles son las estrategias de soporte ventilatorio y de oxigenación en pacientes con infección por SARS-CoV-2/COVID-19?
En pacientes con infección por SARS-CoV-2/COVID-19 puede presentarse insuficiencia respiratoria hipoxémica grave, cuando el paciente con dificultad respiratoria no responde a la terapia de oxígeno estándar, momento en el cual se debe activar el pro ceso para brindar soporte avanzado de oxígeno/ventilación51.
Los pacientes pueden presentar mayor trabajo respiratorio o hipoxemia a pesar la administración de oxígeno a través de una máscara facial con bolsa de reserva (tasas de flujo de 10-15 L / min, que generalmente es el flujo mínimo requerido para man tener la inflación de la bolsa; FiO2 0.60 -0,95). La insuficiencia respiratoria hipoxémica en el SDRA suele ser el resultado de una alteración de la relación ventilación-perfusión intrapulmonar, y generalmente requiere ventilación mecánica68.
Recomendaciones parámetros de ventilación mecánica
Según lo informado los pacientes con COVID-19 presentan principalmente fiebre, mialgia o fatiga y tos seca. Aunque se cree que la mayoría de los pacientes tienen un pronóstico favo rable, los pacientes mayores y aquellos con condiciones subya centes crónicas pueden tener peores resultados. Los pacientes con enfermedades graves pueden desarrollar disnea e hipoxe mia dentro de una semana después del inicio de la enfermedad, lo que puede progresar rápidamente a síndrome de dificultad respiratorio agudo (SDRA) o falla del órgano terminal50.
En la última cohorte descrita de pacientes, los factores de ries go relacionados con el desarrollo de SDRA y la progresión de SDRA a la muerte incluyeron: edad avanzada, neutrofilia y dis función orgánica y de coagulación (p. Ej., Mayor LDH y dímero D). Además, observamos que varios factores asociados con el desarrollo de SDRA no se asociaron con la muerte (Ej., comor bilidades, recuentos de linfocitos, recuentos de células T CD3 y CD4, AST, pre albúmina, creatinina, glucosa, lipoproteína de baja densidad, ferritina sérica, PT). Adicionalmente, la diferencia en la mediana del dímero D entre los grupos de muerte y super vivencia fue mayor que la existente entre los grupos con SDRA y sin SDRA, lo que sugiere que la coagulación intravascular dise minada identificaba pacientes con peor pronóstico.
La patogénesis del coronavirus humano altamente patógeno aún no se comprende completamente. Se cree que la tormen ta de citoquinas y la evasión viral de las respuestas inmunescelulares juegan papeles importantes en la gravedad de la en fermedad69. Vale la pena aclarar que el SDRA no es una enfer medad, es una heterogénea mezcla de pacientes con tantas entidades que hace difícil un abordaje diagnóstico y terapéuti co. La última, la definición de Berlín56, en esta se establecieron como criterios: el tiempo de aparición (menos de una semana posterior a una agresión), infiltrados bilaterales, haber descar tado el edema pulmonar (generalmente por eco) y el deterioro de oxigenación (evaluado por la PaO2/FiO2 a PEEP>5 cmH2O). La mayor parte de los pacientes con neumonía viral en falla res piratoria aguda que requieren intubación orotraqueal y venti lación mecánica cumplen estos requisitos, razón por la cual da remos recomendaciones generales de la estrategia ventilatoria para soportar estos pacientes pero además, para evitar daños asociados con el uso de la ventilación mecánica invasiva70.
Recomendaciones
Se recomienda iniciar soporte respiratorio en insuficiencia respiratoria aguda secundaria a SARS-CoV-2/COVID-19 en pacientes con:
Criterios clínicos: disnea moderada-grave con signos de trabajo respiratorio y/o uso de musculatura accesoria o movimiento abdominal paradójico
ó
ó
Fuerte a favor
El procedimiento debe ser realizado por la persona más entrenada en el equipo y en caso de vía aérea difícil ser intervenida por un experto (Anestesiólogo).
Realizar una evaluación de la vía aérea adecuada que permita definir cuáles pacientes tienen riesgo de vía aérea difícil y de esta manera definir un plan adicional.
Usar dispositivos supraglóticos solo en pacientes con vía aérea difícil y sin personal apto para la intubación. Se debe optar en corto tiempo por una vía aérea de finitiva con intubación orotraqueal.
La IOT despierto no está indicada, excepto en algu nos casos de alto riesgo de broncoaspiración.
Usar un sistema de succión cerrado y no se recomien da preoxigenación con bomba de oxígeno (Ambu) a presión positiva.
En pacientes que requieren IOT sin vía aérea difícil predicha, se debe realizar una secuencia de inducción rápida, que incluye los inductores y coadyuvantes elegidos por el médico a cargo y un relajante muscu lar tipo despolarizante (succinilcolina 1 - 2 mg/kg) o no despolarizante (rocuronio 3 DE 95: 0.9 mg/kg).
Se recomienda utilizar lidocaína en dosis de 1mg/kg IV en dosis única durante la inducción, para disminuir el riesgo de tos inherente al procedimiento.
La laringoscopia debe ser realizada con videolaringos copio o con el dispositivo en el que el médico conside re tenga más experticia. Solo se prescindirá de éste en caso de que no se encuentre disponible rápidamente y prime la necesidad aseguramiento de vía aérea.
Insuflación de neumotaponador rápido para dismi nuir el riesgo de dispersión de aerosoles, siempre confirmar presión, por medio del manómetro, la cual debe ser entre 20 - 30 cm H2O para evitar lesiones de la vía aérea.
Utilizar un filtro de alta eficiencia que debe ser insta lado entre el tubo orotraqueal y el circuito y otro al final del circuito respiratorio.
Uso de capnografía en todos los pacientes ventilados.
No se deben realizar maniobras durante el manejo de la vía aérea que puedan generar aerosoles, entre es tas la ventilación con presión positiva con dispositivo máscara-válvula-bolsa.
No se recomienda el uso de ventilación mecánica no invasiva.
Fuerte a favor
Puntos de buena práctica clínica en ventilación
Se sugieren los siguientes parámetros de ventilación en pa cientes con SARS-CoV-2
En pacientes con SDRA leve y moderado el uso de PEEP entre 5 y 10 cm H2O.
En pacientes con SDRA severo iniciar con PEEP entre 10 y 16 cm H2O con posterior titulación.
Para la titulación de PEEP el uso de la tabla de FiO2/ PEEP para el abordaje inicial.
En pacientes con SDRA moderado a severo, el uso de presión de conducción para la titulación de PEEP.
En pacientes con SDRA moderado a severo, el uso de capnografía volumétrica para la titulación de PEEP.
Relajación Muscular: se sugiere el uso de cisatracurio en las primeras 48 horas, en pacientes con PaO2/FiO2 < 150 mmHg, durante un periodo de 48 horas y mo nitoreo de la relajación.
Se sugiere tener en cuenta las siguientes medidas no farma cológicas:
Evitar el uso rutinario de óxido nítrico en pacientes con SDRA.
Manejo restrictivo de líquidos.
Evitar el uso rutinario de dextranos, almidones y gelatinas en SDRA.
Uso de albúmina para pacientes con SDRA en la fase de reanimación para garantizar un balance neutro o negativo.
Uso de soluciones balanceadas en pacientes con SDRA.
Evitar el uso rutinario del catéter de arteria pulmonar en SDRA.
Se sugiere el Inicio temprano de estrategias de ventila ción en prono por al menos 16 horas continuas en pa ciente con SDRA y PaO2/FiO2 menor a 150 y la termo dilución transpulmonar para monitorizar el manejo de líquidos en pacientes con SDRA moderado a severo.
Terapia ECMO
La terapia ECMO no es la primera línea de tratamiento en caso de pandemia. Se utilizará de acuerdo a disponibili dad. Este recurso es muy limitado a centros especializa dos en nuestro país.
Se recomienda el uso de ECMO en pacientes con hipoxe mia que no respondieron al manejo convencional.
Se sugieren que los siguientes pacientes son candidatos para inicio de terapia ECMO:
Hipoxemia severa: PaFi < 50 con FiO2 > 0.9 durante 3 horas ó, PaFi < 80 con FiO2 > 0.9 durante 6 horas, Hipercapnia severa: PaCO2 > 80 mmHg o, pH < 7.25 y PaCO2 > 60 mmHg durante > 6 horas.
En los pacientes con SDRA en quienes se decidió su uso, se recomienda emplear ECMO veno-venoso temprana en centros especializados.
ECMO veno-venoso es el soporte extracorpóreo para elegir en estos pacientes, sin embargo, dado que la miocarditis está documentada como una de las complicaciones de las infecciones virales por virus Influenza o MERS-CoV, se debe considerar un modo asistido tipo ECMO veno-arterial (VA-ECMO) como última línea en este grupo de pacientes.
V.A.6. ¿Cuál es el papel de las medidas antitrombóticas y quéestrategia de anticoagulación es recomendada en pacientes con infección por SARS-CoV-2/COVID-19?
La mayoría de los pacientes con infección por SARS-CoV-2/ COVID-19 y enfermedad severa presentan afectación en un solo órgano (insuficiencia respiratoria aguda). Sin embargo, algunos progresan a disfunción orgánica múltiple siendo la coagulación intravascular diseminada (CID) una de las com plicaciones de peor pronóstico y que se han asociado con disminución de la probabilidad de sobrevivir a corto plazo71,72). El primer estudio en China mostró como la elevación del dí mero D mayor a 0.5 mg/L, la linfopenia y la trombocitopenia se asociaron con el desarrollo de enfermedad severa, siendo esta determinada como un desenlace primario compuesto, es decir, ingreso a Unidad de Cuidados Intensivos (UCI), uso de ventilación mecánica o muerte71. Con base en lo anterior, y en un metaanálisis en donde se documenta el pobre pro nóstico de los pacientes con trombocitopenia, se recomien da que los pacientes con alguna de estas condiciones sean ingresados sin importar que presenten sintomatología leve aún más en pacientes con edad avanzada o comorbilidades72
Una serie retrospectiva publicada posteriormente incluyó 191 pacientes, 48% de ellos con comorbilidades como dia betes, hipertensión y enfermedad coronaria. De la totalidad de pacientes, 137 fueron dados de alta y 54 murieron durante la hospitalización. En el análisis multivariado los factores aso ciados con mortalidad fueron: edad avanzada, mayor puntaje en el SOFA y dímero D mayor de 1mcg/ml, sin embargo, en los no sobrevivientes fueron más frecuentes la linfopenia, la trombocitopenia, la elevación de la troponina, el tiempo de protrombina (PT) prolongado, la ferritina y la Interleucina 6 (IL6). No se determina en esta serie la asociación de la terapia anticoagulante51.
Posterior a esto, fue publicada una nueva serie retrospectiva en 183 pacientes en la que se comparan también diferentes parámetros entre los pacientes que sobreviven y los que no lo hacen. De forma exploratoria se encontraron diferencias principalmente en la prolongación del tiempo de protrom bina, elevación del dímero D y productos de degradación de fibrina. Se concluye que los resultados anormales en estos parámetros de laboratorio están asociados con un pobre pronóstico pero hasta este momento no se había dilucida do el papel de la terapia anticoagulante73. El mismo autor del estudio anterior y sus colaboradores exploraron entonces en un estudio retrospectivo sobre cual sería el papel del uso de heparinas de forma profiláctica al menos 7 días en la CO VID-19. El desenlace explorado fue mortalidad a 28 días en el cual no hubo diferencias de forma global, pero si hubo un beneficio protector del uso de terapia anticoagulante en pacientes que tuvieran un puntaje de SIC igual o mayor a 474. Basados en este estudio se sugiere que todos los pacientes ingresados en una institución hospitalaria deberían recibir al menos anticoagulación profiláctica a menos de que su uso esté contraindicado, recomendación que es común en la mayoría de guías disponibles75. Aunque el beneficio clínico de la anticoagulación plena no ha sido demostrado específi camente en COVID-19, es muy razonable su uso, basados en datos derivados de escenarios clínicos con comportamiento de CID similares76. Barret et al., del instituto Koch para la in vestigación integrativa en cáncer y universidad de Harvard, realizaron un comentario a las recomendaciones de la Socie dad Internacional de Trombosis y Hemostasia argumentando que en los pacientes con mayor severidad quizás la anticoa gulación plena ofrece mayores beneficios. Se argumenta que los pacientes tienen un fenotipo más con tendencia trombó tica que hemorrágica, que los eventos de sangrado son raros, que es bastante frecuente ver en estos pacientes niveles de fibrinógeno superiores a 700 e inclusive 900 mg/dL y que los niveles de antitrombina III suelen ser bajos lo cual puede ge nerar resistencia a la acción de la heparina y que la profilaxis puede ser, en este sentido, insuficiente. Argumenta además que los estudios muestran mortalidad en UCI que varía entre 22 y 64% y que una de las características más frecuentes en los estudios histopatológicos son los hallazgos de fibrina y micro-trombosis en la vasculatura pulmonar. Es muy posible que en los cuadros severos pasen desapercibidos eventos trombóticos que pueden ser atribuidos a la progresión infec ciosa de la enfermedad77,78.
Recientemente un estudio holandés en pacientes hospitali zados en sala general y UCI demostró una alta incidencia de trombosis venosa profunda inclusive bajo anticoagulación profiláctica ajustada por peso. La incidencia fue especialmente alta en pacientes en UCI con alto recuento leucocitario, eleva da relación neutrófilo/linfocito y dímero D elevado. Este docu mento recomienda que el umbral de sospecha de trombosis venosa profunda debe ser bajo y se debería buscar activamen te la presencia de este en pacientes ingresados en UCI79. Lo mismo fue descrito por Klok et al., también en Holanda, obser vando 31% de complicaciones trombóticas en estos pacien tes80. No se ha demostrado el beneficio de la anticoagulación plena en pacientes sin evento trombótico documentado. Por tanto, las recomendaciones en este sentido deben ser interinas y aunque puede tener un beneficio que no ha sido comproba do, es razonable aumentar la intensidad de la anticoagulación al criterio del médico tratante de acuerdo a la severidad de la enfermedad, los parámetros de CID y el riesgo de hemorragia. De todos modos para cualquier decisión en este sentido, se debe valorar de manera individual el riesgo de sangrado del paciente78,80. Datos recientes muestran que inclusive en algún subgrupo de pacientes, la fisiopatología puede estar explicada por la presencia de anticuerpos antifosfolípidos lo cual expli caría adicionalmente la tendencia trombótica81. Es importante generar actualizaciones con base en la evidencia, los hallazgos clínicos de los estudios y las recomendaciones que sucesiva mente se tengan disponibles82,84.
Recomendaciones
Se sugiere que en los pacientes con bajo riesgo de san grado y con un curso clínico grave o crítico, y elevación del dimero D mayor a 4 veces el valor de referencia del laboratorio o fibrinógeno mayor a 900 mg/dl, se conside re la profilaxis a dosis intermedias o anticoagulación ple na con heparinas de bajo peso molecular, según el riesgo de trombosis por condiciones previas. Deben realizarse ajustes de acuerdo a la función renal, el peso y la edad.
Débil a favor
Se recomienda, cuando los anticoagulantes estén con traindicados o no disponibles, usar tromboprofilaxis mecánica (por ejemplo, dispositivos de compresión neumática).
Fuerte a favor
Se recomienda en pacientes hospitalizados en UCI rea lizar una búsqueda rutinaria de enfermedad tromboem bólica venosa con ultrasonido compresivo cada 5 días sin importar que existan cambios en su condición clínica.
Fuerte a favor
Se recomienda en pacientes con infección por SARS-Cov-2/COVID-19 que presenten deterioro súbito de la oxigenación, taquicardia, o hallazgos radiológicos no compatibles con progresión de la infección viral, realizar búsqueda activa de enfermedad tromboembólica venosa que obligue a la anticoagulación plena.
Fuerte a favor
V.A.7.¿Cuáles son las estrategias de rehabilitación que se deben implementar en pacientes con infección por SARS-CoV-2/COVID-19 que presentaron formas graves de la enfermedad?
Se considera Síndrome de Desacondicionamiento Físico (SDF), a la condición multisistémica que se genera en el humano al momento en que se pasa a un estado de inmovilidad y/o pos tración a partir de las 24 horas de entrar en esta condición y que sus condiciones de deterioro son proporcionales al tiem po de inmovilidad. Sus principales diagnósticos diferenciales son la Polineuropatia y la Miopatia del paciente en estado crí tico. El 69% de los pacientes ventilados por más de 48 horas muestran limitaciones en la función física al egreso de la UCI “por cualquier causa” y aproximadamente el 75% de estas li mitaciones persisten transcurridos 12 meses85. Por lo anterior el mejor tratamiento del SDF es conocerlo y prevenirlo.
Principales manifestaciones por sistemas:
Aparato respiratorio:. disminución de la capacidad vital, disminución de la ventilación voluntaria máxima, varia ciones de la ventilación/perfusión y alteración del meca nismo de la tos.
Sistema nervioso central:. alteración de la sensibilidad, disminución de la actividad motora, labilidad neurovege tativa. trastornos emocionales y de la conducta y déficit intelectual.
Sistema muscular:. disminución de la fuerza muscular, dis minución de la resistencia, atrofia muscular, déficit en la coordinación y reducción de la capacidad de ejercicio.
Esqueleto:. osteoporosis, atrofia del cartílago articular, disminución de la fuerza de tendones y ligamentos y fi brosis y anquilosis de las articulaciones.
Aparato cardiovascular:. aumento de la frecuencia cardiaca, disminución de la reserva cardiaca, disminución del consu mo de oxígeno, hipotensión ortostática y tromboflebitis.
Aparato digestivo:. anorexia, estreñimiento y reflujo gas troesofágico.
Efectos endocrinos y renales:. aumento de la diuresis y desplazamiento del líquido extracelular, disminución de la sensibilidad a la insulina, aumento de la natriuresis, hiper calciuria, desequilibrios hidroelectrolíticos y litiasis renal.
Piel:. atrofia cutánea y úlceras de decúbito.
Estadios del desacondicionamiento físico86:
ETAPA IA:. se inicia en pacientes en estado de coma o bajo efectos de sedación y relajación.
ETAPA IB:. está diseñada para aquellos pacientes con cientes que están confinados en cama.
ETAPA II A:. pacientes con capacidad de deambular con finados a su habitación.
ETAPA II B:. pacientes con capacidad de deambulación que pueden ser traslados al servicio de Rehabilitación Física.
ETAPA III:. Se lleva a cabo en las instalaciones del servicio de Rehabilitación Física, donde a través de ejercicios se busca que el paciente mejore la resistencia al ejercicio y a través de actividades de terapia ocupacional la completa indepen dencia en sus actividades básicas cotidianas. (ABC).
ETAPA IV: . es la fase final. El paciente asiste al servicio de Rehabilitación Física y se busca la reincorporación del paciente a todas sus actividades familiares, laborales, re creativas, deportivas y educativas en los programas de ejercicio establecidos.
Se debe iniciar movilización temprana a pacientes con intu bación mayor de 48 horas en la unidad de cuidado intensivo para prevenir y minimizar las complicaciones del síndrome de desacondicionamiento físico por encamamiento crítico.
Estabilidad hemodinámica:. FC en reposo < 50% de FC máxima para la edad, Variabilidad PA < 20%, ECG normal( No IAM reciente o arritmia cardiaca). PaO2/FIO2>300; SpO2 > 90%; caída SpO2 < 4% en la movilización, Fr me nor de 40 y sin patrón paradójica, adecuado patrón res piratorio, no trombosis venosa profunda ni tromboem bolismo pulmonar, Hb mayor de 7 mgs, leucocitos entre 4.300 - 10.800 células/mm3, temperatura no mayor de 38°, glicemia entre 3.5 - 20 mmol/L85 -(88) .
Postura de prevención:. La postura del paciente en la cama tiene gran importancia. En decúbito supino, el tronco debe estar alineado con las caderas, las rodillas y los cuellos de pies, en una posición neutra, señalando los dedos de los pies hacia el techo. Los hombros deben colocarse en 30º de flexión y 45º de abducción, las muñecas en 20º 30º de extensión, y las manos en posición funcional86.
Movilización de prevención:. Cada 2 horas se debe ubicar en decúbito prono o lateral de carácter estricto en la tetra plejia, el estado de inconsciencia y alteraciones sensitivas. Promover el sedente progresivo de acuerdo a la condición hemodinámica iniciar 30° y 10° interdiario o el sedente a 70 ° por 30 minutos de acuerdo a tolerancia día86.
Movilización terapéutica:. (20 minutos mínimo 1 vez al día, ideal 2 veces por día), ejercicios isométricos, isotó nicos, y aeróbicos, por separado o combinados. Deben ser progresivos y a tolerancia. De manera Pasiva, activa o asistida. Tiempo Ideal de Inicio en las 48 horas iniciales del encamamiento86.
Medios físicos:. con objetivos claros específicos y mien tras no estén contra indicados.
Respiración:. se requiere fisioterapia torácica con ejer cicios de respiración profunda, incentivos respiratorios, ejercicios de percusión torácica etc., de acuerdo a proto colos de terapia pulmonar de cada grupo de trabajo85),86.
Comunicación:. incluyen la intención comunicativa, la estandarización del lenguaje paraverbal indicativo y ges ticular entre el grupo tratante y el paciente. Procesos mo tores básicos de la comunicación y el habla. Deglución segura. En la profesional de Fonoaudiología86.
Interconsulta a fisiatría:. cualquier variación de los pa rámetros de estabilidad o de las recomendaciones du rante la intervención de prevención del SDF86. En caso de sospecharse polineuropatía del paciente crónico y/o miopatía del paciente crítico debe ser interconsultado el médico fisiatra para apoyar el diagnóstico.
La rehabilitación pulmonar es un proceso de intervención no farmacológico, integral y multidisciplinario que busca a través del entrenamiento físico, educación y cambios comportamen tales, lograr en el paciente bienestar físico y sicológico. Dentro de las indicaciones de la rehabilitación pulmonar están las en fermedades pulmonares obstructivas, enfermedades restricti vas y otras condiciones. En la pandemia de COVID-19 vamos a tener muchos pacientes con comorbilidades pulmonares y sobrevivientes de SDRA, que debemos reintegrar de manera temprana a su actividad productiva y vida cotidiana. La reha bilitación pulmonar será en este proceso de gran ayuda89,93
Puntos de buena práctica:
V.A.8 ¿Cuál es el criterio de curación y alta hospitalaria en pacientes con infección por SARS-CoV-2/COVID-19?
La erradicación del virus se define como la desaparición del ARN viral de los fluidos corporales. Teniendo en cuenta las recomendaciones de: World Health Organization (13 de marzo de 2020)94, Ministero della salute, Consiglio Superiore di Sani tà, Italy (28 February 2020)95, China CDC, National Centre for Infectious Diseases (NCID) Singapore96, CDC USA y European Centre for Disease Prevention and Control (10 Mar 2020)97; se recomienda que los pacientes con COVID-19 pueden ser dados de alta y continuar aislamiento en casa si cumplen los siguien tes criterios: ausencia de fiebre >72 horas sin antipiréticos, me joría de los síntomas respiratorios, no requiere hospitalización por otras patologías y 2 RT-PCR para SARS-CoV-2 negativas con intervalo de muestra mayor a 24 horas. Sin embargo en nuestro medio se considera con poco costo beneficio la reali zación de 2 pruebas moleculares para definir el egreso.
Recomendaciones
Se recomienda que los pacientes con infección SARS-CoV-2/COVID-19 pueden ser dados de alta y continuar aislamiento en casa si cumplen los siguientes criterios:
y
y
y
Fuerte a favor
Las recomendaciones para aislamiento una vez se dé el alta se encuentran en el capítulo VIII Prevención y control de la infección intrahospitalaria por SARS-CoV-2.
V.A.9. ¿Qué papel juegan los documentos de voluntades anticipadas (DVA) en la atención de pacientes con infección por SARS-CoV-2/ COVID-19?
Las conversaciones honestas y oportunas sobre las preferen cias y prioridades de la persona, incluidas las decisiones an ticipadas sobre el tratamiento (ventilación mecánica, unidad de cuidado intensivo), son parte de la planificación antici pada de la atención para cualquier persona que tenga una enfermedad progresiva que limita la vida98.
En el contexto de las personas que tienen la enfermedad gra ve por infección por SARS-CoV-2/COVID-19 las conversacio nes honestas sobre los objetivos de la atención y la planifica ción del escalonamiento terapéutico deben iniciarse lo antes posible para que se pueda desarrollarse un plan de atención y apoyo personalizado99,101. Esto deberá revisarse de manera periódica a medida que cambie la situación clínica. Las fa milias y las personas cercanas a la persona deben participar en estas discusiones en la medida de lo posible y de acuer do con los deseos de la persona. Esta es una buena práctica estándar en cuidados paliativos y al final de la vida99,100,102,103. En el contexto de infección por SARS-CoV-2/COVID-19, es probable que la persona presente un deterioro rápido, por lo que la oportunidad de debatir y participar en la toma de decisiones puede ser limitada o pérdida. El equipo de Cui dados Paliativos institucional puede brindarle apoyo para la realización de este abordaje102,103. Se considera discutir los documentos de voluntades anticipadas específicamente so bre tratamiento invasivos tales como ventilación mecánica y admisión a unidad de cuidado intensivo. La Resolución 2665 de 2018 emitida por el Ministerio de Salud y Protección So cial es la guía para la realización del documento de voluntad anticipada en Colombia.
Recomendación
Se recomienda que los pacientes con infección por SARS-CoV-2/COVID-19 cuenten con un documento de volunta des anticipadas donde manifiesten las preferencias y prio ridades de la persona en caso de deterioro clínico que les impida tomar decisiones. Considerando que los pacientes y sus familias participen en estas discusiones en la medida de lo posible y de acuerdo con los deseos de la persona.
Fuerte a favor
V.A.10. ¿Cuál debe ser la conducta en caso de presentarse dilemas éticos o toma de decisiones éticamente complejas durante la atención clínica de un paciente con infección por SARS-CoV-2/ COVID-19?
Los médicos deben asegurarse de que durante la pandemia los pacientes reciban la atención que desean, alineando la atención que se brinda con los valores y objetivos de los pa cientes, la importancia de este punto no es nuevo e incluso cobra mayor importancia durante la pandemia98,100,101. Los pacientes con mayor probabilidad de desarrollar enfermeda des graves son los más ancianos y los que tienen una mayor carga de enfermedad crónica101.
Un marco ético sólido para el cuidado de la salud durante la pandemia debe balancear el deber de cuidado centrado en el paciente, con deberes enfocados en el público para promover equidad e igualdad en las personas y en la distribución de riesgos y beneficios en la sociedad. Es posible que durante la atención a pacientes con infección por SARS-CoV-2/CO VID-19 se presenten dilemas éticos o se requiera toma de de cisiones éticamente complejas, dado los diferentes escenarios clínicos derivados del cuidado. Por lo cual cuando los grupos tratantes presenten alguna de estas situaciones, el equipo de cuidados paliativos institucional puede brindarle apoyo para la realización de este abordaje, cuando no es posible la con sulta directa con un especialista en cuidados paliativos, se deben utilizar sistemas telefónicos, video conferencias o de telemedicina de servicios cercanos que puedan brindar este apoyo104. Otra opción según la complejidad del caso también es la activación de comité de ética de manera prioritaria104.
Recomendación
En caso que durante la atención clínica de un paciente con infección por SARS-CoV-2/COVID-19 se presenten dilemas éticos o se requiera toma de decisiones éticamente com plejas, se recomienda el apoyo por parte del equipo de cui dados paliativos institucional o la activación del comité de ética de manera prioritaria. En caso de no contar con esos recursos en las instituciones se puede considerar el apoyo de centros de referencias por vías digitales para tal fin.
Fuerte a favor
V.B. MANEJO DE SÍNTOMAS EN PACIENTES CON INFECCIÓN POR SARS-COV-2/COVID-19.
V.B.1. ¿Cómo debe ser el manejo de síntomas que tienen impacto en la calidad de vida en pacientes con infección por SARS-CoV-2/COVID-19 que no requieren o no tienen indicación de ventilación mecánica en población adulta y pediátrica?
Se debe proporcionar un buen control de síntomas para to dos los pacientes dado que las consecuencias de no brindar atención de confort en una pandemia son graves. Primero, va en contra de uno de los principios clave del proceso de cla sificación en escenarios de pandemia: el concepto que todos los pacientes deben ser atendidos. Segundo, sí el personal de salud se enfrenta ante situaciones de pacientes en sufrimien to sin las herramientas para su alivio, tiene como consecuen cia tasas más altas de agotamiento del personal105.
Los síntomas clínicos suelen ser respiratorios sin embargo la fiebre es un síntoma muy frecuente, así como el delirio en especial en pacientes con mayores factores de riesgo o comorbilidades106,107. Los síntomas clínicos más frecuentes do cumentados en el meta análisis de Rodríguez-Morales et al., son la fiebre (88.7%, IC 95% 84.5-92.9%), tos (57.6%, IC 95% 40.8-74.4%) y disnea (45.6%, IC 95% 10.9-80.4%) de igual forma fueron las más prevalentes manifestaciones clínicas2. En la población pediátrica es importante mencionar los sín tomas gastrointestinales, diarrea, vómito y deshidratación108.
Estos síntomas en especial en la población con factores de ries go pueden llegar a ser muy significativos y afectar la calidad de vida, en especial en los escenarios donde los pacientes tienen cuadros clínicos que requieren tratamiento hospitalario, pero no tiene indicación o necesidad de manejo avanzado o en UCI105,106.
Por lo anterior, se recomienda evaluar estos síntomas siste máticamente en las evoluciones clínicas y dejar pautados tra tamientos farmacológicos por horario y a necesidad para el control de estos, dado su impacto en la calidad de vida105, 109,110,111.
Fiebre
La frecuencia de la fiebre fue significativamente mayor en adultos en comparación con niños (92.8%, IC 95% 89.4- 96.2%; versus 43.9%, IC 95% 28.2-59.6%)106. Para su tratamien to se recomienda, para el manejo sintomático, el uso de ace taminofén oral o en caso de no tolerancia a la vía oral su uso venoso. Considerar reducción de dosis en paciente anciano frágil, en presencia de falla renal, elevación de transaminasas o peso menor de 50Kg109.
En caso de refractariedad al síntoma se sugiere el uso de Me tamizol (Dipirona) administrando a necesidad, sin superar la dosis máxima al día. Tener en cuenta: estado hemodinámico, recuento de leucocitos/plaquetas y objetivos terapéuticos para establecer riesgo/beneficio de su uso112,113.
Se sugiere no usar AINEs en razón a los efectos secundarios tanto renales como gastrointestinales, particularmente en personas con factores de riesgo (Hipertensión arterial, dia betes mellitus y enfermedad cardiovascular) (114,115,116
El dolor en los adultos debe ser evaluado con la escala ver bal análoga, calificando de manera subjetiva la percepción del dolor en una escala de 0 a 10, siendo 10 dolor severo. Establecer la intensidad es útil para orientar su manejo, una calificación igual o menor de 3 se considera dolor leve, de 4 a 6 se considera dolor moderado y calificaciones superiores a 7 se considera dolor severo, es muy importante una valoración sistemática de este síntoma dado el impacto en la calidad de vida, así como el aumento en el riesgo de delirio y otras complicaciones109.
La evaluación inicial del niño que presenta dolor o signos con ductuales de dolor requiere información sobre su localización, duración y características, así como de las repercusiones del do lor en diversos aspectos de la vida del niño, tales como el sueño, su estado emocional, relaciones, desarrollo y función física117.
El proceso de evaluación del dolor en el niño debe tener en cuenta, su desarrollo cognitivo e información sobre su com portamiento habitual cuando no tiene dolor. La evaluación puede plantear problemas en niños que todavía no hablan y en niños con retraso del desarrollo físico por malnutrición o enfermedad117.
Es necesario reconocer el dolor, evaluarlo, medirlo y seguir su evolución y las estrategias para controlarlo, utilizando para ello instrumentos que sean apropiados para la edad, cultura y estado del niño. Los instrumentos para medir el dolor en niños que no hablan o con alteraciones cognitivas se basan en la cuantificación y puntuación de los signos conductuales. Se recomienda el uso de la escala FLACC para la evaluación del dolor en niños entre 1 mes y 36 meses de edad o en niños mayores con dificultades cognitivas para el autoreporte117,118.
Los instrumentos más comunes de medición del dolor -es calas de intensidad del dolor- se basan en la capacidad para cuantificar el dolor. La intensidad del dolor se puede deter minar enseñando al niño a utilizar escalas cuantitativas del dolor. Los instrumentos prácticos basados en los conceptos de cuantificación y recuento son apropiados para todas las culturas. La capacidad de cuantificación y recuento depende de la edad y del nivel de desarrollo del niño117,118.
Las revisiones han recomendado las escalas de autoevaluación siguientes para medir la intensidad del dolor en niños con dolor agudo y persistente: Escala revisada de caras de dolor Figura 1 117,118.
Estos diferentes instrumentos están validados para medir la intensidad del dolor en niños de más de 3 a 4 años. Para mayores de 7 años se recomienda el uso de la Escala Visual Análoga. Se recomienda el uso de la escala Revisada de Caras y la escala de caras Wong-Baker para la evaluación del dolor en niños entre 3 y 7 años; o en niños mayores con dificulta des cognitivas para el autorreporte118.
Tabla 1 Escala FLACC
0: No dolor, 1 - 2 dolor leve, 3 -5 dolor moderado, 6 - 8 dolor severo, 9 -10 el peor dolor imaginable.
Disnea
Presente en los pacientes con infección por SARS-CoV-2/CO VID-19 entre un 19-55%, estas variaciones están relacionadas con la presentación clínica. La disnea es un síntoma que afecta severamente la calidad de vida, se considera que el tratamien to inicial es el uso de oxígeno suplementario el cual disminuye la sensación de disnea en pacientes con hipoxemia, sin embar go, en ocasiones a pesar de adecuados parámetros de satura ción el paciente puede experimentar persistencia de este sín toma108,109. Por lo anterior se debe adicionar a la oxigenoterapia medidas no farmacológicas dentro de las que encontramos el adecuado posicionamiento del paciente, al estar sentado recomendar una posición recta o inclinada hacia delante, al estar acostado se sugiere la posición prono además el uso de técnicas de relajación109.
Si el síntoma es moderado o severo, en especial en pacientes en quienes no tienen indicación de ventilación mecánica, los opioides ayudan a reducir la percepción de disnea119. El opioide de primera elección es la morfina la cual puede ser usada oral o vía SC/IV109,111, se considera siempre usar la mínima dosis re querida para proveer alivio y titular de acuerdo con su necesi dad, además considerar la profilaxis antiemética y vigilancia de estreñimiento, dado que son un efecto adverso gastrointes tinales muy frecuentes15. En caso de falla renal o intolerancia se puede considerar el uso de oxicodona o hidromorfona IV/ SC, también considerando usar la mínima dosis requerida para proveer alivio y titular de acuerdo con su necesidad, además de estrecha vigilancia clínica de neurotoxicidad109.
La ansiedad es un componente importante de la sensación de disnea por lo que la segunda línea en el manejo farma cológico son las benzodiacepinas de acción rápida como el midazolam105), (109, usar solo en caso que a pesar del manejo con opioides presente ansiedad por disnea, inicialmente adminis trar a necesidad, no por horario y vigilar la respuesta clínica.
Tos
Es uno de los síntoma más frecuentes, en algunas series hasta en el 68% de los casos3. Se debe considerar cada uno de los escenarios clínicos para su tratamiento, al ser un síntoma tan frecuente se puede presentar incluso en el paciente ambula torio y requiere medicamentos para el control sintomático.
En el paciente ambulatorio: manejo farmacológico inicial se recomienda con antitusivos o uso de codeína5. En los niños no están indicados los antitusivos ni los opioides débiles, se recomienda el uso de jarabes con miel o miel pura en los mayores de 1 año117.
En el paciente hospitalario adulto: Iniciar tratamiento con an titusivos o uso de codeína. En caso de que el síntoma sea per sistente sin eficacia a codeína, se sugiere inicio morfina, usar la mínima dosis requerida para proveer alivio y titular de acuerdo a su necesidad109. En caso de falla renal o intolerancia se puede considerar el uso de oxicodona o hidromorfona IV/SC.
En el paciente hospitalario pediátrico: no están indicados los antitusivos ni los opioides débiles, se recomienda como pri mera línea el uso de morfina, y también uso de jarabes conmiel o miel pura en los mayores de 1 año. En caso de falla renal o intolerancia se puede considerar el uso de oxicodona o hidromorfona IV/SC117), (118.
Secreciones
Las secreciones respiratorias pueden ser difíciles de controlar y alterar de manera importante la calidad de vida, particu larmente en el contexto de patología pulmonar subyacente. Se describe el papel de los agentes antisecretores, como el bromuro de hioscina para el control sintomático, así como el uso de Bromuro de ipatropio109), (111. Dado que muchos de estos pacientes pueden tener limitaciones para poder expectorar, fluidificar las secreciones si el paciente no tiene un mecanis mo de tos efectiva no se recomienda109.
Delirium
Con respecto al delirium la probabilidad de que ocurra de lirium multifactorial en esta población es relativamente fre cuente en especial en situaciones de fin de vida. Los sínto mas de delirium pueden estar acompañados de agitación y/o inquietud. Es muy importante valorar y corregir los factores reversibles (dolor, retención urinaria, impactación fecal) (111,119.
Con respecto a su tratamiento si bien los antipsicóticos son los medicamentos de primera elección, en especial para el delirium hiperactivo120, es importante considerar el escenario clínico del paciente con delirium en tratamiento con cloro quina o hidroxicloroquina, frente a los que no reciben anti maláricos. Esta consideración esta en relación con el riesgo del uso de antipsicóticos y la prolongación del QT121.
En los escenarios donde el paciente NO este recibiendo cloroquina o hidroxicloroquina, se considera el uso de ha loperidol, quetiapina, levomepromazina u olanzapina como agentes antipsicóticos. El inicio del haloperidol puede ser por vía IV/SC, si el paciente tiene vía oral y predomina insomnio por intranquilidad o agitación nocturna, considerar uso de quetiapina o levomepromazina109,111,120.
En pacientes en tratamiento CON hidroxicloroquina o cloro quina y presencia de delirium considerar uso de olanzapina iniciando con dosis bajas pues dentro de los antipsicóticos es el que tiene el riesgo más bajo de prolongación de QT (17) o el uso de benzodiacepinas120.
En niños, las causas de delirium son múltiples y está relacio nada con efectos adversos de benzodiacepinas y opioides, con gran frecuencia. Existen múltiples escalas para su diag nóstico, se sugiere utilizar las adoptadas por las unidades cuidado intensivo pediátrico (UCIP) de cada institución. Se recomienda, en general los antipsicóticos como el haloperi dol, risperidona y olanzapina122,123.
Recomendaciones
Los principales síntomas que van a requerir manejo sin tomático de manera simultánea a los tratamientos espe cíficos para la enfermedad son: fiebre, disnea, dolor to rácico, tos, secreciones bronquiales y delirium. En la po blación pediátrica es importante mencionar los síntomas gastrointestinales, diarrea, vómito y deshidratación.
Se recomienda evaluar estos síntomas sistemáticamente en las evoluciones clínicas y dejar pautados tratamientos farmacológicos por horario y a necesidad para el control de estos, dado su impacto en la calidad de vida.
Fuerte a favor
Fiebre
Se sugiere de manera preferencial el uso de acetami nofén oral o venoso a las dosis estándar.
Débil a favor
Se sugiere que en pacientes con fiebre refractaria el uso de dipirona/metamizol. Se recomienda no usar en meno res de 1 año, pacientes en último trimestre de embarazo o en lactancia.
Débil a favor
Se sugiere no usar AINEs en razón a los efectos secun darios tanto renales como gastrointestinales, particular mente en personas con factores de riesgo (Hipertensión arterial, diabetes mellitus y enfermedad cardiovascular)
Débil a favor
Puntos de buena práctica para otros síntomas:
Dolor
Débil a favor
Puntos de buena práctica para otros síntomas:
Dolor
En adultos o niños mayores de 7 años la escala verbal análoga.
En niños entre 1 mes y 36 meses o en niños mayores con dificultades cognitivas de edad el uso de la esca la FLACC (por las iniciales inglesas de sus apartados- Face, Legs, Activity, Cry, Controlability)
En niños entre 3 y 7 años de edad o en niños mayo res con dificultades cognitivas para el autoreporte la escala Revisada de Caras.
En adultos en caso de dolor leve se recomienda iniciar manejo con acetaminofén a dosis estándar, en caso de dolor moderado o severo el uso de opioides débiles ini cialmente y si el dolor no presenta mejoría se recomien da el uso de opioides fuertes como morfina por horario. Usar la mínima dosis requerida para proveer alivio y titu lar de acuerdo con su necesidad.
En niños caso de dolor leve se recomienda iniciar manejo con acetaminofén a dosis estándar, en caso de dolor mo derado o severo se inician opioides fuertes por horario. Usar la mínima dosis requerida para proveer alivio y titu lar de acuerdo con su necesidad
Disnea
Las medidas no farmacológicas juegan un rol importante en el manejo de la disnea, se debe indicar un adecuado posicionamiento del paciente, al estar sentado recomen dar una posición recta o inclinada hacia delante, al estar acostado se sugiere la posición prono. Hacer uso de téc nicas de relajación.
En el caso de los niños, la posición más cómoda es la que escoja el niño; de igual manera, es importante que pueda estar con un familiar que le brinde confianza y tranquilidad.
Se recomienda no usar abanicos o ventiladores de mano.
En pacientes con disnea moderada a severa que no me jora a pesar de oxigenoterapia, los opioides ayudan a reducir la percepción de disnea. Se recomienda el uso de morfina IV/SC, en caso de falla renal o intolerancia se puede considerar el uso de oxicodona o hidromorfona IV/SC. Usar la mínima dosis requerida para proveer alivio y titular de acuerdo con su necesidad.
En los niños, los opioides son la primera línea en manejo farmacológico de la disnea: morfina e hidromorfona.
La ansiedad es un componente importante de la sensa ción de disnea por lo que la segunda línea en el manejo farmacológico son las benzodiacepinas de acción rápida como el midazolam.
Nota aclaratoria
Para el manejo de disnea moderada-severa en pacientes que no tienen indicación de ventilación mecánica, es importante aliviar el sufrimiento asociado al síntoma y la sensación de “ahogo” para lo cual se recomienda morfina en dosis bajas. Este escenario será excepcional en la población pediátrica afectada por COVID-19 por que la evidencia, hasta el mo mento muestra que los casos severos son pocos.
El uso de opioides fuertes en la población pediátrica afectada por COVID-19 será un escenario excepcional dado el porcen taje bajo de complicaciones en este grupo etáreo.
Tos
Como alternativas no farmacológicas se recomienda rea lizar una adecuada hidratación, mantener cabeza levan tada al dormir y evitar el tabaquismo.
En el paciente ambulatorio: manejo farmacológico inicial para los adultos se recomienda con antitusivos o uso de codeína. En los niños no están indicados los antitusivos ni los opioides débiles, se recomienda el uso de jarabes con miel o miel pura en los mayores de 1 año.
En el paciente hospitalario adulto: iniciar tratamiento con antitusivos o uso de codeína. En caso síntomas sea per sistente sin eficacia a codeína, se sugiere inicio morfina, usar la mínima dosis requerida para proveer alivio y ti tular de acuerdo a su necesidad. En caso de falla renal o intolerancia se puede considerar el uso de oxicodona o hidromorfona IV/SC.
En el paciente hospitalario pediátrico: no están indica dos los antitusivos ni los opioides débiles, se recomienda como primera línea el uso de morfina, y también uso de jarabes con miel o miel pura en los mayores de 1 año. En caso de falla renal o intolerancia se puede considerar el uso de oxicodona o hidromorfona IV/SC.
Secreciones bronquiales
Se recomienda el uso de butil bromuro de hioscina en vía SC/IV.
Se recomienda en el uso de Bromuro de ipratropio en inhalamocamara.
No se recomienda el uso de estrategias de fluidificación de secreciones.
No se recomienda usar micronebulizaciones.
Delirium
Para el manejo no farmacológico se recomienda identifi car y tratar posibles causas, incluyendo la oxigenoterapia para tratamiento de hipoxemia.
En adultos:
En pacientes, que presenten delirium hiperactivo, y no estén recibiendo medicaciones que prolonguen el intervalo QTc se recomienda uso de haloperidol vía IV/SC, usar la mínima dosis requerida para proveer alivio y titular de acuerdo con su necesidad, consi derar uso por horario cada 8 horas si el síntoma es persistente.
En pacientes que no reciban medicaciones que pro longuen el QTc, que presenten delirium si predomina insomnio por intranquilidad o agitación nocturna, considerar uso de quetiapina o levomepromazina
En pacientes con medicaciones que potencialmente prolonguen el intervalo QTc y delirium considerar uso de olanzapina iniciando con dosis bajas o el uso de benzodiacepinas (lorazepam, midazolam)
En niños, las causas de delirium son múltiples y está re lacionada con efectos adversos de benzodiacepinas y opioides. Se recomienda, en general los antipsicóticos como el haloperidol, risperidona y olanzapina.