VII. Población pediátrica
VII.1. CLASIFICACIÓN CLÍNICA DE CASOS Y ESTRATIFICACIÓN DEL RIESGO
VII.1.1. ¿Cuál es la clasificación clínica de casos y estratificación del riesgo?
Los casos clínicos en pediatría se clasifican según la severi dad en asintomáticos, leves, graves y críticos.
La enfermedad no complicada, se define como aquellos pa cientes que presentan síntomas de infección aguda del trac to respiratorio superior, que incluyen fiebre, fatiga, mialgia, tos, dolor de garganta, secreción nasal y estornudos. Al exa men físico, hallazgos inespecíficos en faringe y ausencia de cambios a la auscultación pulmonar. Algunos casos pueden no tener fiebre o solo tener síntomas digestivos como náu seas, vómitos, dolor abdominal y diarrea.
Los pacientes con neumonía leve presentan fiebre y tos fre cuente, principalmente tos seca, seguido de tos productiva, algunos pueden tener sibilancias, sin hipoxemia ni dificultad para respirar, anormalidades a la auscultación pulmonar con roncus y crépitos. Algunos casos pueden no tener signos y síntomas clínicos, pero la tomografía de tórax muestra lesio nes pulmonares, que son subclínicas.
En algunos consensos y series publicadas, la neumonía leve es clasificada también como enfermedad moderada (guía es pañola, Brasil, series Wuhan). En este consenso adoptamos la clasificación de la OMS para neumonía.
Graves: son los que desarrollan rápidamente síntomas respiratorios tales como fiebre y tos, que pueden es tar acompañados por síntomas gastrointestinales tales como diarrea. La enfermedad progresa en cerca de una semana, y se acompaña de al menos uno de los siguien tes síntomas:
Cianosis central: La saturación de oxígeno es menor de 92% a altitud < 2000 m sobre el nivel del mar, y menor de 90% a altitud > 2000 m sobre el nivel del mar.
Dificultad respiratoria severa: dada por quejido, ale teo nasal, tiraje supraesternal, retracción torácica se vera o disociación toraco-abdominal.
Incapacidad o dificultad para alimentación.
Disminución del estado de conciencia, letargo o pér dida de conocimiento o convulsiones.
Taquipnea severa (en respiraciones/min): ≥70 rpm en menores de 1 año; ≥50 rpm en mayores de 1 año.
Gasometría arterial: PaO2 < 60 mmHg, PaCO2 > 50 mmHg.
El diagnóstico es clínico; las imágenes de radiografía de tórax pueden excluir complicaciones (atelectasias, infiltrados, derrame).
Pueden estar presentes otras alteraciones tales como trastor nos de la coagulación (tiempo prolongado de protrombina y elevación de dímero-D), daño miocárdico (aumento de enzi mas miocárdicas, cambios de ST-T en el electrocardiograma, cardiomegalia e insuficiencia cardíaca), disfunción gastroin testinal, elevación de enzimas hepáticas y rabdomiólisis1), (2.
Críticos:. son los que rápidamente progresan a un Sín drome de Dificultad Respiratoria Agudo - SDRA o falla respiratoria, y pueden también tener choque séptico, en cefalopatía, lesión miocárdica o falla cardiaca, disfunción cardiaca, y lesión renal aguda. La disfunción orgánica puede ser amenazadora de la vida1.
Criterios diagnósticos de SDRA:
Inicio: nuevo o empeoramiento del cuadro en los 10 días previos.
Rx tórax, tomografía de tórax (TAC) o ecografía de tó rax: Nuevo(s) infiltrado(s) uni/bilaterales compatibles con afectación aguda del parénquima pulmonar.
Origen edema pulmonar: insuficiencia respiratoria en au sencia de otra etiología como fallo cardiaco (descartado por ecocardiografía) o sobrecarga de volumen.
Oxigenación (OI = Índice de oxigenación y OSI = Índice de oxigenación usando SpO2):
VNI bilevel o CPAP ≥5 cmH2O a través de una másca ra facial completa: PaO2/ FiO2 ≤ 300 mmHg o SpO2 / FiO2 ≤264
SDRA leve (ventilación invasiva): 4 ≤ OI < 8 5 ≤ OSI < 7.5
SDRA moderado (ventilación invasiva): 8 ≤ OI <16 7.5 ≤ OSI < 12.3
SDRA grave (ventilación invasiva): OI ≥ 16 OSI ≥ 12.33.
Criterios diagnósticos de sepsis:
Infección sospechada o comprobada y ≥ 2 criterios de SIRS, de los cuales uno debe ser temperatura anormal o recuento leucocitario anormal (los otros 2 criterios son taquipnea y ta quicardia o bradicardia en < 1 año).
Es grave si presenta disfunción cardiovascular, SDRA o >= 2 disfunciones del resto de órganos4.
Criterios diagnósticos de choque séptico:
Cualquier hipotensión (PAS <percentil 5 o >2 DE por debajo de lo normal para la edad) o 2-3 de los siguientes:
Estado mental alterado;
Taquicardia o bradicardia (FC <90 lpm o >160 lpm en lactantes y FC <70 lpm o > 50 lpm en niños);
Llenado capilar lento (>2 segundos) o vasodilatación ca liente con pulsos conservados;
Taquipnea;
Piel moteada o erupción petequial o purpúrica;
Lactato aumentado, oliguria, hipertermia o hipotermia5.
Recomendación
Se recomienda clasificar los casos en asintomáticos, le ves, graves y críticos. La enfermedad leve incluye los ca sos no complicados y neumonía leve sin requerimiento de oxígeno, la grave a aquellos pacientes que requieren hospitalización por factores de riesgo o por requerimien to de oxígeno, y la crítica incluye pacientes que requieren ingreso a UCI (Unidad de Cuidado Intensivo) y/o cum plen criterios de SDRA (Síndrome de Dificultad Respira torio-Aguda), sepsis o choque séptico.
Fuerte a favor
VII.1.2. ¿Cuáles son los elementos para establecer la gravedad de la infección por SARS-CoV-2/ COVID-19?
Hasta la fecha se han descrito únicamente reportes de casos o series de casos de pacientes pediátricos en la literatura y ningu no ha estudiado elementos de gravedad específicos de la enfer medad, solo se han utilizado los elementos previos descritos en infecciones respiratorias agudas y sus complicaciones.
Con esto en mente se buscaron los elementos que se utilizan en Colombia actualmente para estos escenarios que son:
La estratificación de gravedad de la Guía de Práctica Clí nica para la evaluación del riesgo y manejo inicial de la neumonía en niños y niñas menores de 5 años y bron quiolitis en niños y niñas menores de 2 año6.
Los criterios de admisión y egreso para las unidades pediátricas de cuidados intensivos e intermedios en Co lombia por la Asociación Colombia de Medicina Critica y Cuidado Intensivo (AMCI) (6.
La estratificación de gravedad del Síndrome de Dificultad Respiratoria Agudo pediátrico por la conferencia de con senso pediátrico sobre lesión pulmonar aguda (PALICC) (7.
La estratificación de gravedad en sepsis por la conferen cia internacional de consenso sobre sepsis pediátrica.
Con base en esos grupos se define que los elementos a uti lizar son:
La edad con factor de gravedad independiente y como requisito para estandarización de valores normales en constantes vitales.
La presencia de comorbilidades congénitas o adquiridas.
La anormalidad de los signos vitales, en especial la fre cuencia respiratoria (FR) y cardiaca (FC).
La presencia de trabajo respiratorio aumentado: tirajes musculares torácicos, quejido, aleteo, disociación tora coabdominal. entre otros).
Trastornos de la oxigenación: oxímetro de pulso (SpO2) baja según altitud, fracción inspirada de oxígeno (FiO2) elevadas, relaciones de presión arterial de oxígeno (PaO2)/FiO2 o SpO2/FiO2 bajas).
Trastornos ventilatorios: cambios en la presión parcial de dióxido de carbono (PaCO2) o presión dióxido de carbo no al final de la espiración (EtCo2).
Patrón radiológico del tórax: opacidades, derrames.
Alteraciones de conciencia.
Signos de circulación anormal: pulsos anormales, diso ciación de temperatura, cambios de la perfusión distal, aumento en la variabilidad de presión de pulso, fracción de eyección (FE) baja o gasto cardiaco (GC) bajo.
Disfunción de órganos secundaria: renal, hepática, hema tológica, gastrointestinal8.
Recomendación
Se recomienda que se evalúen elementos para clasificar gravedad de acuerdo con la evidencia en otras infeccio nes respiratorias en niños. Tener en cuenta la edad, pre sencia de comorbilidades, frecuencia respiratoria y fre cuencia cardiaca anormales, signos de trabajo respirato rio aumentado, evidencia de trastornos de la oxigenación y ventilación, patrón imagenológico del tórax, cambios de conciencia, signos de circulación anormal y signos de disfunción de otros órganos (renal, hepática, hematoló gica, gastrointestinal, cerebral)
Fuerte a favor
VII.1.3. ¿Cómo se estratifica la infección por SARSCoV-2/COVID-19 de acuerdo con la edad?
La enfermedad en neonatos, lactantes y niños, según ha sido re portado, es menos severa en comparación con los adultos9.10,11.
En etapa neonatal se destacan los siguientes grupos12:
Leve: dificultad para respirar y fiebre.
Grave: intolerancia alimentaria, sangrado gástrico, neumotórax, distrés respiratorio13
En el estudio retrospectivo sobre las características epide miológicas y clínicas en 2143 pacientes menores de 18 años con SARS-CoV-2/COVID-192, la gravedad se definió en fun ción de las características clínicas, pruebas de laboratorio y radiografía de tórax.
Los criterios de diagnóstico fueron los siguientes:
Infección asintomática: sin ningún síntoma ni signo clíni co y la imagen del tórax es normal, con prueba molecular de SARS-CoV-2/COVID-19 positiva.
Leve: síntomas de infección aguda del tracto respiratorio superior, incluyendo fiebre, fatiga, mialgia, tos, dolor de garganta, secreción nasal y estornudos. El examen físico muestra congestión de la faringe y ninguna anormalidad a la auscultación. Algunos casos pueden no tener fiebre o solo tener síntomas digestivos como náuseas, vómitos, dolor abdominal y diarrea.
Moderado: con neumonía, fiebre y tos frecuente, princi palmente tos seca, seguido de tos productiva, algunos pueden tener sibilancias, pero no hipoxemia, como falta de aliento, a la auscultación pulmonar se pueden auscul tar crépitos finos y gruesos. Algunos casos pueden no te ner signos y síntomas clínicos, pero la Tomografía axial de tórax muestra lesiones pulmonares, que son subclínicas.
Grave: los síntomas Respiratorios tempranos, como fie bre y tos, pueden ir acompañados de síntomas gastroin testinales, como diarrea. La enfermedad generalmente progresa alrededor de 1 semana y se produce disnea, con cianosis central. La saturación de oxígeno es inferior al 92%, con otras manifestaciones de hipoxia.
Crítico: los niños pueden progresar rápidamente al Sín drome de dificultad respiratoria aguda (SDRA) o insufi ciencia respiratoria, y también pueden tener shock, en cefalopatía, lesión miocárdica o insuficiencia cardíaca, disfunción de la coagulación y lesión renal aguda. La dis función orgánica puede ser mortal.
Recomendación
Se recomienda estratificar la infección por SARS-CoV-2/ COVID-19 de acuerdo con la edad, de la siguiente ma nera: neonatos, menores de 3 meses, de 3 meses a 12 meses, 1 a 5 años, 6 a 10 años, 11 a 15 años y mayores de 15 años, haciendo especial énfasis en los menores de 1 año.
Fuerte a favor
VII.1.4. ¿Cuáles son los factores de riesgo para presentar complicaciones asociadas a la infección por SARS-CoV-2/COVID-19?
Para definir los factores de riesgo asociados a complicacio nes y/o gravedad, inicialmente se utilizó evidencia indirecta de otras patologías infecciosas virales que cursan con neu monía ya que la evidencia hasta el momento de la escritura del consenso no es suficiente y los artículos publicados son descripciones de series de casos. En un estudio publicado en el 2019 sobre los factores de riesgo por otros coronavirus14 se comparó a niños inmunocomprometidos vs no inmuno comprometidos para definir complicaciones y se encontra ron como factores de riesgo el inmunocompromiso con un OR: 2,5 (p:0.01) enfermedad pulmonar de base con un OR 5,9 para desarrollar neumonía y OR: de 4,5 para enfermedad grave, coinfección viral especialmente por virus sincitial res piratorio (VSR) con un OR: 7,7 y otros virus diferentes a VSR OR 1,4. Describen además mayor riesgo para neumonía en menores de 5 años, especialmente menores de 1 año. Dong Y y colaboradores, reportan uno de los estudios retrospecti vos con mayor número de pacientes pediátricos a la fecha, incluyendo 2.143 pacientes, de los cuales 731 (34,1%) fueron confirmados por estudio de PCR y 1.412 (65,9%) fueron casos sospechosos. La media de edad fue de 7 años. Con respecto a la severidad, es de resaltar que 94,1% de la totalidad de pacientes cursó de forma asintomática o con enfermedad leve a moderada. Sin embargo, aquellos que cursaron con enfermedad grave, fueron principalmente los menores de 1 año, postulando esto como un factor de riesgo en pediatría. Concluyen que el grupo de los lactantes es un grupo de ries go en la infección por SARS-CoV-2/COVID-192.
Se revisó además la guía de práctica clínica del Ministerio de Protección Social en Colombia para bronquiolitis y neumonía y los factores de riesgo que consideró el grupo desarrollador en su elaboración15.
Según la literatura actual, los niños representan aproximada mente del 1 al 5% de los casos diagnosticados de COVID-19. Aproximadamente el 90% de los pacientes pediátricos son diagnosticados como enfermedad asintomática, leve o mo derada (16,17,18. Sin embargo, hasta el 6,7% de los casos pueden ser graves. La enfermedad grave generalmente se observa en pacientes menores de 1 año y pacientes con enfermedades subyacentes19,20. En la serie de casos de Lu X. et al., de los 171 pacientes pediátricos, 3 tenían condiciones preexisten tes tales como hidronefrosis, leucemia e intususcepción21. En otro informe sobre las características de ocho niños con COVID-19 grave, dos de los tres niños que permanecieron gravemente enfermos, tenían comorbilidades preexistentes (Leucemia linfoblástica aguda y estrechez del saco lagrimal); los otros cinco no tenían ninguna comorbilidad y se recupe raron de su enfermedad grave22.
En las 2 primeras semanas de marzo en Madrid, España, se confirmaron un total de 41 niños de 365 que fueron tami zados en 30 hospitales. De estos 41 niños, 25 (60%) fueron hospitalizados, 4 en unidad de cuidados intensivos, de los cuales sólo a un niño se le encontró antecedente de comor bilidad por la presencia de sibilancias recurrentes23. Datos de los CDC de Estados Unidos reportan entre el 12 de fe brero y el 2 de abril de 2020 un total de 149.082 casos de los cuales 2.572 (1.7%) fueron en menores de 18 años. La información sobre el estado de hospitalización estuvo dis ponible para 745 (29%) niños, reportando una mayor tasa de hospitalización en los menores de 1 año. En 345 se indago por condiciones subyacentes, encontrando 80 (23%) de estos niños con al menos una condición de base. Las más comunes fueron la enfermedad pulmonar crónica (incluido el asma) en 40 pacientes, enfermedad cardiovascular en 25 pacien tes e inmunosupresión en 10 pacientes24. Por tal razón, dada la información disponible hasta la fecha acerca del espectro de las comorbilidades subyacentes en las diferentes series de pacientes pediátricos con infección por COVID-19, no se puede establecer de manera general la enfermedad pulmo nar como un factor de riesgo potencial. Sin embargo, tenien do en cuenta la caracterización de los factores de riesgo para infección severa por coronavirus humano se encuentra que la enfermedad pulmonar subyacente (sin discriminar tipo de patología) incrementa el riesgo (OR de 5.9 [IC 95%, 4.1-8.5]) para infección respiratoria baja severa sin diferencias entre las cepas de coronavirus humano14. La Asociación Española de Pediatría dentro de sus guías para manejo de pacientes con COVID-19 incluye como grupo de riesgo para mala evo lución las patologías pulmonares tales como: fibrosis quís tica, displasia broncopulmonar, asma grave, portadores de traqueostomía o ventilación mecánica domiciliaria25.
En la actualización del consenso chino sobre COVID-19 pe diátrico, de acuerdo a sus experiencias con casos confirma dos de COVID-19 en niños, recomiendan considerar de alto riesgo a los niños que cumplen con alguno de estos criterios: 1. Aquellos con contacto de un caso de COVID-19 severo, 2. Aquellos con enfermedades de base como cardiopatía con génita, enfermedad de la vía aérea, enfermedad renal cróni ca, falla cardiaca, desnutrición, cáncer, diabetes, inmunode ficiencia o enfermedad metabólica hereditaria, 3. Pacientes que reciben medicamentos inmunosupresores y 4. Niños menores de 3 meses.
Dada la escasa evidencia actual acerca de los casos pediátri cos y de la evidencia indirecta disponible previamente para infección respiratoria aguda (bronquiolitis y neumonía), en donde la mayoría de los casos graves se presentan en meno res de 3 meses, se acuerda por consenso reducir la edad de riesgo para nuestra población pediátrica a 3 meses en espera de mejor evidencia.
En cuanto a pacientes con asma, se aconseja continuar el ma nejo crónico según las recomendaciones dadas por la Aso ciación Colombiana de Neumología Pediátrica, Asociación Colombiana de Neumología y Cirugía de Tórax26, incluidos los corticosteroides inhalados, según la prescripción médi ca27,28. En caso de presentar crisis los pacientes deben recibir ciclo corto de corticosteroides orales (CCO) si está indicado. Siguiendo las recomendaciones dadas en la Guía GINA (Glo bal Initiative for Asthma) en tiempos de pandemia COVID-19, los pacientes con asma deben continuar con su medicación para manejo crónico independiente de su nivel de severidad, incluidos los casos especiales como el de los pacientes con asma grave los cuales pueden requerir tratamiento prolon gado con CCO además de sus medicamentos inhalados. En este caso, se recomienda continuar los CCO en la dosis más baja posible para evitar el riesgo de crisis/exacerbaciones graves. Se recomienda preferencialmente el uso de inhala dor dosis medida presurizado con inhalocámara durante las crisis graves. (las inhalocámaras no se deben compartir en el hogar). En los pacientes con rinitis alérgica asociada se deben seguir usando los corticosteroides nasales, acorde a lo pres crito por su médico29.
El grupo de consenso presenta la información en pediatría so bre la frecuencia de signos y síntomas basados en la informa ción disponible que proviene de reportes de series de casos.
El primer reporte en niños fue del Hospital Pediátrico de Wu han30. Esta cohorte reporta 171 casos pediátricos confirma dos por laboratorio. El segundo es un reporte americano con 2.572 casos confirmados por laboratorio, de los cuales solo en el 9,4% (242) de los datos se contaba con signos y sínto mas31. En una revisión sistemática de la literatura de casos principalmente asiáticos, se incluyeron 6 series de casos con un total de 93 niños32. Otra revisión sistemática publicada en JAMA el 22 de abril de 2020 resume 1.065 casos pediátricos. Resalta como síntomas principales fiebre y tos, pero llama la atención sobre los síntomas gastrointestinales33. Algunos reportes de casos también han publicado manifestaciones dermatológicas como exantemas34.
Estos fueron en orden de frecuencia los signos y síntomas reportados:
Generales: fiebre (41,5 a 59%), cefalea 81 (28%), mialgias 66 (23%), fatiga (7,6%), taquicardia 72 (42,1%),
Respiratorios: tos (48,5% a 54%), odinofagia (24%), dis nea (13%), rinorrea (7,2 a 7,6 %), eritema faríngeo (46,2%), congestión nasal (5,3%), taquipnea (28,7%).
Gastrointestinales: diarrea (8,8 a 13%), náusea/vómito (6,4 a 11%), dolor abdominal (5,8%).
Otros: exantema, alteraciones ungueales (casos esporádicos).
También se ha reportado un aumento inusual de casos de un síndrome inflamatorio multisistémico temporalmente asociado a COVID-19 definido como MISCA (Multisystemic Inflammatory Syndrome in Children and Adolescents tem porally related with COVID-19) similar al cuadro clínico co nocido en la enfermedad de Kawasaki y en el síndrome de choque tóxico, por lo cual la OMS ha emitido una alerta y consideraciones frente al diagnóstico de esta enfermedad con una definición de caso preliminar mientras se conocen nuevos datos35.
Recomendación
Se recomienda tener en cuenta los factores de riesgo para complicación definida como enfermedad grave que requiera hospitalización e ingreso a UCI en caso de neumonía por SARS-CoV-2/COVID-19. Los factores de riesgo son: inmunosupresión primaria o secundaria, edad menor de 3 meses, coinfección viral del tracto respira torio inferior, comorbilidades como: enfermedades car diacas congénitas, enfermedad pulmonar crónica como fibrosis quística, asma y displasia broncopulmonar; he moglobinopatías como anemia de células falciformes, diabetes, enfermedad renal crónica, desnutrición grave y enfermedades neuromusculares.
Fuerte a favor
Se recomienda que por las características socioeconómi cas de la población colombiana se evalúe el riesgo social en todos los pacientes, como un potencial factor de ries go para complicaciones.
Fuerte a favor
Punto de buena práctica:
Aunque el asma podría ser un factor de riesgo, se sugiere continuar el manejo crónico de los pacientes con asma y rinitis alérgica, incluidos los corticosteroides inhalados, según la prescripción médica. En caso de presentar crisis los pacientes deben recibir ciclo corto de corticosteroi des orales (CCO) si está indicado.
Los pacientes con asma grave deben continuar con los tratamientos biológicos que cumplen los criterios para su uso.
VII.2. MANIFESTACIONES CLÍNICAS EN PEDIATRÍA
VII.2.1. ¿Cuáles son los signos y síntomas en los pacientes pediátricos con sospecha de infección por SARS-CoV-2/COVID-19?
Se realizó una búsqueda sistemática de la literatura con un horizonte desde el 1 enero al 22 de junio de 2020 en los motores de búsqueda: Pubmed, EMBASE, LILACS, SCIELO y Google Scholar.
Se encontraron inicialmente series de casos y más recientemente algunos estudios de cohortes y revisiones sistemáticas, algunas con meta-análisis de estas series de casos. En todas es común la gran heterogeneidad, la dominancia de casos asiáticos y mezclas de diferentes diseños que pueden inducir sesgos en los resultados y conclusiones. A continuación, se resumen los principales hallazgos.
El primer reporte en niños fue del Hospital Pediátrico de Wuhan 36. Esta cohorte reporta 171 casos pediátricos confirmados por laboratorio y reportan predominantes síntomas de infección respiratoria aguda. El segundo es un reporte americano en 2.572 casos confirmados por laboratorio de los cuales solo 242 contaban con datos de signos y síntomas predominando los respiratorios 37. A partir de aquí se han presentado múltiples revisiones sistemáticas, algunas con metaanálisis y nuevas series de casos o cohortes retrospectivas con entre 93 y 2. 914 sujetos totales (38-49) además del más reciente reporte americano de CDC en junio con 69.403 casos en menores de 19 años 50.
Todos estos artículos tienen en común que refieren síntomas respiratorios acompañados de síntomas generales como hallazgos de mayor frecuencia, seguidos por síntomas gastrointestinales en un menor porcentaje de los casos. También se han reportado de forma esporádica algunas manifestaciones dermatológicas ungueales y exantemas.
A continuación, resumimos las frecuencias de signos y síntomas reportados en estos artículos
Generales.
Fiebre 50% (39 a 76%), taquicardia 42%, cefalea 15% (3-29%), mialgias 15% (2-23%), fatiga 5% (2-9%), ageusia/anosmia 4% (2- 6%) y erupción/exantema cutáneo 3%.
Respiratorios.
Tos 38% (12 a 62%), rinorrea 11% (2 a 23 %), odinofagia 9% (4-41%), disnea 8% (1-16%).
Gastrointestinales.
Nauseas/Vómito 12% (8-21%), diarrea 9 % (2,3 a 13,5%) y dolor abdominal 6,6% (4,1 -10,5%).
Otros.
Alteraciones ungueales (casos esporádicos).
Recomendación
Se recomienda sospechar la infección por SARS CoV-2/COVID -19 en pediatría ante la presencia de signos o síntomas de infección respiratoria aguda, asociados o no a fiebre, síntomas sistémicos o manifestaciones gastrointestinales.
Fuerte a favor
VII.3. PRUEBAS DIAGNÓSTICAS EN PEDIATRÍA
VII.3.1. ¿Cuáles son las pruebas diagnósticas para establecer caso confirmado por SARS-CoV-2/COVID-19?
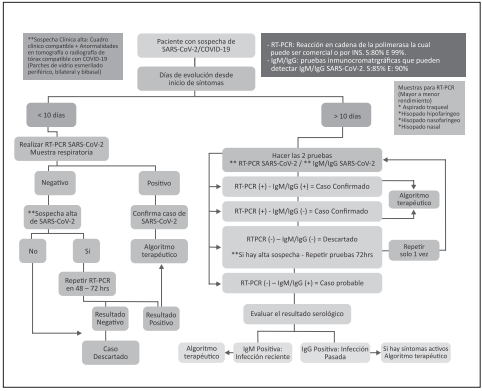
Para hacer un diagnóstico confirmado de SARS-CoV-2/CO VID 19 acorde a la fase de diseminación en la que se encuen tra el país actualmente se sugiere realizar diagnóstico mo lecular por medio de rRT-PCR específica para SARS-CoV-2/ COVID-19. Esta prueba se puede tomar de las siguientes muestras (sensibilidad)51-53:
Lavado broncoalveolar (93%)
Aspirado bronquial o esputo (72%)
Hisopado naso y orofaríngeo (63%)
Las muestras obtenidas por esputo inducido no se recomien dan dado el alto riesgo de formación de aerosoles.
Si el resultado de la prueba es positivo se recomienda sea reprocesado para verificación.
Esta técnica está disponible en nuestro país para procesamiento por parte del Instituto Nacional de Salud (INS) y varios laborato rios en diferentes ciudades del país con el aval del INS.
Las pruebas para realizar en caso sospechoso de SARS-CoV-2/COVID-19 en orden de importancia son51:
Amplificación de Ácido Nucleico (NAAT) como rRT PCR (reacción en cadena polimerasa de transcripción inversa en tiempo real), esta prueba detecta secuencias únicas de ARN por NAAT (genes virales N,E,S, RdRP) en caso de no estar disponibles remitir a un laboratorio de referencia.
Pruebas serológicas: Otra de las pruebas a considerar son las pruebas serológicas, realizadas mediante técnica de ELISA, las cuales han demostrado una mejor sensibili dad y especificidad en muestras a partir del día 10 de la enfermedad comparado con las diferentes opciones por inmunocromatografía o inmunoensayos por lateral flow. Estas pueden tener varios usos54,55,56:
Investigación de un brote en curso, puede ser útil para diagnóstico precoz, hay estudios que demuestran que puede ser adecuado en el contexto de neumo nía asociada a SARS-CoV-2/COVID-19 especialmente en estadios avanzados de la infección (posterior a 10 días) y como complemento a las pruebas NAAT.
Evaluación retrospectiva de la tasa de ataque o la extensión del brote en caso de que los NAAT sean negativos y exista un fuerte vínculo epidemiológico.
En este momento no está recomendado realizar el diagnóstico de SARS-CoV-2/COVID-19 por medio de pruebas serológicas.
Secuenciación viral: confirmación de presencia del virus. Útil para mostrar mutaciones del genoma viral, que pu dieran afectar en el desempeño de las decisiones médi cas, incluidas las pruebas de diagnóstico, también para estudios de biología molecular.
Cultivo viral: no se recomienda de rutina.
Recomendación
Se recomienda la realización de rRT-PCR de SARS-CoV-2/ COVID-19 para hacer diagnóstico de infección por SARSCoV-2/COVID-19 a personas sintomáticas.
Fuerte a favor
Se recomienda la realización de rRT-PCR de SARS-CoV-2/ COVID-19 a muestras de aspirado traqueal o aspirado nasofaríngeo u orofaríngeo, o hisopado nasofaríngeo u orofaríngeo.
Fuerte a favor
Se recomienda la realización de una segunda prueba de rRT-PCR de SARS-CoV-2/COVID-19 a las 48 horas (según disponibilidad), en pacientes con la primera prueba negativa con alta sospecha de neumonía por SARS-CoV-2 / COVID-19.
Fuerte a favor
Se recomienda no usar el esputo inducido por el alto riesgo de formación de aerosoles.
Fuerte en contra
VII.3.2. ¿Cuáles son las pruebas diagnósticas adicionales para un paciente con sospecha de infección por SARS-CoV-2/COVID-19?
Además de las pruebas para SARS-CoV-2/COVID-19, se sugiere, en pacientes con infección respiratoria aguda que requieran hospitalización, pruebas para detección de otros tipos de virus, especialmente Virus Respiratorio Sincitial e Influenza, incluyendo influenza cepa H1N1. Estas pruebas idealmente deben ser realizadas por PCR (simple o multi plex). En caso de no estar disponibles, pueden ser tomadas por métodos antigénicos, teniendo la PCR una mayor sensi bilidad y especificidad para el aislamiento viral51.
Recomendación
Se recomienda realizar PCR múltiple anidada en todos los pacientes con infección grave o crítica para evaluar diagnósticos diferenciales de SARS-CoV-2/COVID-19 así como coinfecciones virales o bacterianas.
Fuerte a favor
En caso de no disponibilidad de pruebas moleculares, se recomienda realizar pruebas antigénicas virales a pacien tes con infección grave o crítica para evaluar diagnósticos diferenciales de SARS-CoV-2/COVID-19.
Fuerte a favor
VII.3.3. ¿Cuáles son los exámenes de apoyo para un paciente con sospecha de infección por SARS-CoV-2/COVID-19?
Los hallazgos de laboratorio documentados en la población pediátrica son similares entre las infecciones causadas por diferentes coronavirus7 . Se han descrito dentro de las alteraciones: recuento leucocitario normal o disminuido, con o sin linfopenia asociada. Puede ocurrir también trombocitopenia. Los reactantes de fase aguda, proteína C reactiva y procalcitonina, se encuentran por lo general en rango normal. Un valor de procalcitonina > 0,5 ng/mL indica coinfección bacteriana. En casos graves: elevación de enzimas hepáticas, Lactato Deshidrogenasa (LDH), enzimas musculares y mioglobina, así como, prolongación de pruebas de coagulación y dímero D aumentado. En el caso de niños infectados por SARS-CoV-2/COVID-19, hallazgos de laboratorio similares a los antes descritos han sido observados.
Henry y colaboradores en una reciente publicación describen las anormalidades de laboratorio en niños con enfermedad por SARS-CoV-2/COVID-1958. Un total de 12 artículos fueron incluidos con un tamaño de muestra total del 66 pacientes. La edad de los pacientes estuvo entre las 2 semanas y los 17 años. La serie blanca fue normal en el 69,6% de los casos. El resto de los pacientes, en similar proporción, presentaron leucocitosis o leucopenia (15,2%). La mayoría de los pacientes tuvieron un recuento de neutrófilos normal. Neutrofilia o neutropenia fue ron documentadas en el 4,6% y 6% de los pacientes, respecti vamente. Un 3% de los casos presentaron linfopenia
Solo 2 pacientes fueron publicados en el estudio de Wang y col., en el cual, sólo se incluyeron pacientes con enfermedad asintomática, leve o moderada59. Los marcadores inflamato rios, PCR y PCT estuvieron elevados en el 13,6% y 10,6% de los casos, respectivamente. No fue reportado, en ninguna de las publicaciones, el comportamiento de otros exámenes como bioquímica hepática o renal. Describen casos de eleva ción en las transaminasas hepáticas, LDH, dímero D, Creatini na, creatinin kinasa (CPK).
La Asociación Española de Pediatría establece los estudios de laboratorio a realizar según la severidad de la enfermedad así60:
Infección no complicada: sólo indicados si el paciente pre senta fiebre. Recomiendan la realización de hemograma, he mocultivos, proteína C reactiva (PCR), procalcitonina (PCT), transaminasas, iones y coagulación.
Infección grave y crítica, incluyendo los admitidos en unidad de cuidados intensivos: en todos los casos, recomiendan: he mogramamograma, hemocultivos, proteína C reactiva (PCR), procalci tonina (PCT), transaminasas, iones y coagulación. Además, la toma de uroanálisis y microalbuminuria (según disponibili dad en la institución), dado que la lesión renal aguda puede ser factor independiente de mortalidad durante la hospitali zación, sugiriendo que la detección temprana puede ayudar a mejorar el pronóstico61,62.
Dentro de los estudios paraclínicos realizados en adultos se ha encontrado que la elevación de la ferritina es un predictor de mortalidad. Sin embargo, su análisis debe ser usado con especial cuidado por no tener evidencia contundente en pe diatría, sobre todo por el número de pacientes pediátricos analizados63. A pesar de esto, es importante determinar que en varios estudios retrospectivos, algunos de estos multicén tricos, como el estudio que analizó 150 casos confirmados de COVID-19 en Wuhan, China, incluyeron ferritina elevada con una media 1.297,6 ng/ml en no sobrevivientes, frente a 614,0 ng/ml en sobrevivientes (p <0 · 001) (60. Otro estudio que analizó 48 pacientes, en el hospital Tongji Medical colle ge, también determinó que una ferritina mayor a 1.006,16 ( 408,265- 1.988,25 p< 0.05), se define como un marcador de mal pronóstico, y como un reactante de fase aguda asociado con la liberación de IL2 , IL7 e IL18 y con un fenómeno infla matorio severo que en algunas condiciones se puede vincu lar con aparición de síndrome hemofagocítico y con mayor mortalidad. Se ha correlacionado valores más altos en los pacientes con mayor severidad clínica64.
La elevación de ferritina puede estar asociada a la respues ta inflamatoria inducida por el virus y/o confecciones63,65,66, o por actividad inflamatoria relacionada con el síndrome hemofagocítico. En esta medida, contar con un nivel de fe rritina determinará la posibilidad de establecer conductas terapéuticas que incluyan el manejo del síndrome hemofa gocítico y así buscar disminuir la mortalidad relacionada a SARS-CoV-2/COVID-19 en el paciente crítico67,68.
Recomendación
Se recomienda no solicitar exámenes de apoyo en ausen cia de alteración de signos vitales o de la oxigenación y sin factores de riesgo.
Fuerte en contra
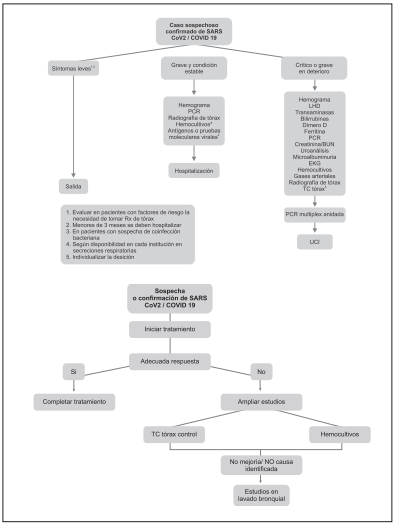
En pacientes con sospecha de infección o infección con firmada por SARS-CoV-2/COVID-19 y enfermedad cla sificada como grave, que se hospitalizan y su evolución es estable se recomienda la realización de hemograma y proteína C reactiva.
Fuerte a favor
En pacientes con sospecha de infección o infección confir mada por SARS-CoV-2/COVID-19 crítico o grave en dete rioro, se recomienda la realización de hemograma, proteína C reactiva, enzimas hepáticas, bilirrubinas, función renal, LDH, CK, EKG, dímero D, uroanálisis, microalbuminuria, fe rritina como factores de estadificación y pronóstico.
Fuerte a favor
Se recomienda solicitar gases arteriales en pacientes con infección grave en deterioro o infección crítica por SARS-CoV-2/COVID-19.
Fuerte a favor
Se recomienda realizar hemocultivos en pacientes con enfermedad grave o crítica en quienes se sospeche coin fección bacteriana.
Fuerte a favor
VII.3.4. ¿Cuál es la utilidad de las imágenes de tórax en el diagnóstico inicial y seguimiento de los pacientes pediátricos con infección por SARS-CoV-2/COVID-19?
La radiografía de tórax se ha usado de forma estándar en la mayoría de los estudios. Reportando de forma no sistemática la presencia de opacidades intersticiales o consolidaciones. El uso de esta parece frecuente, e incluso se ha utilizado como parte de la evaluación de la severidad de la infección en cier tos estudios y guías69,70.
No hay recomendaciones específicas sobre la utilidad diag nóstica de la radiografía de tórax en cuanto a sensibilidad y especificidad. Se considera su usoen el contexto de diagnós tico de neumonía. Se ha reportado normalidad en pacientes con cuadros leves o iniciales de la enfermedad incluso con sospecha clínica de neumonía72. Así mismo, estudios en pe diatría la han usado para clasificar la enfermedad en grado de severidad70 .
La tomografía de tórax ha evidenciado tener alta sensibilidad para la evaluación de posible neumonía viral, evidenciando cambios en pacientes con radiografías de tórax normales o con escasa sintomatología, siendo recomendada por va rios estudios como el método imagenológico de elección. Así mismo es el método imagenológico de elección en Chi na71. Puede mostrar alteraciones en pacientes con pruebas iniciales para SARS-CoV-2/COVID-19 negativas73,74. Los cam bios descritos en niños no difieren en gran medida de los de adultos, reportándose imágenes en vidrio esmerilado de pre dominio bibasal, consolidaciones pulmonares y como rasgo en un estudio pediátrico la presencia de signo de halo75. Así mismo, se ha descrito su utilidad en la evaluación de diag nósticos diferenciales73 .
En general los cambios radiológicos evidencian opacidades en vidrio esmerilado y neumonías de localización uni o bi lateral76. Menos frecuente es la presencia de adenopatías y engrosamiento pleural comparado con otras entidades in fecciosas bacterianas y virales70.
El uso de la ultrasonografía pulmonar (US) para el diagnós tico y seguimiento de pacientes con neumonía por SARS-CoV-2/COVID-19 ha sido descrito por algunos autores. Las ventajas teóricas del ultrasonido pulmonar en el escena rio de la pandemia de SARS-CoV-2/COVID-19 son: la posibi lidadlidad de realizar un diagnóstico temprano basado en cam bios en el estado físico del tejido pulmonar y la facilidad de realizar el estudio sin desplazar el paciente. Incluso, se ha descrito que pueden evidenciarse cambios pulmonares pre vios a la presencia de hipoxemia77. Por las mismas razones, se propone el ultrasonido como alternativa para valorar la evolución de los pacientes77,78,79,80.
El ultrasonido es un estudio operador dependiente y las al teraciones descritas en pacientes con neumonía por SARS-CoV-2/COVID-19 son inespecíficas, por lo que su presencia no se puede considerar diagnóstica de la entidad. Por otra parte, la imposibilidad de valorar el parénquima pulmonar central y definir la distribución de las alteraciones parenqui matosas limita la utilidad del método81
En el contexto de la pandemia es conocida la limitación para realizar estudios con diseños que permitan demostrar la ver dadera utilidad de los diferentes métodos de imágenes en el diagnóstico de neumonía por SARS-CoV-2/COVID-19. Por lo anterior, resulta conveniente apoyarse en el conocimiento previo de situaciones y entidades similares (como la pande mia de influenza A H1N1) y estudios posteriores, que no per miten concluir la utilidad del ultrasonido en el diagnóstico y seguimiento de pacientes con neumonía viral.
Recomendación
Se recomienda, en los pacientes con sospecha clínica de neumonía por SARS-CoV-2/COVID-19, realizar una ra diografía portátil de tórax.
Fuerte a favor
Punto de buena práctica:
Se considera que la presencia de opacidades parenquimatosas (vidrio esmerilado/consolidación) de distribución periférica y predominio basal pueden sugerir el diagnóstico de neumonía por SARS-CoV-2/COVID-19, en un contexto clínico apropiado
Recomendación
Se recomienda la realización de TAC de tórax simple en los siguientes escenarios: pacientes con presentación grave o crítica de la enfermedad, con sospecha de neu monía por SARS-CoV-2/COVID-19 y radiografía de tórax normal o con alteraciones radiológicas inespecíficas, a quienes se desea descartar un diagnóstico alterno.
Fuerte a favor
Se sugiere la realización de TAC de tórax simple para la valoración de pacientes con curso clínico no esperado, para detectar complicaciones y se considera que debería implicar cambios en la conducta terapéutica.
Débil a favor
VII.3.5. ¿Cuáles son las pruebas diagnósticas invasivas que se pueden utilizar en la pandemia por SARS-CoV-2/COVID-19?
La toma de muestras invasivas tales como el lavado bron coalveolar (LBA) pueden formar parte de la atención inicial de pacientes con neumonía82, especialmente en aquellos con presentación severa de etiología no conocida83. En pacientes con sospecha de infección por SARS-CoV-2/COVID-19 está in dicada la realización de LBA, solo en pacientes con ventilación mecánica, en los que se espera que los especímenes del tracto respiratorio inferior permanezcan positivos por un periodo ex tendido de tiempo84. La Organización Mundial de la Salud, en su documento sobre gestión clínica de infección respiratoria aguda grave cuando se sospecha infección por SARS-CoV-2/ COVID-19, recomienda la toma de muestras de LBA en pa cientes ventilados como punto de buena práctica, teniendo en cuenta los lineamientos de bioseguridad universales85. La re comendación de la American Association for Bronchology and Interventional Pulmonology (AABIP por sus siglas en inglés) es la realización del procedimiento en pacientes ventilados, con la presencia del personal esencial para la recolección de la muestra86. De esta misma manera se recomienda la toma de LBA en niños con sospecha de infección severa por SARS-CoV-2/COVID-19 que se encuentren en ventilación mecánica57
Recomendación
Las pruebas invasivas recomendadas para el diagnóstico de la infección por SARS-CoV-2/COVID-19 serán mini lavado bronquial y aspirado traqueal a ciegas con sistema cerrado.
Fuerte a favor
Punto de buena práctica:
Se sugiere restringir la broncoscopia y solo realizarla cuando los resultados no sean concluyentes, se sospeche un diagnóstico alternativo o se espere que los resultados permitan modificar la conducta.
VII.4. MANEJO DEL PACIENTE PEDIÁTRICO CON INFECCIÓN POR SARS-CoV-2/COVID-19
VII.4.1. ¿Qué pacientes pediátricos con sospecha de infección o infección confirmada por SARS-CoV-2/COVID-19 deben ser hospitalizados?
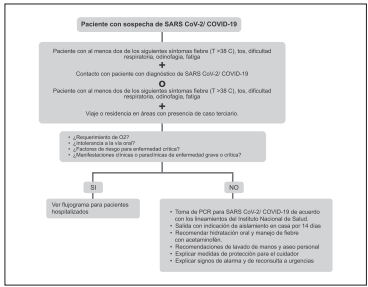
El consenso de diagnóstico, tratamiento y prevención de la nueva infección por coronavirus 2019 en niños87, describe que en la mayoría de los niños infectados hay manifestaciones clínicas leves, no tienen fiebre ni síntomas de neumonía, con un buen pronóstico. La mayoría de ellos se recupera en 1 a 2 semanas después del inicio de la enfermedad. Pocos pueden progresar a infecciones de las vías respiratorias inferiores. Sin embargo, contempla el tratamiento de casos graves y crítica mente enfermos, sobre la base del tratamiento sintomático, promoviendo prevenir y tratar activamente las complicacio nes, las enfermedades subyacentes y la infección secundaria. De esta manera todos los pacientes con signos clínicos de enfermedad grave o crítica requieren hospitalización87-90.
Dentro de los factores de riesgo para enfermedad crítica en pediatría se encuentran: la edad (menores de 1 año), cardio patía congénita, hipoplasia pulmonar, enfermedad pulmonar crónica, enfermedades neuromusculares, desnutrición grave, anemia o hemoglobinopatías, inmunodeficiencia primaria o secundaria, o estar en tratamiento inmunosupresor87,90.
El ingreso a Unidad de Cuidado Intensivo Pediátrico (UCIP) se definirá de acuerdo con criterios de la Asociación Colombia na de Medicina Crítica y Cuidado Intensivo (AMCI) (135.
Recomendaciones
Se recomienda que los pacientes con sospecha de infec ción o infección confirmada por SARS-CoV-2/COVID-19 con infección grave o crítica o con factores de riesgo para enfermedad crítica, sean hospitalizados.
Fuerte a favor
La Asociación Colombiana de Medicina Crítica y Cuidado Intensivo (AMCI), tiene establecidos criterios de hospi talización en Unidades de Cuidado Intensivo Pediátrico (UCIP). Se recomienda que los pacientes con sospecha de infección o infección confirmada por SARS-CoV-2/ COVID-19 se adhieran a los mismos criterios de interna ción en UCIP.
Fuerte a favor
Se recomienda hospitalizar a los pacientes pediátricos con condiciones de vulnerabilidad social.
Fuerte a favor
VII.4.2. ¿Se le debe ofrecer algún tratamiento farmacológico a adolescentes o niños enfermos con enfermedad leve por SARS-CoV-2/COVID-19?
En la literatura se reporta que la mayoría de los casos en pacientes pediátricos resuelven sin complicaciones87,88 y cur san con menos severidad que los adultos89,90. La causa de esta menor severidad no es clara, pero puede relacionarse con la escasa madurez y función del receptor de la enzima conver tidora de angiotensina 291.
De acuerdo con las últimas Guías de Tratamiento publicadas por el NIH (Instituto Nacional de Salud, por sus siglas en in glés) de los Estado Unidos de América hay datos insuficien tes para dar recomendación a favor o en contra del uso de antivirales específicos o agentes inmunomoduladores para el tratamiento de COVID-19 en pacientes pediátricos92.
Punto de buena práctica:
Los niños o adolescentes previamente sanos, que mani fiesten enfermedad leve no tienen indicación de recibir tratamiento farmacológico.
VII.4.3. ¿ Qué tratamiento farmacológico se debe ofrecer a niños o adolescentes con enfermedad grave por SARS-CoV-2/COVID-19?
A pesar de que los casos descritos en pediatría tienen me nor severidad que en adultos, 11% de lactantes menores de 12 meses desarrollaron enfermedad severa o crítica90. Ade más, en niños con coronavirus diferentes a SARS-CoV-2/CO VID-19, las patologías pulmonares de base y las condiciones inmunosupresoras se asocian con mayor severidad93. En niños con otras infecciones por virus respiratorios, aquellos con co morbilidades tienen mayor severidad de la infección94 y en adultos con SARS-CoV-2/COVID-19, las comorbilidades son un factor de riesgo para mortalidad89.
Aunque las Guías Españolas recomiendan la combinación de hidroxicloroquina y lopinavir/ritonavir en pacientes con neumonía95 , considerando que estos medicamentos tienen diferentes mecanismos de acción, en la última actualización del pasado 12 de mayo de 2020, el Panel de Directrices para el Tratamiento de COVID-19 del NIH (Instituto Nacional de Salud, por sus siglas en inglés), de los Estados Unidos de América, publicó las Guías de Tratamiento COVID-19 que en resumen recomiendan no usar ningún medicamento para prevenir o tratar COVID -19 a menos que la persona esté participando en un estudio investigativo clínico, recomendado por su médico96.
La evidencia actual, con el estudio RECOVERY soporta el uso de dexametasona en pacientes hospitalizados con oxigenoterapia y pacientes con ventilación mecánica invasiva. En dicho estudio, se aleatorizaron 2.014 pacientes que recibieron dexametasona y 4.321 se aleatorizaron con manejo habitual. El 21,6% (454) de los pacientes asignados a dexametasona y el 24,6% (1065) del grupo con manejo habitual murieron entre los 28 días de seguimiento, ajustado por edad RR 0,83 (IC 95% 0,74 - 0,9) p<0,001. Las reducciones en la tasa de mortalidad proporcional y absoluta variaron significativamente según el nivel de soporte respiratorio en la aleatorización, la dexametasona redujo las muertes en un tercio de los pacientes que recibían ventilación mecánica invasiva (29,0% vs. 40,7%, RR 0,65. [95% IC 0,51 a 0,82]; p<0,001), también se redujo en un quinto de los pacientes que recibieron oxígeno sin ventilación mecánica invasiva (21,5% vs. 25,0%, RR 0,80 [IC 95% 0,70 a 0,92]; p = 0,002), pero no redujo la mortalidad en pacientes que no recibían soporte respiratorio en la aleatorización (17,0% vs. 13,2%, RR 1,22 [IC del 95%: 0,93 a 1,61]; p = 0,14)97.
Los pacientes en el grupo de dexametasona tuvieron una hospitalización más corta (mediana 12 vs 13 días) y una mayor probabilidad de egreso a los 28 días (RR 1,11 [95% CI 1,04 to 1,19]; p=0,002). En resumen, en los pacientes hospitalizados con infección por SARS-CoV-2/COVID-19, la dexametasona redujo la mortalidad a 28 días entre los pacientes que reciben ventilación mecánica invasiva u oxígeno, pero no entre los pacientes que no reciben soporte respiratorio97.
Cloroquina / hidroxicloroquina
Inicialmente, se hizo una evaluación in-vitro de la cloroquina a partir de un aislamiento clínico de SARS-CoV-2/COVID-19. Los autores concluyen que este medicamento es altamente efectivo en el control de la infección in-vitro, y debe evaluarse en estudios clínicos en pacientes98.
El 17 de febrero, 2020 el consejo de estado de China sostuvo una reunión informativa indicando que, en estudios clínicos multicéntricos conducidos en China, resultados preliminares sugieren que el fosfato de cloroquina es eficaz y tiene aceptable seguridad en el tratamiento de SARS-CoV-2/COVID-1999.
Algunas guías españolas recomiendan el uso de hidroxicloroquina con o sin lopinavir/ritonavir en pacientes inmunosuprimidos, aun en ausencia de neumonía95 . Por otra parte, un consenso de expertos de un grupo multicéntrico colaborativo del Departamento de Ciencia y Tecnología de la Provincia de Guangdong describen que el tratamiento con cloroquina en pacientes con neumonía por SARS-CoV-2/COVID-19 puede aumentar la tasa de cura y reducir estancia hospitalaria100.
Posteriormente, una revisión sistemática de la eficacia y seguridad de cloroquina para el tratamiento de SARS-CoV-2/ COVID-19 concluyó que existe evidencia preclínica de efectividad contra SARS-CoV-2/COVID-19, y amplia experiencia con este medicamento para otras indicaciones, lo que justifica su uso en emergencias como intervención no registrada101. Aunque existe suficiente experiencia con este medicamento en pediatría para el manejo de malaria así como de enfermedades autoinmunes, y amplios fundamentos teóricos de su posible mecanismo de acción contra SARS-CoV-2/ COVID-19102, no hay a la fecha ningún estudio en población pediátrica que demuestre efectividad de este medicamento para la infección por SARS-CoV-2/COVID-19.
La hidroxicloroquina es un medicamento con menor toxicidad que la cloroquina, con el cual se tiene experiencia en pediatría por su uso crónico en pacientes reumatológicos103. Al igual que la cloroquina ha demostrado efectividad para inhibir SARS-CoV-2/COVID-19 in vitro104, y está recomendado en guías de hospitales locales en España94 .
La FDA emitió el pasado 28 de marzo de 2020 una Autorización de Uso de Emergencia (EUA, por sus siglas en inglés) para uso temporal durante la pandemia de SARS-CoV-2/COVID-19 para el tratamiento del virus en pacientes hospitalizados cuando los ensayos clínicos aún no estén disponibles, o cuando la participación en los mismos no sea factible. Por lo anterior, advierten al público que la hidroxicloroquina y la cloroquina, ya sea solas o en combinación con azitromicina, cuando se utilizan en pacientes con infección por SARSCoV-2/COVID-19 deberían limitarse a entornos de ensayos clínicos o para el tratamiento de determinados pacientes hospitalizados conforme a la EUA106.
En Colombia, el pasado 23 de abril de 2020, el INVIMA (Instituto Nacional de Vigilancia de Medicamentos y Alimentos), ante la solicitud hecha por el Ministerio de Salud y Protección Social a la Sala Especializada de Moléculas Nuevas, Nuevas Indicaciones y Medicamentos Biológicos de la Comisión Revisora del Invima, sobre la evaluación de indicaciones para los principios activos cloroquina e hidroxicloroquina, en la atención de pacientes con COVID-19, emitió un comunicado informando que a la fecha no hay evidencias científicas que comprueben la efectividad de la cloroquina e hidroxicloroquina en el tratamiento del COVID-19. Consideró aceptable el uso de la hidroxicloroquina y la cloroquina en el ámbito hospitalario en pacientes con COVID-19, siempre y cuando se encuentren bajo el criterio médico, preferiblemente en ensayos clínicos, y supeditado al surgimiento de nueva información científica. Por esto, el INVIMA, a través de la Sala Especializada mencionada, no recomienda, por el momento, la inclusión en el registro sanitario de las indicaciones para el manejo hospitalario por la enfermedad COVID-19, por el contrario, considera pertinente agregar los medicamentos cloroquina, e hidroxicloroquina, en la lista UNIRS (medicamentos con usos no incluidos en el registro sanitario) (105.
El pasado 24 de abril de 2020, la FDA (Administración de Drogas y Alimentos de los Estados Unidos, por sus siglas en inglés), emitió un aviso de seguridad acerca de los graves problemas del ritmo cardiaco en pacientes que están sufriendo de COVID-19 y que han recibido tratamiento con hidroxicloroquina o cloroquina, a menudo en combinación con azitromicina y otros medicamentos que prolongan el intervalo QT. De igual forma la cloroquina y la hidroxicloroquina se han asociado a taquicardia y fibrilación ventricular, y en algunos casos con la muerte. Esta combinación de medicamentos se está haciendo incluso para pacientes ambulatorios. Hasta el momento no se ha demostrado que la hidroxicloroquina y la cloroquina sean seguras y eficaces para el tratamiento o la prevención de infección por SARS-CoV-2/COVID-19.
Aunque los estudios in vitro realizados con hidroxicloroquina y cloroquina muestran una eficacia in-vitro en el control de la infección por SARS-CoV-2/COVID-19, los estudios realizados en pacientes no mostraron beneficio para recomendar su uso, de acuerdo con el estudio RECOVERY según información divulgada el pasado 5 de junio de 202097. Finalmente, la FDA posterior a la revisión de la nueva evidencia revocó la autorización de Uso de Emergencia (EUA, por sus siglas en inglés) el 15 de junio 2020 dado que se consideró que los beneficios no superan los riesgos conocidos y potenciales. (https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-revokes-emergency-useauthorization-chloroquine-and)
Existen muchos protocolos de estudio que se pueden consultar en la página web www.clinicaltrials.gov, que están evaluando este uso en particular.
Lopinavir/ritonavir
Inicialmente, las pocas publicaciones respecto al tratamiento de SARS-CoV-2/COVID-19 en pediatría indicaron el uso de lopinavir/ritonavir, aunque su eficacia y seguridad en niños con SARS-CoV-2/COVID-19 es incierta 107,108. Este medicamento es un inhibidor de proteasa, que inhibe la proteinasa principal del CoV, interrumpiendo su replicación101.
Durante la epidemia de SARS en el 2003, dos estudios sugirieron respuestas clínicas favorables con el uso de lopinavir/ ritonavir. En uno de ellos, los pacientes tratados con lopinavir/ritonavir y ribavirina tuvieron menos SDRA o muerte que aquellos tratados sólo con ribavirina (2.4% vs. 28.8%)109. En el otro estudio, la evaluación retrospectiva de una cohorte de pacientes con SARS, demostró que la adición temprana de lopinavir/ritonavir a la terapia estándar se asoció con reducción en la tasa de muerte (2.3%) e intubación (0%) en comparación con una cohorte apareada que recibió tratamiento estándar (15.6% y 11%, respectivamente, P<0.05) 110. Sin embargo, en una revisión sistemática reciente fue imposible obtener conclusiones que respalden el uso de este medicamento debido a posibles sesgos de selección en los estudios111
El único ensayo clínico aleatorizado publicado hasta la escritura de esta guía clínica no demuestra utilidad en mejoría clínica cuando es utilizado en monoterapia. Sin embargo, en el análisis de intención a tratar modificado y en algunos desenlaces secundarios su uso fue favorable (débil asociación) 112. El Panel de las Directrices de Tratamiento COVID-19 del NIH de los Estados Unidos de América en su última actualización del 12 de mayo de 2020 emite recomendación en contra del uso de lopinavir/ritonavir u otros inhibidores de proteasa debido a su farmacodinamia desfavorable y a datos de ensayos clínicos negativos92.
El estudio RECOVERY concluye que no existe beneficio clínico del uso de lopinavir/ritonavir en pacientes hospitalizados con infección por SARS-CoV-2/COVID-19 según información publicada el 29 de junio de 202097.
Azitromicina
Respecto a la azitromicina, existen dos estudios que sugieren utilidad en la reducción de la carga viral. El primero es un ensayo clínico realizado en Francia en 36 pacientes con COVID-19, en el cual la adición de azitromicina a hidroxicloroquina en 6 pacientes fue significativamente más eficiente en la eliminación viral en comparación de la terapia estándar o la monoterapia con hidroxicloroquina 113. El segundo es un estudio observacional que reporta una serie de 80 pacientes con COVID-19 que recibieron terapia combinada con hidroxicloroquina y azitromicina, sin grupo comparador. El 97.5% de ellos tuvo cultivos negativos de muestras respiratorias en el día 5 posterior a inicio de tratamiento, y el 93% tuvo PCR negativo al día 8114.
A pesar de que esta información sugiere utilidad al reducir la excreción viral, ambos estudios tienen deficiencias metodológicas y no existen datos clínicos lo suficientemente robustos que nos permitan recomendar esta combinación a pacientes con COVID-19. Podría considerarse su uso en protocolos de investigación mientras se publica más información que avale su uso.
Es importante también tener presente que hasta el momento la azitromicina no tiene aprobación por la FDA para el manejo de pacientes con COVID-19106. El Panel de las Directrices de Tratamiento COVID-19 del NIH de los Estados Unidos de América emite recomendación en contra del uso de la combinación de hidroxicloroquina más azitromicina debido al potencial de toxicidad, con excepción del contexto de un experimento clínico92.
Ivermectina
Respecto a la ivermectina para tratar la infección por SARSCoV-2/COVID-19, se cuenta con un estudio in vitro que demostró que la ivermectina redujo el ARN viral 5.000 veces en un curso de 48 horas y redujo en un 99,8% el RNA viral en comparación con los cultivos celulares tratados con Dimetilsulfóxido (DMSO) 115. En la literatura se encontraba disponible un reporte en preimpreso de un grupo de autores de quienes previamente se han conocido otras publicaciones con relación a Hidroxicloroquina y macrólido para uso en la infección por SARS-CoV-2/COVID-19, y que fueron retiradas de la revista por no permitir acceso y auditoría de los datos. A la fecha no se han publicado ensayos clínicos aleatorizados que demuestren su eficacia en humanos con infección por SARSCoV-2/COVID-19 por lo que no existe suficiente evidencia para emitir una recomendación acerca de su uso y la FDA no ha emitido autorización para uso de emergencia en pacientes con esta patología. ()
Remdesivir
In vitro, el remdesivir ha demostrado inhibir el SARS-CoV-2/ COVID-19 113 y tiene una actividad superior frente a lopinavir/ritonavir en MERS-CoV116. En el modelo animal (ratón), el remdesivir también demostró potencial para el tratamiento de MERS-CoV117. Este medicamento se ha utilizado con buenos resultados en el primer caso de SARS-CoV-2/COVID-19 en Estados Unidos118 y actualmente se encuentra en ensayos clínicos en humanos. Es un tratamiento experimental no autorizado ni disponible en Colombia. De acuerdo con datos preliminares de experimentos clínicos el Panel de Guías de Tratamiento de COVID-19 del NIH de los Estados Unidos, recomienda el uso de remdesivir para el tratamiento de infección por SARS-CoV-2/COVID-19 en pacientes hospitalizados con enfermedad severa definida por la SpO2 £ 94% al aire ambiente (a nivel del mar), con requerimiento de oxígeno suplementario, ventilación mecánica, u oxigenación de membrana extracorpórea (ECMO) (92.
El remdesivir no está aprobado por la FDA, y está disponible para su uso en Estados Unidos a través de una autorización de uso de emergencia, en experimentos clínicos, o a través de un programa de acceso de emergencia en niños y mujeres gestantes. El Panel recomienda no usar remdesivir para el tratamiento de infección por SARS-CoV-2/COVID-19 leve o moderada fuera de un ensayo clínico 92. No hay estudios en población pediátrica acerca del uso de remdesivir para el manejo de la infección por SARS-CoV-2/COVID-19.
Interferón
Respecto al interferón, las recomendaciones emitidas por el centro nacional de investigaciones clínicas en salud infantil de la República China, soportan el uso de Interferón a2b nebulizado91 . Además, el documento técnico del manejo clínico de pacientes con infección por SARS-CoV-2/COVID-19 avalado por la Asociación Española de Pediatría, Sociedad Española de Infectología Pediátrica, Sociedad y Fundación Española de Cuidados Intensivos Pediátricos, recomiendan el uso de interferón tipo I en adultos (Interferón a2b nebulizado o interferón β1B) (107. Existen datos in-vitro del efecto anti SARS del interferón tipo I111. Sin embargo, no existe una recomendación homogénea para el uso de este medicamento, y la revisión sistemática para el tratamiento de SARS determina que los efectos del interferón a no son concluyentes111. Además, un estudio clínico aleatorizado no soporta el uso de interferón β-1a en el manejo de síndrome de distrés respiratorio agudo119. Cabe anotar que este medicamento no está aprobado para su uso en menores de 18 años, ni para esta indicación, por el INVIMA. No se recomienda su uso de rutina en este grupo de pacientes.
Más recientemente el pasado 12 de mayo de 2020, El Panel de Directrices de Tratamiento de COVID-19 del NIH de los Estados Unidos emitió recomendación en contra del uso de interferones para el tratamiento de infección por SARS-CoV-2/ COVID-19 excepto en el contexto de un ensayo clínico, debido a la falta de eficacia en el tratamiento del Síndrome Respiratorio Agudo Severo (SARS, por sus siglas en inglés), en el Síndrome respiratorio del Medio Oriente (MERS, por sus siglas en inglés) y por toxicidad92 .
Plasma
El plasma de pacientes convalecientes es una estrategia con potencial terapéutico120. Sin embargo, hasta este momento no existe evidencia suficiente para hacer recomendación a favor o en contra de su uso en pacientes con infección por SARSCoV-2/COVID-19. Algunos pacientes críticos con infección por SARS-CoV-2/COVID-19 tienen un perfil de citoquinas sugestivo de linfohistiocitosis hemofagocítica (HLH). En ellos, el uso de tocilizumab (bloqueador selectivo de IL-6) tiene potencial terapéutico121. Sin embargo, hasta este momento no existe evidencia suficiente para hacer recomendaciones a favor o en contra de su uso en pacientes con infección por SARS-CoV-2/COVID-19. En población pediátrica no hay evidencia de ningún experimento clínico con respecto al uso de plasma convaleciente para el manejo de infección por SARS-CoV-2/COVID-19.
En la actualidad con los datos del estudio RECOVERY publicado el pasado 16 de junio de 2020, realizado en adultos, se recomienda no usar hidroxicloroquina, cloroquina y lopinavir/ritonavir en pacientes con infección por SARS-CoV-2/ COVID19 en estado leve, moderado, grave o crítico. No se tienen suficientes datos para aconsejar o desaconsejar el uso de ivermectina, tocilizumab, azitromicina en pacientes con infección por SARS-CoV-2/COVID-19 que se encuentren en estado leve, moderado, grave o crítico de la enfermedad. En población pediátrica no existe a la fecha ningún estudio que demuestre efectividad o eficacia de cualquiera de los medicamentos listados con potencial antiviral contra la infección por SARS-CoV-2/COVID-19.
Recomendación
Se recomienda usar dexametasona en los pacientes con infección por SARS-CoV2/COVID-19 que requieran oxigenoterapia, preferiblemente después de 7 días de inicio de los síntomas.
Fuerte a favor
Se recomienda no usar en la práctica clínica hidroxicloroquina o cloroquina en el manejo de pacientes con infección por SARS-CoV-2/COVID-19.
Fuerte en contra
Se recomienda no usar lopinavir/ritonavir en pacientes con infección por SARS-CoV-2/COVID-19.
Fuerte en contra
No se emite recomendación a favor o en contra de administración de otros medicamentos a los ya mencionados (ivermectina, tocilizumab, azitromicina) en pacientes con infección por SARS-CoV-2/COVID-19.
Puntos de buena práctica:
Se aconseja que los medicamentos diferentes a dexametasona que se vayan a usar en el tratamiento de la infección por SARS-CoV-2/COVID-19 se administren dentro de un protocolo de investigación.
Se aconseja administrar ivermectina como desparasitante antes del uso mencionado de dexametasona.
VII.4.4.¿Cuáles son las intervenciones terapéuticas adicionales para realizar en niños y adolescentes de acuerdo con la clasificación de la infección por SARS-CoV-2/COVID-19?
Hasta la fecha no existen estudios ni reportes de grandes series de casos en pediatría que permitan hacer unas recomendaciones basadas en investigación directa de casos con el virus. La mayoría de la información a continuación se considera puntos de buena práctica clínica basados en el manejo de patologías similares y el comportamiento de otros virus en pacientes pediátricos122-125.
Leves:. este tipo de pacientes requiere medidas de soporte generales según su edad y comorbilidades. La terapia va encaminada a mantener una adecuada nutrición e hidratación (idealmente oral). En caso de requerir hospitalización se sugiere mantener un manejo sintomático basado en hidratación, oxigenoterapia de bajo flujo si amerita (saturaciones según altitud) y control de la fiebre con medidas antipiréticas, idealmente acetaminofén.
Graves:. este grupo de pacientes en la mayoría de los casos requieren manejo hospitalario. En estos pacientes se debe encaminar esfuerzos a descartar complicaciones, como desbalances hidroelectrolíticos, oxigenoterapia en bajo o alto flujo, seguimiento multiorgánico y búsqueda activa de coinfecciones. En algunos casos amerita monitoría no invasiva continua por lo que serán admitidos a unidades de cuidado intensivo e intermedio. En estos escenarios se podrán utilizar medidas de soporte ventilatorio no invasivas para los casos menos graves, considerando siempre mantener bien aislado por el riesgo de aspersión de germen en el ambiente.
Críticos:. para estos casos se debe hacer un ingreso temprano a unidades de cuidado intensivo pediátrico para soporte hemodinámico y ventilatorio invasivo de forma temprana, utilizando estrategias de soporte de SDRA como son la ventilación protectora, la restricción hídrica y el prono temprano o relajantes neuromusculares según lo amerite. El uso de esteroides tempranos continúa siendo tema de debate, en caso de utilizarlos se recomienda que sea metilprednisolona por pocos días (3-5 días). Mantener un alto índice de sospecha en las coinfecciones y complicaciones para recibir manejo de forma temprana.
Recomendación
Se recomienda adherirse a la estrategia AIEPI- Guías de neumología en los casos leves y a las guías internacionalmente aceptadas descritas en Surviving Sepsis Campaign para el manejo de sepsis. Se recomienda el uso de oseltamivir en caso de sospecha de coinfección por virus de influenza A o B.
Fuerte a favor
VII.4.5. ¿Cuál es la utilidad de asociar antibióticos en infección confirmada por SARS-CoV-2/ COVID-19?
Existe poca evidencia en la actualidad de la frecuencia de coinfección bacteriana en SARS-CoV-2/COVID-19. Series iniciales describieron 1% en adultos, algunas con porcentajes más elevados126-127. De forma rutinaria NO se requiere manejo antibiótico126-128. El inicio de tratamiento empírico, por tanto, debe basarse en el diagnóstico clínico y considerarse ante sospecha de sobreinfección bacteriana de acuerdo con la sospecha: neumonía adquirida en la comunidad o neumonía asociada a la atención en salud, y deberá individualizarse según factores de riesgo del paciente129.
En casos de sospecha de sobreinfección de origen comunitario deberá considerarse el uso de penicilina cristalina a 300.000 UI/kg/día IV cada 4 horas o ampicilina a 200 mg/kg/ día IV cada 6 horas. En caso de tolerar la vía oral se prefiere amoxicilina a 90 mg/kg/día cada 8 horas. De acuerdo con la severidad en algunos casos considerar ampicilina/ sulbactam, particularmente en compromiso respiratorio severo y sospecha de sobreinfección90.
En paciente inmunocomprometido, por ejemplo, en un paciente oncológico se debe ampliar el espectro con cefepime y dependiendo de los hallazgos de la radiografía de tórax, y características clínicas del paciente se considerará inicio de vancomicina ante sospecha de S. aureus. En casos severos en los que se consideró inicio de antibiótico, se debe reevaluar en las primeras 48 a 72 horas para, de acuerdo con el reporte de cultivos, reactantes de fase aguda, considerar suspender tempranamente el manejo antibiótico90,130.
Recomendación
Se recomienda terapia antibiótica empírica en los pacientes con sospecha de coinfección por SARS-CoV-2/COVID-19 y neumonía bacteriana acorde a guías nacionales o guías institucionales.
Fuerte a favor
Se recomienda terapia antibiótica empírica en los pacientes con sospecha de coinfección por SARS-CoV-2/ COVID-19 y neumonía bacteriana grave acorde a guías nacionales o institucionales para esta enfermedad, cuando no estén disponibles pruebas diagnósticas de alta precisión (PCR múltiple).
Fuerte a favor
VII.4.6. ¿Cuáles son las estrategias de soporte ventilatorio y de oxigenación en infección por SARS-CoV-2/COVID-19 en niños o adolescentes?
Hasta la fecha no existen estudios ni reportes de grandes series de casos que permitan hacer unas recomendaciones basadas en investigación directa de casos con este virus. La mayoría de la información a continuación se considera puntos de buena práctica clínica basados en el manejo de enfermedades similares y en el comportamiento de otros virus en pacientes pediátricos131,132.
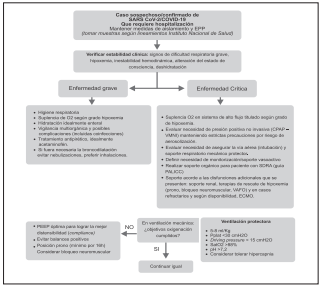
Las estrategias ventilatorias para niños con infección por SARS-CoV-2/COVID-19 mantienen las pautas habituales en el manejo del síndrome de distrés respiratorio en niños, salvo algunas consideraciones a tener en cuenta. Cuando se presente la hipoxemia (según los rangos preestablecidos por la altitud de cada ciudad), se debe brindar suplencia de O2 de manera rápida, prefiriendo los sistemas de bajo flujo o máscaras de oxígeno, si la condición clínica del niño lo permite. Los sistemas de alto flujo y la ventilación mecánica no invasiva (VMNI) e invasiva deben ser administradas cuando sea necesario según la gravedad del caso.
Los niños que luego de 2 horas en el sistema de alto flujo o en VMNI, presenten intolerancia a la terapia, no mejoría o deterioro del cuadro clínico (aumento del trabajo respiratorio, aumento de secreciones, tos persistente grave o inestabilidad hemodinámica) deben ser intubados para iniciar la ventilación invasiva123.
En series de adultos se ha recomendado la intubación temprana en pacientes graves, más que las terapias de alto flujo o VMNI, por un mayor riesgo de contaminación por generación de aerosoles. La estrategia ventilatoria con los niños se basa en las recomendaciones del consenso de SDRA pediátrico (PALICC) con los objetivos de: ventilación protectora, volúmenes tidal bajos (5-8 ml/Kg), PEEP óptima que permita disminuir FiO2, presión meseta ≤30 cmH2O, driving pressure<15 cmH2O e hipercapnia permisiva en algunos casos133.
Además, se pueden aplicar distintas estrategias auxiliares para mejorar la oxigenación según el contexto del paciente, tales como sedación profunda, posición prona y bloqueo neuromuscular. El empleo de óxido nítrico inhalado (ONi) en pacientes adultos no parece aportar una mejora significativa, pero en niños es indeterminado (se puede considerar en presencia de hipertensión pulmonar o disfunción ventricular derecha) (133. Las maniobras de reclutamiento y evitar los signos de sobrecarga de volumen son otras estrategias a tener en cuenta. Si a pesar de intentar todo lo anterior persiste el compromiso de la oxigenación se puede considerar la utilización de oxigenación por membrana extracorpórea (ECMO).
Recomendación
Se recomienda adherirse a las recomendaciones de tratamiento de SDRA pediátrico según las guías Pediatric acute lung injury consensus conference (PALICC).
Fuerte a favor
VII.4.7. ¿Cuál es el criterio de curación y alta hospitalaria en niños o adolescentes con infección por SARS-CoV-2/COVID-19?
Basados en el manejo habitual de los cuadros neumónicos y de infección respiratoria baja, los pacientes deben ser dados de alta cuando completen 12 a 24 horas afebriles, saturación de oxígeno mayor del 90% por al menos 12 horas, no presenten dificultad respiratoria ni taquicardia de acuerdo con la edad y toleren la vía oral. Además, que tengan cuidadores capaces de proveer las medidas de atención en casa y no tengan barreras significativas de acceso a la atención en salud90,123. Otros textos recomiendan hasta 3 días afebril previo a egreso, basados en recomendaciones de expertos134. Además de lo mencionado, se deben mantener las medidas de aislamiento tras el egreso de los pacientes, bajo la recomendación actual de 14 días desde el diagnóstico o hasta dos muestras de NAAT negativas123,134.
Recomendación
Se recomienda que los pacientes con infección SARS-CoV-2/COVID-19 puedan ser dados de alta y continuar aislamiento en casa si cumplen los siguientes criterios:
Ausencia de fiebre >48 horas sin antipiréticos
y
Mejoría clínica de los síntomas respiratorios y la hi poxemia
y
No requiere hospitalización por otras patologías
y
Tolerancia a la vía oral
Fuerte a favor
VII.5. SÍNDROME INFLAMATORIO MULTISISTÉMICO TEMPORALMENTE ASOCIADO A LA INFECCIÓN POR SARS-CoV-2/ COVID-19 (SIMS TAC)
VII. 5.1. ¿Cuáles son los signos y síntomas presuntivos del síndrome inflamatorio multisistémico temporalmente asociado a la infección por SARS-CoV-2/COVID-19 (SIMS-TAC) ?
El síndrome inflamatorio multisistémico temporalmente relacionado a infección por SARS-CoV-2/COVID [SIMS-TAC] [MIS-C o PIMS] es una enfermedad grave que incluye la fiebre persistente por más de 72 horas, síntomas gastrointestinales como diarrea, vómito y dolor abdominal, hipoxemia como signo respiratorio más frecuentemente observado y cambios en piel y mucosas incluyendo rash de diferentes presentaciones, inyección conjuntival y cambios en la mucosa oral. Otros síntomas menos frecuentes son alteraciones neurológicas y edemas en manos y pies. Mas de la mitad de los pacientes se presentan con hipotensión y/o choque. Es importante descartar otras causas de sepsis y choque como sepsis bacterianas (incluyendo choque tóxico por Staphylococcus aureus o Streptococcus pyogenes) y otras infecciones vírales asociadas a miocarditis.
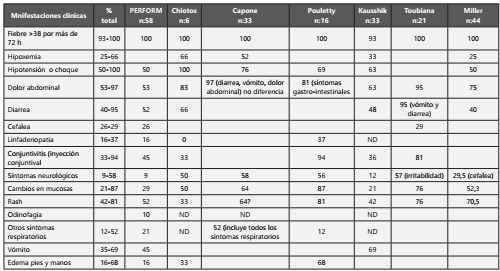
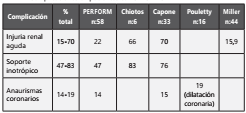
Se evaluaron diferentes series de casos y notas editoriales recientemente reportadas en la literatura, las cuales se describen a continuación. Se resalta que se desconoce la incidencia de esta enfermedad pues la información hasta el momento son series de casos, por lo que se considera una enfermedad infrecuente. En una serie publicada en JAMA por Wittaker E. y col. (136 con datos de la red PERFORM, la cual incluye 24 hospitales de 10 países de Europa, Gambia y Taiwán, se describen 58 pacientes pediátricos procedentes de 8 hospitales de Inglaterra con un promedio de edad de 9 años en 33 (57%). El diagnóstico de infección por SARS-CoV-2/COVID-19 se realizó por rtPCR en 15/58 pacientes representando al 26% y por anticuerpos IgG en 40/46 correspondiente al 87%. Una serie de casos publicada por Chiotos et al. (137 describe 6 pacientes pediátricos entre 5 y 12 años, 5 niñas y 1 niño, sin comorbilidades de importancia, críticamente enfermos con SIMS-TAC (PIMS por sus siglas en inglés) atendidos en el hospital de niños de Filadelfia, cuyas claves diagnósticas para este síndrome fueron fiebre, diarrea, choque y presencia variable de rash, conjuntivitis, edema de extremidades y cambios en las membranas mucosas; todos los pacientes tenían procalcitonina y PCR elevadas. Capone et al. (138 en un estudio retrospectivo realizado en el Cohen Children’s Medical Center, describieron 33 niños con una mediana de edad 8,6 años, quienes fueron agrupados por síntomas por sistemas tales como neurológicos 58%, gastrointestinales 97%, respiratorios 52% y con síntomas compatibles con enfermedad de Kawasaki completo en 64%.
Kaushik et al. (139 en un estudio retrospectivo realizado en unidades de cuidados intensivos en Nueva York, describen 33 niños con una mediana de 10 años, 45% con comorbilidades y en 81% de ellos hubo asociación a infección por SARS-CoV-2/COVID-19 por pruebas de anticuerpos, 33% por rtPCR positiva y 18% para ambos. Belot et al. (140, en un estudio multicéntrico en Paris, Francia, reportan 176 niños con cuadro clínico sugestivo de síndrome inflamatorio sistémico, de los cuales, 108 estuvieron asociados a infección por SARS-CoV-2/COVID-19; 79 fueron confirmados, 16 probables, 13 posibles y 48 no concluyentes con una mediana de 8 años (5 -11 años), siendo confirmados con rtPCR 28, por serología 42 y ambos en 9 casos; en el 73% de los pacientes se documentó hipotensión. Las diferencias estadísticamente significativas entre los casos relacionados a infección por SARS-CoV-2/COVID-19 con los no relacionados fueron con miocarditis en el 70% versus 10% respectivamente y con la presentación como síndrome de activación macrofágica en 23% versus 2%. En contraste, la enfermedad similar a Kawasaki fue menos frecuente en los relacionados a infección por SARS-CoV-2/COVID-19, 61 versus 81%140.
Pouletty et al. (141 publicaron una serie de casos de pacientes con SIMS-TAC (PIMS), infección por SARS-CoV-2/COVID-19 severa y no severa; en el grupo de SIMS-TAC incluyeron 16 pacientes con una edad mediana de 10 años (RIQ 4,7 a 12,5), el 37% tenían comorbilidades como asma y sobrepeso; todos los pacientes tenían PCR y BNP elevados141.
Toubiana et al. (142, describen las características clínicas de 21 niños y adolescentes afectados por SIMS-TAC en un hospital pediátrico en Paris, Francia, 12 niñas y 9 niños, con una mediana de edad de 9 años (RIQ 3,7-16,6); el 52% se presentaron como un Kawasaki completo; todos los pacientes se presentaron con marcadores inflamatorios elevados y no se identificaron dilataciones coronarias142.
Ramcharam et al. (143 describen una serie de casos de 15 pacientes con una mediana de edad de 8,8 años quienes fueron atendidos en el Birmingham Children’s Hospital (BCH) del Reino Unido. Todos los pacientes se presentaron con fiebre, 87% con síntomas gastrointestinales y 53% con manifestaciones clínicas de enfermedad de Kawasaki, sin cumplir con todos los criterios diagnósticos; 27% de los pacientes (4/15) presentaron mialgias y letargia143.
Miller et al. (144 realizaron un estudio retrospectivo de los pacientes con SIMS-TAC en el Children’s Hospital at Columbia University Irving Medical Center, encontrando que todos los pacientes presentaron fiebre y en el 84% al menos un síntoma gastrointestinal siendo éste el sistema más comprometido144. A continuación, se presentan las principales manifestaciones clínicas y complicaciones según los estudios ( Tabla 1 y Tabla 2 ).
En resumen, los niños descritos en la literatura con síndrome inflamatorio multisistémico se presentan con fiebre y síntomas gastrointestinales en la mayoría de los casos, hipotensión y con cambios en la piel como rash o alteraciones en las mucosas. Recomendación
Se recomienda definir como signos y síntomas presuntivos de SIMS-TAC la fiebre persistente mayor de 72 horas, asociada a síntomas gastrointestinales (como diarrea, vómito y dolor abdominal), cambios en piel y mucosas e inyección conjuntival.
Fuerte a favor Punto de buena práctica:
Los pacientes en edad pediátrica con sospecha de SIMSTAC pueden presentarse en más de la mitad de los casos con signos de choque, por lo cual considere realizar una evaluación cuidadosa de la perfusión periférica, tensión arterial y frecuencia cardiaca en el momento de la atención en el servicio de urgencias.
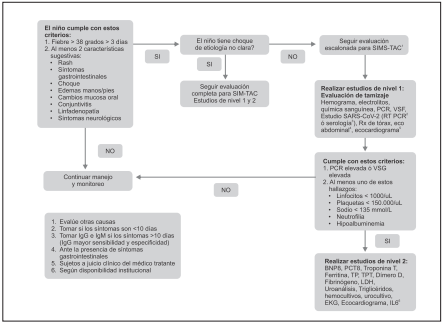
VII.5.2. ¿Cuáles son los criterios diagnósticos de un paciente con sospecha de síndrome inflamatorio multisistémico temporalmente asociado a la infección por SARS-CoV-2/COVID-19 (SIMS-TAC)?
Desde principios de mayo de 2020 cuando el Real Colegio de Pediatría y Salud Infantil (RCPCH) emitió una alerta nacional145 por la aparición de varios casos de inflamación multisistémica en niños con características clínicas similares (al que se denominó síndrome inflamatorio multisistémico pediátrico temporalmente asociado con infección por SARS-CoV-2/COVID-19, PIMS-TS por sus siglas en inglés Pediatric Inflammatory Multisystem Syndrome Temporally Associated with SARS-CoV-2) se han venido describiendo cada vez más series de casos similares especialmente en Europa y EEUU. Para mediados de mayo, los Centros para el Control y Prevención de Enfermedades (CDC) de los Estados Unidos146, alertaron sobre la presencia de un síndrome inflamatorio multisistémico asociado a infección por SARS-CoV-2/COVID19, y lo denominaron MIS-C (del inglés Multisystem Inflammatory Syndrome in Children), también con unos criterios clínicos determinados. Posteriormente la Organización Mundial de la Salud (OMS) hizo su respectivo reporte12 adhiriendo la denominación de MIS-C.
Los criterios del Real Colegio de Pediatría y Salud Infantil (RCPCH) son los siguientes145:
Niños con fiebre persistente (mayor a 38,5ºC), que cursan con inflamación (neutrofilia, PCR elevada y linfopenia) y evidencia de disfunción orgánica única o múltiple (choque, alteración cardiaca, renal, respiratoria, gastrointestinal o neurológica). Puede incluir a niños que cumplan criterios completos o parciales para enfermedad de Kawasaki.
Exclusión de otras causas infecciosas, incluyendo sepsis bacteriana, choque tóxico por estafilococo o estreptococo, infecciones asociadas con miocarditis como enterovirus.
PCR para SARS-CoV-2/COVID-19 puede ser positiva o negativa.
Los criterios de los CDC son146:
Menores de 21 años, ≥38ªC por ≥24h o fiebre subjetiva≥24h.
Evidencia de inflamación en laboratorios (Incluido, pero no limitado a uno o más de los siguientes: elevación en PCR, eritrosedimentación, fibrinógeno, procalcitonina, dímero D, ferritina, DHL, o IL-6, elevación de neutrófilos, linfopenia y albúmina baja) y evidencia de enfermedad grave que requiera hospitalización, con afectación orgánica (≥ 2) multisistémica (cardiaco, renal, respiratorio, hematológico, gastrointestinal, dermatológico o neurológico).
Ausencia de diagnóstico alternativo plausible.
Positividad para infección actual o reciente por SARSCoV-2/COVID-19 por RT-PCR, serología o test antigénico; o exposición a COVID-19 en las 4 semanas previo al inicio de los síntomas.
Los criterios de la OMS son 147:
Niños de 0 a 19 años, con fiebre más de 3 días, Y dos de las siguientes:
Rash o conjuntivitis bilateral no purulenta o signos de inflamación mucocutánea.
Hipotensión o choque.
Disfunción cardíaca, pericarditis, valvulitis o anomalías coronarias.
Evidencia de coagulopatía (TP, TTP, dímero D).
Afectación gastrointestinal aguda (diarrea, vómito o dolor abdominal) Y
Elevación de marcadores de inflamación PCR, velocidad de sedimentación, procalcitonina.
Ausencia de otras causas de inflamación microbiológica, incluidas sepsis y síndrome de choque tóxico estafilocóccico o estreptocóccico.
Evidencia de infección por SARS-CoV-2/COVID-19 (RTPCR, antígeno o serología positiva) o contacto probable con pacientes con infección por SARS-CoV-2/COVID-19
Hasta ahora se desconoce su etiología exacta, pero dado el comportamiento temporal en su aparición, entre 4-6 semanas después del pico de enfermedad en la población adulta, se cree que tiene implícita una reacción inmune desencadenada por la infección por SARS-CoV-2/COVID-19148.
Independientemente de los criterios usados, la enfermedad se caracteriza por: presencia de fiebre (usualmente de varios dias de evolución), síntomas gastrointestinales (dolor abdominal, diarrea, vómito), síntomas neurológicos (síncope, cefalea, confusión) y alteraciones de piel o mucosas (exantema, edema de manos y pies, conjuntivitis, inflamación mucosa oral y labios), asociado a hallazgos de laboratorio de inflamación (neutrofilia, elevación de PCR, procalcitonina, ferritina, dímero D) y de disfunción orgánica (elevación de troponina, péptido natriurético cerebral, elevación de transaminasas, etc). Se puede asociar choque vasopléjico y disfunción miocárdica.
Por su similitud con enfermedad de Kawasaki, síndrome de choque tóxico bacteriano, miocarditis aguda, choque séptico o síndrome de activación macrofágica, se han acuñado términos confusos como kawashocky, coronasaky, choque hiperinflamatorio, etc.
No hay elementos basados en la evidencia para recomendar una tabla de criterios sobre otra. Para este consenso se tomó la decisión de basar las recomendaciones en los criterios de la OMS.
Recomendación
Se recomienda que en paciente pediátrico con sospecha de SIMS-TAC, se establezca el diagnóstico usando los criterios dados por la Organización Mundial de la Salud (OMS):
Niños de 0 a 19 años, con fiebre por más de 3 días y dos de las siguientes:
Rash o conjuntivitis bilateral no purulenta o signos de inflamación mucocutánea.
Hipotensión o choque.
Disfunción cardíaca, pericarditis, valvulitis o anomalías coronarias.
Evidencia de coagulopatía (TP, TTP, dímero D).
Afectación gastrointestinal aguda (diarrea, vómito o dolor abdominal) y:
Elevación de marcadores de inflamación PCR, velocidad de edimentación, procalcitonina.
Ausencia de otras causas de inflamación microbiológica, incluidas sepsis y síndrome de choque tóxico estafilocócico o estreptocócico.
Evidencia de infección por SARS-CoV-2/COVID-19 (RT- PCR, antígeno o serología positiva) o contacto probable con pacientes con infección por SARSCoV-2/COVID-19
Fuerte a favor
VII.5.3. ¿Cuáles son las pruebas diagnósticas a realizar en un paciente con sospecha de síndrome inflamatorio multisistémico temporalmente asociado a la infección por SARS-CoV-2/COVID-19 (SIMS-TAC)?
SIMS-TAC es un nuevo síndrome que aparece en niños durante la pandemia de infección por SARS-Cov-2/COVID-19. Su diagnóstico se fundamenta en criterios clínicos, laboratorio e imágenes que permiten la detección de inflamación, afectación multisistémica e infección por SARS-CoV-2/COVID-19. Los hallazgos de laboratorio observados en las series de casos disponibles incluyen linfopenia, neutrofilia, trombocitopenia, proteína C reactiva (PCR), velocidad de sedimentación globular (VSG), procalcitonina, ferritina, fibrinógeno, dímero-D e interleucina 6 elevados; aumento en troponina y péptido natriurético cerebral; hipoalbuminemia, incremento en enzimas hepáticas y lactato deshidrogenada (LDH) e hipertrigliceridemia, entre otros136,137,139,142-144,149-158.
En la serie de 33 pacientes pediátricos descrita por Kaushik S. et al. en la que el 45% de los pacientes fue de origen hispano/latino se encontró: una fracción de eyección disminuida en el 63% de los pacientes y en todos los pacientes la PCR, procalcitonina, dímero D y péptido natriurético tipo B estuvieron elevados152. Igualmente, en la serie de Cheung EW et al. que describe 17 niños y adolescentes previamente sanos que desarrollaron SIMS-TAC, los niveles de marcadores inflamatorios estuvieron elevados en todos los pacientes. La mayoría tenía linfopenia (n=12), bandemia (n=11), nivel elevado de troponina T (n=14) y nivel elevado de NT-proBNP (n=15) (159. Teniendo en cuenta los criterios clínicos y conociendo la naturaleza del compromiso de múltiples órganos de esta condición asociada a la infección por SARS-CoV-2/COVID-19, se requiere el apoyo diagnóstico paraclínico para poder determinar el compromiso sistémico. Según el Colegio Americano de Reumatología en su guía de práctica clínica para niños con el síndrome de respuesta multisistémica inflamatoria asociada a infección por SARS-CoV-2/COVID-19 e hiperinflamación en infección por SARS-CoV-2/COVID-19 proponen el estudio secuencial de niños con sospecha clínica en cuanto al abordaje paraclínico, iniciando con la búsqueda de criterios clínicos sugestivos del síndrome, en el cual es pertinente la evaluación de etiologías infecciosas y no infecciosas del cuadro160.
En pacientes con fiebre y evidencia de compromiso clínico de al menos dos sistemas se recomienda como primer paso para el abordaje diagnóstico evaluar la presencia de signos de choque. El diagnóstico de choque será considerado ante la presencia de varias de las siguientes: taquicardia para la edad, dificultad respiratoria, alteraciones de consciencia (somnolencia o irritabilidad); cambios en la coloración (palidez, moteado, cianosis), la temperatura (frialdad distal) o en la turgencia de la piel; llenado capilar > 2 sg, disminución en la intensidad de los pulsos distales, vómito o distensión abdominal después de la alimentación, historia de oliguria en las últimas horas; la hipotensión sistólica se considera un signo tardío, ominoso y representativo de un estado descompensado.
La presión arterial sistólica mínima en pediatría puede calcularse así:
<1 año: 70 mm Hg
1-10 años: 70 + (edad x 2) mm Hg
> 10 años: >90 mm Hg
Se recomienda en ausencia de choque de etiología no clara, considerar SIMS-TAC y realizar inicialmente: hemograma, VSG, PCR, AST, ALT, fosfatasa alcalina, bilirrubinas, proteínas totales, albúmina, electrolitos séricos, BUN, creatinina; Rx de tórax y ecocardiograma (a criterio médico), ecografía abdominal (en caso de afectación gastrointestinal); y RT PCT o serología IGG-IGM para infección por SARS-CoV-2/COVID-19160.
En caso de documentar elevación en la PCR o VSG y al menos uno de los siguientes: recuento absoluto de linfocitos < 1000/uL, recuento plaquetario < 150.000/uL, Na < 135 mmol/L, neutrofilia, hipoalbuminemia, se recomienda solicitar: procalcitonina (si está disponible), ferritina, LDH, triglicéridos, uroanálisis, fibrinógeno, TP, TPT, dímero D, troponina, péptido natriurético cerebral (si está disponible), interleucina 6 (si está disponible); electrocardiograma y ecocardiograma160.
Ante la presencia de choque de etiología no clara se recomienda realizar una evaluación diagnóstica completa para SIMS-TAC y solicitar: hemograma, VSG, PCR, ferritina, AST, ALT, fosfatasa alcalina, bilirrubinas, LDH, proteínas totales, albúmina, triglicéridos, electrolitos séricos (sodio, potasio), BUN, creatinina, uroanálisis, fibrinógeno, TP, TPT, dímero D, antitrombina III (si está disponible), troponina, péptido natriurético cerebral (si está disponible), interleucina 6 (si está disponible); Rx de tórax (a criterio médico), ecografía abdominal (en caso de afectación gastrointestinal), electrocardiograma y ecocardiograma; y RT-PCR o serología IgG-IgM para infección por SARS-CoV-2/COVID-19. Se recomienda además la realización de los estudios antes mencionados en caso de ser documentado la presencia de fiebre asociado con la afectación de un sistema y signos de choque de etiología no clara. Se recomienda la realización de estudios adicionales según sospecha clínica para evaluar diagnósticos diferenciales160.
Recomendación
Se recomienda el uso de pruebas diagnósticas secuenciales en el paciente pediátrico con sospecha de SIMS-TAC, de acuerdo a lo propuesto en el “Flujograma de diagnóstico en pediatría de SIMS-TAC asociado a la infección por SARS-CoV-2/COVID-19” .
Fuerte a favor
VII.5.4. Flujograma de diagnóstico en pediatría de SIMS-TAC asociado a la infección por SARS-CoV-2/COVID-19.
VII. 5.5. ¿Cuál es el tratamiento recomendado para el síndrome inflamatorio multisistémico temporalmente asociado a la infección por SARSCoV-2/COVID-19 (SIMS-TAC)?
El SIMS-TAC es una entidad recientemente descrita en Europa y Estados Unidos que se ha asociado a la infección por el virus SARS-CoV-2. Esta comparte la fisiopatología, así como ciertas características clínicas y paraclínicas de síndromes como la enfermedad de Kawasaki, el síndrome de choque tóxico y el síndrome de activación macrofágica. El uso de inmunomoduladores como inmunoglobulina G a dosis altas de 2 g/K, esteroides, anti IL-1, anti IL-6, y otros medicamentos como los antiagregantes plaquetarios y la terapia de anticoagulación han sido utilizados con resultados favorables, por lo que en la actualidad existen recomendaciones de su uso, basadas en estudios observacionales y consensos de expertos142,161.
Los reportes indican que, aunque se puede presentar durante la infección aguda cuando la prueba de RT-PCR para SARSCoV-2/COVID-19 es positiva, parece ser más frecuente durante el periodo convaleciente en el que se demuestra la infección por el SARS-CoV-2/COVID-19 sólo por serología IgG y/o IgM positiva. Se ha observado en pacientes pediátricos en los que no se ha demostrado la infección por SARSCoV-2/COVID-19, pero que ha ocurrido en países algunas semanas después del pico de presentación de casos, lo que sugiere una posible asociación y relación con un evento post infeccioso o inflamatorio de aparición tardía.
Debido a las manifestaciones clínicas de severidad que semejan lo observado en otros síndromes mediados por superantígenos, se ha propuesto que las bases del manejo sean las mismas que se utilizan en este tipo de patologías (Enfermedad de Kawasaki, síndrome de choque tóxico por Staphylococcus aureus o Streptococcus pyogenes).
De igual forma hay otras manifestaciones que semejan lo observado al síndrome hemofagocítico asociado a infección o en el síndrome de activación macrofágica, por lo que se ha propuesto el uso de esteroides y de inhibidores de IL-6 y de IL-1. No existen hasta el momento experimentos clínicos aleatorizados para cada uno de los medicamentos propuestos para el manejo. Las recomendaciones existentes hasta el momento publicadas por el Colegio Americano de Reumatología han sido hechas por Consenso de Expertos con información basada en la evidencia publicada en diferentes instituciones de Europa como de Estados Unidos160.
En un estudio observacional realizado en Francia a 21 pacientes reportados con clínica de SIMS-TAC se les aplicó al 100% IgG a altas dosis de 2 g/K, con aplicación concomitante de esteroides a dosis entre 2 a 10 mg/k/día en 7 de ellos. Por resistencia al tratamiento con la primera dosis de IgG, se aplicó una segunda dosis de IgG de 2 g/k en 5 pacientes, y a 4 de estos 5 se les adicionó esteroides, con evolución favorable en todos los casos142.
En un estudio observacional realizado en Inglaterra en el que se describen 58 niños con SIMS-TAC, se dio manejo de soporte en el 22%, inmunoglobulina G en el 71%, esteroides en el 64%, y fue necesario el uso de anakinra en 5% (3 casos) e infliximab en 14% (8 casos). En esta serie de casos sólo se presentó una mortalidad en un paciente con choque que no cumplió criterios de enfermedad de Kawasaki, que tenía infección confirmada por SARS-CoV-2/COVID-19136.
En un estudio publicado en Italia por Verdoni et al., de 10 pacientes con SIMS-TAC, el manejo administrado fue con inmunoglobulina en el 100% de los casos, acompañado de metilprednisolona en 8 de los casos (80%), y de aspirina en los 2 casos (20%) restantes. Fue necesario inotrópicos en sólo el 20% y la respuesta fue favorable en todos los casos154.
En otro estudio de cohorte con control histórico realizado en Francia que comparó 16 casos de SIMS-TAC con una cohorte histórica de 220 pacientes con enfermedad de Kawasaki, encontraron que hubo mayor resistencia al uso de una dosis de IgG a dosis altas en los pacientes con el SIMS-TAC (62%) en comparación con enfermedad de Kawasaki (20%), con necesidad de una segunda dosis de IgG asociada o no a esteroides. Los casos fueron clasificados como severos cuando los pacientes requirieron ingreso a UCIP por falla de un órgano y/o un desenlace fatal; mientras que los no severos no cumplieron estos criterios. Fue administrado al menos una dosis de IgG a dosis altas en el 100% de los casos severos en comparación con el 89% de los clasificados como no severos. En uno de los 7 casos severos fue necesaria una segunda dosis de IgG. En los 9 casos no severos fue aplicada una dosis única de IgG en 4 de ellos, mientras que en otros 4 fue necesaria una segunda dosis. Los esteroides fueron utilizados en 3 de los 7 clasificados como severos, 1 recibió anti IL-1 (anakinra a 4 mg/k) y otro recibió anti IL-6 (tocilizumab 8 mg/k). El uso de ASA a dosis antiinflamatorias fue utilizado en 43% de los casos severos y en el 37% de los no severos, mientras que recibieron dosis antiagregantes en el 57% de los casos severos y 62% de los no severos141.
En el estudio publicado por Miller J. et al. en el que reportan 44 pacientes pediátricos con SIMS-TAC se dio tratamiento con esteroides en 42 (95%) de los casos, inmunoglobulina G intravenosa en 36 pacientes (81.8%), anakinra en 8 (18.2%) y anticoagulación en 40 (90.1%). Sólo en un caso hubo necesidad de ventilación mecánica, otro requirió de terapia de reemplazo renal, y no hubo mortalidad144.
Capone CA et al. publicaron una serie de 33 casos de pacientes con SIMS-TAC los cuales fueron manejados con inmunoglobulina G endovenosa a altas dosis en el 100% de los casos, siendo necesario el uso de una segunda dosis en el 33% de los pacientes; fue administrado manejo con metilprednisolona en el 70%, aspirina en el 88%, anakinra en el 12%, tocilizumab en el 9%, infliximab en el 3% y enoxaparina en el 42%.
La funcionalidad cardiaca al egreso fue normal en el 42%, disminuida pero luego normalizada en el 30% y ligeramente disminuida en el 27%. Todos los casos incluidos fueron dados de alta vivos138.
En otro estudio observacional realizado en tres centros hospitalarios de Nueva York que incluyó pacientes que fueron ingresados a UCIP, se utilizó inmunoglobulina intravenosa en 18 (54%), corticosteroides en 17 (51%), tocilizumab en 12 (36%), remdesivir en 7 (21%), vasopresores en 17 (51%), ventilación mecánica en 5 (15%), oxigenación por membrana extracorpórea (ECMO) en 1 (3%) y bomba de balón intraaórtico en 1 (3%). La Fracción de Eyección del Ventrículo Izquierdo (FEVI) se normalizó en el 95% de las personas con fracción de eyección deprimida. Todos los pacientes fueron dados de alta con una mediana de duración de estadía en la UCIP de 4,7 días (RIC, 4-8 días) y estadía en el hospital de 7,8 días (RIC, 6-10,1 días). Un paciente falleció secundario a un accidente cerebrovascular mientras se encontraba en ECMO139.
El Colegio Americano de Reumatología publicó el pasado 17 de junio una guía clínica preliminar para el manejo de los pacientes con SIMS-TAC. Fue realizada mediante consenso de expertos de diferentes áreas que incluyó reumatólogos pediatras, reumatólogos de adultos, cardiólogos pediatras, infectólogos pediatras y un intensivista pediatra. El consenso se calificó como bajo (L), moderado (M) o alto (H) en función de la dispersión de los votos a lo largo de la escala numérica entre 1 y 9. El consenso menciona que algunos pacientes con síntomas leves pueden requerir únicamente monitoreo estrecho sin tratamiento inmunomodulador. El panel de expertos observó incertidumbre sobre el uso empírico de la inmunoglobulina intravenosa (IGIV), en este contexto para prevenir los aneurismas de arteria coronaria160.
El consenso establece que160:
Se debe utilizar una progresión gradual de las terapias inmunomoduladoras para tratar SIMS-TAC con IGIV y/o glucocorticoides considerados como tratamientos de primer nivel (M/H).
Dosis altas de IVIG (1-2 g/kg) pueden ser consideradas para el tratamiento de MIS-C. La función cardiaca y el balance hídrico debe ser evaluada en pacientes con SIMS-TAC sin choque, antes que el tratamiento con inmunoglobulina intravenosa sea administrado, y administrar la IVIG cuando la función cardiaca sea restablecida. (M/H).
En pacientes con manifestaciones que amenazan la vida como choque o en el caso que el paciente requiera altas dosis o múltiples inotrópicos y/o vasopresores, se podría considerar el uso de esteroides a dosis altas.
En los casos en que haya resistencia al manejo previo, o en pacientes que tengan contraindicación para su uso, podría considerarse el uso de anakinra.
Se recomienda el uso de aspirina a dosis baja (3-5 mg/k/día, máximo 81 mg/día en pacientes con SIMS-TAC y hallazgos de enfermedad de Kawasaki - like, y/o trombocitosis (conteo plaquetario ≥ 450,000/µL) y continuar hasta tener normalización del conteo de plaquetas y evaluación normal confirmada de las arterias coronarias luego de ≥ 4 semanas después del diagnóstico. El tratamiento con aspirina debe ser evitado en pacientes con un conteo plaquetario ≤80,000/µL.
Los pacientes con SIMS-TAC con aneurisma de la arteria coronaria y un z-score máximo de 2,5 - 10 deben ser tratados con dosis bajas de aspirina y terapia de anticoagulación con enoxaparina (nivel de factor Xa de 0,5 - 1,0) o Warfarina. Se recomienda que los pacientes con SIMS-TAC y trombosis documentada o una fracción de eyección < 35% reciban anticoagulación terapéutica con enoxaparina hasta al menos 2 semanas después del egreso del hospital.
Las indicaciones para prolongar el uso ambulatorio de enoxaparina incluyen: aneurisma de arteria coronaria con zscore > 10,0 (tratamiento indefinido), trombosis documentada (tratamiento por ≥ 3 meses dependiendo de la resolución de trombosis), o disfunción moderada a severa del ventrículo izquierdo.
Para pacientes con SIMS-TAC quienes no cumplen con los criterios arriba mencionados, la aproximación al uso de manejo antiplaquetario y anticoagulante debe ser guiado por el riesgo de trombosis del paciente.
No hay descripción específica de efectos no deseables de las diferentes intervenciones medicamentosas en esta patología. Se recomienda evaluar la función cardiaca y el balance hídrico en pacientes con SIMS-TAC con choque antes del manejo con IgG; la administración de IgG se debe realizar cuando se haya recuperado del choque. Se ha descrito la presencia de síndrome de sobrecarga hídrica con la aplicación de Inmunoglobulina en dosis altas (2 gr/kg/dosis) en pacientes con disfunción cardiaca. Adicionalmente el uso de IgG a dosis altas se ha asociado con efectos adversos como cefalea y fiebre160.
El uso de dosis altas de esteroides se ha asociado a hipertensión arterial, psicosis por esteroide, hipernatremia, hiperglucemia162. El uso de anti IL-6 (tocilizumab) se ha asociado a mayor riesgo de infección por bacterias y por hongos; puede producir aumento de colesterol, enzimas hepáticas, y está contraindicado en neutropenia y trombocitopenia163.
El uso de ASA a dosis antiinflamatorias de hasta 100 mg/k/ día se ha asociado con sangrado digestivo, epistaxis y alteración en la función hepática. Dos estudios publicados recientemente describen que el efecto a nivel coronario con dosis de aspirina por debajo de 30 mg/K/día no es inferior al que se observa con dosis superiores, con disminución de los efectos adversos164,165.
La evidencia publicada hasta el momento está basada en series de casos, en los cuales se ha planteado un tratamiento diferencial dependiendo de la severidad de la presentación de cada caso. Aunque en enfermedad de Kawasaki, así como en síndrome de choque asociado a enfermedad de Kawasaki está recomendado el uso de IgG a altas dosis, no hay evidencia suficiente para emitir una recomendación fuerte a favor de su uso en SIMS-TAC. Sin embargo, en la mayoría de los casos de las diferentes series, ésta ha sido la terapia de inicio más empleada acompañada o no de esteroides a dosis altas.
Se sugiere que el uso y las dosis de esteroide sea individualizado de acuerdo con la severidad de presentación del cuadro clínico.
En pacientes con manifestaciones que amenazan la vida como choque, o en el caso que el paciente requiera altas dosis o múltiples inotrópicos y/o vasopresores, se podría considerar el uso de esteroides a dosis altas.
En los casos en que haya resistencia al manejo previo, o en pacientes que tengan contraindicación para su uso, podría considerarse el uso de inhibidor de IL-6 (tocilizumab) dada la no disponibilidad de inhibidor de IL-1, (anakinra) en el país, lo cual debe decidirse en una junta médica interdisciplinaria.
Hay muy poca información acerca del uso de infliximab para poder emitir una recomendación a favor o en contra de su uso.
Existe nueva evidencia publicada que apoya el uso de menores dosis antinflamatorias de aspirina (20 - 50 mg/k/día) en pacientes con enfermedad de Kawasaki con menores efectos adversos y de similar efectividad. De igual forma hay evidencia del uso de aspirina a dosis antiagregantes en la fase inicial, sin el uso previo de dosis altas, sin que se haya documentado incremento en el riesgo de daño en las coronarias. La aspirina podrá ser usada en SIMS-TAC sólo si no hay trombocitopenia, sangrado gastrointestinal, alteración de las pruebas de función hepática (hasta 5 veces los valores normales de transaminasas), intolerancia a la vía oral, asma no controlada o infección por virus de influenza A o B.
Recomendación
Se sugiere el uso de IgG a dosis de 2 g/k a todos los pacientes que cumplan criterios diagnósticos de SIMS-TAC.
Débil a favor
Se sugiere aplicar una segunda dosis de IgG a dosis de 2 g/k en caso de no respuesta a las 36 horas de la primera dosis, con o sin esteroide a dosis baja (prednisolona por vía oral a máximo 1 mg/k/día o su equivalente intravenoso si hay intolerancia a la vía oral, según respuesta) .
Débil a favor
Se sugiere, además del uso de IgG, la administración de pulsos de metilprednisolona a 30 mg/k/día por 3 días en caso de choque asociado a SIMS-TAC.
Débil a favor
Se recomienda el uso de aspirina a dosis antiinflamatorias (30 - 50 mg/K/día en 4 dosis) hasta control de la fiebre si no hay trombocitopenia, sangrado gastrointestinal, alteración de las pruebas de función hepática (hasta 5 veces los valores normales de transaminasas), asma no controlada, intolerancia a la vía oral o infección por virus de influenza A o B.
Fuerte a favor
Se recomienda el uso de aspirina a dosis antiagregante (3- 5 mg/k/día) una vez controlada la fiebre por más de 48 horas en caso de trombocitosis (≥ 450,000/µL) o dilatación de las arterias coronarias hasta su resolución.
Fuerte a favor
Puntos de buena práctica:
Al terminar los pulsos de esteroides, se sugiere dejar una dosis baja de esteroides que se irá disminuyendo en el lapso de 2 a 3 semanas.
El uso de esteroides debe ir precedido por administracion de manejo antiparasitario (albendazol o ivermectina).
El uso de otros medicamentos inmunomoduladores como tocilizumab para el manejo de pacientes que presenten falla al manejo con dos dosis altas de Inmunoglobulina G endovenosa y ciclo de esteroides (metilprednisolona a 30 mg/k/día por 3 días). Dicho manejo debe ser discutido y aprobado por una junta interdisciplinaria citada para tal fin.
VII.5.6. ¿Cuál es el seguimiento para los pacientes pediátricos con síndrome inflamatorio multisistémico temporalmente asociado a la infección por SARS-CoV-2/COVID-19 (SIMS-TAC)?
En el contexto de la pandemia de SARS-CoV-2/COVID-19, la población pediátrica se ha considerado con manifestaciones clínicas menos significativas y severas en comparación con los adultos. Sin embargo, recientemente se ha identificado un grupo de menores de 21 años con manifestaciones clínicas similares a la enfermedad de Kawasaki, al síndrome de choque tóxico y, en algunos casos al síndrome de activación macrofágica que se ha denominado síndrome inflamatorio multisistémico temporalmente asociado a la infección por SARC-CoV-2/COVID-19. Se han establecido criterios diagnósticos para su identificación e intervención apropiadas y, solamente hasta ahora se está describiendo la historia natural de su curso y desenlaces, lo que crea la necesidad de establecer el manejo y seguimiento multidisciplinario desde el momento de su sospecha inicial, durante su atención hospitalaria y, sin duda, en el seguimiento ambulatorio posterior.
Es importante individualizar la condición de cada paciente a la hora de definir el seguimiento, teniendo en cuenta que no todos los pacientes con SIMS-TAC (MISC-C) requieren hospitalización en cuidado intensivo.
Los pacientes con presentaciones menos severas podrían ser evaluados con estricto seguimiento de la historia clínica dirigida, examen físico amplio y pruebas de laboratorio establecidas en los criterios paraclínicos como hemograma, VSG, PCR, electrolitos, glicemia, albúmina, función hepática, bilirrubinas y, de acuerdo con los hallazgos ampliar estudio con BNP, troponina, ferritina, PT, PTT, fibrinógeno, triglicéridos, LDH, EKG y ecocardiograma160.
Se considera importante el seguimiento de los pacientes con presentaciones menos severas por pediatría entre 24-72 horas de su egreso y a la semana con laboratorios incluyendo hemograma VSG, PCR, BNP, dímero D, ferritina; los otros laboratorios se realizarán de acuerdo con la condición del paciente y las alteraciones que se hayan documentado 166.
En pacientes con MISC- C con compromiso cardíaco 160 se debe realizar:
Medición de BNP y troponina, en caso de estar elevados deben ser monitorizados durante la hospitalización y de manera ambulatoria hasta que sean normalizados.
Las alteraciones de conducción deben ser evaluadas con EKG cada 48 horas durante la hospitalización y luego en cada visita de seguimiento, si se observan anormalidades de la conducción se sugiere la realización de monitorización con Holter.
Ecocardiograma debe incluir evaluación ventricular, valvular, presencia de derrame pericárdico y medicación de arterias coronarias con cálculo de Z score. Se realizará ecocardiograma al diagnóstico, repetirse entre los días 7-14 y, posteriormente entre la semana 4-6. En caso de encontrarse anormalidades la frecuencia será definida por los hallazgos y/o al año del diagnóstico160,166.
Para los pacientes con severa disfunción de ventrículo derecho se sugiere RMN cardíaca 2 a 6 meses después de diagnóstico
En relación con los seguimientos en casos similares a enfermedad de Kawasaki:
Si los pacientes han presentado manifestaciones similares a enfermedad de Kawasaki se hará seguimiento por infectología pediátrica para recomendaciones en relación con las indicaciones de vacunación si ha recibido inmunoglobulina, si requiere vacunas vivas que se hayan diferido o si recibe ASA para la indicación de vacuna contra la influenza.
El seguimiento en caso de compromiso coronario por cardiología pediátrica es definitivo y a largo plazo, especialmente con los controles ecocardiográficos y para establecer duración de manejo con ASA.
Se requiere seguimiento de reumatología pediátrica si ha requerido manejo antiinflamatorio adicional, como terapia corticoide en bolos o de mantenimiento o terapia biológica.
En los casos que hayan cursado con síndrome de activación macrofagia debe tener seguimiento cercano por hematología pediátrica. Solo se han reportados los desenlaces al terminar la hospitalización, pero no en el seguimiento posterior y, por lo tanto, se requiere establecer un seguimiento que permita una mejor aproximación a los desenlaces clínicos y sus efectos a largo plazo que se están conociendo hasta este momento. La identificación temprana de los desenlaces a corto, largo y mediano plazo de los pacientes identificados con criterios diagnósticos de síndrome inflamatorio multisistémico en niños temporalmente asociado a SARS-CoV-2/COVID-19 es necesaria para establecer sus implicaciones en la salud integral de los afectados y su diferenciación con condiciones similares como enfermedad de Kawasaki. Puntos de buena práctica:
El seguimiento de los pacientes con SIMS-TAC requiere un equipo multidisciplinario con participación de pediatría, infectología, reumatología y de acuerdo con el compromiso otras especialidades como oftalmología, neurología, cardiología, nefrología, lo cual dependerá de las manifestaciones y complicaciones presentadas durante la hospitalización.
Es importante individualizar la condición de cada paciente a la hora de definir el seguimiento, teniendo en cuenta que no todos los pacientes con SIMS-TAC requieren hospitalización en unidad de cuidado intensivo.
VII.6. VACUNACIÓN
VII.6.1. ¿Qué consideraciones deben tenerse en cuenta con respecto a la aplicación de vacunas en tiempos de pandemia?
En un contexto de pandemia como en el que se encuentran muchos países a nivel mundial, la selección de prioridades en salud debe estar guiada por el contexto propio del sistema de salud y la carga local de enfermedad, pero en forma prioritaria debe estar inicialmente orientada a prevenir enfermedades transmisibles, evitando la morbilidad y mortalidad materna e infantil, la prevención de exacerbaciones agudas de afecciones crónicas mediante el mantenimiento de regímenes de tratamiento establecidos, y manejo de condiciones de emergencia que requieran intervención urgente167. Por tanto, al planificar el funcionamiento de medidas vitales y esenciales para la sociedad como es la vacunación rutinaria, se debe tener en cuenta que cualquier interrupción de los servicios de inmunización, incluso por períodos cortos, traerá como resultado una acumulación de individuos susceptibles y una mayor probabilidad de brotes de enfermedades prevenibles por vacunación (EPV), causando no sólo un incremento en la morbimortalidad sino una carga mayor sobre los sistemas de salud que ya están respondiendo al COVID-19168. Esta situación ya ha sido observada en brotes previos como el de ébola en África occidental entre 2014-2015, donde se demostró que el aumento en el número de muertes causadas por sarampión, malaria, VIH/SIDA y tuberculosis atribuible a fallas del sistema de salud, superó las muertes por ébola167,169,170.
Teniendo en cuenta que la inmunización es un componente esencial de los servicios de salud, la OMS recomienda que la vacunación no debe ser interrumpida171. La inmunización de rutina debe mantenerse siempre que las medidas de respuesta a la pandemia por SARS-CoV-2/COVID-19 lo permitan. Ahora más que nunca deben mantenerse altas coberturas para evitar brotes por enfermedades prevenibles por vacunación para los diferentes grupos etáreos contemplados en los Programas Ampliados de Inmunización (PAI) de cada país, enfatizando en las cohortes atrasadas y en los grupos con factores de riesgo y priorizados según condiciones especiales.
La importancia de mantener la vacunación rutinaria se ve reforzada si tenemos en cuenta que se plantea que las vacunas vivas contra polio, sarampión y tuberculosis entre otras, pueden estimular y madurar la respuesta de células Natural Killer (NKC) y T citotóxicas además de estimular la producción de citoquinas inherentes a la respuesta inmune que podrían potencialmente prevenir infecciones virales respiratorias incluyendo la infección por SARS-CoV2/COVID-19172.
Los trabajadores de la salud son uno de los grupos que tiene un alto riesgo de contraer SARS-Cov-2, y desarrollar COVID-19 en cualquiera de sus manifestaciones clínicas. Hay dos ensayos clínicos en curso los cuales tienen como objetivo estudiar los efectos de la vacuna BCG administrada a los trabajadores de la salud directamente involucrados en la atención de pacientes con COVID-19174,175. No hay evidencia suficiente hasta el momento que demuestre que la vacuna Bacille Calmette-Guérin (BCG) proteja a las personas contra la infección con el virus SARS-CoV2/COVID-19173.
Con respecto a la vacunación con vacuna oral de polio (OPV) no hay evidencia que la aplicación de esta vacuna prevenga la infección por SARS-CoV2/COVID-19; sólo hay un estudio en curso aprobado por la FDA en Estados Unidos en esta línea de investigación.
Consideraciones para implementar la vacunación
Recomendaciones para vacunar en época de pandemia174:
Seguir las pautas existentes sobre las medidas de prevención de infección por COVID-19 durante las sesiones de inmunización.
Permitir solo un padre o tutor acompañante a la sesión.
No asistir a la sesión si ellos o cualquiera de sus hijos tienen síntomas de una infección respiratoria (como fiebre, dolor de garganta, secreción nasal, dificultad para respirar o tos) o si han regresado del extranjero en los últimos 14 días, o se les ha dicho que se auto aíslen por sospecha o confirmación de Covid-19, en este caso debe reprogramarse la cita en forma telefónica.
Todo usuario debe lavarse las manos o usar desinfectante para manos en la entrada de la recepción o en el área de espera.
Garantizar el distanciamiento físico con al menos 2 metros de distancia entre cada usuario, factor extremadamente importante para mantener el orden y el flujo hacia el área de vacunación, si llegan varios pacientes al mismo tiempo; implementar medidas opcionales como sistemas de citas para vacunas, llamadas telefónicas al momento de ingreso y/o áreas de espera alternas sin que existan aglomeraciones (ej. espera en los automóviles) antes y después de la vacunación, con el fin de monitorear un evento adverso después de la misma.
Priorizar las vacunas de series primarias y las ya establecidas en el PAI. Este aspecto es especialmente importante para las vacunas contra sarampión, rubéola, parotiditis, poliomielitis y otras vacunas combinadas, así como la vacunación contra influenza y neumococo en cohortes con comorbilidades o condiciones especiales. Ver Manual técnico administrativo del Programa Ampliado de Inmunizaciones PAI Colombia 2015-2016 en: https://www.minsalud.gov.co/sites/rid/paginas/freesearchresults.aspx?k=manual%20tecnico&scope=Todos; Guías para la inmunización del adolescente y adulto en Colombia. Documento de actualización 2016 en https://www.sciencediret.com/science/article/pii/S0123939216300285?via%3Dihub; y Lineamientos para la vacunación contra influenza estacional cepa sur 2020 en Colombia en href="https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/RIDE/VS/PP/ET/lineamientos-vacunacioncontra-influenza.pdf
Evitar las campañas de vacunación masiva de acuerdo a la situación epidemiológica vigente.
Vacunar a los recién nacidos (según el calendario nacional de vacunación) en los hospitales de atención materno-infantil.
Establecer un acuerdo de administración segura con el servicio prestador de salud, preferiblemente a nivel domiciliario, si la administración se ha diferido por la situación epidemiológica generada por el SARS-CoV-2/COVID-19.
Comunicar claramente a la comunidad y a los profesionales de la salud (a través de anuncios o carteles con mensajes claves) las razones para incluir la inmunización como uno de los servicios de salud prioritarios durante la pandemia de COVID-19, así como los riesgos de las EPV y los beneficios de la vacunación, al igual que anticipar el posible aumento de ESAVIs (Evento Supuestamente Atribuido a Vacunación o Inmunización) dada la coincidencia de SARS-CoV-2 en la comunidad.
Recordar que si la capacidad del sistema de Salud lo permite, la vacunación debe realizarse en los puntos y lugares establecidos, garantizando el cumplimiento de las medidas de bioseguridad y utilizando los EPP correspondientes según el área En caso de evidenciar disminución en el suministro de vacunas debe priorizarse la vacunación para las poblaciones vulnerables y de alto riesgo ya descritas anteriormente (170.
Fijar, siempre que sea posible, los servicios de vacunación en un área exclusiva diferente a las áreas destinadas para otros servicios.
Continuar la vigilancia rutinaria de EPV, utilizando y optimizando la tecnología disponible. Priorizar la vigilancia de enfermedades con potencial epidémico como influenza, meningococo, fiebre amarilla, sarampión, rubeola, difteria, y polio.
Mantener la vacunación contra Sarampión con dosis 0 para los lactantes entre 6-11 meses en municipios con mayor riesgo o brotes activos de sarampión, así como en zonas fronterizas175.
Posponer y reprogramar la vacunación de adolescentes hasta cuando sea más oportuno (10) .
Vacunación contra influenza, neumococo y sarampión
La emergencia de la infección por SARS-Cov-2/COVID-19 está reforzando la importancia de la prevención y control de infecciones causadas por diferentes agentes infecciosos a nivel respiratorio especialmente la influenza y el neumococo. Diferentes organizaciones de salud recomiendan la vacuna contra la influenza en los menores de 5 años, embarazadas, adultos > 65 años e individuos de cualquier edad con comorbilidades o condiciones médicas crónicas. La vacunación a los trabajadores de la salud es una medida efectiva si se asegura una cobertura que se refleje en la protección y reducción de las infecciones asintomáticas y sintomáticas del 70-91%, tal como se reflejan diferentes revisiones sistemáticas y metaanálisis11,12. La vacunación a los trabajadores de la salud es una medida efectiva si se asegura una cobertura que se refleje en la protección y reducción de las infecciones asintomáticas y sintomáticas del 70-91%, tal como se identifica en diferentes revisiones sistemáticas y metaanálisis177,178. Colombia enfoca el programa de vacunación contra influenza a los menores entre 6-23 meses, embarazadas, poblaciones de cualquier edad con patologías crónicas y los mayores de 60 años. La vacuna cepa sur 2020-2021 disponible por el Ministerio de Salud y Protección Social, basada en la recomendación de la Organización Mundial de la Salud [OMS], protege contra los virus tipo A/ Brisbane/ 02/2018 (H1N1) pdm09, virus similar a A/Australia del Sur/ 34/2019 (H3N2) y el virus tipo B /Washington/ 02/2019 (linaje B/ Victoria) 179.
Streptococcus pneumoniae continúa siendo el principal agente etiológico de la neumonía adquirida en la comunidad y una causa significativa de otras infecciones severas en grupos de alto riesgo, especialmente la población pediátrica, los adultos mayores y las poblaciones con comorbilidades especialmente en temporadas de picos de influenza180. La prevención de las infecciones por Streptococcus pneumoniae, representa un método efectivo para reducir la carga de enfermedad neumocóccica invasiva (ENI) tanto en adultos como en niños. La mortalidad debida a ENI independiente del tratamiento recibido es elevada, fluctuando entre 10 a 25% de los pacientes siendo la neumonía el principal foco181.
La vacunación rutinaria contra neumococo con vacunas conjugadas tienen un efecto directo en la reducción de carga de enfermedad contra los serotipos vacunales y además tiene efectos indirectos gracias a la disminución en la portación nasofaríngea y su efecto rebaño182. Un ejemplo de este caso, es el uso de la vacuna neumocócica conjugada en Estados Unidos, donde al cabo de un año de su introducción, la incidencia de la enfermedad neumocócica invasiva cayó en 69% entre los niños menores de 2 años vacunados, pero también, mostró un descenso del 32% en adultos jóvenes (de 20 a 39 años) y del 18 % entre los grupos de más edad (más de 65 años), ninguno de los cuales había recibido nunca la vacuna183.
La introducción universal de las vacunas contra rotavirus, influenza y neumococo disminuyeron la mortalidad por cualquier causa en menores de 5 años en el 34%184.
El Programa Ampliado de Inmunizaciones de Colombia cuenta con vacunación universal neumocócica conjugada para menores de 15 meses185. La vacuna polisacárida 23 [PPV23] que incluye protección contra 23 serotipos de neumococo ha sido ampliamente discutida y recomendada en los adultos mayores de 65 años e individuos con comorbilidades o condiciones de alto riesgo. La Asociación Colombiana de Infectología - ACIN, desarrolló las guías de inmunización en adolescentes y adultos e incluyó los pacientes de alto riesgo186.
Si debido a la propagación de COVID-19 es necesario posponer la vacunación contra sarampión, se deben intensificar los esfuerzos para rastrear a los niños no vacunados, así como a las poblaciones más vulnerables para que puedan recibir vacunas contra el sarampión tan pronto como sea posible187.
Recomendación
Se recomienda continuar el esquema de vacunación rutinario de acuerdo con las edades y condiciones especiales de la población objeto, (recién nacidos, lactantes, preescolares, escolares, y adolescentes, gestantes, adultos mayores, y personas con comorbilidades, así como la población general que requiera la vacunación) .
Fuerte a favor
Se recomienda posponer el esquema de vacunación rutinario en paciente con sospecha o confirmación de infección por SARS-CoV-2/COVID-19 hasta su recuperación.
Fuerte a favor
Se recomienda realizar la vacunación bajo las medidas de distanciamiento físico y con todas las medidas de protección personal tanto por parte de los trabajadores de la salud como de los asistentes a los puestos de vacunación.
Fuerte a favor
Punto de buena práctica:
La población objeto de vacunación contra neumococo en Colombia debe continuar el esquema de vacunación para neumococo del Programa Ampliado de Inmunizaciones.
La vacunación contra influenza con la cepa-sur 2020-2021 debe seguir los lineamientos establecidos por el Ministerio de Salud y Protección Social de Colombia desde abril del 2020