Una vacuna para COVID 19 es una necesidad urgente de la comunidad global. El justificado temor por la premura con la cual se han desarrollado las evaluaciones de candidatos vacunales para COVID 191 no debe evitar un análisis racional, detallado e integral de los pasos que se deben cumplir y superar para dar licencia a una vacuna2. Las comparaciones con desarrollos previos de vacunas no son posibles para entender el estado actual, pues se deben tener en cuenta factores sin precedentes como la extraordinaria cooperación internacional, las alianzas público privadas y la disponibilidad de recursos tanto públicos como privados2. Además se ha logrado definir perfiles de respuesta inmune utilizando la citometría multi parámetro para el análisis de más de 200 variables inmunológicas3 y obtener datos de transcriptómica de la respuesta inmune de miles de genes para caracterizar los cambios en pacientes con COVID severo4. De otro lado, la inmunoinformática ha permitido seleccionar y diseñar nuevas vacunas, lo que permite velocidades y tasas de éxito mayores cuando se pasa a la evaluación en modelo animal, que en el caso de SARS-Cov-2 está limitado a algunas pocas especies5.
Varios criterios se han planteado para considerar el uso, como estrategia de control de esta pandemia, de una vacuna para COVID 19. La Organización Mundial de la Salud (OMS) ha definido como parámetros mínimos de perfil de productos para una vacuna para COVID 19 que estos demuestren seguridad e inmunogenicidad suficiente que supere el balance riesgo beneficio, que no tenga efectos adversos severos y que ofrezca por lo menos un 50% de protección o reducción de enfermedad o enfermedad severa o reducción en excreción del virus o transmisión6. De otro lado, el grupo de investigación de vacunas para COVID de la Universidad de Oxford considera que debe ser efectiva con una o dos dosis, brindar protección en los grupos poblacionales prioritarios como son las personas mayores de 65 años, personas con comorbilidades e inmunodeprimidos, que la duración de la protección sea de al menos 6 meses, ser capaz de reducir la transmisión comunitaria de la infección y que se pueda producir en gran escala, a un coste asequible y en tiempo oportuno7. Se ha señalado además que es necesario se haga una validación independiente que realice comparaciones directas de las respuestas inmunes obtenidas en los diferentes ensayos y que exista un acuerdo sobre los criterios de correlación entre inmunidad y biomarcadores de respuesta inmune8.
La urgencia sanitaria provocada por la pandemia de COVID-19 ha sido un impulso extraordinario para el desarrollo de más de 200 esfuerzos públicos y privados enfocados en desplegar una vacuna eficaz y segura. Ante esta necesidad, el primer temor es si la urgencia evitará hacer una evaluación adecuada de la seguridad1,2. Hasta ahora, las vacunas que se encuentran en Fase III han cumplido con los criterios requeridos que permiten nuestros conocimientos actuales. De los ensayos en fase I que se han realizado para las nuevas vacunas en COVID-9 y reportadas en la literatura todas tuvieron evaluación de efectos secundarios adversos e inmunogenicidad. En el caso de la vacuna basada en adenovirus recombinante (Cansino Ad 5 Covid 19) evaluada en 108 individuos sanos, se encontró que después del día siete de vacunación más del 70% de los participantes presentaron reacciones adversas, la mayoría leves o moderadas, siendo las más frecuentes el dolor en el sitio de infección, fiebre, fatiga y cefalea9. Con la vacuna Moderna (mRNA 1273) evaluada en 45 adultos que recibieron dos vacunaciones con un intervalo de 28 días entre ellas, con dosis de 25 μg, 100 μg, o 250 μg más de la mitad presentaron fatiga, escalofríos, cefalea, mialgia y dolor en el sitio de inyección10. Se presentaron mayores efectos adversos con la segunda dosis y tres (21%) de los que recibieron la dosis más alta de 250-μg reportaron uno o más efectos adversos10. Con la vacuna del grupo de Oxford (ChAdOx1) basada en el uso de un virus recombinante derivado del chimpancé y evaluada en 487 individuos, el 67% presentaron dolor leve a moderado, 70% fatiga, 68% cefalea, 60% mialgia, 61% malestar y 48% escalofríos7. Por lo tanto, estos candidatos vacunales presentan reacciones adversas similares a las observadas con otras vacunas y ninguna de ellas fue severa en las dosis que son capaces de inducir respuesta inmune, por ello se pueden considerar que son seguras para administrar en el humano. La única que no merece comentarios es la anunciada por Rusia, denominada Sputnik. A la fecha y luego del anuncio de su licencia, se terminaron los estudios según lo declarado en el sitio web de Clinical Trials, pero no se han compartido sus resultados11. Una vacuna sin datos compartidos con la comunidad científica se aleja de los principios generales de una ciencia abierta y honesta.
En estos ensayos fase I para vacunas, los riesgos más importantes que se pueden evaluar son los de reacciones alérgicas a la vacuna o a sus componentes, pero existen otros que requieren seguimiento a largo plazo o estudios clínicos específicos tales como una producción continuada de proteína por vacunas basadas en ácidos nucleicos, lo cual sin embargo hasta ahora parece descartado10. El riesgo real más importante es la amplificación dependiente de anticuerpos o ADE (por sus siglas del inglés: antibody-dependent enhancement) el cual consiste en el incremento en la severidad de una infección mediado por anticuerpos que se adquirieron previamente por una infección anterior o por vacunación o por transferencia pasiva12,13. El fenómeno de ADE fue descrito por primera vez en dengue, en donde la presencia de anticuerpos previos no neutralizantes contra un serotipo diferente incrementan el número de células infectadas, lo que lleva a un un aumento en la viremia y una respuesta inmune aberrante, lo que se traduce en mayor severidad de la enfermedad14. En el caso particular de la infección por el SARS-CoV-2 la ADE es una preocupación general para el desarrollo de vacunas y terapias con anticuerpos, porque los mecanismos que subyacen a la protección de anticuerpos contra cualquier virus tienen un potencial teórico para amplificar la infección o desencadenar una inmunopatología dañina12,15. A la fecha, no hay evidencia de que el fenómeno de ADE ocurra y se relacione con la severidad de COVID-19 y adicionalmente dos estudios que evaluaron candidatos a vacunas para COVID-19 en macacos Rhesus, no evidenciaron el desarrollo de ADE16,17.
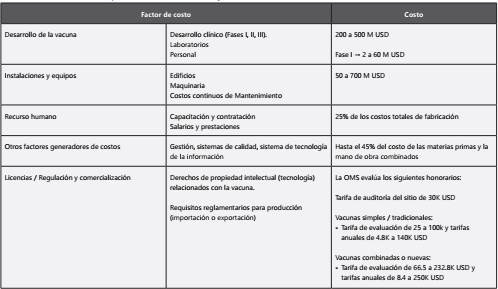
En Colombia para el momento de escribir esta editorial se han reportado más de 17 mil fatalidades18 y una reducción del 5% del producto interno bruto19. Tanto Colombia como otros países latinoamericanos deben establecer una hoja de ruta que permita diversas alternativas para mitigar el impacto del virus más allá del distanciamiento físico y la compra de vacunas desarrolladas por compañías privadas. En la evaluación de costo beneficio debe incluirse la alternativa del desarrollo de una manufactura propia20. Esto tiene varias ventajas. De una parte, uno de los costos mayores de cualquier vacuna desarrollada por fondos privados son las regalías (Tabla 1) las cuales compensan la inversión realizada y asimismo dan cuenta del lucro al cual aspiran los inversionistas privados, por lo cual la evaluación de una producción propia es un imperativo en cualquier análisis de beneficio para la inversión de recursos públicos20,21. De otro lado esto reinauguraría una capacidad de producción local de vacunas contra la rabia, DPT, BCG, fiebre amarilla como la tuvo Colombia y que incluso exportaba vacuna de fiebre amarilla y rabia, entre otras22,23.
Nosotros proponemos que la hoja de ruta para la selección de la estrategia para Colombia de las vacunas para COVID 19, además de los criterios señalados de eficacia y seguridad, tenga en cuenta los costos y beneficios de las alternativas: 1) compra de vacuna fabricada en el extranjero; 2) compra de licencia y manufactura por el país; 3) desarrollo y producción propia.
En su artículo sobre los sesenta años de producción de vacuna antiamarilica el Profesor Groot (q.e.p.d) contaba lo siguiente: "La vacuna ha mantenido siempre sus condiciones de excelencia. Durante los últimos años se han preparado cantidades variables de 1 a 4 millones de dosis por año, según las necesidades del país. Sin embargo, el laboratorio está en capacidad de producir 8 a 10 millones anuales de dosis si tales cantidades fueran necesarias. Millones de personas han sido protegidas con la vacuna colombiana y a miles también se les ha evitado el morir dramáticamente"22. Al leer esto asaltan muchas preguntas como ¿en qué momento Colombia perdió esa capacidad de producción de vacunas? ¿Hemos logrado aumentar o reducir nuestra capacidad de autonomía biotecnológica? ¿Existe apoyo y voluntad política para ir hacia adelante y no retroceder en el desarrollo científico del país? ¿Tener la capacidad de desarrollar una vacuna debe ser considerada como parte de la estrategia de seguridad nacional?
Colombia se merece la oportunidad de desarrollar una vacuna para COVID 19. Cuenta con grupos de investigación en inmunología, ciencias biomédicas, bioinformática y ciencias clínicas con las capacidades para hacerlo24-26. También cuenta con reconocidos científicos liderando esfuerzos en estas áreas en otros países. Hay consenso dentro del reto de esta pandemia que existe una oportunidad para realizar esfuerzos que dejen una huella duradera para el desarrollo biotecnológico del país y su autonomía científica27. Las enormes consecuencias humanas y económicas deben convertirse en una oportunidad para corregir rumbos equivocados, como el no desarrollo de ciencia estratégica propia y la falta de una necesaria voluntad política para convertir la ciencia en la base para un desarrollo de una economía con alto valor agregado en sus productos28. Este paso requiere cuatro aspectos importantes, i) la creación y fortalecimiento de laboratorios regionales de referencia para el diagnóstico y monitoreo de enfermedades infecciosas y zoonóticas como se ha venido impulsando por el Ministerio de Ciencias con recursos del Sistema General de Regalías, ii) la potenciación de nuestra capacidad para trabajar con organismos de máxima seguridad dentro de laboratorios P3 y P4, iii) una reconfiguración de las prioridades estratégicas regionales dentro de un plan nacional y iv) la potenciación del capital intelectual de clústeres de investigación fomentado las asociaciones público-privadas. Debemos aprovechar como país la coyuntura actual que nos ha impuesto la pandemia del Covid-19 e incluir dentro de la reforma que se está realizando al sistema general de regalías, la posibilidad de invertir parte de los recursos destinados a la ciencia y tecnología para hacer realidad este clamor de la comunidad científica nacional y poder estar a la altura de las expectativas del ciudadano de a pie. La lección tiene que ser aprendida en toda su magnitud con una respuesta reflejada en inversión a corto, mediano y largo plazo, pues sin ella estaremos condenados a las consecuencias de las respuestas tardías y la dependencia de las buenas intenciones de otras naciones y empresas privadas a compartir sus desarrollos tecnológicos. Esto es un asunto de seguridad nacional29,30.