Descripción del caso
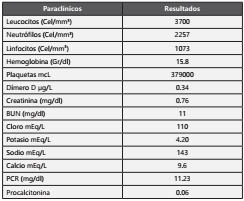
Se presenta un paciente masculino de 16 años, residente y proveniente de Bogotá con antecedentes de glomerulonefritis de cambios mínimos corticoideresistente diagnosticada por biopsia renal, hipercolesterolemia secundaria, catarata subcapsular por uso de corticoides, síndrome de Cushing, además antecedentes farmacológicos de uso de prednisona 10 mg cada día, ciclosporina y rituximab el año previo a este episodio con posterior remisión de la sintomatología. Se presentó al servicio de urgencias con picos febriles cuantificados de alrededor de 38 grados y paraclínicos adjuntos (Tabla 1), gases arteriales con pH 7.44 PCO2 30.1 PO2 84.7 HCO3 20.3 SO2 96.9 BE -2.3 LACTATO 2.6, la radiografía de tórax reportó engrosamiento del intersticio peribroncovascular parahiliar bilateral con opacidades heterogéneas en patrón de “vidrio esmerilado” de distribución difusa en ambos campos pulmonares de predominio derecho, se dio diagnóstico de síndrome broncoobstructivo y egresó con amoxicilina-clavulanato por 7 días, al día siguiente el paciente reconsulta con picos febriles cuantificados, persistencia de disnea, dolor pleurítico y cefalea holocraneana, posteriormente es revalorado presentando signos de dificultad respiratoria con ruidos respiratorios velados en ambas bases pulmonares, consideran el diagnóstico de enfermedad intersticial por ciclosporina, piden unos nuevos gases arteriales y una tomografía axial computarizada de alta resolución (TACAR) (Figura 1), se hace traslado al área de reanimación para monitorización continua, posteriormente el paciente presentó deterioro del estado general con signos de dificultad respiratoria y Pa02/ Fi02 con un trastorno moderado de la oxigenación (195), el paciente requirió intubación orotraqueal con necesidad de ventilación mecánica invasiva, en ese momento se consideró que había neumonía con criterios de severidad e indicaron manejo antimicrobiano con meropenem + vancomicina + trimetoprim-sulfametoxazol (TMP-SMX) además de necesidad de ingresó a UCI con diagnóstico de shock séptico SOFA: 6, se determinó el requerimiento de tomar una biopsia pulmonar, los cultivos de secreción orotraqueal salieron positivos para Pseudomonas aeruginosa, Streptococcus oralis/mitis y Neisseria sicca, se continuó manejo con Cefepime. Posteriormente hubo aumentó de opacidades en vidrio esmerilado y presencia de enfisema subcutáneo, la biopsia pulmonar evidenció la presencia de quistes de Pneumocystis Jirovecii y un parénquima pulmonar con septos alveolares engrosados con neumocitos reactivos y hemorragia en la luz alveolar (Figura 2), se inició TMP-SMX cada 6 horas por 21 días, con posterior evolución hacia la mejoría y egreso hospitalario 2 semanas después, continua en observación periódica por parte del servicio de nefrología e infectología.
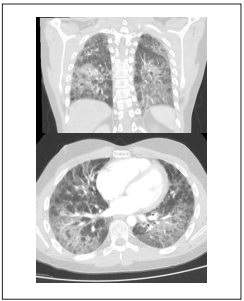
Figura 1 Opacidades intersticiales reticulares y micronodulares, distribuidas de manera difusa en ambos parénquimas pulmonares, de predominio en los tercios inferiores bilaterales, con áreas de aumento de densidad pulmonar en vidrio esmerilado, sin observar zonas francas de consolidación, ángulos costofrenicos libres.
Introducción
La neumocistosis se ha presentado desde hace varias décadas en pacientes con desnutrición severa y cáncer, actualmente, ha sido una de las principales enfermedades definitorias de SIDA en países desarrollados (en EE. UU, representa el 25%, en Europa el 17,3% de la prevalencia mundial en pacientes con HIV) y una de las causas más prevalentes en países en vía de desarrollo donde ocupa un lugar predominante junto con la candidiasis esofágica y la tuberculosis. Dentro del espectro del paciente inmunosuprimido no VIH, en Colombia no se conoce exactamente su prevalencia, en un hospital de cuarto nivel de atención en Medellín, Colombia, donde se incluyeron pacientes VIH positivos con diagnóstico confirmado de neumonía por Pneumocystis Jirovecii mediante tinción de plata metenamina en muestra de lavado broncoalveolar, se reportó una incidencia de 11,9%, la edad promedio fue 33,1 años y fue la enfermedad definitoria de síndrome de inmunodeficiencia adquirida en 5 pacientes (19,2%), el 15,2% era desconocedor de su condición de infección por VIH en esta serie 1, el desconocimiento de la prevalencia de la neumocistosis en pacientes sin VIH en el territorio Colombiano asociado a la ausencia de ensayos clínicos aleatorizados con alta evidencia para su tratamiento específicamente en el campo de la inmunosupresión, justificaria mayor investigacion en este campo.
Discusión
El conocimiento pleno de la casuística, comportamiento de la enfermedad y de un claro algoritmo diagnóstico es de gran importancia al reconocer nuevos grupos poblacionales a riesgo, en particular en pacientes sin infección por VIH. El punto final de esta revisión y el objetivo de exponer el presente caso clínico es reconocer diferentes herramientas diagnósticas, a manera de orientación sobre un abordaje claro y oportuno para evitar complicaciones conocidas en relación la neumonía en pacientes inmunosuprimidos VIH negativo, esto gracias a que no está estandarizado y posiblemente no se puede transpolar el conocimiento de esta condición en pacientes VIH.
Los principales factores de riesgo asociados a esta enfermedad tanto para su colonización y para su expresión mórbida son cuadros de inmunosupresión (VIH, recuento de CD4 bajo, cáncer, enfermedades autoinmunitarias, trasplante de órganos); fármacos inmunosupresores (corticoides, inhibidores del factor de necrosis tumoral-alfa [TNF-a] y otras terapias biológicas); EPOC y otros trastornos pulmonares crónicos incluyendo la falta de proteína A de surfactante encontrada en modelos murinos2. Además, los pacientes VIH negativo tienden a presentar un gradiente alveolar-arterial de oxígeno más amplio al momento de su diagnóstico y es más probable que requieran ventilación mecánica al momento de manifestarse la enfermedad3. Clínicamente la enfermedad se manifiesta con signos y síntomas tales como taquipnea, taquicardia, cianosis y crepitaciones finas; la presencia de disnea con inicio súbito y dolor torácico de tipo pleurítico obliga a descartar la presencia de neumotórax, aspecto clínico que ha sido reportado como manifestación inicial2. Dentro de los métodos de apoyo diagnóstico tales como histopatología con tinciones especiales y técnicas moleculares, cabe destacar un meta-análisis del año 2011 en el cual se concluyó que en pacientes con SIDA debido a la alta carga de microorganismos que ellos poseen, la identificación en fresco de estructuras típicas es de gran utilidad, se obtuvo con ella una especificidad y sensibilidad de 85% y 100%, y de 71% y 100% con las tinciones de Gomori-Grocott, con un VPN y VPP de 96% y 94%, respectivamente. Sin embargo, esta aproximación diagnostica puede tener menor rendimiento en pacientes VIH negativos con una carga de Pneumocystis Jirovecii menor, aunque sigue siendo la visualización con tinciones especiales el "Gold standard" para su diagnóstico, comparándola con técnicas más modernas como la PCR4; sin embargo, en la literatura encontramos que la amplificación del gen mtLSU rRNA, uno de los más usados como diana para fines diagnósticos no permite distinguir entre la colonización y la infección por Pneumocystis Jirovecii5. La imageno logía y las pruebas de difusión de monóxido de carbono han mostrado tener utilidad, en un estudio prospectivo encontraron que una radiografía de tórax normal sin cambios o con lectura dudosa y una TACAR de tórax sin opacidades en vidrio esmerilado descartaron la enfermedad en casi todos los casos. De forma similar, varios estudios han demostrado que una radiografía de tórax normal o sin cambios y una capacidad de difusión del monóxido de carbono con inspiración única (DLco) mayor del 75% de la predicha descartan casi por completo el diagnóstico de neumonía por Pneumocystis Jirovecii, es decir, poseen en combinación un alto valor predictivo negativo para descartar esta entidad6.
En cuanto al tratamiento, la terapia de primera línea en infección activa es trimetoprim-sulfametoxazol (TMP-SMX) (7. La dosis recomendada es de 15 a 20 mg/kg/día de TMP y 75-100 mg/kg/día de sulfametoxazol por 21 días en los pacientes con SIDA, sin embargo en los pacientes no VIH esto no está suficientemente estudiado, aunque consenso de expertos aceptan la recomendación de 14 días de duracion8. En diversos estudios realizados en pacientes inmunodeprimidos sin infección por VIH, los autores concluyeron que las personas con los siguientes factores de riesgo deben recibir profilaxis según la evidencia del riesgo sustancial: pacientes que reciben una dosis de glucocorticoides equivalente a ≥20 mg de prednisona por día durante un mes o más y otras causas de inmunodepresión (por ejemplo, ciertas neoplasias hematológicas o un segundo fármaco inmunosupresor) (9,10.
En pacientes con inmunosupresión no VIH se describió en una cohorte de 70 pacientes en China que hasta en un 54.3% de los casos puede coexistir una coinfección con Citomegalovirus (CMV) (11, la mayoría de estos pacientes estaban inmunosuprimidos con corticoides a altas dosis y neoplasias hematológicas en proceso de quimioterapia, llama la atención que las manifestaciones pulmonares de ambas infecciones por aparte son igual de inespecíficas , pero la presencia de nódulos centrolobulares en la TACAR llevaría a pensar más en una coinfección con Pneumocystis Jirovecii-CMV11. Aún en el siglo XXI es difícil dilucidar cuando hacer o no profilaxis para Pneumocystis Jirovecii en pacientes no VIH, sin trasplante de órgano sólido ni de precursores hematopoyéticos ni con neoplasias hematológicas, el grupo de Lewis White plantea que los pacientes mayores de 65 años,que presentan estructuralidad pulmonar y el uso crónico de corticoides podrían beneficiarse de estos, En pacientes reumatológicos que recibieron esteroides en dosis altas, la incidencia de neumocistosis y la mortalidad asociada después de 1 año se redujo mediante la profilaxis. La profilaxis fue bien tolerada con el número necesario de tratamiento para prevenir un caso de neumocistosis de (52, IC 95%: 33-124) menor que el número necesario para generar efectos adversos graves de (131, IC 95%: 55) (12. Hasta el momento, no se encuentran grandes estudios aleatorizados ni controlados donde se evalué la mejor forma de dar tratamiento con TMP-SMX en el contexto del paciente inmunosuprimido no VIH, no receptor de trasplantes ni con neoplasias hematológicas12.
Como conclusión, la infección por Pneumocystis jirovecii en pacientes sin VIH es un campo de batalla incierto, las técnicas diagnósticas y las conductas terapéuticas no están del todo validadas12. Además de que los cambios en la fisiología pulmonar en este grupo de pacientes hacen que la terapia coadyuvante con corticoides no sea de preferencia como se evidenció en un metaanálisis del año 2016 donde en 7 estudios observacionales el uso de corticoides en pacientes con diferentes tipos de inmunosupresión no VIH evidenció que no había cambios en mortalidad, necesidad de intubación, ingreso a unidad de cuidados intensivos y duración de estancia en unidad de cuidados intensivos13. Se requiere de investigación adicional para determinar cuáles son las mejores alternativas al momento de tratar a este tipo de pacientes en pro de disminuir la morbi-mortalidad asociada.