Introducción
Klebsiella pneumoniae es una especie de bacterias Gram (-), de morfología bacilar, que pertenece al orden Enterobacterales1,2.
Dos de los principales mecanismos de resistencia que desarrollan los bacilos de Klebsiella pneumoniae son la producción de enzimas Betalactamasas de Espectro Extendido (BLEE) y de enzimas Carbapenemasas. Las primeras, son capaces de inhibir la acción de cefalosporinas, penicilinas y monobactámicos; y las segundas, son efectivas para generar resistencia contra todos los betalactámicos, incluyendo carbapenémicos, cefalosporinas, penicilinas y monobactámicos1,3.
De acuerdo a un estudio SMART (Study for Monitoring An timicrobial Resistance Trends), en América Latina hubo una elevación considerable del número de casos de infecciones nosocomiales causadas por microorganismos productores de BLEE, hecho que se tradujo en aumentos de tasas de mor bimortalidad y de gastos para Salud Pública. Estos incremen tos, se deben por un lado, a que el cuadro clínico que oca siona este tipo de gérmenes puede comprometer múltiples sistemas (como circulatorio, digestivo, respiratorio, urinario e inclusive tejidos blandos) y por otro lado, a que la terapia antibiótica previa juega un rol fundamental (puesto que en pacientes medicados con antibióticos como cefepime, cef triaxona, ciprofloxacina e imipenem, la mortalidad se elevaría de 27,3% a una cifra de hasta 51,3%)1,4,5.
Los mecanismos de resistencia bacteriana, tienen implicancia en las Unidades de Cuidados Intensivos (UCI), a raíz de que estos mecanismos junto con otros atributos adaptativos, son los que favorecen la supervivencia de las especies bacteria nas como Klebsiella pneumoniae a condiciones desfavorables y consecuentemente, posibilitan su permanencia en el am biente intrahospitalario1.
En la actualidad no solo existe evidencia del aislamiento de Klebsiella pneumoniae en muestras de pacientes críticos, sino también en: personal de salud, habitación de pacientes, lava manos y fórmulas nutricionales, de UCI6,7,8,9.
Debido a lo expuesto, este estudio tiene como objeto eva luar la presencia y el perfil de resistencia de Klebsiella pneu moniae, en distintos tipos de muestras de una UCI, con la finalidad de valorar la permanencia del germen en el servicio.
Material y Método
Diseño y muestra
Este es un estudio observacional descriptivo, de corte transversal. El tipo de muestreo realizado fue no probabilístico, de casos consecutivos. Los datos se recopilaron entre los meses de octubre y diciembre del año 2019, en la Unidad de Cuidados Intensivos para adultos, del Hospital Regional de Coronel Oviedo ¨Dr. José Ángel Samudio¨.
Fueron incluidas todas las muestras que provenían de la UCI. Se recolectaron muestras de pacientes críticos (muestras bio lógicas de los internados en cuidados intensivos), de fórmulas enterales (nutrición enteral administrada a los pacientes, antes de cumplir 1 hora desde el inicio de su administración) y de ambiente interno (área de la UCI donde habitan los pacientes).
Respecto a las muestras biológicas, fueron incluidas todas las muestras de pacientes mayores de 18 años que ingresaron a la UCI estudiada, que poseían información correctamente documentada en las fichas clínicas (datos personales, histo ria clínica y datos bioquímicos; como fecha y origen de cada muestra de cultivo realizado). Además, de los tres tipos de muestras analizadas, fueron excluidas las muestras con los aislamientos de otra especie bacteriana diferente a Klebsiella pneumoniae.
Procesamiento de muestras
Para el análisis bioquímico de las muestras de pacientes, se realizaron cultivos (de: punta de catéter, líquido cefalorra quídeo, orina, sangre y secreción traqueal), utilizando como medio agar MacConkey.
Para evaluar las fórmulas enterales se utilizaron placas tipo Pe trifilm específicas para enterobacterias y en los casos positivos, se realizó reaislamiento en placas Petri con agar MacConkey.
Y para analizar el ambiente de la UCI, se usó la técnica de exposición de agar, en donde se ubicaron las placas tipo Petri (con agar MacConkey en su interior) en zonas estratégicas de la unidad, siendo expuestas durante un periodo de 3 horas, para luego cerrarse y ser trasladadas al laboratorio.
En las tres clases de muestras, cuando se observó crecimien to microbiano, se efectuaron pruebas bioquímicas (Citrato, L.I.A., M.I.O., O.N.P.G., Phe, S.I.M., T.S.I., V.P. y Ureasa); para determinar si se trataba de Klebsiella pneumoniae.
En las muestras en donde se identificó a la especie Klebsiella pneumoniae, se llevaron a cabo pruebas de sensibilidad, con los siguientes antibióticos: amikacina, amoxicilina clavuláni co, ampicilina, cefazolina, cefoxitina, ceftazidima, ceftriaxona, colistina, gentamicina, imipenem, meropenem, piperacilina tazobactam y trimetoprima sulfametoxazol.
Las pruebas de sensibilidad se realizaron con el método de disco difusión de Kirby- Bauer, en agar Mueller-Hinton. Para determinar el perfil de resistencia se tuvo en cuenta los pun tos de corte establecidos en el Clinical and Laboratory Stan dards Institute CLSI (2018) .
Finalmente, para la detección de producción de enzimas, se utilizaron los métodos de doble disco y disco combinado (empleando cefalosporinas de tercera generación y amoxicilina clavulánico) para las BLEE y el Método de Inactivación de Carbapenémicos (MIC), para las carbapenemasas.
Análisis de datos obtenidos
Los datos fueron cargados en planilla electrónica Microsoft Office Excel 2017©. Para el procesamiento estadístico, dichos datos se exportaron al paquete de software estadístico STATA 14.0® (Stata Corporation, College Station, Texas, USA). Las variables se expresaron utilizando frecuencias absolutas y relativas.
Resultados
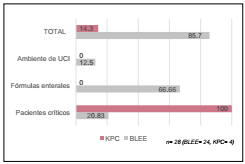
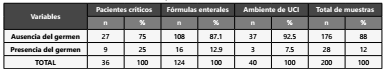
Se procesaron un total de 200 muestras, de las cuales; 124 (62%) correspondían a fórmulas de nutrición enteral, 40 (20%) provenían del ambiente interno de UCI y 36 (18%) pertene cían a pacientes críticos. Se constató presencia de Klebsiella pneumoniae en 28 (14%) Al clasificar los aislamientos, según el origen de la muestra, se observó crecimiento del germen en 9 (25%) de las muestras de pacientes críticos (subtipo de mues tra: 3 de orina, 3 de secreción traqueal, 2 de sangre, 1 de líqui do cefalorraquídeo), en 16 (12,9%) de las muestras de fórmu las enterales y 3 (7,5%) de las muestras del ambiente de UCI (Tabla 1). Luego, se interpretaron las pruebas de sensibilidad a los antimicrobianos y se obtuvieron los siguientes porcentajes de resistencia: 100% a amoxicilina clavulánico, cefazolina, ce foxitina, ceftazidima y ceftriaxona, 89,3% a gentamicina, 14,3% a imipenem, meropenem y piperacilina tazobactam, 7,1% a trimetoprima sulfametoxazol y 3,5% a amikacina.
Posteriormente, al evaluar la producción de enzimas, se constató producción de enzimas tipo BLEE en 24 (85,7%) de las muestras y producción de enzimas tipo carbapenemasas en 4 (14,3%) de las muestras. La distribución de estos por centajes, acorde a la procedencia de las muestras, se detalla en la Figura 1.
Además, se hizo una comparación de la respuesta a los antibióticos entre las muestras de pacientes, fórmulas enterales y ambiente de UCI; con presencia de Klebsiella pneumoniae productora de BLEE. En donde en todas las muestras se observaron perfiles con una respuesta común; resistencia a: amoxicilina clavulánico, cefazolina, cefoxitina, ceftazidima, ceftriaxona y gentamicina.
Por último, en los aislamientos con producción de carbapenemasas (de pacientes), se obtuvieron tres perfiles de respuesta antimicrobiana diferentes. El primero, Multidrogoresistente (MDR) en 2 (7,15%) aislamientos, con resistencia a: amoxicilina clavulánico, cefazolina, cefoxitina, ceftazidima, ceftriaxona, imipenem, meropenem, piperacilina tazobactam. El segundo, también MDR en 1 (3,57%) aislamiento, con perfil idéntico al primero, pero con la adición de resistencia a: trimetoprima sulfametoxazol. Y el tercero, Pandrogoresistente(PDR) en 1 (3,57%) aislamiento, con resistencia a: todos los antibióticos probados.
Discusión
En esta investigación se aisló Klebsiella pneumoniae en las tres clases de muestras analizadas de la UCI (pacientes críticos, fórmulas enterales y ambiente interno), resultado que se asemeja a los reportes de otros estudios. Como los informes de crecimiento de Klebsiella pneumoniae en cultivos de pacientes bajo cuidados intensivos10,11,12,13,14, los reportes de aislamiento de coliformes y/o Klebsiella pneumoniae en fórmulas nutricionales 7,8,15,16; y los informes de detección de enterobacterias y/o Klebsiella pneumoniae en centros hospitalarios y habitación de pacientes de UCI6,17).
La presencia de Klebsiella pneumoniae en las distintas clases de muestra, sugiere una diseminación y una probable colonización del germen en la UCI estudiada, conjetura que es coherente con la de diversos trabajos, en donde refieren colonización por Klebsiella pneumoniae en UCI y otros servicios hospitalarios18,19,20.
Respecto al perfil de resistencia antimicrobiana de los gérme nes aislados, en este estudio se constató mayor resistencia cefalosporinas (cefazolina, cefoxitina, ceftazidima y ceftriaxo na); resistencia que es cotejable con otros análisis realizados en Unidades de Cuidados Intensivos, donde se observaron resistencias de hasta 74 y 74,3% a las cefalosporinas13,21. Ade más, en esta investigación, se obtuvo una resistencia elevada a gentamicina; resultado que es comparable con un estudio que halló resistencia a gentamicina de hasta 62,4%21, pero que difiere con otros trabajos, donde el porcentaje superior de sus aislamientos, fue sensible a este antibiótico12,13,14.
En el caso de la resistencia a cefoxitina, en las cepas de Kleb siella pneumoniae aisladas, la misma pudo haberse presenta do, como consecuencia de mecanismos como la impermea bilidad de la membrana externa y/o la génesis de enzimas betalactamasas tipo AMP-C22,23.
Por otro lado, la alta resistencia a gentamicina, pudo haber se ocasionado, gracias a la trasferencia horizontal de genes de resistencia. Ya que acorde investigaciones, la resistencia a gentamicina en enterobacterias es generalmente plasmídica y puede adquirirse a través de plásmidos conjugativos, a par tir de bacterias ambientales no patógenas o cepas clínicas, portadoras de los mismos24,25,26.
En cuanto a la sensibilidad de los microorganismos analiza dos, la mayor sensibilidad se presentó al aplicar amikacina, sensibilidad que es similar a la de estudios hechos en UCI, que hallaron Klebsiella sensible a este antibiótico en cifras desde 88% hasta 100%13,14. Secundariamente, en este estudio se observó alta sensibilidad a: trimetoprima sulfametoxazol, imipenem y meropenem, respuesta que es semejante a la de otros trabajos, donde se obtuvieron porcentajes de sen sibilidad de 55,5% hasta 77% al aplicar trimetoprima sulfa metoxazol 12,14 y cifras superiores al 70% de sensibilidad al examinar los carbapenémicos12,13,14.
La obtención de una elevada sensibilidad a amikacina, pero alta resistencia a gentamicina, es comprensible; debido a que la efectividad de gentamicina como antibiótico, puede verse afectada por una mayor cantidad de mecanismos de resis tencia bacteriana, que el antimicrobiano amikacina22.
Referente a la producción de enzimas, en esta investigación se obtuvo un alto número de Klebsiella pneumoniae produc tora de BLEE, al igual que en análisis efectuados en Hospita les de países; como Argentina, Chile, Cuba y Perú5,10,12,20,21,27,28. Además, todas las cepas de Klebsiella pneumoniae BLEE de este estudio, presentaron respuesta común a los antibióticos examinados, comportamiento que podría deberse a la dise minación clonal entre los aislamientos 18.
Curiosamente en este trabajo, la producción de carbapene masas, solo se observó en muestras procedentes de pacien tes. Este hallazgo podría fundamentarse, en las mutaciones de genes cromosómicos o la adquisición de mecanismos plasmídicos, que las bacterias manifiestan cuando se en cuentran en el organismo de pacientes que reciben antibió tico terapia mal dirigida (empleo de antimicrobianos que los microorganismos son capaces de resistir, gracias a procesos de presión selectiva)29.
Entre las limitaciones de este estudio, se podría mencionar a la técnica empleada para recolectar las muestras ambientales, dado a que a pesar de que esta técnica es sencilla de efectuar y de bajo costo, es una técnica con una sensibilidad limitada y también porque puede alterarse a causa de fac tores externos, que sean capaces de influenciar en el creci miento de microorganismos, dentro del medio seleccionado.
Se considera recomendable, para profundizar aún más, sobre las resultantes de esta investigación, la realización de análisis de nivel molecular, con el fin de verificar la relación clonal de los aislamientos y los genes que codifican para betalactama sas y carbapenemasas.
No obstante, los aportes de este estudio, son significati vos como para colaborar con el recinto involucrado en los siguientes aspectos: a) alertar a la institución sobre la de tección de patógenos MDR Y PDR b) dar hincapié para que se refuercen los protocolos de desinfección y de manejo del plantel de la Unidad c) promover a que el personal médico direccione mejor la terapia antibiótica aplicada en pacientes críticos; y consecuentemente d) reducir el crecimiento de la especie bacteriana analizada.
Para concluir, se resalta que; si no se aplican de manera efectiva las medidas de higiene y prevención pertinentes, el servicio de UCI se convierte en un escenario predispuesto para la aparición de microorganismos resistentes, debido a la conjunción de tres factores, que actúan como determinan tes en la transferencia de genes de resistencia bacterianos. El primero, un entorno con condiciones propicias para el intercambio genético, debido a que el ambiente de UCI es considerado un punto crítico, por su posible alta densidad de bacterias, fagos y plásmidos30; el segundo, un medio de proliferación ideal, como lo son las fórmulas nutricionales, las cuales por tener proteínas, humedad y temperatura me dia, pueden favorecer a la replicación bacteriana; y el último factor, la presencia de un huésped susceptible, como lo son los pacientes críticos, los cuales frecuentemente suelen estar inmunocomprometidos, con terapia antibiótica previa y/o en tratamiento con antibióticos de amplio espectro, lo cual podría potenciar la patogenicidad del germen y facilitaría su multi-resistencia.