Introducción
Las Enterobacterias productoras de carbapenemasas (EPC) han tomado gran importancia a nivel mundial debido al au mento en tasas de morbi-mortalidad y en los costos hospi talarios. El tracto gastrointestinal es el principal reservorio de este tipo de microorganismos multirresistentes1,2,3. Tanto en pacientes adultos como en neonatos se ha evidenciado que la exposición prolongada a antibióticos de amplio espectro como cefalosporinas o carbapenémicos y la estancia prolon gada en unidades de cuidado intensivo (UCI) de adultos o Unidad de Cuidado intensivo Neonatal (UCIN) incrementan el riesgo de colonización por EPC 4,5,6,7.
Una de las estrategias primordiales de la vigilancia epide miológica activa, es la búsqueda de pacientes colonizados con EPC a través de la tamización con hisopado rectal. Una vez detectado el paciente portador de EPC, se deben ins taurar medidas de aislamiento apropiadas y procedimientos de descolonización, que conlleven a evitar su diseminación y posibles brotes8,9,10,11.
La implementación de técnicas rápidas para la tamización rectal en neonatos recobra gran importancia por el aumento de casos de colonización y su gran potencial de disemina ción en el ambiente hospitalario, que pueden desencadenar diferentes tipos de infecciones en el portador o en otros pa cientes neonatales, aumentando las tasas de mortalidad12. Incluso algunos estudios han demostrado que la implemen tación de estos cultivos de vigilancia activa contribuye a una disminución en el riesgo de infección, en las tasas de morbi-mortalidad y en la estancia hospitalaria10,11,13,14.
Para la tamización con hisopados rectales se han desarrollado diferentes métodos basados en agares cromogénicos, prue bas moleculares y técnicas como la nefelometría láser, que realizan la detección de EPC15,16. Adicionalmente, las pruebas basadas en inmunocromatografía nos permiten diferenciar el tipo de carbapenemasa presente, con una sensibilidad y especificidad reportadas del 100% en diversos estudios com parados con técnicas de biología molecular17,18,19.
A nivel mundial, existen pocos estudios de búsqueda y ca racterización de EPC en pacientes neonatos o pacientes pe diátricos, que demuestren la presencia y las tasas de colo nización a nivel intestinal, ya que la mayoría de los estudios se han enfocado en pacientes adultos5. De igual forma, en nuestro país, no existen estudios donde se analicen a neona tos portadores o colonizados.
Por lo anterior el objetivo de nuestro trabajo fue detectar la presencia de Enterobacterias productoras de carbapenemasas en hisopados rectales de neonatos colonizados mediante técnica rápida de nefelometría láser por nefelometría laser HB&L Carbapenemase Kit (Alifax®) y caracterización del tipo de carbapenemasa mediante test inmunocromatográfico RESIT- 3 O.K.N (Coris BioConcept®).
Materiales y métodos
Estudio descriptivo de corte transversal. Se estudiaron pacientes neonatos que ingresaron al servicio de UCIN de la Fundación Cardioinfantil, a quienes se les realizó un hisopado rectal para búsqueda de EPC, entre los meses de febrero a abril del año 2019. Criterios de inclusión: neonatos menores a 2 meses de edad, neonato remitido de otra institución e ingreso a UCI neonatal. Criterios de exclusión: neonatos sin orden de tamización, pacientes mayores de 2 meses de edad paciente sin orden de hospitalización en la institución.
Los hisopados rectales de cada neonato fueron tomados según protocolo institucional con un hisopo de dacrón, introduciendo un centímetro dentro del recto del paciente y tomando partículas de materia fecal y luego se colocaba este hisopo en el medio de transporte líquido eSwab de COPÁN® para ser llevados al laboratorio de microbiología donde se procesaron de la siguiente manera:
Procesamiento de hisopados rectales por técnica rápida HB&L CARBAPENEMASE KIT (Alifax®)
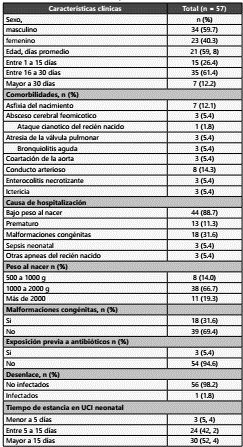
Se homogeneizó la muestra de hisopado rectal en vortex durante 1 minuto y se agregó 200 uL de muestra al vial con caldo BHI del kit y se adicionó 200 uL del reactivo del kit que consiste en una mezcla de antibióticos y antifúngicos que inhiben la microbiota acompañante. Finalmente, se ingresaron los viales en el equipo automatizado HB&L Light® durante un tiempo de 6 h. Al cabo de este tiempo, se observó el dato de positividad o negatividad que arroja el equipo y un valor del recuento de colonias expresado en UFC/mL. (Figura 1)
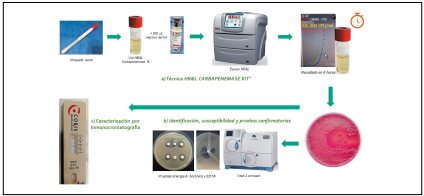
Figura 1 Montaje de hisopados rectales por técnica de nefelometría laser, identificación por sistema automatizado, pruebas fenotípicas confirmatorias (test de Hodge, sinergia con ácido borónico y sinergia con EDTA) y caracterización del tipo de carbapenemasa por ensayo inmunocromatográfico.
Pruebas de identificación, susceptibilidad y pruebas confirmatorias:
Los viales procesados por el equipo HB&L que arrojaron un resultado positivo se sembraron en agar MacConkey y se incubaron a 37ºC por 24 horas. Posteriormente, del cre cimiento de colonias, se realizaron pruebas de identificación bacteriana y perfil susceptibilidad con tarjetas AST-272 por sistema automatizado Vitek 2 Compact® (biomerieux).Tam bién se realizó Test de Hodge de acuerdo con las guías de Clinical Laboratory Standards Institute (CLSI) y pruebas de si nergia con ácido borónico y con EDTA, según los protocolos del Instituto Nacional de Salud de Colombia (INS). (Figura 1)
Caracterización del tipo de carbapenemasa mediante método inmunocromatográfico Lateral Flow RESIST-3 - O.K.N (Coris BioConcept®):
En un tubo de plástico se añade 10 gotas de la solución amortiguadora del kit, se agregaron tres colonias bacterianas con asa desechable según especificaciones del fabricante y se mezclaron homogéneamente. Luego se dispensó 3 gotas de esta suspensión en el pocillo de muestra del cassette. Se dejó correr la muestra por un tiempo máximo de 15 minutos y se realizó la lectura. (Figura 1).
Toma de cultivos ambientales de superficies y manos de personal asistencial:
Se realizó toma de muestras ambientales de superficies y de manos de personal asistencial con ayuda de un hisopo estéril y se colocaron dentro de un tubo con caldo tioglicolato. Es tos caldos nutritivos llevaron a incubación a 37ºC durante 2 horas. Posteriormente se procedió a realizar siembra en agar chocolate y agar sangre, según recomendaciones de la Se cretaría Distrital de Salud de Bogotá.
Controles de prueba: Controles positivos: K. pneumoniae ATCC BAA 1705 (blaKPC+), K. pneumoniae ATCC BAA 2146 (blaNDM+), y controles negativos K. pneumoniae ATCC 700603 y E. coli ATCC 25922.
Resultados
Encontramos un alto porcentaje de colonización rectal (22.9%) correspondiente a 13 muestras positivas mediante la técnica de nefelometría laser en un tiempo de 6 horas de incubación, obteniendo recuentos bacterianos comprendidos entre 50 UFC/mL y 10.000.000 UFC/mL. 44 muestras (77.1%) de hisopado rectal fueron negativas por nefelometría láser. El 50.9% (n=29) de los pacientes fueron de sexo femenino y el 49.9% (n=27) de sexo masculino, entre los 12 y los 49 días de vida (M= 24), todos nacidos a pretérmino en otras instituciones y remitidos a la UCIN de Fundación Cardio Infantil. Se describen diferentes condiciones clínicas de los neonatos en la tabla 2.
Por sistema Vitek 2 Compact® se obtuvo identificación de Klebsiella pneumoniae en los 13 hisopados rectales positivos por HB&L. El perfil de susceptibilidad realizado con tarjeta AST-272 reveló resistencia a carbapenémicos con MIC mayores a 4mg/dL en imipenem, meropenem y ertapenem. Las pruebas de Test de Hodge y prueba de sinergia con ácido borónico fueron positivos y sinergia con EDTA fue negativa en el 100% de los casos¸ indicando la presencia de carbapenemasas tipo serina (Tabla 1).
Tabla 1 Aislamientos de hisopados rectales de pacientes neonatos que ingresaron a UCIN y resultados de las pruebas pruebas fenotípicas confirmatorias (test de Hodge, sinergia con ácido borónico y sinergia con EDTA) y tipo de carbapenemasa presente detectada por ensayo inmunocromatográfico.
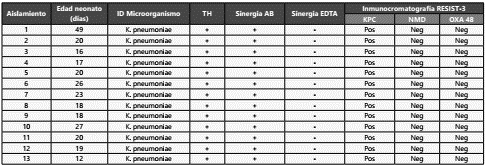
TH: test de Hodge; AB: ácido borónico. Pos: Positivo; Neg: Negativo.
BioConcept®) se evidenció la producción de carbapenemasa tipo blaKPC en los 13 aislamientos positivos (100%), ninguno para NDM (0%) y ninguno para OXA-48 (0%) (Tabla 1).
Los resultados positivos se informaron inmediatamente y el comité de infecciones tomó las medidas necesarias para evitar la diseminación de EPC: a) aislamiento inmediato de los neonatos colonizados, b) toma de cultivos ambientales de superficies, cultivos de manos del personal asistencial, c) limpieza y desinfección de la UCI neonatal, d) descolonización de los neonatos con aseo del área perianal con toallitas de clorhexidina acuosa al 2% según recomendaciones de la FDA (Food and Drug Administration) 20,21 e) restricción de ingreso de nuevos pacientes a la UCI neonatal.
Los cultivos de superficies y cultivos de manos del personal asistencial de la UCIN fueron negativos a las 72 horas de incubacion.
Discusión
Nuestro estudio demuestra que un porcentaje significativo de neonatos que ingresan a las UCIN se encuentran colo nizados con EPC en tracto intestinal, convirtiéndose en un riesgo potencial para su diseminación y llegar a desencade nar diferentes cuadros de infección en el portador o en otros pacientes, debido a su alta transmisibilidad1,12.
Dentro del ambiente hospitalario, especialmente en una uni dad de cuidado intensivo, es de alerta la circulación de estos microorganismos, pues las condiciones de los pacientes, ta les como dispositivos médicos, trasplantes de órganos y en especial el estado de inmunosupresión, son propicias para que se desarrolle una infección posterior12,22,23,24. De igual forma, la hospitalización previa o la estancia en UCI son unos factores de riesgo muy importantes relacionados a mayor colonización por microrganismos multirresistentes6,12,23.
En los neonatos que se encuentran en UCIN, el riesgo de morbi-mortalidad es aún más alto, por el gran compromiso de su estado inmunológico. Los últimos estudios muestran que los aislamientos de EPC en niños de los Estados Unidos, aumentó del 1,2% en el año 2001 a 4,6% en el 201112,25,26.
Aunque a nivel mundial no existen muchos estudios de EPC en la población neonatal, los datos epidemiológicos, los fac tores de riesgo y los resultados de EPC en población pediátri ca sugieren un comportamiento muy similar al estudiado en adultos, ya que se han reportado brotes por diferentes tipos de carbapenemasas, como el caso en una UCIN de California causado por blaIMP, en una UCIN en España por blaVIM y en una UCIN de Nepal blaNDM12,25,27,28,29. En Colombia también existe reportes de brotes en UCIN causados por K. pneumo niae productora de blaNDM, en el año 2011, los cuales per tenecían al clon ST104330.
En este estudio se logró demostrar que, además del alto porcen taje de colonización intestinal por EPC, Klebsiella pneumoniae productora de blaKPC es la principal Enterobacteria encontrada en neonatos, siendo detectada en el 22.9% de las tamizaciones que realizamos. De igual manera, se evidencia que la estrategia de tamización con hisopado rectal es muy útil para lograr su detección, como lo reportan Wiener y Buehlmann31,32,33.
Ben David y Kochar reportan una disminución en la inciden cia de EPC, cuando incluyeron cultivos de vigilancia rectal, al ingreso del paciente y semanalmente, en sus programas de control de infecciones31,34,35,36,37. Además, es de suma importan cia articular un programa de control de infecciones, donde el primer paso sea identificar rápidamente un paciente portador de EPC, seguido del inicio de medidas efectivas de aislamiento de pacientes y estrictos protocolos de limpieza y desinfección. De igual forma, se debe contar con un equipo de trabajo coor dinado, con comunicación efectiva y en tiempo real31.
En nuestro estudio, nosotros nos apoyamos con metodologías rápidas como la nefelometría laser para la oportuna detección de EPC en pacientes colonizados y también técnicas como la inmunocromatografia como método de confirmación del tipo de carbapenemasa presente, ambas metodologías con muy buena sensibilidad y especificidad frente a otros metodologías, ofreciéndonos múltiples ventajas en cuanto a rapidez, tiempo de detección, facilidad de montaje, y son costo-efectivas, según demostrado en estudios de comparación con otras técnicas en agar y pruebas moleculares38.
Es importante la implementación de estrategias de vigilancia activa como la tamización rectal para la detección oportuna de pacientes neonatos portadores de EPC en las unidades de cuidado intensivo neonatal y servicios de pediatría, apoyados con un programa de control de infecciones y con barreras de contención adecuadas, mediante el uso de nuevas tecnologías y metodologías rápidas, costo efectivas y asequibles, para lograr esa rápida detección y por ende un control en la diseminación y propagación de EPC.