Introducción
El género Malassezia comprende levaduras lipofílicas y lipo dependientes, comensales de la piel de humanos y animales, que pueden convertirse en patógenos cuando hay factores predisponentes como cambios en el microambiente cutáneo o alteración de los mecanismos de defensa del hospedero. Su principal característica es que en su genoma carecen de ge nes codificantes para la ácido graso sintasa, razón por la cual no sintetizan ácidos grasos de novo, lo que se manifiesta en el requerimiento de una fuente exógena de lípidos para su desa rrollo1. M. globosa, M. restricta, M. sympodialis y M. furfur emer gen en este orden como las especies más comúnmente aisla das de la biota cutánea normal en humanos y como agentes asociados a diversas patologías dermatológicas como pitiriasis versicolor, foliculitis, dermatitis seborreica, dermatitis atópica y psoriasis2. En sujetos con condiciones predisponentes pueden causar infecciones sistémicas, particularmente en recién naci dos pretérmino de bajo peso con comorbilidades propias de la prematurez, hospitalizados en la Unidad de Cuidados Inten sivos Neonatal (UCIN), con tratamiento antibiótico de amplio espectro, nutrición parenteral total (NPT) prolongada con su plementación lipídica y catéteres venosos centrales (CVC) 3.
La información acerca de las fungemias por este microorganis mo es limitada, sin embargo, la mayoría de infecciones invasivas reportadas en la literatura han sido asociadas con M. furfur y con la especie zoofílica M. Pachydermatis3. Existen pocos re portes de colonización de catéteres venosos y fungemia por M. sympodialis en la literatura médica4-7, a pesar que esta especie se considera que habita en la piel humana saludable, principalmente del dorso y tórax, pero también en otras áreas corporales como el conducto auditivo, y ha sido aislada de piel con pitiriasis versicolor8. Se presenta un caso de fungemia por M. sympodialis en un recién nacido hospitalizado en la UCIN de un hospital colombiano con sospecha clínica de sepsis neonatal.
Descripción del caso
Recién nacido pretérmino de sexo masculino, 36 semanas de edad gestacional, proveniente del municipio de La Virginia (Ri saralda). Madre de 24 años de edad, segundo embarazo con controles prenatales adecuados y ruptura de membranas de 2 horas de evolución, remitida a hospital de tercer nivel de la ciudad de Pereira por parto pretérmino. Nacimiento por parto vaginal eutócico. El recién nacido es trasladado a la UCIN por signos de dificultad respiratoria y desaturación para soporte ventilatorio mecánico, con un peso de 2,965 gramos, talla de 48 cm y perímetro cefálico de 32 cm. Al ingreso presenta ale teo nasal y tirajes subcostales. Se realiza un hemograma que reporta leucocitosis leve y una radiografía de tórax que mues tra infiltrados intersticiales en ambos campos pulmonares.
Se diagnostica síndrome de dificultad respiratoria del recién nacido, por lo cual se le realiza intubación orotraqueal y ad ministración de surfactante pulmonar. Además, se considera riesgo de sepsis por corioamnionitis materna, por lo cual se solicitan hemocultivos para gérmenes comunes y se inicia ampicilina 300 mg IV cada 12 horas y gentamicina 12 mg IV cada 24 horas por 5 días. El paciente no recibió NPT con suplementación lipídica ni se le colocó CVC.
Durante la hospitalización el paciente desarrolló hipertensión pulmonar leve e ictericia neonatal tardía. Sin embargo, fue dado de alta a los 16 días por mejoría de su cuadro respirato rio, sin soporte de oxígeno, tolerando la vía oral, con signos vitales, gasto urinario y glucometría dentro de los paráme tros normales para la edad.
Dentro de los exámenes realizados se extrajeron 2 ml de san gre periférica adicionales y se depositaron en botellas de he mocultivo con caldo BHI (MDM Científica), glicerol (Sigma-Al drich) 0,1% m/v y Tween 80 (Sigma-Aldrich) 0,0025% m/v9. Se realizaron frotis de piel con un hisopo estéril humedecido en 2 ml de agua con Tween 80 al 0,05%2. Estas muestras fueron incubadas a 32°C durante 5 días en el laboratorio del hospital y posteriormente trasladadas al laboratorio de Microbiología de la Fundación Universitaria Autónoma de las Américas. La muestra de frotis de piel fue sembrada inmediatamente en agar Dixon modificado (agar Mycosel [BD] 36 g L-1, Oxbile [Sigma-Aldrich] 20 g L-1, extracto de malta [Oxoid] 36 g L-1, glicerol [Sigma-Aldrich] 2 mL L−1, ácido oleico [Sigma-Aldrich] 2 mL L−1 y Tween 40 [Sigma-Aldrich] 10 mL L−1) e incubada a 32°C durante 5 días. Dado que las botellas de hemocultivo no presentaban turbidez, se incubaron a 32°C durante 5 días más, momento en el cual se observó turbidez en el medio, se realizó subcultivo en agar Dixon modificado y se incubó a 32°C por otros 5 días. Pasado este tiempo, en la superficie del agar se obtuvieron colonias sugestivas de Malassezia spp. por sus características macroscópicas y microscópicas (Fig. 1A y 1B). Este resultado fue informado inmediatamente al labora torio del hospital, sin embargo, el paciente ya había sido dado de alta, por lo cual no recibió tratamiento antifúngico empí rico. El cultivo de frotis de piel fue informado como negativo.
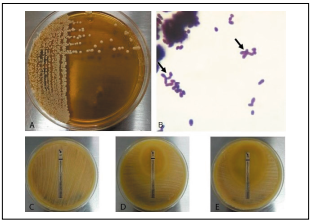
Figura 1 Caracterización microbiológica de M. sympodialis aislada de sangre. A) Cultivo en agar Dixon modificado que muestra colonias cremosas, color marrón, elevadas, de bordes regulares. B) Tinción de Gram que muestra células levaduriformes y blastoconidias con gemación simpodial (flechas), 100X. C) Prueba de susceptibilidad antifúngica con anfotericina B que muestra CIM de 2,0 ug/ml. D) Prueba de susceptibilidad antifúngica con fluconazol que muestra CIM de 6,0 ug/ml. E) Prueba de susceptibilidad antifúngica con voriconazol que muestra CIM de 0,064 ug/ml.
Para la identificación a nivel de especie no se llevaron a cabo acercamientos fenotípicos, ya que estas pruebas a menudo no permiten la diferenciación de Malassezia spp. íntimamente relacionadas, y por esto las herramientas moleculares deben ser usadas en estudios epidemiológicos y ecológicos, así como en aspectos de la patogénesis y enfermedades causadas por miembros de este género10. Por lo anterior, este aislamiento fue sometido a un protocolo de extracción de ADN mediante un kit comercial (Norgen) según las indicaciones del fabricante. Posteriormente se realizó amplificación de las regiones blanco 5.8S ADNr-ITS2, utilizando los iniciadores ITS3 (5’-GCATCGATGAAGAACGCAGC-3’) e ITS4 (5’-TCCTCCGCTTATTGATATGC-3’)11,12, y 26S ADNr, utilizando los iniciadores 5’-TAACAAGGATTCCCCTAGTA-3’ y 5’-ATTACGCCAGCATCCTAAG-3’12,13, mediante una PCR convencional previamente estandarizada14. Como control se utilizaron las cepas de referencia M. Furfur CBS 7019, M. pachydermatis CBS 1879 y M. slooffiae CBS 7956, amablemente donadas por el Grupo de Investigación Celular y Molecular de Microorganismos Patógenos (CeMoP) de la Universidad de los Andes. Los productos de amplificación se evidenciaron mediante electroforesis en geles de agarosa al 2% y fueron enviados para su purificación y secuenciación a Macrogen ® Inc. (http://www.macrogen.com). Las secuencias de ADN fueron editadas y ensambladas manualmente usando el programa Geneious v7.0.6. (http://www.geneious.com). La secuencia consenso obtenida con la región 5.8S ADNr-ITS2 tiene 398 pb y número de acceso GenBank MT648822, mientras que la obtenida con la región 26S ADNr tiene 567 pb y número de acceso GenBank MT648771. Posteriormente fueron comparadas con las secuencias depositadas en la base de datos del GenBank mediante la herramienta BLASTn del NCBI (https://www.ncbi.nlm.nih.gov/BLAST/). El aislamiento fue identificado como M. sympodialis para ambos genes ribosomales con un 100% de identidad.
Se realizó prueba de susceptibilidad antifúngica a este aislamiento por el método de difusión en agar (epsilométrico) de acuerdo al documento M44-A2 del Clinical and Laboratory Standards Institute (CLSI)15 con algunas modificaciones para cumplir los requerimientos nutricionales del género Malassezia16, teniendo en cuenta que varias publicaciones comparando las técnicas de microdilución en caldo y E-test® han demostrado que este último es un método diagnóstico confiable para uso rutinario en los laboratorios de micología clínica17,18. Los antifúngicos utilizados fueron anfotericina B y voriconazol en una concentración de 0,002-32 ug/ml, y fluconazol 0,016-256 ug/ml. Debido a que no se han definido puntos de corte para categorizar aislamientos de Malassezia spp., se utilizaron los correspondientes para Candida spp15. Como controles de calidad se emplearon las cepas Candida parapsilosis ATCC 22019 y C. krusei ATCC 6258. Se obtuvo una Concentración Inhibitoria Mínima (CIM) de 0,064 ug/ml para voriconazol (susceptible), 6,0 ug/ml para fluconazol (susceptible) y 2,0 ug/ml para anfotericina B (resistente) (Fig. 1C-E). El hallazgo, confirmación y susceptibilidad de este microorganismo fue reportado posterior al egreso del paciente de la institución de salud, por lo que no recibió terapia antifúngica específica. Cabe resaltar que los hemocultivos para otros gérmenes fueron negativos.
Discusión
El primer caso de Malassezia spp. como agente etiológico de infecciones del torrente sanguíneo y sepsis fue reportado a principios de la década de los 80 en Ohio, Estados Unidos, en un recién nacido recibiendo NPT a través de CVC. Durante las dos décadas pasadas se han reportado casos de infecciones invasivas por Malassezia spp. en UCIN, particularmente en neo natos recibiendo lípidos intravenosos. Existen investigaciones acerca de la colonización de líneas venosas centrales por Ma lassezia spp. que han demostrado tasas de colonización de 2.4- 32% en neonatos críticamente enfermos3. Es de resaltar que el paciente del caso reportado no tenía presencia de CVC ni NPT rica en lípidos, lo que sugiere que existen otros factores de ries go importantes para fungemia por Malassezia spp.
Malassezia spp. puede ser aislada a partir de la piel del 3% de recién nacidos a término no hospitalizados, pero 30-64% de neonatos prematuros hospitalizados son colonizados por esta levadura. Similarmente se ha reportado que el 28% de recién nacidos en una UCIN pueden ser colonizados en la primera semana de vida, mientras que el 84% de neonatos mayores de 7 días hospitalizados en estas Unidades, tienen cultivos de piel positivos para M. furfur19. Lo anterior indica que la colonización cutánea en neonatos está asociada con una menor edad gestacional, la admisión a la UCIN y la dura ción de la hospitalización, y esta condición parece ser un pre rrequisito para la fungemia3. A pesar de lo anterior, en este paciente no se aislaron levaduras del género Malassezia en los frotis de piel. Esta ausencia de crecimiento podría deberse a pérdida de viabilidad de la levadura durante el prolonga do tiempo de incubación, y no fue posible tomar una nueva muestra por el alta hospitalaria del paciente. Además, es bien sabido que estos microorganismos son de difícil aislamiento, ya que las colonias de Malassezia spp. frecuentemente pasan desapercibidas a causa de su pequeño tamaño9. Por tanto, creemos que el origen más probable de la fungemia de este paciente fue la diseminación de la levadura desde la piel has ta el torrente sanguíneo a través de los catéteres periféricos.
Los factores de riesgo para infecciones invasivas por Malas sezia spp. en neonatos reportados en la literatura científica son entre otros, las comorbilidades de la prematurez, la ad misión a UCIN, el uso de tratamiento antibiótico de amplio espectro, la NPT prolongada con suplementación lipídica y la presencia de CVC. Los criterios clínicos y de laboratorio para su diagnóstico incluyen fiebre persistente que no responde a antibióticos, alteraciones en el recuento de glóbulos blancos y plaquetas, y cultivos de rutina negativos3. Muchos de estos factores predisponentes y hallazgos paraclínicos estuvieron presentes en este paciente, y la fungemia por Malassezia spp. se confirmó como lo recomiendan algunas revisiones3, por la presencia de levaduras con morfología característica de este género a partir de frotis sanguíneos y hemocultivo positivo en medios micológicos especializados.
Aunque no existen recomendaciones de tratamiento basadas en la evidencia para infecciones invasivas por Malassezia spp., se han utilizado triazoles intravenosos o anfotericina B, mien tras que flucitosina y las equinocandinas parecen ser inacti vas3; sin embargo, algunas publicaciones han documentado valores elevados de CIM para anfotericina B en las pruebas de susceptibilidad in vitro, como lo es el caso del trabajo de Velegraki et al. que evaluó la sensibilidad de ocho especies de Malassezia frente a diferentes azoles y anfotericina B me diante microdilución y E-test, encontrando valores de CIM ≥ 16 ug/ml para anfotericina B en M. furfur, M. restricta, M. glo bosa y M. slooffiae17; el estudio de Galvis et al. que evaluó la actividad antifúngica in vitro de azoles y anfotericina B frente a 20 aislamientos clínicos de M. furfur por el método de mi crodilución y E-test, encontrando que el 70% de aislamientos fueron resistentes para anfotericina B por la técnica de refe rencia16; y la revisión de Theleen et al. que afirma que uno de los antifúngicos menos activos in vitro contra Malassezia spp. es anfotericina B, la cual mostró amplios rangos de CIM para M. furfur, M. sympodialis y M. globosa1, a pesar del éxito tera péutico observado en algunos reportes de caso al utilizar este antifúngico6,7. Todo lo anterior concuerda con los resultados de susceptibilidad obtenidos en este aislamiento donde tam bién se observaron valores altos de CIM para anfotericina B.
La información acerca de las fungemias por levaduras del gé nero Malassezia es limitada, sin embargo, la mayoría de in fecciones invasivas publicadas han sido asociadas con M. fur fur y M. pachydermatis3, a diferencia de lo encontrado en este informe de caso donde se aisló M. sympodialis. Existen pocos reportes de fungemia producida por esta especie, como por ejemplo el caso de un hombre de 63 años con CVC después de gastrectomía total por cáncer gástrico4, la colonización de CVC en el 1.8% de pacientes pediátricos hospitalizados en UCI de Argentina5, un niño de 7 años asmático con corticos teroides inhalados hospitalizado por complicación quirúrgi ca de apendicectomía6, y más recientemente, un hombre de 34 años con un sistema de acceso venoso Port-a-Cath® que desarrolló tos, nódulos pulmonares, fiebre y eosinofilia7, los dos últimos casos tratados exitosamente con anfotericina B. Todos estos reportes concuerdan en que M. sympodialis es una levadura subestimada como causa de fungemia en indi viduos con factores predisponentes.
En conclusión, esta es la primera vez que se reporta M. sym podialis como causa de fungemia en un recién nacido hospitalizado con sospecha clínica de sepsis neonatal en Colombia. Se recomienda realizar hemocultivos con suplementación li pídica en neonatos pretérmino, en tratamiento con antibióti cos de amplio espectro y cuyos hemocultivos de rutina sean negativos. En los hemocultivos que se obtengan aislamientos de Malassezia spp., utilizar antifúngicos del grupo de los azo les para el tratamiento de las fungemias producidas por este agente en caso de no ser posible la realización de pruebas de susceptibilidad. Los resultados de este informe señalan la importancia de llevar a cabo futuros estudios tendientes a optimizar el medio para hemocultivos que permita la recu peración eficiente de levaduras lipodependientes, y realizar investigaciones que determinen la prevalencia de sepsis neo natal por Malassezia spp. a nivel regional y nacional.














