Introducción
La Enfermedad por Coronavirus 2019 (COVID-19) fue reportad por primera vez el 12 de diciembre de 2019 en Wuha (Provincia de Hubei, República Popular de China), en un grupo de 27 pacientes, siete de ellos en condiciones críticas, quienes cursaron con una neumonía viral y compartían como noción de contacto un mercado mayorista1,2. Días después, identificaron como agente etiológico a un virus emergente con alta capacidad zoonótica denominado SARS-CoV-2, para el cual, el desarrollo de pruebas diagnósticas ha sido imperioso3,4.
El diagnóstico de la infección por SARS-CoV-2 se realiza basado en criterios clínicos y pruebas diagnósticas las cuales buscan documentar directa o indirectamente la presencia del virus6. Para la determinación del virus, se pueden realizar dos grupos de pruebas, aquellas que detectan ácidos nucleicos (ARN viral) o antígenos del virus (nucleoproteína viral); y aquellas pruebas que detectan los anticuerpos específicos contra el virus3-5. Las primeras técnicas desarrolladas fueron aquellas que detectaban el material genético del virus en muestras de secreciones respiratorias, las cuales, se han convertido en el estándar de oro para la detección del virus6,7.
Debido al impacto global generado por la reciente pandemia asociada a SARS-CoV-2, el desarrollo de técnicas diagnósticas para su identificación, como paso inicial para su prevención y control, ha sido una necesidad para la salud pública; sin embargo, esta situación se dificulta cuando el rendimiento de estas pruebas no es adecuado, presentando un porcentaje significativo de falsos negativos6. Actualmente, se considera a la detección del virus vía RT-PCR como prueba diagnóstica y de seguimiento recomendada, con una sensibilidad del 80% y especificidad del 99%, aproximadamente. Esta prueba detecta secuencias únicas de ARN por amplificación de ácidos nucleicos (NAAT) (genes virales N, E, S, RdRP). Otro factor que condiciona el rendimiento de la prueba es la muestra que será analizada, de modo que, las muestras del tracto respiratorio inferior (lavado bronco-alveolar, aspirado traqueal e hisopado de hipofaringe) tienen mayor probabilidad de detectar partículas virales en comparación a muestras del tracto respiratorio superior (hisopado nasofaríngeo o nasal)6. La sensibilidad de la prueba RT-PCR varía dependiendo del tipo de muestra utilizada para el diagnóstico: lavado bronco-alveolar (93%), aspirado bronquial o esputo (72%) e hisopado naso y orofaríngeo (63%)5,6.
La evidencia actual, sugiere que a partir del día 10 del inicio de síntomas, la probabilidad de detectar partículas virales en muestras respiratorias comienza a disminuir progresivamente, de modo que, un paciente con alta sospecha clínica y resultado negativo, obliga a repetir la prueba o utilizar pruebas complementarias6-10. Las pruebas serológicas de detección IgM/IgG pueden ser utilizadas en casos de dudas, para investigación y para evaluaciones retrospectivas de la tasa de ataque, casos en los cuales, su medición debe ser pareada (en fase aguda y convaleciente), previa validación, para garantizar un rendimiento diagnóstico mínimo con una sensibilidad del 85% y una especificidad del 90% comparado con RT-PCR6-8.
El individuo asintomático infectado, presintomático o con resolución de síntomas puede ser fuente de transmisión si no se encuentra en cuarentena, en esta población, podría ser util la realización de pruebas serológicas IgM/IgG, las cuales podrían repetirse cada 4 semanas6,7. La implementación de protocolos diagnósticos que incluyen pruebas serológicas han logrado una sensibilidad de 88% conservando la especificidad del 90%10, siendo capaz de detectar IgM a partir del día 5 (RIQ 3-6)11 e IgG a partir del día 14 (RIQ 10-18)6,11. En Colombia, el rendimiento de las pruebas rápidas serológicas parece ser inadecuado antes del día 11, sin embargo, después del día 11 la sensibilidad y especificidad para IgM son de 75% y 94% respectivamente, mientras que para IgG son de 83,3% y 100 respectivamente6-8.
La Asociación Colombiana de Infectología recientemente recomendó la utilización de pruebas moleculares (RT-PCR) para el diagnóstico de infección por SARS-CoV-2 antes del día 10, y en casos posteriores, si la RT-PCR es negativa, realizar al día 14 pruebas de detección de IgM/IgG si se considera un caso probable de infección por SARS-CoV-26,8,9. Comprendiendo la problemática de salud pública ocasionada por el brote de Coronavirus 2019 (COVID-19), y los problemas asociados al rendimiento y costos de las pruebas12,13, se realizó este estudio orientado a la validación de una prueba diagnóstica serológica rápida utilizada en el departamento de Risaralda, Colombia.
Materiales y métodos
Se realizó un estudio de corte transversal que validó una prueba serológica utilizada en el departamento de Risaralda (Colombia) como pruebas diagnósticas para infección por SARS-CoV-2. Se incluyeron muestras de un biobanco de sueros, seleccionadas por conveniencia, correspondientes a adultos mayores, trabajadores de la salud de la ciudad de Pereira, Colombia, quienes tuvieron sospecha clínica y epidemiológica de infección por SARS-CoV-2 desde el 15 de marzo hasta el 30 abril de 2020, quienes autorizaron su participación en el estudio. La selección fue realizada por conveniencia. No hubo criterios de exclusión. El procesamiento y validación de las pruebas fue realizado en las instalaciones de la Universidad Tecnológica de Pereira por personal capacitado, teniendo en cuenta todas las instrucciones de uso de la prueba registradas por el desarrollador en el inserto del kit.
Procesamiento de la prueba
Para llevar a término la validación, los kits se almacenaron a temperatura ambiente y protegidos de la luz solar directa. Los kits utilizados por caja de 25 unidades registraron fecha de vencimiento del 25/10/2022, con número de lote 20036668 y buffer de dilución con la misma fecha de vencimiento y con número de lote 03/2022. Las muestras se encontraban almacenadas a -70°C bajo medidas rigurosas para la preservación de estas en el Laboratorio de Biología Molecular y Biotecnología de la Universidad Tecnológica de Pereira.
Para iniciar el procesamiento, los sueros fueron descongelados a temperatura de refrigeración (5 ± 3°C), y posteriormente a temperatura ambiente (14 ± 7°C) hasta el momento del montaje. Como parte del protocolo, previo al montaje de cada muestra, se verificó que el empaque del dispositivo estuviera sellado correctamente y no presentara ninguna anormalidad; posteriormente se marcó cada dispositivo en la parte superior con el número de la muestra correspondiente para cada vial. Posteriormente se procedió a homogenizar la muestra manualmente, se tomaron 10 μl de suero con ayuda de una micropipeta Eppendorf (equipo calibrado) y depositándolos en el sitio de adición de la muestra del dispositivo, e inmediatamente se depositaron dos gotas de tampón de detección en el sitio del dispositivo destinado para este fin. Después de 15 minutos de incubación a temperatura ambiente, se procedió a la lectura de la prueba. Los resultados fueron evaluados por dos observadores, quienes recibieron el mismo entrenamiento, pero realizaron el registro en diferentes momentos, se contó con una concordancia de k=1, teniendo como base de interpretación lo descrito por los fabricantes de la prueba en el inserto, por lo cual, la interpretación del observador no podía variar. Se consideraron 2 evaluadores para evitar errores en el registro. Todas las pruebas se evaluaron en el Laboratorio de Biología Molecular y Biotecnología de la Universidad Tecnológica de Pereira.
Recolección de la información y análisis estadístico
La información se registró en una base de datos específica para la validación de la prueba en medio magnético. Los registros fueron sometidos a control de calidad de la información durante la obtención, compilación y procesamiento de los datos para su validación y análisis por parte de personal capacitado y los autores de esta investigación. Se analizaron medianas y rangos intercuartílicos (RIQ) de las variables continuas y discretas. Las variables nominales se analizaron a través de frecuencias absolutas y relativas. Se calculó la sensibilidad y especificidad de las pruebas rápidas serológicas IgM/IgG usando como prueba de oro la RT-PCR. Esta evaluación se realizó utilizando la metodología de curvas ROC (Receiver Operating Characteristic Curves). Los mejores puntos de corte correspondieron a los días con el mayor porcentaje de individuos correctamente clasificados. Todos los análisis fueron realizados con el software estadístico STATA 14,2 en su versión oficial.
Resultados
Se incluyeron 144 muestras, correspondientes a 144 profesionales de la salud de la ciudad de Pereira, Colombia, quienes tuvieron sospecha clínica y epidemiológica de infección por SARS-CoV-2 en un período comprendido entre el 15 de marzo y el 30 de abril 2020. La edad mediana fue 31 años con un rango intercuartílico entre 26 y 39 años; El 41,7% presentaba algún síntoma al momento de la prueba.
Análisis de los grupos de estudio para IgM
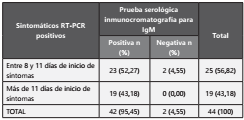
De un total de 144 muestras evaluadas con RT-PCR (44 positivas y 100 negativas), 54 muestras fueron positivas para SARS-CoV-2 con la prueba rápida y 90 muestras fueron clasificadas como negativas, para anticuerpos tipo IgM, tal como se muestra en la Tabla 1.
Tabla 1 Clasificación diagnóstica de los grupos en estudio para prueba rápida de IgM en el departamento de Risaralda, Colombia.

De acuerdo con la fecha de inicio de síntomas el grupo de pacientes sintomáticos con RT-PCR positiva (n=44), fue dividido en dos grupos para el análisis, considerando la fecha de inicio de síntomas: i) entre 8 y 11 días y ii) más de 11 días. 54 muestras fueron clasificadas por la prueba serológica rápida como positivas y 90 como negativas tal como se evidencia en la Tabla 2.
Análisis de los grupos de estudio para IgG
De un total de 144 muestras evaluadas con RT-PCR, 55 muestras fueron positivas para SARS-CoV-2 con la prueba serológica rápida "AMP Rapid Test SARS-CoV-2 IgG/IgM- Cassettes" y 89 muestras fueron clasificadas como negativas, para anticuerpos tipo IgG por esta prueba tal como se puede observar en la Tabla 3.
Tabla 3 Clasificación diagnóstica de los grupos en estudio para prueba rápida de IgG en el departamento de Risaralda, Colombia.

De acuerdo con la fecha de inicio de síntomas el grupo de pacientes sintomáticos con RT-PCR positiva (n=44), fue dividido en dos grupos para el análisis, considerando la fecha de inicio de síntomas: i) entre 8 y 11 días y ii) más de 11 días. 40 muestras fueron clasificadas por la prueba serológica rápida como positivas y 4 como negativas tal como se observa en la Tabla 4.
Tabla 4 Clasificación diagnóstica del grupo de pacientes sintomáticos para la prueba de IgG en el departamento de Risaralda, Colombia.

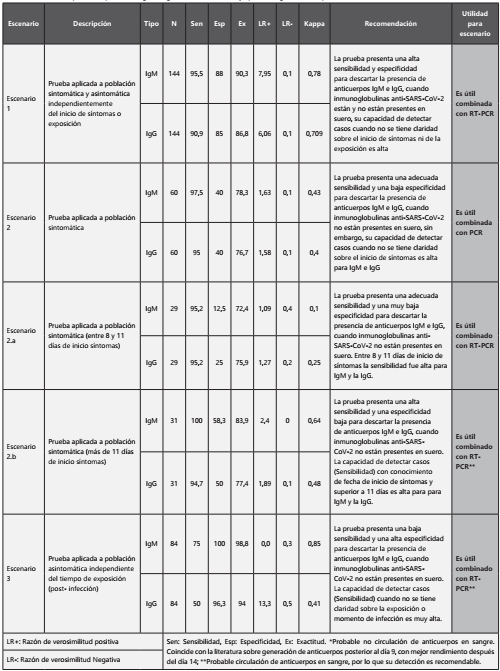
Las pruebas serológicas rápidas evidenciaron ser útiles para identificar o descartar la presencia de anticuerpos IgM e IgG, tanto en pacientes sintomáticos como asintomáticos, tanto cuando no se tiene claridad sobre la exposición o el momento de la infección, como cuando el inicio de los síntomas es superior a 11 días. Las recomendaciones sobre la utilidad de pruebas serológicas según los hallazgos de nuestro estudio se muestran en la Tabla 5.
Discusión
En nuestro conocimiento, este es el primer estudio realizado para validar las pruebas serológicas rápidas utilizadas en el departamento de Risaralda, Colombia. Nuestro estudio estableció la sensibilidad y especificidad de utilizar pruebas serológicas rápidas en pacientes adultos para identificar o descartar la presencia de anticuerpos IgM e IgG, en casos sintomáticos y asintomáticos, tanto cuando no se tiene claridad sobre la exposición o el momento de la infección, como cuando el inicio de los síntomas es superior a 11 días.
Día a día, el uso de pruebas rápidas es cada vez más frecuente, no sólo por la rapidez de sus resultados, sino también por los bajos costos asociados. Estas pruebas se dividen en pruebas rápidas moleculares y pruebas rápidas serológicas; estas últimas han generado expectativa sobre su utilidad masiva para el control y la prevención de la propagación del virus14-16, puesto que, el riesgo latente de falsos negativos o falsos positivos en las pruebas de RT-PCR17-20, sugieren la aplicación de pruebas alternativas y complementarias a las pruebas moleculares RT-PCR para uso masivo, especialmente en el cribado de individuos ya expuestos a la infección, quienes son considerados como no susceptibles, para priorizar su retorno a actividades laborales en comunidad, especialmente, aquellas consideradas de alto riesgo para adquirir COVID-196. De esta manera, la detección de anticuerpos en población laboralmente activa, es crítica en el marco de la vigilancia epidemiológica de la actual pandemia, especialmente en países de bajos y medianos ingresos, como el caso de América Latina6,14,15.
Las pruebas serológicas permiten la identificación de anticuerpos específicos contra antígenos del virus generados a partir de la respuesta inmunológica del individuo, las proteínas estructurales de nucleocápside (N) y la proteína de espiga (S) son las más frecuentemente identificadas por su papel inmunogénico6. Adicionalmente, las pruebas serológicas juegan un papel fundamental en la investigación de enfermedades infecciosas y en la valoración retrospectiva de las pandemias mediante mediciones como la tasa de ataque, posterior a las fases epidémicas iniciales6,9,11,15.
El conocimiento y la evidencia disponible sobre el comportamiento de la generación de anticuerpos para SARS-CoV-2, al igual que los hallazgos de este estudio, sugieren la presencia de IgM e IgG contra SARS-CoV-2 en sangre a partir del día 9-11 después del inicio de síntomas, o de iniciada la infección6-8. Aunque un método analítico representado en una prueba o test de laboratorio haya sido normalizado previamente, es necesario confirmar el adecuado desempeño de la prueba para aumentar la probabilidad de una adecuada clasificación de los pacientes antes de proceder a su uso rutinario, puesto que, los resultados pueden variar por aspectos clínicos (inicio o no de síntomas, el tiempo desde la exposición o post-infección), de laboratorio (equipos, reactivos, muestras), entre otros factores1-6,9-12,15.
A este procedimiento mediante el cual se evalúa el desempeño del método para demostrar que cumple con los requisitos para el uso previsto establecido (como resultado de la validación, en este caso, la inmunocromatografía para identificar IgM e IgG, específicas para proteínas de SARS-CoV-2) se le denomina verificación o validación secundaria. Cuando se trata de procedimientos cualitativos o de pruebas subjetivas (relacionadas con las capacidades o adiestramiento del observador), se deben incorporar a los procesos de verificación, controles positivos y negativos, siempre que sea posible2-8,17-23. La validación además se hace necesaria cuando se busca demostrar equivalencia de los resultados obtenidos por dos métodos (por ejemplo, contrastar la inmunocromatografía con el ELISA o con la quimioluminiscencia). Dado que títulos mayores de anticuerpos así como una mayor seroconversión, son detectados en la mayoría de los individuos sintomáticos con COVID-19, los sueros de controles positivos deben ser colectados de individuos hospitalizados con cuadros graves o críticos de COVID-19. Esta tendencia podría ser problemática si se tiene en cuenta que el uso de las pruebas serológicas inmunocromatográficas se ha sugerido como estrategia para identificar posibles portadores infecciosos asintomáticos, debido a que sólo entre un 20-30% de casos asintomáticos identificados por RT-PCR logran una seroconversión, lo cual, puede deberse a que la carga viral en asintomáticos es menor que la reportada en pacientes COVID-19 grave a crítico, carga viral (carga antigénica) que puede ser la responsable de la respuesta inmune, representada en anticuerpos detectables o en una escasa o nula seroconversión, respectivamente24-30.
En países de bajos y medianos ingresos, donde los arbovirus y otras enfermedades tropicales como el caso de dengue, zika o chikungunya son altamente endémicas, la propagación del SARS-CoV-2 representa un desafío adicional para la salud pública, puesto que estas patologías infecciosas comparten características clínicas, y recientemente, se han descrito reactividad cruzada en pruebas de laboratorio, lo cual, enreda aún más el panorama31,32. La posibilidad de tener falsos positivos de dengue en pacientes con infección por SARSCoV- 233, y la posibilidad de falsos positivos para SARS-CoV-2 en pacientes con dengue34, podría generar un alto riesgo de diagnósticos erróneos, con consecuencias peligrosas para los pacientes tras abrir la posibilidad de un tratamiento inicial incorrecto o retrazado, lo cual, en casos de pandemia puede ser especialmente preocupante por la necesidad de identificar y aislar de inmediato a pacientes positivos32,34. Estos hallazgos no sólo corresponden a reactividad cruzada, sino que también pueden reflejar una co-infección como en el caso descrito por Kembuan GJ35. Ambos escenarios a los cuales se encuentra expuesta la población de América Latina32,36.
Este estudio tuvo limitaciones que no pudieron ser corregidas al ser un estudio retrospectivo. La más importante fue la ausencia de análisis multivariados para correlacionar los resultados con variables sociodemográficas, historial clínico, paraclínico y con desenlaces mayores. Sin embargo, nuestro estudio cumplió el objetivo para el cual fue planteado, reportando los resultados de validez y concordancia (con la RT-PCR) de la prueba serológica rápida "AMP Rapid Test SARS-CoV-2 IgG/IgM- Cassettes".
Conclusiones
Nuestro estudio permite concluir: 1. Alta sensibilidad y especificidad tanto para IgM como para IgG, presentando validez de criterio del 96% en ambos; 2. Sensibilidad alta para IgM e IgG alcanzando el 95% para cada uno nuevamente, este desempeño se refiere a muestras de población sintomática tomadas por encima de los 11 días de inicio de síntomas; 3. Una especificidad muy baja para IgM e IgG en el escenario entre 8 y 11 días de inicio de los síntomas pero mejorando un poco la especificidad en el periodo de 11 y más días en el escenario 2a; 4. La concordancia de la prueba en estudio frente al estándar de referencia RT-PCR, medida como kappa, fue muy buena específicamente para IgM en casi todos los escenarios pero nuevamente se baja el Kappa en el escenario 2a. Reconociendo las utilidades, las limitaciones y los resultados contradictorios en la literatura científica sobre pruebas serológicas rápidas en COVID-19, así como los resultados evidenciados en nuestro estudio, es importante concluir que las pruebas rápidas serológicas no pueden reemplazar a la RT-PCR, sin embargo, son el complemento adecuado para aumentar la exactitud diagnóstica de COVID-19 en algunos escenarios propuestos.
Es momento de intensificar el compromiso individual y como sociedad, por lo cual se deben realizar estudios multicéntricos de carácter regional y nacional, que brinden evidencia rápida y de la más alta calidad, que sea utilizada para el desarrollo e implementación de protocolos y políticas públicas durante la actual pandemia por COVID-19.