Introducción
La tuberculosis es un problema importante de salud pública. La Organización Mundial de la Salud (OMS) en 2018 estimó 10,0 millones de casos de TB y 1,5 millones de muertes por esta causa. Además, estimó 558.000 casos nuevos de TB re sistente a rifampicina (RIF), de los cuales el 82% fueron TB multi fármaco-resistentes (MDR-TB)1.
La observación microscópica de los bacilos acido-alcohol re sistentes (BAAR) en muestras clínicas es el método de diag nóstico más ampliamente usado por su simplicidad, rapidez y bajo costo. Sin embargo, no proporciona información sobre la viabilidad, identificación de especie del agente infeccioso, resistencia a medicamentos y se requiere un alto número de bacilos para obtener un resultado positivo2,3.
El cultivo sigue siendo el método diagnóstico de referencia, aunque el crecimiento de Mycobacterium tuberculosis puede tardar entre 8 a 24 días de acuerdo con el medio de culti vo empleado y debe ser observado hasta por ocho semanas antes de ser reportado negativo. En los sistemas de cultivo líquido, se reduce el tiempo del resultado entre una o dos semanas con respecto a los medios sólidos4. A partir de este se puede realizar la identificación o la tamización para detec ción de la resistencia a isoniazida y rifampicina disminuyendo los tiempos de reporte por el laboratorio5-7.
La introducción reciente de diferentes técnicas de biología molecular, ha contribuido a disminuir los tiempos de reporte estableciendo diagnósticos más oportunos; algunas de ellas permiten la detección simultánea del complejo MTB y su resis tencia a algunos medicamentos8-11. En el 2010, la OMS avaló el uso de Xpert MTB/RIF (Xpert), especialmente en entornos con altas tasas de TB asociada al virus de la inmunodeficiencia hu mana (HIV) y de TB-MDR, posteriormente en 2013, amplio el aval de su uso en pacientes con tuberculosis pulmonar y ex trapulmonar12,13. Esta técnica permite detectar simultáneamente el complejo MTB y las mutaciones más comunes asociadas a resistencia a RIF, mediante amplificación genómica por reacción en cadena de la polimerasa (PCR) en tiempo real en dos horas13.
El Xpert MTB/Rif ha demostrado tener un mejor rendimien to para el diagnóstico de TB comparado con la baciloscopia de esputo en pacientes con cultivo positivo, con sensibilidad que se acerca a la del cultivo y una alta especificidad14,15. No obstante, la sensibilidad es más alta en muestras de esputo positivas por microscopía que en las que son paucibacilares y sus valores predictivos están estrechamente relacionados con la prevalencia de la enfermedad15,16.
Las ventajas del uso del Xpert MTB/RIF han resultado en la adopción masiva de esta tecnología en algunos países como reemplazo de la microscopía17. Una nueva versión de esta téc nica el Xpert MTB/RIF Ultra, fue recientemente avalada por la OMS como reemplazo del anterior con importantes mejoras en la sensibilidad, pero con una menor especificidad18.
Desde el año 2000, la OMS desarrolló una guía para los aná lisis de costo-efectividad (ACE) (19, útil para determinar los cos tos de implementación de nuevas tecnologías diagnósticas en tuberculosis20. Debido al elevado costo económico inicial de las nuevas tecnologías y a su efectividad para la detec ción del complejo MTB comparadas con las técnicas conven cionales, su aplicación sistemática en pacientes con elevada sospecha de TB y TB resistente podría disminuir finalmente el costo económico de la atención21.
Actualmente en Colombia se usa Xpert MTB/RIF como prue ba molecular en el diagnóstico de TB y más recientemente el Xpert MTB/RIF ultra. Su uso esta recomendado por el progra ma nacional de control de tuberculosis en sus nuevas guías según la resolución 0000227 del 2020 del Ministerio de Salud2. De acuerdo con lo anterior y teniendo en cuenta la recomen dación para el uso de esta prueba en el país, este estudio tuvo como objetivo determinar la contribución del uso de Xpert MTB/RIF y su costo-efectividad en el diagnóstico de tubercu losis pulmonar y la resistencia a rifampicina, bajo la perspectiva institucional de un laboratorio diagnóstico, y comparada con los métodos convencionales de diagnóstico de la enfermedad.
Materiales y métodos
Tipo de estudio
Se realizó un estudio descriptivo retrospectivo de corte tras versal para determinar la contribución de la prueba Xpert MTB/RIF en el diagnóstico de tuberculosis pulmonar y la re sistencia a rifampicina y la evaluación de su costo-efectividad comparada con métodos diagnóstico convencionales (culti vos y baciloscopias), en muestras procesadas en el laborato rio de bacteriología y micobacterias de la Corporación para Investigaciones Biológicas (CIB) en Medellín, Colombia, de agosto de 2013 a diciembre de 2015.
Población de estudio
La población de estudio fueron las muestras clínicas de ori gen respiratorio de pacientes niños o adultos, remitidas para diagnóstico, al laboratorio especializado de la Unidad de Bacteriología y Micobacterias de la Corporación para Inves tigaciones Biológicas. las muestras se procesaron simultá neamente para baciloscopia por auramina-rodamina, cultivo liquido BACTEC MGIT 960® y Xpert MTB/RIF®, durante el periodo de tiempo definido para el estudio. Se definió un resultado microbiológico positivo como el estándar diagnós tico cuando la baciloscopia y/o el cultivo y/o la prueba mole cular fueron positivos.
Procesamiento de muestras
Las muestras se descontaminaron utilizando el método estándar N-acetil-L-cisteína e hidróxido de sodio (NaCis/ NaOH) y se concentraron por centrifugación a 4.500r.p.m. en refrigeración a 4ºC22. Del sedimento obtenido se realizó baciloscopia que se coloreó con tinción fluorescente de au ramina-rodamina (AR). El tubo MGIT se inoculó con 500 mL de muestra y 800 mL de PANTA (polimixina B, anfotericina B, ácido nalidíxico, trimetoprim y azlocilina) + OADC BD® y se incubó por 56 días en el equipo BACTEC MGIT 960, según las instrucciones del fabricante (BD Diagnostics, Sparks, MD, USA). A las muestras detectadas como positivas se les reali zó subcultivo en MB7H11 (agar de capa delgada), para dife renciar el complejo MTB y las micobacterias no tuberculosas (NTM) y tamizaje para la detección de resistencia a isoniazida (INH) y rifampicina (RIF) de acuerdo a procedimientos des critos6,7. Los cultivos positivos se confirmaron como bacilos acido alcohol resistente y la identificación de la especie se realizó utilizando métodos fenotípicos recomendados22.
Las muestras clínicas pulmonares se procesaron para Xpert® MTB/RIF de acuerdo con las instrucciones del fabricante (Ce pheid, Sunnyvale, CA, USA). En breve: Las muestras se inac tivaron adicionando 2 mL de la muestra y 4 mL de reactivo de muestra, se agitó manualmente dos veces durante un pe ríodo de incubación de 15 minutos a temperatura ambiente. Posteriormente, 2 mL de la mezcla se transfirieron al cartucho Xpert, el cual se cargó en el equipo para la extracción, ampli ficación y detección de ácidos nucleicos.
Análisis Estadístico
Los datos se consignaron en una base de datos en Micro soft Excel ® 2010 y los cálculos se realizaron usando el soft ware SPSS versión 21.0 ® y Epidat 3.1 (Xunta de Galicia). Se determinó la concordancia observada de los resultados de Xpert MTB/RIF y los resultados obtenidos por la baciloscopia y cultivo MGIT, calculando el índice Kappa de Cohen con sus respectivos intervalos de confianza (IC) del 95%. Para la re sistencia a RIF, se calcularon la sensibilidad, la especificidad y los valores predictivos teniendo como referencia el resultado de la sensibilidad a rifampicina en la tamización en agar capa delgada a partir del cultivo MGIT.
Análisis de costos
Los costos de las pruebas diagnósticas fueron medidos tenien do en cuenta la metodología definida por Coyle y Drummond 200123 y los lineamientos del Instituto de Evaluación Tecnoló gica en Salud, Manual Metodológico para la elaboración de evaluaciones económicas en salud Bogotá DC IETS 2.01424.
Los costos fueron clasificados entre directos e indirectos. Para definir los costos directos se listaron insumos, equipos necesarios para realizar cada prueba y gastos de personal. Para los costos indirectos, se tuvieron en cuenta estimacio nes en el uso del espacio y secciones de laboratorio en cada prueba. Con la perspectiva del prestador, es decir el labora torio que realiza la prueba y con un horizonte temporal de un periodo máximo de cincuenta y seis días que equivale al mayor tiempo utilizado por las tecnologías en evaluación, en este caso el tiempo de incubación en el cultivo de MGIT; debido a que el horizonte temporal es menor a un año, no se aplicó tasa descuento, y se realizó indexación para el año 2018, ya que los costos fueron captados en el año 2016.
Análisis de efectividad
Para la evaluación de la efectividad de las pruebas y el análi sis de costo-efectividad, la medida de efectividad fueron los casos diagnosticados correctamente, es decir, el desempeño operativo que tuvo cada prueba para diagnosticar un caso de TB como verdadero positivo o falso positivo de acuerdo con el estándar, que fue definido como el resultado microbiológico positivo para MTB (BK positivo y/o positivo por cultivo y/o positivo por Xpert).
Análisis de costo-efectividad
Para el análisis de costo-efectividad se calcularon tanto el costo por prueba procesada como la capacidad que tiene cada prueba para identificar un caso verdadero positivo de TB, utilizando como estándar el resultado microbiológico po sitivo para MTB.
Se calcularon la razón de costo efectividad (RCE) y la razón de costo-efectividad incremental (RICE). La RCE es el cocien te entre el costo de una alternativa y su efectividad, utilizado para evaluar alternativas independientes. La RICE, considerada una medida más exacta para evaluar alternativas diagnósticas consideradas mutuamente excluyentes, y proporciona infor mación relacionada a los costos y las efectividades adicionales que tiene una prueba evaluada sobre otra (comparador).
Resultados
Durante el periodo de estudio se incluyeron en total 1.574 muestras clínicas, el lavado broncoalveolar representó el 76% (n= 1.198) de las muestras, esputo el 15% (n= 231) y lavado bronquial el 4% (n= 67). El aspirado traqueal, la biopsia pul monar, el jugo gástrico y la secreción pulmonar representa ron el 5% (n= 78). Ver distribución en Tabla 1.
Tabla 1 Distribución de los resultados del cultivo de acuerdo con las diferentes muestras clínicas
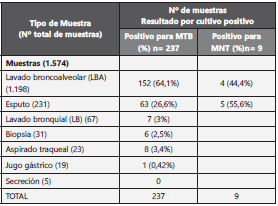
MTB: M. tuberculosis
MNT: Micobacteria No Tuberculosa
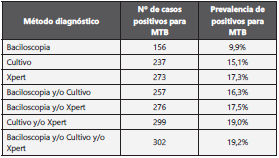
La baciloscopia fue positiva en el 9,9% (n= 156) de las mues tras, el 39,1% (n= 9) de los aspirados traqueales y el 25,9% (n= 60) de los esputos. En cultivo MGIT, 237 muestras (15,1%) fueron positivas para MTB y 9 muestras (0,61%) positivas para micobacterias no tuberculosas.
En la Tabla 2, se presenta las pruebas diagnósticas realizadas y su positividad individual y al combinarse con otras pruebas. Al realizar el Xpert MTB/RIF en conjunto con la baciloscopia aumentó la positividad a 17.5%, al adicionar el Xpert al cul tivo el incremento en la positividad fue 3.9% y la positividad combinada de las tres técnicas diagnósticas la incrementó a 19,2% en la población de estudio.
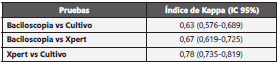
Del total de muestras positivas el Xpert detectó el 90,4% (273/302), el cultivo MGIT el 78,5% (237/302) y la bacilosco pia el 51,7% (156/302). Adicionalmente, de las 1.574 mues tras evaluadas, el 1,7% (26 muestras) fueron negativas por Xpert y positivas por cultivo MGIT y 3,9% (61 muestras) fue ron positivas por Xpert y negativas por cultivo MGIT para MTB. En la Tabla 3, se observa la concordancia de positividad de los tres métodos utilizados.
Se detectó resistencia a RIF en el 8,1% (22/273) de muestras positivas por Xpert, de estas por tamizaje en agar capa del gada a partir del cultivo MGIT se detectó resistencia en 16 aislamientos; de las 6 muestras discordantes, dos fueron sen sibles a RIF, una sensible a RIF resistente a INH y tres fueron negativas para MTB por cultivo MGIT.
Al comparar el desempeño del Xpert MTB/RIF con el tamizaje en agar capa delgada para detección de resistencia a rifampi cina, el Xpert tuvo sensibilidad de 94,1% (IC95%: 73,0-99,0%), especificidad de 98,4% (IC95%: 95,5-99,5%), VPP de 84,2% (IC95%: 62,4-94,5%) y VPN de 99,5% (IC95%: 97,1-99,9%). Se presentaron dos aislamientos con resistencia “Indetermina da” por Xpert, de los cuales uno fue negativo por cultivo y el otro fue sensible a rifampicina en la tamización en capa delgada. De las 1.301 muestras negativas por Xpert, el 2,0% (26 muestras) fueron positivas para MTB por cultivo MGIT, de estas, dos presentaron mono resistencia a INH.
En las 211 muestras que fueron positivas para MTB simul táneamente por Xpert MTB/RIF y cultivo MGIT, a partir del cultivo se observó monoresistencia a INH en 9 aislamientos (4,3%), uno de estos aislamientos monoresistentes a INH fue resistente a RIF por Xpert; todos los aislamientos con mono resistencia a INH detectada por el tamizaje a partir del cul tivo, fueron confirmados por pruebas de susceptibilidad fe notípicas. La concordancia en la detección de resistencia a RIF entre el agar capa delgada y el Xpert presentó un índice Kappa de 0,88 (IC95%: 0,76-1,00). En la Figura 1, se presenta el comportamiento de las muestras del presente estudio con las técnicas estudiadas.
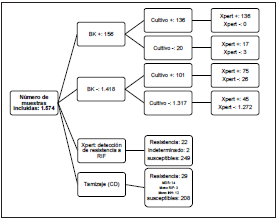
Figura 1 Comportamiento de la baciloscopia, cultivo MGIT y Xpert en la detección de MTB y resistencia a RIF e INH en 1574 muestras respiratorias
Análisis de costos
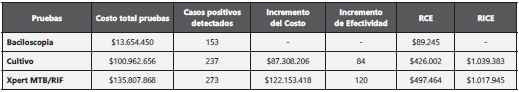
Procesar una muestra por cada uno de los tres métodos diag nósticos utilizados tiene un costo que va desde $8.675 ($2,30 dolares) para la baciloscopia hasta $86.282 ($23,07 dolares) para el Xpert. La Tabla 4, discrimina los costos por prueba, y el estimado invertido para evaluar las 1.574 muestras de pacientes con sospecha de tener TB pulmonar.
Tabla 4 Costo unitario y total por prueba.
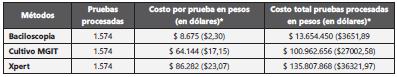
*precio del dólar en pesos aproximado en el último año
Fuente: Datos y elaboración propia de acuerdo con los costos desde una perspectiva institucional
En los resultados del análisis de costo efectividad en mues tras clínicas, el Xpert fue una prueba más económica y efecti va con una RICE de $1.017.945 frente a la del cultivo que fue $ 1.039.383 (Tabla 5).
Discusión
La TB sigue siendo un importante problema para la salud pú blica mundial, a pesar de los esfuerzos para controlarla1. Los métodos convencionales para la detección de MTB en mues tras clínicas tienen limitaciones. La coloración (baciloscopia) es inespecífica, con sensibilidad moderada, no diferencia ba cilos viables y el cultivo requiere mayor cantidad de tiempo para proporcionar resultados, más experiencia técnica del personal e instalaciones de laboratorio adecuadas2,3. Los mé todos moleculares avalados por la OMS, como el Xpert, son alternativas que proporcionan un diagnóstico más rápido con sensibilidad adecuada y alta especificidad12,13.
En este estudio la comparación del Xpert con la baciloscopia, aumento la positividad de 9,9% a 17,3%, lo que proporcionó un diagnóstico más temprano en los pacientes paucibacila res, en quienes la confirmación microbiológica del paciente no fuera posible hasta que el resultado del cultivo esté dis ponible. El diagnóstico temprano en pacientes paucibacila res con Xpert contribuye al inicio temprano del tratamiento, disminuyendo la carga bacilar y por tanto corta temprana mente la cadena de trasmisión, lo cual a su vez contribuye a la disminución en el número de casos, la disminución en la morbilidad y mortalidad y de los costos de atención al siste ma de salud25.
El Xpert MTB/RIF tuvo 26 resultados negativos que fueron positivos por cultivo MGIT. Estas diferencias pueden ser ex plicadas por la presencia de inhibidores de PCR, una menor sensibilidad comparado con el cultivo, o eventuales diferen cias de calidad de la muestra procesada por cada uno de los métodos26-30. Es necesario tener en cuenta que el límite de detección del Xpert MTB/Rif es 131 ufc/mL comparado con el cultivo MGIT que es de 10-100 bacilos/mL, por lo tanto, un resultado negativo del Xpert no excluye el diagnóstico de TB, en estos casos se recomienda interpretar los resultados en conjunto con los criterios clínicos y epidemiológicos de los pacientes para definir el diagnóstico y soporta la nece sidad de realizar cultivos en todas las muestras microscopía negativa31,32. La nueva versión del Xpert, el Xpert ultra MTB/ RIF fue diseñada para amplificar dos blancos multicopia dife rentes, IS6110 y IS1081 de M. tuberculosis, lo cual incrementa su sensibilidad hasta hacerla cercana a la del cultivo (15 UFC/ ml). Este desempeño disminuirá el número de resultados dis crepantes entre el cultivo y el Xpert ultra soportando el uso de última tecnología como método inicial de diagnóstico33.
Se identificaron 62 muestras con resultado negativo por cul tivo MGIT, que fueron positivas por Xpert, 23 de ellas con resultado “Muy bajo”, 26 “Bajo”, 11 “Medio” y 2 “Alto”. En este estudio no se tuvo información acerca de si las muestras recibidas fueron de pacientes previamente tratados, por lo que no se pudo evaluar la contribución a la positividad del Xpert de ADN micobacteriano no viable y no cultivable29. Un estudio realizado en pacientes previamente tratados demos tró que reclasificando los pacientes con bajos niveles semi cuantitativos como negativos aumenta la especificidad, pero disminuye la sensibilidad31.
El Xpert MTB/Rif detectó 8,1% de resistencia a rifampicina, con sensibilidad y especificidad de 94,1% y 98,4% respecti vamente, comparado con las pruebas de susceptibilidad ba sadas en cultivo. Las diferencias en sensibilidad pueden ser explicadas por la posible presencia de mutaciones en el gen rpoB asociadas con resistencia a RIF de bajo nivel que no están incluidas en las detectables por la prueba molecular pero que sí son detectables como resistentes por pruebas de susceptibilidad fenotípicas34. También es necesario conside rar que las pruebas fenotípicas no siempre detectan el 100% de las resistencias a rifampicina, ya que se ha demostrado mutaciones en el locus rpoB con pruebas fenotípicas que muestran sensibilidad a rifampicina35,36.
Una de las limitaciones del Xpert es la no detección de la sen sibilidad a isoniacida, en este estudio se observó que de las 237 muestras positivas para MTB por cultivo MGIT y tamizaje en agar CD, el 5,1% presentó monoresistencia a INH, más alto a lo reportado por Torres et al., 2,2% y más bajo que lo obser vado por Vadwai et al., que fue 8,7%37,38. De acuerdo con los datos de un metaanálisis realizado en estudios de pacientes sin tratamiento previo, el tratamiento con el régimen están dar recomendado en pacientes en los que no se detectó una resistencia inicial a INH, hubo 11% de fallas en el tratamiento, 10% de recaídas y 8% de ellos desarrollaron multirresistencia39.
La prueba Xpert MTB/RIF en un escenario de endemicidad mediana para TB como Colombia, tiene costos de implemen tación que pueden ser altos a pesar de los precios subsidia dos del reactivo a los sistemas de atención pública y a las organizaciones sin ánimo de lucro que establece la compañía en un convenio con varias organizaciones (programa HBDC, Cepheid). Esto podría ser una barrera inicial en la implemen tación amplia del Xpert como reemplazo de la microscopía en el diagnóstico inicial de la enfermedad tal como lo reco mienda la OMS40,41.
En este estudio los costos asociados al Xpert se comparan fa vorablemente con los del cultivo para muestras pulmonares, con la ventaja de ofrecer un resultado más rápido. Esta tecnología diagnóstica ha demostrado ser costo-efectiva como método inicial de diagnóstico en países de carga baja y media para TB42,43. No obstante lo anterior, un estudio en Sudáfrica, un país con alta prevalencia de tuberculosis que ha implementado Xpert como reemplazo de la microscopía, demostró que el uso de esta tecnología no mejoró el costo efectividad del diagnós tico de tuberculosis44. Otro estudio, también en Sudáfrica, no demostró que el uso de Xpert mejora desenlaces como morta lidad a los 6 meses comparado con la baciloscopia45.
Los resultados pueden tener limitaciones para su generaliza ción puesto que la RCE fue calculada desde una perspectiva institucional de un laboratorio diagnóstico ubicado en una ciudad como Medellín que tiene tasas de incidencia de tu berculosis superior al promedio del país y puede variar con relación a costos de insumos y de otros costos directos de acuerdo con la institución. Igualmente al no disponer de in formación clínica de los pacientes no es posible explicar con razonable certeza las discordancias entre los resultados del Xpert MTB y el cultivo.
De acuerdo con los resultados de este estudio el Xpert MTB/ RIF es tan costo efectivo y tan preciso como el cultivo, pro porciona resultados rápidos en la identificación de MTB y su susceptibilidad a rifampicina, lo cual le otorga ventajas como método diagnóstico comparado con el cultivo. No obstante, tiene también limitaciones como se observó, con relación a que no identifica micobacterias no tuberculosas y no identifica la resistencia a isoniazida en los casos de TB. Los resultados del estudio también muestran que el mejor diagnóstico se realiza con la combinación de métodos convencionales basados en cultivo y baciloscopia combinados con el Xpert MTB.