Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de Salud Pública
versión impresa ISSN 0124-0064
Rev. salud pública v.10 n.5 Bogotá nov./dic. 2008
Artículos Originales/Original Articles
Anticuerpos Neutralizantes contra el Virus de la Fiebre Amarilla 17 D en Colombianos Vacunados y no Vacunados con Inmunidad a Dengue
Yellow fever virus 17D neutralising antibodies in vaccinated Colombian people and unvaccinated ones having immunity against dengue
Sergio Y. Gómez y Raquel E. Ocazionez
Centro de Investigaciones en Enfermedades Tropicales, Universidad Industrial de Santander, Bucaramanga, Colombia. sergioyebrailgm@yahoo.com, relocaz@uis.edu.co
Recibido 25 Marzo 2008/Enviado para Modificación 18 Octubre 2008/ Aceptado 5 Noviembre 2008
RESUMEN
Objetivo Determinar la frecuencia de título protector de anticuerpos neutralizantes contra el virus de la fiebre amarilla (AN-VFA a título >1:10) en colombianos vacunados con la cepa 17 D y conocer la magnitud de neutralización del VFA por anticuerpos contra dengue.
Metodología Se colectó suero de 100 individuos con vacuna documentada por carné y de 116 residentes en municipios de Norte de Santander afectados por el brote en 2002-2003, quienes informaron haber sido vacunados. Se incluyeron sueros de individuos no vacunados con (n=61) y sin (n=16) anticuerpos contra dengue. Todos los sueros se analizaron por la prueba de neutralización para VFA por 75 % de reducción de placa.
Resultados AN-VFA a título >1:10 se encontraron en 90 % de vacunados con carné y sin variación aparente en relación con edad. Al contrario, hubo correlación entre disminución de la frecuencia de título protector de anticuerpos e incremento del tiempo de inmunización (r=0,95; p=0,04). En residentes de Norte de Santander, AN-VFA a título >1:10 se encontraron en 92,6 % adultos y 69 % niños. El VFA fue neutralizado (52 -100 %) por sueros de inmunes a dengue más eficientemente que por sueros de no inmunes (p<0.001).
Conclusiones Vacunados con el virus 17 D podrían no estar protegidos contra fiebre amarilla: hasta 31 % niños y 10 % adultos. Anticuerpos contra dengue inhibieron el VFA y su significancia en términos de protección contra fiebre amarilla deberá ser investigada.
Palabras Clave: Fiebre Amarilla, flavivirus, vacuna contra la fiebre amarilla, pruebas de neutralización (fuente: DeCS, BIREME).
ABSTRACT
Objective Determining the frequency of yellow fever seroprotective antibody neutralising titres (YF-NT >1:10) in Colombians vaccinated with the 17 D virus and ascertaining the extent to which YF virus can be neutralised by dengue antibodies.
Materials and Methods Serum samples were taken from 100 subjects who showed their vaccination record and from 116 residents in municipalities (Norte de Santander) affected by a wild YF outbreak in 2002-2003 who were reported to have been YF vaccinated. Sera from individuals with (n=61) and without (n=16) dengue antibodies who had never been YF vaccinated were included. All the sera were tested by 75 % YF plaque-reduction neutralization test.
Results YF-NT titres >1:10 were founded in 90 % of subjects with vaccination recorded with minors variations in relation to age. In contrast, there was correlation between decrease of seroprotective YF-NT titres frequency and increase of immunization time (r=0.95; p=0.04). In residents in YF endemic area, YF-NT titres > 1.10 were founded in 92,6 % adults and 69 % children. YF 17 D virus was neutralized (52-100 %) by dengue sera more efficiently than non-dengue immune sera (p<0.001).
Conclusions Individuals immunised with YF vaccine 17 D could not be protected against YF: up to 31% children and 10 % adults. Dengue antibodies inhibited YF virus and its significance in terms of YF protection must be investigated.
Key Words: Yellow fever, flavivirus, yellow fever vaccine, neutralisation test (source: MeSH, NLM).
La Fiebre Amarilla ocurre en varios países de América del Sur y África de la cual se registran numerosas epidemias. La enfermedad es causada por el virus del mismo nombre (VFA) que se adquiere a través de la picadura de mosquitos vectores. El ciclo natural de transmisión del virus ocurre en áreas selváticas entre primates no humanos y el hombre se infecta accidentalmente al internarse en estas. Los individuos virémicos provenientes de la selva pueden iniciar el ciclo de transmisión en áreas urbanas (1). La Organización Mundial de la Salud estima que aproximadamente 200 000 casos se reportan cada año de los cuales por lo menos 50 % mueren (2).
El virus de la Fiebre Amarilla pertenece al genero Flavivirus (familia Flaviviridae) donde se agrupan otros de importancia médica, también trasmitidos por mosquitos, como el virus del dengue (VDEN), virus del Oeste del Nilo (VON), virus de encefalitis de San Luis (VESL), virus de encefalitis del Valle de Murray (VEVM), entre otros. Los Flavivirus comparten determinantes antigénicos que inducen anticuerpos neutralizantes de reacción cruzada (3). Algunas evidencias sugieren que la inmunidad previa a un Flavivirus puede contribuir a la inmunidad contra la infección por otro. Individuos infectados en el pasado con el VDEN parecen estar protegidos de encefalitis severa por el VON y el VESL (4,5) y animales previamente inmunizados con el VDEN no desarrollan encefalitis o daño hepático severo cuando se infectan con el VFA (6,7).
La Fiebre Amarilla es una enfermedad inmunoprevenible. La vacuna contiene un virus atenuado (17 D) desarrollado por Max Theiler y colaboradores hace más de 70 años (8). Aproximadamente 20-25 millones de dosis de vacuna se producen anualmente con participación de diez fabricantes, cada uno usando una de las tres semillas originales del virus conocidas como 17D-204, 17DD y 17D-204-WHO. La Fundación Oswaldo Cruz de Brasil es el mayor productor en Latinoamérica suministrando el preparado a países de la región, entre esos Colombia (9,10). En pobladores de áreas endémicas se aplica una única dosis después del primer año de vida o antes según el riesgo. Los viajeros hacia zonas enzoóticas se deben vacunar cada 10 años con el fin de validar el Certificado Internacional de Vacunación. La presencia de anticuerpos neutralizantes del virus en el suero diluido 10 veces (título 1:10) se considera estado protector contra la infección natural conferido por la vacuna (9). Es ampliamente aceptado que la vacuna antiamarílica presenta una eficacia protectora superior a 90 % en niños y adultos. Varios factores pueden influir en la respuesta a la vacuna, entre los que se incluyen el transporte en relación a la cadena de frío, la dosis (altas dosis pueden resultar en disminución de la respuesta), sitio de inyección y características del individuo (11). Debido a esas variaciones, es necesario verificar regularmente la inmunogenicidad de los lotes con prioridad después de campañas masivas de vacunación. Varios estudios reportan hasta 30 % de vacunados sin anticuerpos a título protector dependiendo de la edad y tiempo después de la inmunización (12-15).
En Colombia la Fiebre Amarilla ha estado presente desde 1729 con brotes en diferentes regiones, aunque transmisión urbana no se reporta desde 1929 (16-18). En el 2003 ocurrió el último brote con 106 casos selváticos, la mayoría de municipios del Departamento de Norte de Santander, de los cuales 47 murieron (18). La vacunación en el país hasta hace algunos años estuvo restringida a pobladores de áreas endémicas. Antes del último brote había 3 784 280 inmunizados y la cobertura en áreas de alto riesgo era < 60 %. Entre 2003-2005 se aplicaron millones de dosis resultando en 19 096 694 individuos inmunizados y cobertura > 95 % en zonas de riesgo (19). El último estudio, encontrado en las bases bibliográficas, sobre eficacia protectora de la vacuna contra la Fiebre Amarilla en colombianos inmunizados se publicó en 1965 (20).
La amplia campaña de vacunación contra la Fiebre Amarilla en Colombia entre 2002 2006 en áreas rurales y urbanas, las segundas con alta endemia de dengue, motivó la realización de este estudio. El objetivo fue investigar la frecuencia de título protector de anticuerpos neutralizantes contra el virus 17 D en colombianos residentes en zonas de riesgo de Fiebre Amarilla selvática y urbana en relación con edad y tiempo de inmunización. Por otro lado, se investigó la neutralización del virus 17 D por suero de individuos inmunes al dengue y sin historia de vacunación contra la Fiebre Amarilla. Lo segundo para conocer la reactividad cruzada teniendo en cuenta que la inmunidad previa al dengue se ha sugerido como factor protector contra Fiebre Amarilla severa (6,7).
METODOLOGÍA
Población
Se incluyeron 293 individuos entre 1 y 76 años de edad quienes fueron invitados a participar en el estudio. De cada uno se colectó una muestra de sangre previo consentimiento informado y el comité de ética de la Universidad Industrial de Santander aprobó el estudio. La población se distribuyó en cuatro grupos:
- Grupo A: Vacunados contra la Fiebre Amarilla (n=100). El estado de vacunación se confirmó con el carné expedido por la autoridad local de salud. Todos los individuos habían recibido una única dosis de la vacuna 17 D entre 3 a 24 meses antes de la inclusión en el estudio.
- Grupo B: Residentes de Ocaña y municipios vecinos del Departamento de Norte de Santander (n=116). En esta zona del país la cobertura de vacunación contra la fiebre amarilla durante el periodo del estudio se presumió mayor que 95 %. Esto debido a la campaña como consecuencia del brote del 2002 y por información verbal de funcionarios del Instituto Departamental de Salud de Norte de Santander. Los casos fueron seleccionados de los que asistieron a consulta médica en el Hospital Emiro Quintero Cañizares de Ocaña y quienes, adultos o padres de los niños, manifestaron verbalmente haber sido vacunados una vez. En la mayoría de los participantes la información verbal no se confirmó con el carné.
- Grupo C: Con inmunidad a dengue y ausencia de vacunación contra la fiebre amarilla (n=61). Individuos residentes permanentes en Bucaramanga y área metropolitana y sin viajes a zonas con brotes selváticos de Fiebre Amarilla. De estos, 24 adultos fueron seleccionados para el estudio y los 37 restantes fueron niños (< 11 años) con diagnóstico confirmado de dengue de un estudio previo realizado por los autores en 1998 (21) y de quienes se tenia suero almacenado a -70oC. Los adultos informaron verbalmente no haber sido vacunados contra la fiebre amarilla en ninguna oportunidad y la inmunidad a dengue se confirmó por presencia de anticuerpos como se describe adelante. Los niños se consideraron no inmunizados contra la fiebre amarilla debido a que en 1998 y años anteriores no se hicieron campañas de vacunación en Bucaramanga y área metropolitana.
- Grupo D: Sin inmunidad a Flavivirus (n = 16), residentes en área rural de los municipios de Mutiscua y Pamplona (N. de Santander) donde transmisión de Arbovirus no se ha documentado por estar ubicados a 2 600 m sobre el nivel del mar. Todos manifestaron verbalmente no haber sido vacunados contra la fiebre amarilla en ninguna oportunidad.
Anticuerpos neutralizantes contra el virus 17 D
Los anticuerpos se buscaron en el suero de todos los individuos incluidos en el estudio, utilizando un protocolo modificado de la prueba de neutralización para dengue previamente descrito (22). Brevemente, 30-40 UFP del virus se incubaron 2 hs a temperatura ambiente con diluciones base 4 (1:10 hasta 1:320) de suero inactivado a 56oC. La mezcla se adicionó por duplicado a cultivos de células Vero crecidas en cajas de 24 pozos en medio esencial mínimo completo (MEM, GIBCO-BRL), por 1 h a 37ºC en atmósfera de CO2 (5 %). Luego, las monocapas se lavaron con tampón fosfato (PBS) y después de adicionar medio (M-199 2X, suero bovino fetal 7 %; carboximetil celulosa 3 %) las cajas se incubaron bajo las mismas condiciones por 7 días. Como control se incluyó virus preincubado en medio de cultivo. Las placas virales se visualizaron por coloración con cristal violeta (3 %), se contaron y se determinó la reducción por cada suero con respecto al control. El titulo de anticuerpos se definió como la dilución mayor del suero que redujo 75 % o más placas producidas por el virus 17 D calculada por regresión lineal. Valores e" 1:10 se consideraron títulos protectores (11). La reactividad cruzada del suero de los inmunes a dengue se expresó como el porcentaje de reducción de placa del virus 17 D.
Inmunidad previa a dengue
Los sueros de los individuos no vacunados contra la fiebre amarilla (grupos C y D) se procesaron para buscar anticuerpos IgG contra dengue usando el estuche ELISA DENGUE-DUO (PanBio) y siguiendo las instrucciones del fabricante como previamente se describió (21). El resultado positivo se consideró inmunidad previa a dengue y el negativo lo contrario.
Análisis de los datos
La frecuencia de anticuerpos neutralizantes contra el virus 17 D a título > 1:10 se correlacionó con el tiempo de inmunización. Se comparó el porcentaje de reducción de placas del virus 17 D por suero de no vacunados con y sin inmunidad a dengue. La significancia de las diferencias se estableció por análisis de correlación y con la prueba de Mann-Whitney, respectivamente, usando el software SSPS versión 13.0.
RESULTADOS
Anticuerpos en vacunados con el virus 17 D
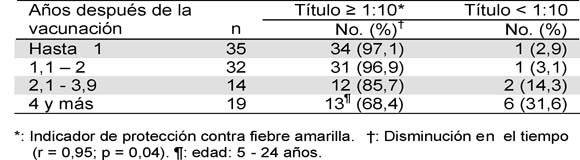
En 90 % de los individuos en quienes la vacunación se confirmó con el carné se detectaron anticuerpos neutralizantes a título protector (> 1:10), sin variación significativa de la frecuencia (86,4- 91 %) en relación con el grupo de edad (Tabla 1). Al contrario se observó con el tiempo después de la inmunización. Hubo correlación entre disminución de la frecuencia de individuos con anticuerpos a título >1:10 e incremento en años de haber sido vacunado (r=0,95; p=0,04. Tabla 2). En los individuos con anticuerpos protectores, 52,2 % tenían títulos entre 1:10-1:80 y 30 % >1:180 (Tabla 3). En residentes de Ocaña y municipios vecinos (grupo B) se encontraron anticuerpos neutralizantes a título > 1:10 en 81 % con menor frecuencia en niños (69 %). De los 22 individuos de este grupo que no presentaron título protector de anticuerpos 18 eran menores de 16 años (Tabla 4).
Tabla 1. Anticuerpos neutralizantes contra el virus de la Fiebre Amarilla 17 D en colombianos vacunados y en relación con edad
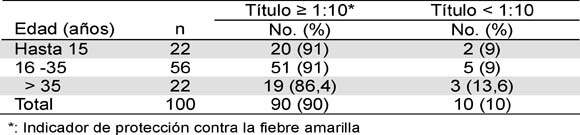
Tabla 2. Anticuerpos neutralizantes contra el virus de la Fiebre Amarilla 17 D en colombianos vacunados en relación con tiempo de inmunización
*: Indicador de protección contra Fiebre Amarilla. †: Disminución en el tiempo (r = 0,95; p = 0,04). ¶: edad: 5 - 24 años
Tabla 3. Título protector de anticuerpos neutralizantes en colombianos inmunizados con el virus 17 D
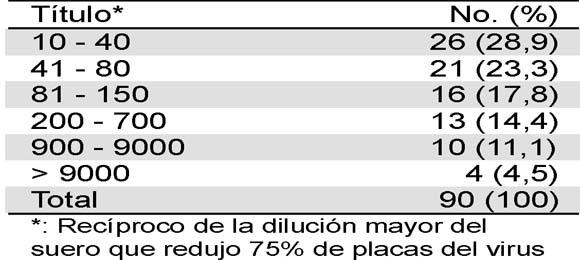
*: Recíproco de la dilución mayor del suero que redujo 75% de placas del virus
Tabla 4. Frecuencia de anticuerpos neutralizantes contra el virus de la Fiebre Amarilla 17 D en residentes de Ocaña y municipios vecinos (Norte de Santander, Colombia), 2004-2005
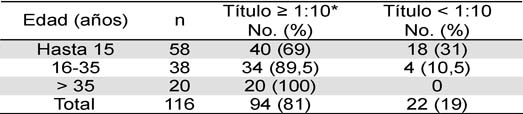
Información verbal de vacunación no confirmada en la mayoría de los casos.*:Indicador de protección contra la Fiebre Amarilla.
Neutralización cruzada del virus 17 D
La incubación previa del virus 17 D con 53 (86,8 %) de 61 sueros de inmunes a dengue no vacunados contra fiebre amarilla (grupo C), resultó en reducción >50 % del número de placas de infección en células Vero. En contraste, con ningún suero sin inmunidad a Flavivirus (grupo D) de los 16 analizados hubo reducción de placas virales >50 %. Cuando se compararon entre si los porcentajes de reducción de placas de los dos grupos de sueros la diferencia fue significativa (p<0,001. Figura 1). Los resultados sugieren que los anticuerpos contra virus dengue pudieron neutralizar el virus de la fiebre amarilla y disminuir la infección de las monocapas celulares.
DISCUSION
La eficacia protectora de la vacuna 17 D se evalúa buscando anticuerpos en suero colectado antes y algunos días después de la inmunización. Seroconversión con título de anticuerpos = 1:10 se considera inmunidad protectora (11). No hay reportes en población colombiana vacunada en los últimos 20 años. En este estudio se buscaron anticuerpos neutralizantes en un único suero colectado 3 meses hasta 24 años después de la inmunización y en 90 % se detectaron anticuerpos neutralizantes protectores. Frecuencia similar fue reportada por Groot (20) en niños (89,1 %) y adultos colombianos (94,6 %) y por otros en Brasileros (13-15), Peruanos (12) y Alemanes (23).
Figura 1. Reducción de placas del virus de la fiebre amarilla 17 D por suero de individuos no vacunados con (1) o sin (2) inmunidad a dengue. P<0.001 (Mann-Whitney) 
En 10 % de vacunados del estudio el título de anticuerpos fue < 1:10 que se considera no protector. En población Latinoamericana el título no protector se ha reportado en 0,5 % hasta 32,0 % de vacunados (12-15). Entre los factores individuales que pueden influir sobre la respuesta inmune a la vacuna se reconocen la carga genética y la edad. Hispanos vacunados respondieron con títulos mayores de anticuerpos comparados con Caucasianos (24). Algunos estudios reportan tasas menores de seroconversión a la vacuna 17 D en niños que adultos pero la razón se desconoce (14,15,25). En este, no se encontraron diferencias relacionadas con la edad y esto pudo deberse al limitado número de individuos de cada grupo.
En 10 % de vacunados del estudio el título de anticuerpos fue < 1:10 que se considera no protector. En población Latinoamericana el título no protector se ha reportado en 0,5 % hasta 32,0 % de vacunados (12-15). Entre los factores individuales que pueden influir sobre la respuesta inmune a la vacuna se reconocen la carga genética y la edad. Hispanos vacunados respondieron con títulos mayores de anticuerpos comparados con Caucasianos (24). Algunos estudios reportan tasas menores de seroconversión a la vacuna 17 D en niños que adultos pero la razón se desconoce (14,15,25). En este, no se encontraron diferencias relacionadas con la edad y esto pudo deberse al limitado número de individuos de cada grupo.
Un hallazgo del estudio para resaltar es que 18 (31 %) de 40 niños de Ocaña y municipios vecinos no portaban título protector de anticuerpos. No se descarta que esa alta frecuencia pudo deberse a que se incluyeron niños que en realidad no fueron vacunados contra la Fiebre Amarilla, ya que no se confirmó con el carné y es común que los padres no conozcan o confundan contra cuál enfermedad sus hijos han sido inmunizados. No obstante, se esperaba mayor frecuencia de anticuerpos neutralizantes protectores considerando la alta cobertura de vacunación que se presume se ha conseguido en esa zona del país. Groot y colaboradores (26) no encontraron anticuerpos a título protector en 26,3 % de residentes de San Vicente de Chucurí (Departamento de Santander) tiempo después de una campaña de vacunación. Este hallazgo y el del estudio en Ocaña, muestran la necesidad de evaluar en la comunidad el grado de protección inducido por la vacuna meses después de campañas masivas.
La frecuencia de título protector de anticuerpos en vacunados fue menor cuanto más años de la inmunización (Tabla 2) y así ha sido demostrado por otros (23,27-30). Hay acuerdo en que ocurre disminución del nivel sérico de los anticuerpos a través del tiempo y es la razón para una segunda dosis después de 10 años (9,11). No obstante, anticuerpos a título > 1:10 se han encontrado 17 y 35 años después de la vacunación (29,30). Es para resaltar que en 31,6 % de los vacunados del estudio con 4 y más años de vacunación el título de anticuerpos fue <1:10, aunque no se descarta que el escaso número (n=19) pudo haber determinado el resultado. Esta frecuencia fue mayor que en europeos (25,5 %) con más de 10 años de inmunización (23).
No se conoce si individuos con título de anticuerpos < 1:10 son inmunes contra la infección natural por el VFA. Esto podría ser muy probable considerando que la vacuna es un virus atenuado que logra activar la inmunidad innata, inespecífica y celular (31-33). En ese contexto, es necesario investigar activación de la respuesta inmune de tipo celular en quienes no se detecta título protector de anticuerpos para conocer el grado de protección conferido por la vacuna.
La estrecha relación antigénica entre el VFA y el VDEN resulta en anticuerpos que reaccionan de forma cruzada (34) y esto se evidenció al detectar reducción de placas de infección del primer virus por incubación previa con suero de individuos no vacunados con inmunidad a dengue (Figura 1). En la experiencia de los autores (35) y de otros1 la reactividad cruzada con la prueba de neutralización se ha visto entre anticuerpos anti dengue versus VFA pero no al contrario. Esta reactividad alerta sobre la dificultad que podría tenerse al interpretar resultados sobre eficacia protectora de la vacuna 17 D, luego de una campaña de vacunación en residentes de áreas endémicas de dengue. Es muy posible incluir falsos positivos. En otro contexto, la reactividad de anticuerpos anti dengue podría verse como factor de protección contra infección natural contra el VFA y esto podría en parte explicar la ausencia de Fiebre Amarilla en áreas urbanas de municipios colombianos con brotes de Dengue y Fiebre Amarilla selvática. No existen estudios en humanos demostrando protección contra fiebre amarilla por inmunidad previa al dengue. No obstante, residentes en áreas con circulación simultánea de varios Flavivirus que se infectan con el VFA por lo general no desarrollan síntomas o la enfermedad es leve (36,37).
Los resultados presentados en este reporte confirman la eficacia protectora de la vacuna 17 D reportada en varios estudios y muestran la necesidad de evaluar la respuesta a la vacuna luego de campañas masivas de vacunación clarificando el grado de protección en quienes no portan título protector de anticuerpos neutralizantes. Debido a la alta cobertura de vacunación contra la fiebre amarilla en municipios colombianos con endemia de dengue, se hace necesario estudiar la influencia de la inmunidad previa al dengue sobre la respuesta a la vacuna 17 D.
Agradecimientos. A los médicos, enfermeras y bacteriólogos del Hospital Emiro Quintero Cañizares, funcionarios de la Secretaría de Salud del municipio de Ocaña y miembros del grupo de Epidemiología del Instituto Departamental de Salud de Norte de Santander por el soporte logístico para el estudio. Este estudio fue financiado por COLCIENCIAS - Universidad Industrial de Santander, proyecto No. 1102-04-16376.
REFERENCIAS
1. Monath T. Yellow fever: an update. Lancet Infect Dis. 2001;1:11-20. [ Links ]
2. World Health Organization. Yellow fever situation in Africa en South America. Weekly epidemiological record 2006;81;317-324. [ Links ]
3. Burke D, Monath T. Flavivirus. En: Knipe D, Howley P, Griffin D, Lamb R, Martin M, Roizman B, Straus S, eds. Fields Virology. Fourth edition. Philadelphia: Lippincott Williams and Wilkins; 2001. pp 1043-1126.
4. Price W, Thind I. Protection against West Nile virus induced by a previous injection with dengue virus. Am J Epidemiol. 1971; 94:596-606. [ Links ]
5. Bond J, Hammon W. Epidemiological studies of possible cross-protection between dengue and St. Louis encephalitis arboviruses in Florida. Am J Epidemiol 1970;92:321-330. [ Links ]
6. Xiao S-Y, Guzman H, Travassos da Rosa A, Zhu H-B, Tesh R. Alteration of clinical outcome and histopathology of yellow fever virus infection in a hamster model by previous infection with heterologous flaviviruses. Am J Trop Med Hyg. 2003; 68:695-703. [ Links ]
7. Theiler M, Anderson C. The relative resistance of dengue-immune monkeys to yellow fever virus. Am J Trop Med Hyg. 1975; 24:115-117. [ Links ]
8. Theiler M, Smith H. The use of yellow fever virus modified by in vitro cultivation for human immunization. J Exp Med 1937; 65:787-800. [ Links ]
9. World Health Organization. Standards for the manufacture and control of yellow fever vaccine. United Nations Relief and Rehabilitation Administration. World Health Organ Epidemiol Bull.1945; I:1-365. [ Links ]
10. Groot H. Sesenta años de vacuna antiamarílica. Biomédica 1999;19:269-271. [ Links ]
11. Monath T. Yellow fever vaccine. Expert Rev Vaccines 2005;4:553-574. [ Links ]
12. Belmusto-Worn V, Sanchez J, McCarthy K, Nichols R, Bautista C, Magill A, et al. Randomized, double-blind, phase III, pivotal field trial of the comparative immunogenicity, safety, and tolerability of two yellow fever 17D vaccines (Arilvax and YF-VAX) in healthy infants and children in Peru. Am J Trop Med Hyg 2005;72:189-197. [ Links ]
13. Tavares-Neto J, Freitas-Carvalho J, Teixeira M, Rocha G, Guerreiro S, Damasceno E, et al. Pesquisa de anticorpos contra arbovírus e o vírus vacinal da febre amarela em uma amostra da população de Rio Branco, antes e três meses após a vacina 17D. Rev Soc Bra Med Trop. 2004; 37:1-6. [ Links ]
14. Guerra H, Sardinha T, da Rosa A, Lima e Costa M. Effectiveness of the yellow fever vaccine 17D: an epidemiologic evaluation in health services. Rev Panam Salud Publica 1997;2:115-120. [ Links ]
15. Lopes O, Guimaraes S, Carvalho R. Studies on yellow fever vaccine. III-Dose response in volunteers. J Biol Stand. 1988;16:77-82. [ Links ]
16. Aguirre C. Fiebre Amarilla. Revista Médica de Bogotá1904; 285:198-208. [ Links ]
17. Peña A, Serpa R, Bevier G. Yellow fever in Colombia with special reference to epidemic in Socorro in 1920. J Prev Med. 1930:4; 417- 457. [ Links ]
18. Velandia M. Fiebre Amarilla y su control. Biomédica. 2004; 24:5-6. [ Links ]
19. Derecho a la salud: Evolución de algunos indicadores de interés en salud pública. [Internet]. Disponible en: http://www.minproteccionsocial.gov.co/vbecontent/library/documents /DocNews No15417DocumentNo2666.PDF. Consultado 10/03/2007.
20. Groot H, Gast A. Observaciones sobre la vacuna de virus 17D contra fiebre amarilla aplicada por escarificación cutánea. Rev Invest (Guadalajara). 1965; 5:5-25. [ Links ]
21. Ocazionez R, Cortés F, Gómez S. Serotipo, Patrón de infección y dengue hemorrágico en área endémica colombiana. Rev Salud Publica (Bogotá). 2007; 9:262-274. [ Links ]
22. Ocazionez R, Cortés F, Villar L, Gómez S. Temporal distribution of dengue virus serotypes in Colombian endemic area and dengue incidence. Re-introduction of dengue-3 associated to mild febrile illness and primary infection. Mem Inst Oswaldo Cruz 2006; 101:725-731. [ Links ]
23. Niedrig M, Laderman M, Emmerich P, Lafrenz M. Assessment of IgG antibodies against yellow fever virus after vaccination with 17D by different assays: neutralization test, haemaglutination inhibition test, immunofluorescence assay and ELISA. Trop Inf Int Health 1999; 4:867-871. [ Links ]
24. Monath T, Nichols R, Archambault W, Moore L, Marchesani R, Tian J, et al. Comparative safety and immunogenicity of two yellow fever 17D vaccines (ARILVAX and YF-VAX) in a phase III multicenter, double-blind clinical trial.Am J Trop Med Hyg. 2002;66:533-541. [ Links ]
25. Fox J, Cabral A. The duration of immunity following vaccination with the 17D strain of yellow fever virus. Am J Hyg. 1943;37:93-120. [ Links ]
26. Groot H, Kerr JA, Sanmartin CV. Antibodies to yellow fever and other arthropod-borne viruses in human residents of San Vicente de Chucuri, Santander, Colombia. Am J Trop Med Hyg. 1959;8:175-189. [ Links ]
27. Rosenzweig E, Babione R, Wisseman J. Immnunological studies with group B arthropod-borne viruses, IV. Persistence of yellow fever antibodies following vaccination with 17D strain yellow fever vaccine. Am J Trop Med Hyg. 1963;12:230-235. [ Links ]
28. Smithburn K, Mahaffy A. Immunization against yellow fever: studies on time of development and duration of induced immunity. Am J Top Med 1945;25:217-223. [ Links ]
29. Poland J, Calisher C, Monath T, Downs W, Murphy K. Persistence of neutralizing antibody 30-35 years after immunization with 17D yellow fever vaccine. Bull WHO 1981; 59:895-900. [ Links ]
30. Groot H, Ribero R. Neutralizing and haemaglutination-inhibition antibodies to yellow fever 17 years after vaccination with 17D vaccine. Bull WHO 1962;27: 699-707. [ Links ]
31. Querec T, Pulendran B. Understanding the role of innate immunity in the mechanism of action of the live attenuated Yellow Fever Vaccine 17D. Adv Exp Med Biol.. 2007; 590:43-53. [ Links ]
32. Barba-Spaeth G, Longman R, Albert M, Rice C. Live attenuated yellow fever 17D infects human DCs and allows for presentation of endogenous and recombinant T cell epitopes. J Exp Med. 2005; 202:1179-1184. [ Links ]
33. Santos A, Bertho A, Dias D, Santos J, Marcovistz R. Lymphocyte subset analyses in healthy adults vaccinated with yellow fever 17DD virus.Mem Inst Oswaldo Cruz 2005;100:331-337. [ Links ]
34. Calisher C, Karabatsos N, Darlymple J, Shope R, Porterfield J, Westaway E, et al. Antigenic relationship between Flavivirus as determined by cross-neutralization test with polyclonal antisera. J Gen Virol. 1989;70:37-43. [ Links ]
35. Gómez S, Ocazionez R. Neutralización del virus de la fiebre amarilla por anticuerpos anti-dengue como factor que puede contribuir a la ausencia de casos urbanos. Biomédica. XIII Congreso Colombiano de Parasitología y Medicina Tropical. 2007;27(2):158 [ Links ]
36. Monath T, Craven R, Adjukiewicz A, Germain M, Francy D, Ferrara L, et al. Yellow fever in the Gambia, 1978-1979: epidemiologic aspect with observations on the occurrence of Orungo virus infections. Am J Trop Med Hyg. 1980:29;912-928. [ Links ]
37. Ashcroft M. Historical evidence of resistance to yellow fever acquired by residence in India. Trans R Soc Trop Med Hyg.1979; 73: 247-248. [ Links ]














