Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Salud Pública
Print version ISSN 0124-0064
Rev. salud pública vol.12 no.6 Bogotá Nov./Dec. 2010
Dinámica de transmisión del Dengue clásico con control mecánico y profilaxis
Classical dengue transmission dynamics involving mechanical control and prophylaxis
Hernán D. Toro-Zapata1, Leonardo D. Restrepo1, Juan G. Vergaño-Salazar2 y Aníbal Muñoz-Loaiza1
1 Departamento de Matemáticas, Facultad de Educación, Universidad del Quindío. Armenia, Colombia. hdtoro@uniquindio.edu.co, ldrestrepo@uniquindio.edu.co, anibalml@hotmail.com
2 Departamento de Física Facultad de Ciencias Básicas y Tecnologías Universidad del Quindío, Armenia, Colombia. jgvs190@gmail.com.
Recibido 26 Febrero 2010/Enviado para Modificación 20 Diciembre 2010/Aceptado 27 Diciembre 2010
RESUMEN
Se modela la dinámica de transmisión del dengue clásico en una región endémica considerando el uso de medidas preventivas y de control mecánico en la reducción de la transmisión de la enfermedad. Se plantea un sistema de ecuaciones diferenciales ordinarias que describe la dinámica y mediante simulación numérica se determina su evolución en el tiempo. Se comparan diferentes estrategias de control mecánico y profilaxis con la situación sin control. Se determina el número básico de reproducción R0, mostrando que si R0 > 1 hay un alto riesgo de epidemia y que en caso contrario la enfermedad se mantiene en niveles de bajo impacto; estos resultados se contratan con los obtenidos numéricamente. Se concluye que si bien la profilaxis y el control mecánico por si solos brindan resultados efectivos en el control de la enfermedad, cuando se combinan ambos controles los niveles de infección se ven reducidos significativamente. Niveles de control mecánico y profilaxis cercanos al 60 % son los que brindan resultados adecuados en el control del brote de dengue.
Palabras Clave: Modelos Matemáticos, dengue, número básico de reproducción, control de vectores (fuente: DeCS, BIREME).
ABSTRACT
Dengue fever transmission dynamics were studied in an endemic region considering the use of preventative measures and mechanical control in reducing transmission of the disease. A system of ordinary differential equations was proposed, describing the dynamics and their evolution as determined by numerical simulation. Different mechanical control and prophylaxis strategies were compared to the situation without control. The basic reproduction number R0 was determined R0 to show that if R0 > 1 there would be a risk of an epidemic and otherwise the disease would have low impact levels. The basic reproduction number helps determine the dynamics' future pattern and contrast the results so obtained with those obtained numerically. It was concluded that although prophylaxis and mechanical control alone provide effective results in controlling the disease, if both controls are combined then infection levels become significantly reduced. Around 60 % mechanical control and prevention levels are needed to provide suitable results in controlling dengue outbreaks.
Key Words: Mathematical model, dengue, basic reproduction number, vector control (source: MeSH, NLM).
El dengue es una infección viral transmitida por artrópodos, siendo Aedes aegypti el mosquito vector y principal responsable de la transmisión de la enfermedad. Los virus del dengue son, identificados con los serotipos den-1, den-2, den-3 y den-4, y pueden producir manifestaciones leves (dengue clásico), dengue hemorrágico y síndrome de shock del dengue, que al no ser tratados a tiempo pueden provocar la muerte. Los individuos que se recuperan de la infección de alguno de los serotipos se tornan inmunes a él y puede haber inmunidad cruzada entre los serotipos por un periodo corto de tiempo (1).
Un brote epidémico ocurre cuando hay una población susceptible en una región con virus circulando (región endémica), y usualmente sucede cuando hay un crecimiento gradual y localizado de la densidad de A. aegypti. La situación se complica por los cambios demográficos a nivel global, la deteriorada infraestructura de los servicios de salud en muchos de los países, el incremento en los viajes internacionales y el cambio climático que altera los ecosistemas y crea las condiciones ideales para la expansión y diseminación de organismos patógenos y de vectores (2-4).
El modelado del dengue en la literatura está orientado principalmente a:
1. La dinámica de transmisión del dengue clásico, con población humana constante y población humana variable1 (5-10).
2. La transmisión vertical en el mosquito (11).
3. La dinámica de transmisión espacio temporal (12,21,22).
4. La dinámica de transmisión de los diferentes serotipos del virus (13,14).
5. Influencia del clima en la ocurrencia del dengue (1,15-19).
6. La dinámica de estructura poblacional (20).
7. El control del mosquito:
- Utilizando el efecto de adulticidas y larvicidas en las tasas de mortalidad y control mecánico (3,18,23, 24).
- Aplicando el principio del máximo de Pontryagin2 (10,25-28).
El modelo
Se considera un brote epidémico de dengue clásico en una región endémica. Con y1 = y1(t) se representa la población susceptible, con y2= y2(t) se representa la población infectada, y con y3 = y3(t) se representan los individuos que se recuperan de la enfermedad. El mosquito adulto puede ser portador o no del virus, y en consecuencia los segundos y4 = y4(t) están en condiciones de transmitirlo a un huésped susceptible, mientras que los primeros y5 = y5(t) se alimentan del huésped sin transmitir el virus. La población de mosquitos inmaduros y6 = y6(t) (huevos, larvas y pupas) se encuentra libre del virus, y su desarrollo depende de la disponibilidad de criadero y7 = y7(t).
Sea la población humana total N = y1+ y2+ y3> 0 y la y4+ y5 población total de mosquitos adultos también positiva. Con esto se tiene que el número promedio de personas que se infectan con el virus en un tiempo t
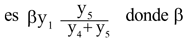
es la probabilidad de transmisión por contacto de un mosquito portador y una persona susceptible. Se tiene entonces que la ecuación que describe la variación de y1 con respecto al tiempo es,
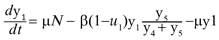
El término µN representa el número promedio de nacimientos que ocurren durante el brote y µy1 es el número promedio de personas que mueren por causas ajenas a la infección. El término u1y1 denota el número promedio de personas que hace uso de medidas preventivas para evitar la transmisión de la enfermedad, de modo que [(1-u]1)y1 es el número promedio de personas que no usan medidas preventivas y por tanto tienen mayor riesgo de infectarse. Denotando con θ la tasa de recuperación de los infectados, el número promedio de personas que se recuperan de la enfermedad está dado por el término θ y2 , así la población infectada está descrita por la ecuación,
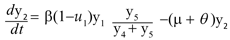
Donde µy2 es el número promedio de personas infectadas que mueren por causas ajenas a la infección. La población recuperada se describe mediante,
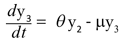
Con µy3 el número promedio de personas recuperadas que mueren por causas ajenas a la infección. Para el vector se define el parámetro λ como la probabilidad de que un vector no portador del virus lo adquiera de una persona infectada; así el número promedio de mosquitos no portadores del virus que se infecta está dado por el término
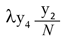
Las ecuaciones para la población de mosquitos no portadores y portadores respectivamente son:
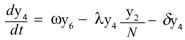
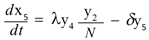
Donde δy4 y δy5 representan el número promedio de mosquitos portadores y no portadores del virus, respectivamente que mueren por causas no relacionadas con el virus. El término ωy6 y es el número promedio de mosquitos que alcanzan la madurez, así ω es la tasa de maduración del mosquito.
Se asume que la población de mosquitos inmaduros obedece la ley logística, con φ la tasa de ovoposición de los mosquitos y γy7 la capacidad de carga, donde y7 , es el número de criaderos disponibles y γ es la proporción de mosquitos por criadero. Los inmaduros inviables se miden con el término εy6 donde e representa la tasa de mortalidad, se obtiene la ecuación,
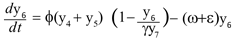
El número de criaderos tiene capacidad de carga k y son creados a una tasa υ y por lo tanto éstos siguen un comportamiento logístico dado por la ecuación,
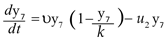
Donde u2y7 representa la aplicación del control mecánico. Se tiene el sistema de ecuaciones diferenciales para describir la transmisión del dengue:
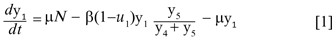
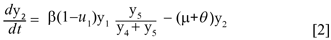

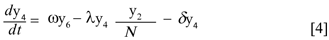
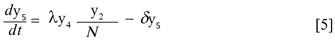
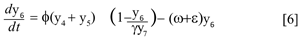
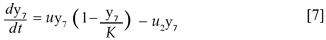
Donde θ, γ, δ, ε, ω, µ, φ, k > 0; β, λ ∈(0,1) y υ≥0. Para demostrar que N es constante basta con verificar que 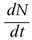 = 0,
= 0,
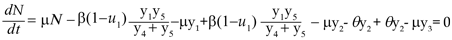
Este resultado es importante porque al expresar y3 = N - y1- y2 , puede eliminarse la tercera ecuación del sistema. Cambiamos la notación por una más conveniente haciendo x1 = y1 , x2 = y2 , x3 = y5 , x4 = y4 + y5 , x5 = y6 y x6= y7. Con lo que el sistema queda reducido a seis ecuaciones y desacoplado en dos sistemas y una ecuación diferencial. El sistema formado por las primeras tres ecuaciones (sistema A) es el responsable por la dinámica de la enfermedad en los humanos:
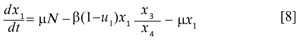
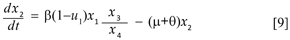
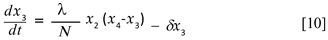
El sistema B, formado por la cuarta y quinta ecuación describe la dinámica del mosquito:

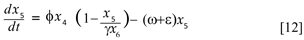
Finalmente la ecuación diferencial que describe la dinámica de los criaderos,
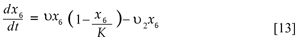
Definido sobre
Ω={(x1,x2, x3,x4,x 5,x6)∈R6:0 < x1 ≤N,0 < x2 < N, x3 , x4 > 0,0 < x5 ≤ γk; 0 < x6 ≤ k}
Que representa una región del espacio R6 en la que las variables y el modelo planteado tienen sentido biológico.
Número básico de reproducción R0
El Número básico de reproducción R0 está ligado a la efectividad de los medios de transmisión de la enfermedad y a la duración de los periodos epidemiológicos, por esta razón debe determinarse a partir del sistema A, responsable de la dinámica de la enfermedad en los humanos. Está formalmente definido como el número de infecciones secundarias que un solo individuo infectado es capaz de producir en una población de hospederos susceptibles.
Determinar el R0 es equivalente a responder la pregunta: ¿bajo qué condiciones la población infectada con la enfermedad aumenta.
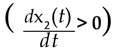
considerando la llegada de un individuo infeccioso en una población enteramente susceptible (x11(t)=N) Puede entenderse que no hay infección en el medio y que el brote es producido por un individuo infectado que entra en la población. De este modo, el R0 se obtiene mediante la desigualdad,
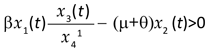
Donde x41 = 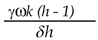 corresponde al valor de x4(t) en el punto de equilibrio estable del subsistema B y donde h
corresponde al valor de x4(t) en el punto de equilibrio estable del subsistema B y donde h 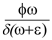 es el umbral de crecimiento del mosquito. A partir de la ecuación (10) se obtiene que; x3(t)=
es el umbral de crecimiento del mosquito. A partir de la ecuación (10) se obtiene que; x3(t)= 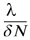 x2(t) (x41 - x3(t)) llevando esta expresión a [9] se tiene,
x2(t) (x41 - x3(t)) llevando esta expresión a [9] se tiene,
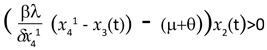
Y por lo tanto, se tiene que la población infectada aumenta cuando
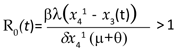
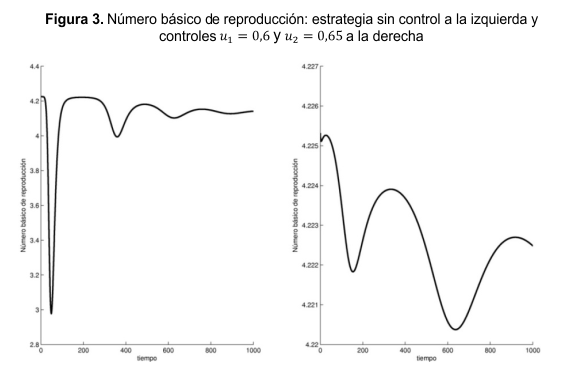
Un incremento en las tasas β ó λ tiende a incrementar el R0, un incremento en la virulencia del parásito pueden reducir la propagación del patógeno a través de la población, lo que conduce a un decrecimiento en R0. En la Figura 3 se muestra el comportamiento del R0 con u1= u2 = 0 en la figura de la izquierda y con u1= 0,6 y u2= 0,65 en la figura de la derecha. Si los mosquitos están inicialmente libres del virus y el brote es ocasionado por la llegada de un individuo infeccioso, entonces x3(0)=0 y por lo tanto,
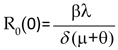
Expresión importante en regiones que tienen poblaciones humanas y de mosquitos, pero en las que no circula el virus; cuando éste llega de otras regiones, la enfermedad puede colonizar la población de mosquitos y generar un brote de dengue. Según la teoría del R0, la enfermedad desaparece cuando R0(0) < 1, se presenta endemia cuando R0(0)=1 y se presenta epidemia cuando R0(0) > 1.
Para interpretar el significado que tiene R0(0), se tiene en cuenta que 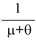 es el periodo infeccioso y que β es la probabilidad de que una persona adquiera el virus de un mosquito portador, por lo tanto la incidencia en la población humana está dada por el término
es el periodo infeccioso y que β es la probabilidad de que una persona adquiera el virus de un mosquito portador, por lo tanto la incidencia en la población humana está dada por el término 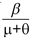 . Del mismo modo, la incidencia sobre el mosquito esta dada por
. Del mismo modo, la incidencia sobre el mosquito esta dada por 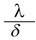 , donde
, donde 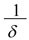 es la vida media del mosquito, y λ es la probabilidad de que un mosquito adquiera el virus de na persona infectada.
es la vida media del mosquito, y λ es la probabilidad de que un mosquito adquiera el virus de na persona infectada.
Resultados numéricos
La simulación se hizo en ambiente MATLAB. Los valores de los parámetros se muestran en la Tabla 1 y fueron extraídos de la literatura. El tiempo usado fue de 500 días. En las Figuras 1 y 2 se muestra la simulación para las variables x1(t) a x6(t) considerando u2= 0 en la Figura 1 y u2= 0,65 en la Figura 2. Se observa como al aumentar el valor de u1 se reduce la transmisión de la enfermedad (aumentan los susceptibles y disminuyen los infectados y los mosquitos portadores). La población total de mosquitos, los mosquitos inmaduros y los criaderos no se ven afectados por la variación en u1 sino por la variación en u2 (Figuras 1 y 2).

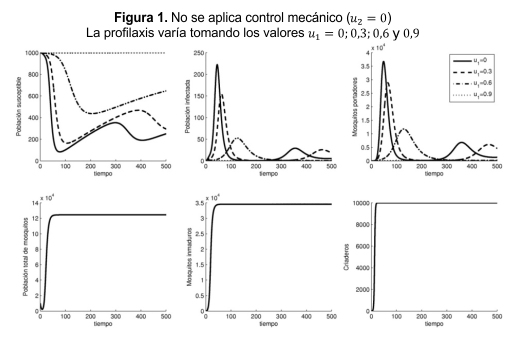
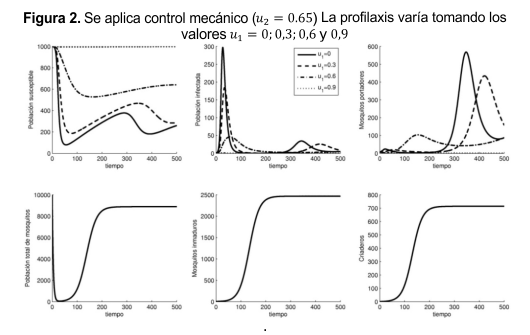
El mayor número promedio de infectados se presenta en ausencia de los dos controles y el menor corresponde al máximo nivel de control. Utilizar un control mecánico superior a 0,7 implica la extinción de la población de mosquitos, lo cual no es alcanzable; se debe aceptar como estrategia de control la que equilibre niveles bajos de mosquitos portadores con niveles bajos de infectados, por ejemplo la mostrada para u1= 0,6 y u2= 0,65.
Conclusiones
Las poblaciones afectadas por el virus responden tanto al control mecánico, como a la profilaxis, se puede afirmar que son estrategias adecuadas para el control del dengue durante un brote epidémico. El conocimiento de la dinámica y del comportamiento del número básico de reproducción permite establecer estrategias para mantener la enfermedad en niveles de bajo impacto.
La profilaxis o el control mecánico por si solos brindan resultados efectivos en el control de la enfermedad pero cuando se combinan ambos controles se obtienen mejores resultados. Niveles de control mecánico y profilaxis cercanos al 60 % son los que brindan resultados adecuados en el control del brote de dengue. Éstos niveles de control pueden variar según los valores de los demás parámetros del modelo que son tomados de fuentes secundarias.
Según la Figura 3, el control mecánico y la profilaxis no tienen impacto significativo en la reducción del número básico de reproducción; esto debe entenderse como que siempre hay riesgo de que un brote epidémico prospere y se propague en toda la región.
Una región geográfica con las características consideradas en este trabajo, puede aplicar el modelo y esto le permite determinar el nivel adecuado de control mecánico y profilaxis que requiere. Las instituciones encargadas de la salud pública deben guardar registros de parámetros demográficos, epidemiológicos y ecológicos, para que modelos como este y otros que existen en la literatura, puedan ser aplicables a casos reales.
NOTAS AL PIE
1 Muñoz A. Modelado matemático del dengue clásico. Tesis doctoral. Doctorado en Ciencias Matemáticas. Facultad de Ciencias Físico Matemáticas (FCFM), Benemérita Universidad Autónoma de Puebla (BUAP). Biblioteca FCFM-BUAP, Puebla, México, 2007.
2 Toro ZHD. Modelo de la transmisión del dengue clásico durante un brote epidémico. Tesis de Maestría.
Maestría en Biomatemáticas, Universidad del Quindío. Biblioteca Euclides Jaramillo Arango, Universidad
del Quindío, Armenia. Colombia. 2010.
REFERENCIAS
1. Chowel G, Diaz-Dueñas P, Miller JC, Alcazar-Velazco A, Hyman JM, Fenimore PW, et al. Estimation of the reproduction number of dengue fever from spatial epidemic data. Mathematical Biosciences. 2007; 208:571-589. [ Links ]
2. Busemberg S, Cooke K. Vertically transmitted diseases. Berlin: Spriger-Verlag; 1988. [ Links ]
3. Buratani MN, Chen M, Chow A, Coutinho FAB, Goh KT, Lopez LF, et al. Modelling the control strategies against dengue in Singapore. Epidemiol. Infect. 2007; 136:309-319. [ Links ]
4. PAHO. Dengue en las Américas. Programa Regional de Dengue. Septiembre; 2007. [ Links ]
5. Coutinho FAB, Burattini MN, Lopez LF, Massad E. Threshold conditions for a nonauthonomous epidemic system describing the population dynamics of dengue. Bulletin of Mathematical Biology. 2006; 68:2263-2282. [ Links ]
6. Coutinho FAB, Burattini MN, Lopez LF, Massad E. An approximate threshold condition for a non-authonomous system: An application to vector-borne infection. Mathematics and Computers in simulation. 2005; 70:149-158. [ Links ]
7. Dye C. Models of the population dynamics of the yellow fever mosquito, A. aegypti. Journal of Animal Ecology. 1984; 53:247-268. [ Links ]
8. Esteva L, Vargas C. Model for dengue disease with variable human population. Journal of Mathematical Biology. 1999; 38:220. [ Links ]
9. Mendes LP, Codeco TC, Massad E, Struchiner CJ. Uncertainties regarding dengue modelling in Rio de Janeiro, Brazil. Memorias del Instituto Oswaldo Cruz. 2003; 98:871-878. [ Links ]
10. Esteva L, Vargas C. Influence of vertical and mechanical transmission on the dynamics of dengue disease. Mathematical Biosciences. 2000; 167:51-64. [ Links ]
11. Takahashi LT, Maidana NA, Ferreira Jr. WC. O Aedes e sua onda. Biomatemática XIII 2003; 33-44. [ Links ]
12. Esteva L, Vargas C. Coexistence of different serotypes of dengue virus. J. Math. Biol. 3003; 46:31-47. [ Links ]
13. Feng Z, Velasco-Hernández JX. Competitive exclusion in a vector-host model for the dengue fever. J. Math. Biol. 1997; 35:523-544. [ Links ]
14. Alcántara IC, Toledo RP, Morales RM. Modelagen da incidência do dengue na Paraíba, Brasil, por modelos de defasagem distribuída. Cad. Saúde Pública, Rio de Janeiro. 2007; 23 (11):2623-2630. [ Links ]
15. Lloyd AL, Zhang J, Root M. Stochasticity and heterogeneity in host-vector models. Journal of Royal Society Interface 2007; 4:851-863. [ Links ]
16. Marcelo O, Solari HG, Schweigmann N. A stochastic population dynamics model for Aedes aegypti: Formulation and application to a city with temperate climate. Bulletin of Mathematical Biology; 2006. Volume 68, Number 8, 1945-1974. [ Links ]
17. Predescu M, Sirbu G, Levins R, Awerbuch-Friedlander T. On the dynamics of a deterministic and stochastic model for mosquito control. Applied Mathematics Letters 2007; 20:919-925. [ Links ]
18. Pongsumpan P, Tang IM. Transmission of dengue hemorrhagic fever in an age structured population. Journal of Mathematical and Computer Modelling. 2003; 37(9-10):949-961. [ Links ]
19. Bartley L, Donelly C, Garnett GP. The seasonal pattern of dengue in endemic areas. Mathematical models of mechanisms, J. Transactions of the Royal Society of Tropical Medicine and Hygiene 2002; 96(4):387-397. [ Links ]
20. Freitas RM, Codeco CT, de Oliveira RL. Body size-associated survival and dispersal rates of Aedes aegypti in Rio de Janeiro. Medical and Veterinary Entomology. 2007; 21:284-292. [ Links ]
21. Rotela C, Fouque F, Lamfri M, Sabatier P, Introini V, Zaidenberg M. Space-time analysis of the dengue spreading dynamics in the 2004 Tartagal outbreak, Northern Argentina. Acta tropica. 2007; 103:1-13. [ Links ]
22. Newton EA, Reiter PA. A model of the transmission of dengue fever with an evaluation of the impact of Ultra-Low Volume (ULV) insecticide applications on dengue epidemics. American Journal Of Tropical Medicine and Hygiene. 1992; 47:709-720. [ Links ]
23. Caetano MA, Yoneyama T. Optimal and sub-optimal control in Dengue epidemics. Optimal control applications and methods. 2001; 22:63-73. [ Links ]
24. Greenhalgh D. Some results on optimal control applied to epidemics. Mathematical Biosciences. 1986; 88:125-158. [ Links ]
25. Gersovitz M, Hammer JS. The economical control of infectious diseases. The Economic Journal. 2004; 144:1-27. [ Links ]
26. Anderson RM. The populations dynamics of infectius diseases: Theory and applications. New York: Champan and Hall; 1982. [ Links ]
27. Bailey NTJ. The mathematical theory of infectius diseases. New York: Hafner Press; 1957. [ Links ]














