Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Salud Pública
Print version ISSN 0124-0064
Rev. salud pública vol.15 no.2 Bogotá Mar./Apr. 2013
Genotoxicidad sobre linfocitos humanos expuestos a PM10 de tres sitios del Valle de Aburrá (Antioquia)
Genotoxicity in human lymphocytes exposed to PM10 from three sites in the Valle de Aburrá (Antioquia)
Lady C. Mendoza-Zapata, Luz Y. Orozco-Jiménez, Lina M. Zapata-Restrepo y Jaime A. Palacio-Baena
Universidad de Antioquia. Medellín, Colombia. mendozapata@gmail.com, lyorozcoj@gmail.com, zapata.lina@gmail.com, jpalaciob@gmail.com.
Recibido 16 Noviembre 2012/Enviado para Modificación 5 Febrero 2013/Aceptado 21 Marzo 2013
RESUMEN
Objetivo Evaluar la calidad del aire en tres sitios del Valle de Aburrá (Antioquia) a través de la determinación de la genotoxicidad del PM10 en linfocitos humanos.
Métodos A partir del valor de referencia de PM10 para Colombia (50 μg/m3/año) se eligieron tres sitios del Valle de Aburrá con diferente promedio de PM10, Barbosa con 25 μg/m3, Corantioquia con 44 μg/m3y Facultad de Minas con 91 μg/m3. Los filtros de PM10 expuestos por 24 horas, se analizaron en la épocas de lluvia, transición y seca entre Julio de 2011 y abril de 2012. Con el extracto orgánico obtenido en cada filtro se trataron linfocitos humanos para evaluar in vitro el daño en el ADN por medio del ensayo Cometa Alcalino.
Resultados Todos los sitios indujeron genotóxicidad altamente significativa (p< 0.001) respecto al control negativo, presentando el mayor daño durante la época de transición. Se observaron diferencias significativas (p<0.05) en la genotoxicidad inducida por el PM10 entre los tres sitios evaluados.
Conclusiones Aunque los valores de PM10 reportados para Barbosa y Corantioquia fueron inferiores al nivel máximo permisible, se encontró actividad genotóxica del PM10 proveniente tanto de ellos como de Facultad de Minas cuyo valor de PM10 es superior a la norma. Estos resultados indican que únicamente el monitoreo fisicoquímico del material particulado es insuficiente para evaluar el riesgo relativo sobre la población expuesta. En consecuencia, estos estudios deben ser complementados con biomarcadores de genotoxicidad como el ensayo cometa.
Palabras Clave: Contaminación ambiental, biomarcadores, genotoxicidad, ensayo cometa (fuente: DeCS, BIREME).
ABSTRACT
Objective Assessing air quality by determining PM10 genotoxicity in human lymphocytes at three locations in the Valle de Aburrá (Antioquia department).
Methods Three sites were chosen in the Valle de Aburrá (Barbosa, Corantioquia and the School of Mines) using Colombian reference (50 g/m3) and PM10content values, having annual low (25 mg /m3), medium (44 ug/m3) and high PM10 average (91 ug/m3). PM10filters were analyzed during three different seasons between 2011 and 2012: rainy, transitional and dry. Human lymphocytes were treated with the organic extract obtained from each filter to evaluate DNA damage using an alkaline comet assay.
Results Genotoxicity was found to be highly significant (p<0.001) in all cases, compared to the negative control. The highest damage (six times) was seen in material from the School of Mines and during the transitional period. Differences were found between material from Barbosa and Corantioquia regarding that from the School of Mines concerning the induction of damage.
Conclusions Although the PM10 values reported for Barbosa and Corantioquia were below the maximum permitted level, genotoxic activity was found for PM10from both sites as well as for the School of Mines. These results show that physical-chemical monitoring of particulate matter is not enough for assessing the exposed population's relative risk. Such analysis should thus be accompanied by using genotoxicity biomarkers, such as the comet assay.
Key Words: Environmental pollution, biomarker, genotoxicity, comet assay (source: MeSH, NLM).
La industrialización y el aumento del tráfico vehicular han incrementado la exposición de la población humana a agentes potencialmente genotóxicos, que agreden mediante múltiples mecanismos el patrimonio genético (1). De acuerdo con Park & Choi (2) en Europa y Estados Unidos se ha registrado un aumento de enfermedades respiratorias y cardiovasculares asociadas con la contaminación atmosférica. Especialmente se ha encontrado una relación positiva entre la morbilidad y la mortalidad con altos niveles de partículas PM10 en centros urbanos (3). Las partículas menores de10 micras, PM10, resultan principalmente de la combustión incompleta de diferentes tipos de combustibles y de fuentes industriales (4). Este material, que es inhalado a través de la respiración, puede depositarse en tráquea, bronquios y bronquiolos de animales y humanos. A este material se adhieren contaminantes orgánicos con conocida actividad muta carcinógenica como los Hidrocarburos Policíclicos Aromáticos (HPA), benceno, tolueno y compuestos inorgánicos tóxicos como sulfatos, nitratos, amonio y metales pesados (5).
Medellín es una urbe con alta contaminación atmosférica, debido a la obsolescencia e incremento del parque automotor, baja calidad del combustible utilizado, reducida cobertura vegetal en las vías principales e insuficiente control de las emisiones móviles e industriales (6). El monitoreo de la calidad del aire en el Valle del Aburrá se basa en el seguimiento de variables físico-químicas, pero aún se desconocen muchos efectos ecológicos y epidemiológicos ocasionados por el deterioro de la calidad del aire. En los últimos años se han monitoreado los niveles de contaminantes como: monóxido de carbono, dióxido de nitrógeno y de azufre, ozono, PM10, PM2.5 y partículas totales en suspensión (PST) en gran parte del Valle de Aburrá; pero aún se desconoce la composición del material particulado (MP) del Valle y los posibles efectos genotóxicos que permitan determinar de forma temprana el peligro para la salud de la población expuesta.
En las últimas décadas se ha incrementado el interés en la evaluación de los impactos de compuestos puros o de mezclas potencialmente genotóxicas y carcinogénicas, ya que estas sustancias generan a largo plazo efectos adversos sobre la salud de los ecosistemas y de los humanos expuestos. Las alteraciones tempranas previas al desarrollo de una enfermedad, constituyen biomarcadores apropiados para el análisis de riesgo ambiental (7) y en consecuencia, son usados como una primera señal en un "sistema de alerta temprano" (8).
Algunas entidades de control ambiental han validado una serie de pruebas para la generación de información como insumo inicial para el análisis de riesgo para la salud y para la generación de estrategias de regulación (9-10). El ensayo cometa es una de las metodologías más usadas para detectar daño genómico, con él se evalúa la integridad del ADN, aspecto fundamental para la salud de los organismos, ya que los quiebres o rupturas del ADN que constituyen lesiones premutagénicas potenciales (2).
Esta investigación busca establecer a través del ensayo cometa alcalino la actividad genotóxica del material particulado PM10 de tres sitios del Valle de Aburrá en células humanas y su relación con la época climática para implementarlo como parámetro de evaluación de la calidad del aire y caracterizar su potencial peligro para la salud.
MATERIALES Y MÉTODOS
Área de estudio y sitios de muestreo
El Valle de Aburrá está ubicado en el Departamento de Antioquia, a 1 538 msnm, la temperatura fluctúa entre los 13 y 35°C y la precipitación media alcanza 2200 mm por año. Aunque los vientos característicos del Valle soplan generalmente de Norte a Sur, son modificados constantemente por la topografía (11).
De acuerdo con los resultados del monitoreo del material particulado de la Red Nacional de Vigilancia de la Calidad del Aire (REDAIRE) en el Valle del Aburrá, se eligieron tres sitios de muestreo con diferentes niveles de contaminación (Fig.1 y Tabla 1) (12).
Obtención del material particulado PM10
REDAIRE cuenta con muestreadores de alto volumen PM10 a lo largo del Valle de Aburrrá. Estos equipos se fundamentan en el principio de impactación inercial para clasificar las partículas según el tamaño. Las partículas con diámetro ≤10μm son depositadas en filtros de cuarzo expuestos durante 24 horas.
Obtención del Material Orgánico Extraíble (MOE)
Para la obtención del MOE se siguió la metodología propuesta por Sato et al., (13) con algunas modificaciones. Los filtros fragmentados se llevaron a recipientes de vidrio, se cubrieron con 2 ml de Diclorometano (DCM) por cada gramo de PM10 y se sometieron a ultrasonicación durante una hora con el fin de desprender los compuestos orgánicos adheridos a las partículas. Posteriormente, el solvente se rotaevaporó, se diluyó en PBS y se emulsionó por medio de una llave de tres vías acoplada a un sistema de dos jeringas y un filtro de 0.22 μm, con el fin de obtener una solución estéril para los ensayos celulares.
Citotoxicidad y ensayos celulares
A partir de 10mL de sangre heparinizada se obtuvieron linfocitos humanos provenientes de un voluntario sano, no fumador ni consumo de alcohol, no deportista de alto rendimiento. Para la separación de las células se empleó el método de separación por gradiente con Ficoll Hystopaque (14). En la suspensión celular, se determinó la citotoxicidad mediante el uso del colorante vital azul de tripano en cámara de Neubauer. Para el cálculo de la citotoxicidad se empleó la expresión citoxicidad (%)= (No. de células muertas / No. de células totales)*(100)
Los ensayos con el MOE se realizaron cuando la citotoxicidad fue menor al 10 %. Con el MOE de cada filtro se hicieron dos ensayos independientes por duplicado y se trataron 100 000 linfocitos con 25, 50 y 100 Ñg equivalentes de PM10 durante una hora. Solo las suspensiones celulares que presentaron citotoxicidad máxima de 25±5 % se consideraron genotóxicas (15). Un filtro sin exposición a PM10 fue empleado como blanco y se le realizó el mismo procedimiento. Se contó con un control negativo y para el control positivo se utilizó peróxido de hidrógeno 100mM.
Evaluación Genotóxica del MOE por medio del ensayo Cometa Alcalino
Para visualizar las rupturas generadas por el MOE, se siguieron el protocolo propuesto por Singh et al., (16) y las modificaciones para trabajar en gelbond (17). Inicialmente, se mezclaron 20 μl de células tratadas con 80 uL agarosa de bajo punto de fusión al 0.5 % (DEACI), de esta mezclase sembraron 10 μl en la lámina del gelbond, luego de la solidificación a 4°C se llevaron a una solución lisis fresca (NaCl 2.5 M, Na2EDTA 100 mM, Tris 10 mM, sarcosinato de sodio 1 %, Triton X-100 y DMSO 10%) durante 24 h. Al concluir este periodo, las láminas se dejaron 20 minutos en buffer de electroforesis fresca (Na2EDTA 1 mM y NaOH 300 mM a pH 13.5) para permitir la desnaturalización del ADN. Luego se hizo el corrido electroforético a 25mV y 300mA (BIORAD Power Pac 3 000) por 30 minutos a 4°C en condiciones de oscuridad. Las láminas Gelbond se lavaron con solución neutralizante (Tris- HCl 0.4M a pH 7.5), se tiñeron con Bromuro de Etidio 2ul/ml y la lectura de los núcleos se hizo en un microscopio de fluorescencia marca Boeco, con filtro verde y magnificación de 20X. Se analizaron 100 células para cada tratamiento con el software Casp y los resultados se expresaron como longitud de cola del cometa (micrómetros).
El criterio para determinar daño genético fue la media de la longitud de cola del control negativo más la desviación estándar más uno (X±DS+1). De acuerdo a este valor, se clasificó arbitrariamente el tipo de daño (TD) en cinco categorías: TD=0 células sin daño; TD=1 células con daño bajo; TD=2 células con daño medio; TD=3 células con daño alto y TD=4 células con daño total. Con base en ellas se determinó el Índice de Daño Ponderado (IDP) por tratamiento, según la fórmula propuesta por Ferreiro et al (18): IDP = (n1+2n2+3n3+4n4). Donde: IDP es el índice de Daño Ponderado; n1 a n4 el número de células por categoría.
Además se consideró el factor de inducción (FI) de daño, como el incremento relativo de la longitud de cola del tratamiento con relación a la longitud de cola del control (19), así:
FIa=Xa / Xc.
Donde:
FIa es el factor de inducción de la concentración o tratamiento a,
Xa corresponde al promedio de la longitud de cola de la concentración a,
Xc es el promedio de la longitud de cola del control negativo.
Adicionalmente, se incluyó la frecuencia de células dañadas en cada tratamiento.
Análisis Estadísticos
Dado que el coeficiente de variación fue <10 %, los resultados se homogenizaron y se presentaron como la media (± DS) de la longitud de cola. La distribución de los datos se determinó mediante curtosis y simetría. Las diferencias de los resultados entre los sitios con respecto a los tratamientos y las épocas climáticas se evaluaron mediante la prueba de Kruskal-Wallis. La influencia de todos los factores (sitios, dosis y épocas climáticas) se determinó con la prueba de rangos múltiples. Valores de p<0,05 fueron considerados significativos. Para los análisis se aplicó el software Stat Graphic Centurión XVI.
RESULTADOS
Después de una hora, la citotoxicidad celular fue menor al 30 % en todos los tratamientos y en consecuencia, la actividad genotóxica se puede atribuir a la acción del MOE y no a otros factores de citotoxicidad.
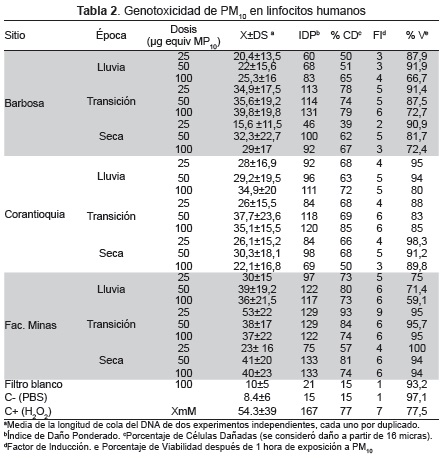
El FI fue de tres a seis veces mayor en las células tratadas con MOE en comparación con el control (p<0.001) (Tabla 2). El índice de daño ponderado (IDP) fue significativo en todos los tratamientos con MOE y alcanzó valores 2 a 10 veces mayores que el control negativo. La fracción de células con daño (%) osciló entre 39 y 79 %, en Barbosa, entre 50 y 85 % en Corantioquia y entre 73 y 93 % en la Facultad de Minas. En los tres sitios el mayor daño se presentó en los tratamientos con material colectado durante la época de transición (Tabla 2) y el menor en el periodo seco.
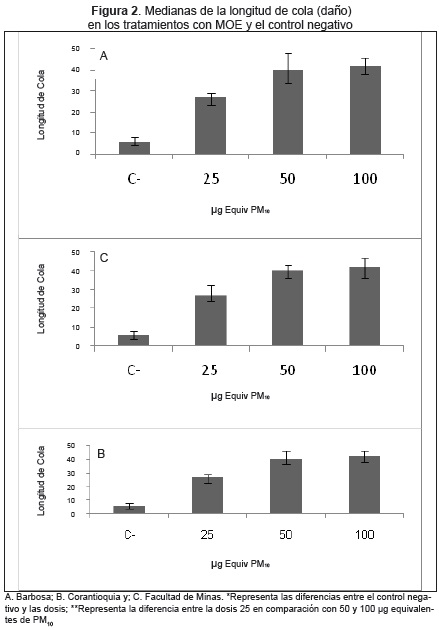
Al comparar los resultados de los tratamientos con MOE y el control negativo, se encontraron diferencias estadísticamente significativas (p<0.001), es decir, los tratamientos con el material de los tres sitios resultaron genotóxicos independientemente de los niveles de PM10 (Fig. 2). Aunque en ningún caso se logró establecer una relación dosis-respuesta, se presentaron diferencias estadísticamente significativas (p<0.001) entre los tratamiento de 50 y 100 μg equivalentes de PM10 respecto a la concentración de 25 μg equivalente de PM10de los tres sitios monitoreados (20).
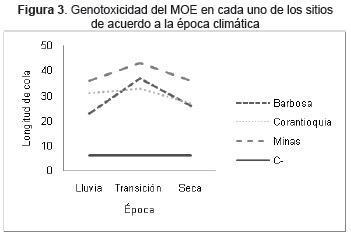
No se evidenciaron diferencias estadísticamente significativas entre la actividad genotóxica del MOE procedente de Barbosa y de Corantioquia, pero entre estos y el efecto del MOE de Facultad de Minas se encontraron diferencias (p<0.001) debido a una mayor genotoxicidad en este último sitio. Según la época climática se observó el mismo comportamiento, siendo 1.3 veces mayor la genotoxicidad del MOE en Facultad de minas (Fig. 3).
Al analizar la influencia de la época climática, se observó que durante la transición se incremento la actividad genotóxica del MOE de los tres sitios (p<0.001), principalmente de Barbosa con el cambio de valores medios de daño en el DNA de 22.64 μm en época seca y 25.94 μm en lluvia, a 36.78 μm en transición. En Facultad de Minas estos valores se incrementaron de 38.8 μm en las épocas seca y de lluvia a 43 μm en el periodo de transición.
DISCUSIÓN
El tipo de MOE obtenido de los distintos PM10 presentó características aceitosas y fue más denso el extracto de PM10 proveniente de Facultad de Minas, debido principalmente a que el muestreador está ubicado a una altura de 3m y a una distancia de 2m de una de las vía con mayor tráfico vehicular de la ciudad de Medellín. Esta situación hace que en los filtros se acumule principalmente material particulado proveniente de emisiones de tráfico automotor, especialmente de camiones de motor diesel (20). Aunque en Barbosa y Corantioquia, los muestreadores están ubicados en calles con alto flujo vehicular, su ubicación a 7 y 12 m de altura, respectivamente, permite que se acumule en los filtros material procedente de los vehículos y de otras fuentes y en consecuencia el material orgánico adherido a estas partículas presenta una composición diferente al encontrado en la Facultad de Minas. De acuerdo con Wendy et. al (21), la cantidad de lípidos asociada al material particulado depende del tipo de fuente y del tamaño de las partículas, así la fracción lípídica modula la potencial toxicidad potencial que presenta la partícula.
Aunque se esperaba que en la zona semi urbana de Barbosa, con bajos niveles de PM10, la genotoxicidad fuera muy reducida, se observó que triplicaba la respuesta del tratamiento con el filtro control. Según Pope et al. (22) los efectos adversos del MP se presentan a muy diferentes concentraciones de material. El efecto genotóxico del extracto del material colectado en Barbosa podría estar relacionado con los compuestos orgánicos que se adhieren a las partículas de 10 μm, catalogados como mutagénicos, genotóxicos y/o carcinógenos, por entes de regulación internacional como algunos Hidrocarburos policíclicos aromáticos (23). Aproximadamente el 70-90 % de los HPA que se encuentran en el aire están unidos a MP, especialmente los de peso molecular alto, como Benzo (a) Pireno, Benzo (k) fluorantreno y los de peso molecular medio del tipo Benzo (a) antraceno y pireno (24).
Los HPA pueden ser liberados en el proceso de combustión principalmente de motores diesel (25) y su efecto genotóxico está mediado por enzimas microsomales, especialmente Cyp 1A1 (24-27). Aunque los linfocitos tratados no expresan una amplia gama de enzimas de metabolización de xenobióticos, si tienen la capacidad de metabolizar HPA que requieren Cyp1A1, además, el efecto observado también puede ser atribuido a los HPA modificados que ejercen su acción genotóxica de manera directa (26-27).
De acuerdo a los resultados del estudio en la época de transición se evidenció una mayor genotoxicidad del PM10, considerada en este estudio como la terminación del periodo de lluvias y el comienzo del periodo seco. Una mayor humedad relativa (HR) del aire favorece la capacidad de absorción de las partículas para adherir materiales en suspensión al actuar como núcleos de condensación (24). Muchos compuestos mutacarcinogénicos son liberados directamente al ambiente, otros se generan a partir de compuesto primarios por reacciones químicas, biológicas y fotoquímicas en ese ambiente (28) como nitro, hidroxi y oxo HPA que resultan de fotorreacciones con NOx, ozono y OH (27-29).En este estudio la humedad relativa en la época seca (Julio de 2011 y enero de 2012) fluctúo entre 62 y 67 %, en el período de lluvias(Octubre de 2011 y Abril de 2012) la HR alcanzó el 70 % mientras que en la época de transición (Diciembre de 2011) alcanzó el 80 %.
Los resultados indican el potencial peligro para la salud de la población expuesta a PM10en las zonas urbanas y con alto tráfico. El enfoque de este estudio estuvo basado en PM10, las partículas más finas, PM2.5, tienen mayor facilidad de entrar a los alvéolos pulmonares y por ello deberían ser también evaluadas ya que sólo con PM10 se podría sobreestimar el peligro. Identificar y estimar la exposición humana a estos compuestos mutacarcinógenos es imperativo para el análisis de riesgo de la salud pública. Se sugiere que adicionalmente al monitoreo químico convencional, se mida el efecto biológico (ejemplo, ensayos de genotoxicidad) que podría mejorar considerablemente este análisis de riesgo dada la complejidad de la mezcla de contaminantes. Estos resultados alertan sobre la necesidad de una continua revisión y ajuste de niveles de referencia como medida de control y protección de la salud pública.
Agradecimientos: Esta investigación fue financiada por la Universidad de Antioquia (Comité para el Desarrollo de la Investigación -CODI-, proyectos de investigación de mediana cuantía 2011). Agradecemos a la Red Nacional de Vigilancia de Calidad del Aire (REDAIRE) en el Valle del Aburrá por su colaboración con los filtros de los muestreadores de alto volumen PM10a lo largo del Valle de Aburrá.
Conflictos de interés: Ninguno
REFERENCIAS
1. Tancell PJ, Rhead MM, Pemberton RP, Braven J. Survival of Polycyclic Aromatic Hydrocarbons During Diesel Combustion. Environmental Science Technology.1995; 29:2871-2876. [ Links ]
2. Park S, Choi J. Cytotoxicity, genotoxicity and ecotoxicity assay using human cell and environmental species for the screening of the risk from pollutant exposure. Environmental International. 2007; 33:817-822. [ Links ]
3. Solarte I, Caicedo M, Restrepo S. Contaminación atmosférica y enfermedad respiratoria en niños menores de 14 años en Santa Fe de Bogotá. Revista Médica Sanitas; 2010, Volumen 5, Número 2. [ Links ]
4. Díaz-Suárez V, Páez-Pérez C. Contaminación por material particulado en Quito y caracterización química de las muestras. ACTA NOVA. 2006; 3(2):308-322. [ Links ]
5. Zuluaga QM, Valencia RAM, Ortiz TI. Efecto mutagénico y genotóxico de contaminantes atmosféricos. Medicina UPB. 2009; 28(1):32-41. [ Links ]
6. Toro G, Molina V, Serna PJ. Evaluación de los niveles de contaminación atmoesferica en las zonas urbanas del Valle de Aburrá. [Internet]. Disponible en: http://www.areadigital.gov.co/CalidadAire/lsdocCalidadAire/Evaluacion.pdf. Consultado en mayo de 2012. [ Links ]
7. Ohe T, Watanabe T, Wakabayashi K. Mutagens in surface waters: a review. Mutation Research. 2004; 567:109-149. [ Links ]
8. Den Beste P. Concepts for the implementation of biomarkers in Environmental monitoring. Marine Environmental Research. 1998; 46(5):253-256. [ Links ]
9. USEPA. Health Assessment Document for Diesel Engine Exhaust, US Environmental Protection Agency, Office of Research and Development, National Center for Environmental Assessment, Washington, D.C.; 2002 (EPA/600/8-90/057F). [ Links ]
10. OECD. Organization for Economic Co-operation and Development. Test 207: earthworm, acute toxicity tests. En: Organization for Economic Co-operation and Development (ed.), OECD Guidelines for Testing of Chemicals; 1984. [ Links ]
11. Hermelin M. Valle de Aburrá ¿Quo Vadis? Gestión y Ambiente. 2007; 10(2):1-10. [ Links ]
12. Área Metropolitana. Características de los sitios de monitoreo PM10. [Internet]. Disponible en: http://www.areadigital.gov.co/CalidadAire/lsdocCalidadAire/InformeFinal. Consultado en Junio de 2013. [ Links ]
13. Sato M, Valent G, Coimbrão CA, Coelho MC, Sanchez Sanchez P, Alonso CD et al. Mutagenicity of airbone particulate organic material from urban and industrial areas of São Paulo, Brazil. Mutation Research. 1995; 335(3):317-330. [ Links ]
14. Noble PB, Cuttis JH. Separation of blood leukocytes by ficoll gradient. Can. Vet. Journal. 1967; 8:110-111. [ Links ]
15. Platel A, Gervais V, Sajot N, Nesslany F, Marzin D, Claude N. Study of gene expression profiles in TK6 human cells exposed to DNA-oxidizing agents. Mutatation Research. 2010; 689(1-2):21-49. [ Links ]
16. Singh, NP, McCoy M, Tice R, Edward E. A simple technique for quantitation of low levels of DNA damage in individual cells. Exp. Cell Res 1988; 175:184-19. [ Links ]
17. McNamee JP, McLean JR, Ferrarotto CL, Bellier PV. Comet assay: rapid processing of multiple samples. Mutation Research. 2000; 466:63-69. [ Links ]
18. Ferreiro G, Cancino Badías L, Lopeznigro M, Palermo A, Mudry M, Prieto Gonzalez E, et al. DNA single strand breaks in peripheral blood lymphocytes induced by three nitroimidazole derivatives. Toxicology Letters. 2002; 132:109-115. [ Links ]
19. Seitz N, Böttcher M, Keiter S, Kosmehl T, Manz W, Hollert H, Braunbeck TA novel statistical approach for the evaluation of comet assay data. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 2008; 652:38-45. [ Links ]
20. Redaire, Área Metropolitana. Evaluar y monitorear la calidad del aire en el Valle de Aburrá. [Internet]. Disponible en: http://www.areadigital.gov.co/CalidadAire/lsdocCalidadAire/InformeFinal Consultado en Junio de 2013. [ Links ]
21. Wendy-Hsiao WL, Zi-Yao M, Ming F, Xin-mei S, Fu W. Cytotoxicity of PM2.5 and PM2.5-10 ambient air pollutants assessed by the MTT and the Comet assays. Mutation Research. 2000; 471:45-55. [ Links ]
22. Pope CA, Burnet RT, Thun MJ, Calle EE, Kewski D, Ito K, Thurstan GD. Lung cancer, cardiopulmonary mortality and long-term exposure to fine particulate air pollution. Journal of the American Medical Association. 2002; 287:1132-1141. [ Links ]
23. Yvonne CMS, Daphnee SP, Marcel HMVH, Ralph HG, Lou MM, Costas I, et al. Interactions between polycyclic aromatic hydrocarbons in binary mixtures: Effects on gene expression and DNA adduct formation in precision-cut rat liver slices. Mutagenesis. 2008; 23:491-499. [ Links ]
24. Legator MS, Au WW. Application of integrated mutagenic monitoring: the optimal approach for detecting environmental carcinogens. Environ Health Perspect. 1994;102:125-32. [ Links ]
25. Rosenkranz HS. Direct-acting mutagens in diesel exhausts: magnitude of the problem. Mutation Research. 1982;101:1-10. [ Links ]
26. Mersch-Sundermann V, Kern S, Wintermann F. Genotoxicity of nitrated polycyclic aromatic hydrocarbons and related structures on Escherichia coli PQ 37 (SOS Chromotest). Environ Mol Mutagen. 1991;18:41-50. [ Links ]
27. Škarek M, Janošek J, Cupr P, Kohoutek J, Novotná-Rychetská A, Holoubek L. Evaluation of genotoxic and non-genotoxic effects of organic air pollution using in vitro bioassays. Environment International. 2007; 33:859-866.
28. Finlayson-Pitts BJ, Pitts JN. Tropospheric air pollution: ozone, airborne toxics, polycyclic aromatic hydrocarbons and particles. Science. 1997; 276:1045-52. [ Links ]
29. Finlayson-Pitts BJ, Pitts Jr JN. Chemistry of the upper and lower atmosphere. San Diego, CA: Academic Press. 2000:59-866. [ Links ]