Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Salud Pública
Print version ISSN 0124-0064
Rev. salud pública vol.16 no.1 Bogotá Jan./Feb. 2014
https://doi.org/10.15446/rsap.v16n1.31316
http://dx.doi.org/10.15446/rsap.v16n1.31316
Artículo/Investigación
Agar de capa delgada: Una opción costo-efectiva para el diagnóstico rápido de tuberculosis multirresistente
Thin layer agar represents a cost-effective alternative for the rapid diagnosis of multi-drug resistant tuberculosis
José M. Hernández-Sarmiento1,2, Milton A. Martínez-Negrete2, Diana M. Castrillón-Velilla1,2, Sergio A. Mejía-Espinosa1,2, Gloria I. Mejía-Mesa1,2, Elsa M. Zapata-Fernández2, Sara Rojas-Jiménez1, Andrés E. Marín-Castro1 y Jaime A. Robledo-Restrepo1,2
1 Universidad Pontificia Bolivariana (UPB). jhernandez@cib.org.co, sara.rojasji@alfa.upb.edu.co, andrese9@hotmail.com;
2 Corporación para Investigaciones Biológicas (CIB). miltonestadistico@yahoo.es; nanmc@gmail.com; s.mejiae@gmail.com; gmejia@cib.org.co, ezapata@cib.org.co, jrobledo@cib.org.co
Recibido 27 Julio 2012/Enviado para Modificación 10 Julio 2013/Aceptado 16 Agosto 2013
RESUMEN
Objetivo Realizar un análisis de costo efectividad comparando el método de cultivo en agar de capa delgada y el método estándar de proporciones múltiples, utilizados en el diagnóstico de Tuberculosis Multi-drogorresistente (TB MDR).
Métodos Estudio de evaluación económica en el cual se evalúan los costos y la efectividad de dos pruebas diagnósticas, ejecutado en la Corporación para Investigaciones Biológicas-CIB en Medellín, Colombia.
Resultados Se evaluaron 100 pacientes, encontrando una prevalencia de resistencia a la Rifampicina de 10,8 % y resistencia a Isoniazida de 14,3 %. Se presenta un análisis en términos de costo-efectividad mediante el diseño de un árbol de decisiones (Treeage Pro ®), resultando ser la prueba basada en cultivo en agar de capa delgada más costo-efectiva; con valores de sensibilidad, especificidad y predictivos del 100 % para detectar resistencia a Rifampicina e Isoniazida. El valor del método de las proporciones múltiples fue calculado en US$ 71, con una media de tiempo para ser reportado de 49 días versus US$ 18 y 14 días respectivamente para el cultivo en agar de capa delgada.
Discusión Se han desarrollado nuevas tecnologías para el diagnóstico de Tuberculosis, aparentemente más rápidas y efectivas, que deben ser evaluadas no solo en sus características operativas, sino también en términos de costo-efectividad. El presente estudio establece que el empleo de la capa delgada es menos costoso, igualmente efectivo, y puede aportar resultados más rápidamente; cuando se compara con el método tradicional. Esto implica, entre otros aspectos, que el paciente pueda recibir más oportunamente el tratamiento dirigido para TB MDR.
Palabras Clave: Tuberculosis resistente a múltiples medicamentos, mycobacterium tuberculosis, diagnóstico, evaluación de costo-efectividad (fuente: DeCS, BIREME).
ABSTRACT
Objective Using cost-benefit analysis for comparing the thin-layer agar culture method to the standard multiple proportion method used in diagnosing multidrug-resistant tuberculosis (MDR TB).
Methods A cost-benefit evaluation of two diagnostic tests was made at the Corporación para Investigaciones Biológicas (CIB) in Medellín, Colombia.
Results 100 patients were evaluated; 10.8 % rifampicin resistance and 14.3 % isoniazid resistance were found. A computer-based decision tree model was used for cost-effectiveness analysis (Treeage Pro); the thin-layer agar culture method was most cost-effective, having 100 % sensitivity, specificity and predictive values for detecting rifampicin and isoniazid resistance. The multiple proportion method value was calculated as being US$ 71 having an average 49 day report time compared to US$ 18 and 14 days for the thin-layer agar culture method.
Discussion New technologies have been developed for diagnosing tuberculosis which are apparently faster and more effective; their operating characteristics must be evaluated as must their effectiveness in terms of cost-benefit. The present study established that using thin-layer agar culture was cheaper, equally effective and could provide results more quickly than the traditional method. This implies that a patient could receive MDR TB treatment more quickly.
Key Words: Tuberculosis, multidrug-resistance, mycobacterium tuberculosis, diagnosis, cost-benefit analysis (source: MeSH, NLM).
La Tuberculosis (TB) continúa siendo una importante causa de morbimortalidad, principalmente en países en vía de desarrollo, donde se estima que una tercera parte de la población está infectada. Para el año 2009 hubo 9,4millones de casos nuevos de TB,de los cuales 7,9 millones se presentaron en países en vía de desarrollo. Los casos de multi-drogorresistencia (MDR) fueron estimados en 440 000, y la mortalidad fue estimada en 1,5 millones de personas (1).
La incidencia para Colombia en 2009, fue de 25,9 por 100 000 habitantes (2); mientras que elinforme sobre resistencia de M. tuberculosis (M t) en 2004 y 2005 reportó una prevalencia para MDR de 2,38 [1,58-3,57], y en casos previamente tratados de 31,44 [26,14-37,27] por 100 mil habitantes (3).
Para el diagnóstico de TB pulmonar, se debe tomar una muestra de esputo para la técnica de baciloscopia, la cual es un método simple, barato y rápido; con sensibilidad entre el 34 % cuando se toma en única muestra y el 80 % cuando se incluyen tres muestras (4,5). La demostración microbiológica de M t es el estándar de oro para el diagnóstico. Existen diferentes medios de cultivo (sólidos o líquidos), más costosos en comparación con la baciloscopia y con resultados entre 14 días y 30 días, según el medio utilizado. Para el diagnóstico de TB MDR, el método de agar en capa delgada utilizando Middlebrook 7H11 es una opción que se ha evaluado en algunos países. Este se basa en la observación temprana de las microcolonias de M t, con una sensibilidad del 93 % comparada con el 84,7 % del medio tradicional de Lowestein Jensen 6-11). El método de las proporciones múltiples es considerado como el método de referencia para el diagnóstico de la MDR, y toma entre 8 y 12 semanas obtener resultado (12-18).
En el año 2009, la Asamblea Mundial de la Salud, hizo un llamado a fortalecer el diagnóstico y tratamiento de la TB MDR. La "Strategic and Technical Advisory Group For Tuberculosis" STAG-TB 2009, recomendó a países de baja y medianos ingresos, seleccionar y evaluar medios de cultivo rápido no comerciales, que permitan hacer diagnóstico de TB MDR rápido y a bajo costo, como solución interina para frenar rápidamente la emergencia de casos de TB MDR.
En este estudio, se evalúan los costos y la efectividad del agar de capa delgada comparándolo con el método tradicional de las proporciones múltiples, modelando en un árbol de decisiones (software Treeage®), ambas alternativas para la implementación en un escenario como el colombiano.
MÉTODOS
Estudio de evaluación económica, en el cual mediante un análisis de costo-efectividad se comparan dos técnicas para el diagnóstico rápido de TB MDR, como son el método en agar de capa delgada y el de las proporciones múltiples en Lowestein Jensen; tomándose este último como estándar de referencia para el diagnóstico.
Se ingresaron pacientes con diagnóstico de TB y factores de riesgo para padecer TBMDR provenientes de dos Unidades Intermedias de la ESE Metrosalud de Medellín, en quienes, previa firma de un consentimiento informado, se les tomó una muestra de esputo. Esta muestra fue procesada por las dos metodologías en evaluación en el laboratorio de bacteriología y micobacterias de la Corporación para Investigaciones Biológicas (CIB) en la ciudad de Medellín, Colombia.
El método de las proporciones múltiples indirecto es considerado como de referencia para pruebas de susceptibilidad a M t. Este método requiere el aislamiento inicial de M t, el cual se obtiene del cultivo de esputo en un medio sólido como puede ser el Ogawa Kudoh o el Lowestein Jensen. Una vez se obtiene el aislamiento microbiológico, se preparan en un medio sólido, como el Lowestein Jensen, las concentraciones críticas de cada antibiótico, en las cuales se agrega una dilución del inóculo estandarizado y se incuban en atmósfera de CO2 a 37°C. Se realizan lecturas semanalmente durante tres semanas para identificar si hay crecimiento o no en la presencia de la concentración del antibiótico (19).
El método de cultivo en agar de capa delgada está basado en la observación temprana de las microcolonias de M t en medio sólido a partir de la muestra de esputo. El medio utilizado es el Middlebrook 7H11 suplementado con BBL-OADC® (Albumina Bovina, Dextrosa, Catalasa, Ácido Oleico), el cual es preparado en cajas de Petri dividas en cuatro cuadrantes así: el primer cuadrante contiene el control de crecimiento conteniendo solo MB7H11; el segundo cuadrante contiene MB7H11 con PNB que inhibe selectivamente el complejo M t; el tercer cuadrante contiene MB7H11 con la concentración crítica para Isoniazida; el cuarto cuadrante contiene MB7H11 con la concentración crítica para Rifampicina. Esto permite observar cuáles aislamientos de M t son sensibles o resistentes a estos medicamentos. El medio permite la observación temprana de crecimiento a través del factor cordón característico del complejo tuberculoso. El procedimiento se realiza sembrando 100 ml del sedimento de la muestra en cada cuadrante, sellando las cajas y llevándolas a incubación en atmósfera de CO2 a 37°C. Los cultivos se observan dos veces por semana con aumento de 10X en microscopio de luz por un período de cuatro a seis semanas hasta observar el crecimiento(15).
Para cada técnica evaluada, se realizó un microcosteo desde el punto de vista institucional incluyendo costos directos (equipos, reactivos o insumos, personal especializado de laboratorio), como indirectos (infraestructura, administración, mantenimiento, etc.). Los costos de los insumos se obtuvieron con base en los precios promedio de compras del laboratorio y la institución para el año 2009. El costo del recurso humano se calculó a partir del salario integrado neto anualizado tras considerar tanto las prestaciones sociales como otros beneficios no monetarios percibidos por el trabajador. Los costos de los activos fijos (inmuebles, equipo e instrumental) se depreciaron de acuerdo con la metodología de costo anual equivalente (CAE). Los costos se expresan en dólares americanos para favorecer la interpretación regional de los resultados (20,21).
Para la efectividad de la prueba se tuvo en cuenta el número de días en los cuales el método evaluado arroja un resultado para tomar una conducta con el paciente. Esta decisión estuvo basada en el beneficio que otorga el inicio de una terapia oportuna y el romper rápidamente la cadena de transmisión cuando se inicia el tratamiento.
Para el análisis de datos se utilizó el programa Tree Age Pro® 2008 (Software Inc., Williamstown, Massachusetts USA), módulo de salud (Healthcare Module) que permite modelar decisiones en salud, bien sea en base al costo de un procedimiento, a la efectividad que tenga su utilización, o en base a las dos variables analizadas.
Se cumplió con los principios éticos de beneficencia, justicia y dignidad humana, se garantizo el anonimato de la información de los participantes y se respeto la libertad de los pacientes para la participación en el estudio a través del consentimiento informado. Se consideró un estudio con riesgo mínimo para la salud de acuerdo a la resolución número 008430 del 4 de Octubre de 1993, del Ministerio de Salud.
RESULTADOS
Se evaluaron 100 pacientes con diagnóstico de TB que consultaron en la red pública de Medellín. Se encontró una prevalencia de resistencia a la Rifampicina de 10,8 % y resistencia a Isoniazida de 14,3 %. El método de agar en capa delgada reportó una sensibilidad del 100 % (IC95 % 93,7-100) para detectar resistencia a Rifampicina y de 100 % (IC95 % 95,8-100) para detectar resistencia a Isoniazida, comparándolo con el método de las proporciones múltiples. La especificidad fue del 100 % para ambos antibióticos, así como los valores predictivos positivo y negativo.
El valor del método de las proporciones múltiples fue calculado en US$ 71, con una media de tiempo de 49 días para el reporte; distribuidos en 21 días del primer cultivo para el aislamiento de la cepa (método convencional en Lowestein Jensen) y luego la prueba de sensibilidad de la cepa que toma en promedio 28 días.
El valor del método en agar de capa delgada fue calculado en US$ 18, con una media de 14 días para reportar el aislamiento y la susceptibilidad de la cepa a la Rifampicina e Isoniazida.
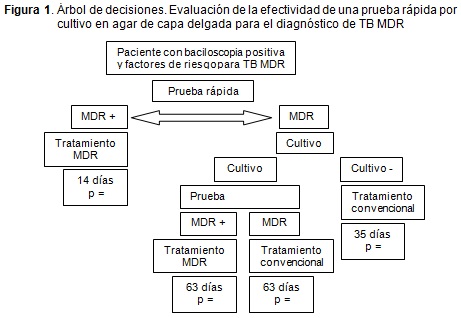
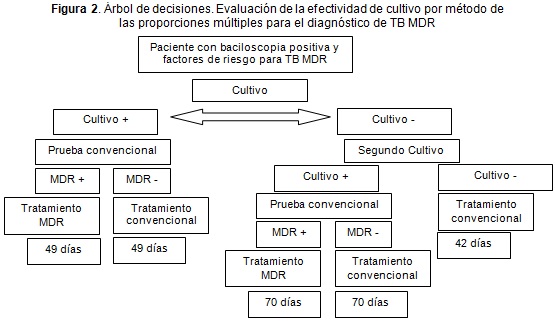
En las Figuras 1 y 2 se presenta el árbol de decisiones que inicia con el paciente que tiene una baciloscopia de esputo positiva y presenta algún factor de riesgo para padecer TB MDR; la conducta a seguir en estos pacientes según el protocolo nacional es la realización de pruebas de susceptibilidad para aclarar el diagnóstico.
En el Figura 1, se encuentra la estrategia denominada "prueba rápida", en la cual, al paciente se le realiza el aislamiento y las pruebas de susceptibilidad por el método de agar de capa delgada. Si el aislamiento y la susceptibilidad confirman el diagnóstico de TB MDR se inicia inmediatamente el tratamiento. Si el resultado de la prueba es negativo, el protocolo recomienda que se tome una nueva muestra al paciente y se le realice un cultivo por el método de las proporciones múltiples. Si el resultado es positivo y se confirma TB MDR, se inicia el tratamiento para MDR; pero si es negativo se realiza el tratamiento convencional para la TB.
En el Figura 2, se encuentra la estrategia denominada "cultivo", en la cual, al paciente se le realiza el aislamiento y las pruebas de susceptibilidad por el método de las proporciones múltiples. Las opciones que tiene el paciente son: que el cultivo sea positivo y se aísle una cepa de M t; o que el cultivo sea negativo, con lo cual se recomienda repetirlo para intentar el aislamiento de la cepa de M t. Obtenida la cepa se le realizan las pruebas de susceptibilidad, y de acuerdo con estas se confirma el diagnóstico de TB o TB MDR, y se inicia el tratamiento indicado.
Los resultados obtenidos en el modelo realizado en el software Tree Age® muestran como el uso de la técnica de cultivo en agar de capa delgada es la opción más costo-efectiva para el diagnóstico de TB MDR en nuestro medio.
DISCUSIÓN
El diagnóstico rápido de TB y el inicio de la terapia farmacológica oportuna permiten romper la cadena de transmisión de la enfermedad y evitarque el paciente progrese hacia formas más crónicas o la muerte. Aunque la TB pulmonar se puede diagnosticar con métodos ya existentes, se han desarrollado nuevas tecnologías diagnósticas más rápidas y efectivas, que deben ser evaluadas antes de ser incorporadas en el sistema de salud (22,23).
Aunque la Organización Mundial de la Salud (OMS), ha recomendado el uso de métodos moleculares para el tamizaje rápido de la TB MDR en países con alta carga de la enfermedad, hasta ahora estos ensayos no han probado ser la solución. En 2005 se publicó una revisión donde se incluyeron estudios realizados entre 1995 y 2004, comparaban el rendimiento del INNO-Lipa Rif con un método estándar de referencia. La sensibilidad general reportada en este metanálisis variaba entre 82 % y 100 % con especificidad del 92-100 %. Sin embargo, se reportaron un número importante de muestras con resultado indeterminado, que no fueron incluidos dentro del análisis, pudiendo no reflejar el rendimiento del INNO- Lipa en condiciones clínicas reales. Aunque la técnica proporciona resultados en las primeras 48 horas, se requiere de dos a seis semanas para realizar el aislamiento inicial de la micobacteria, con un costo moderadamente alto de $US 116 por kit diagnóstico (24).
A partir del 2009, el ensayo Genotype® MTBDR plus ha sido utilizado como método de tamizaje inicial para TB MDR. Desde entonces se han realizado múltiples estudios analizando el desempeño de la prueba en diferentes condiciones. Uno de ellos desarrollado en Uganda, evaluó el rendimiento del Genotype® MTBDR plus en la detección rápida de la resistencia a Isoniazida y Rifampicina directamente en especímenes con bacilos copia positiva y tratamiento antituberculoso previo, comparándolo con el rendimiento del sistema automatizado MGIT® 960 y las pruebas de susceptibilidad convencionales. Se obtuvo un resultado interpretable en el 95.8 % de los casos a los dosdías de procesada la muestra con sensibilidad, especificidad, y valores predictivos positivos y negativos del 92,3 %, 96,2 %, 80 % y 98,7 %, respectivamente para aislamientos MDR (25). Estos resultados contrastan con los publicados por Akpaka (26), en donde el rendimiento de la prueba para la detección de multidrogo-rresistencia fue tan solo del 29,4 % en comparación con el estándar de referencia. En este estudio, el MTBDR plus obtuvo buen rendimiento en la detección de la resistencia a Rifampicina, sin embargo únicamente identificó el 34,6 % de los aislamientos resistentes a Isoniazida en comparación con el BACTEC- MGIT® 460. Por otro lado, existeuna relación inversamente proporcional entre el número de reportes inválidos y la densidad bacilar reportada en el examen directo del mismo aislamiento,siendo mayor el porcentaje de resultados inválidos en aislamientos paucibacilares (27,28).
Por todo lo anterior, a pesar de la rapidez en la entrega de resultados y simplicidad de las técnicas, estos métodos rápidos han demostrado tener limitaciones. Hasta ahora ninguno de estos ensayos ha eliminado la necesidad de realizar el cultivo para micobacterias, aún requerido para el conocimiento del patrón de susceptibilidad a los demás medicamentos de primera y segunda línea. Muchas de estas pruebas demandan infraestructura especializada y personal experto, pocas veces disponible en los lugares en que se necesitan implementar estas herramientas diagnósticas a la mayor brevedad. La mayoría de estas pruebas sólo tienen buen rendimiento en especímenes con baciloscopia positiva, limitando su aplicación en poblaciones especiales caracterizadas por la paucibacilaridad de sus especímenes (pacientes con coinfección VIH, niños, pacientes con TB extrapulmonar, etc). Finalmente, aunque el costo "per test" es bajo, este se termina incrementando por los costos que se adicionan en la ejecución de las pruebas (27, 28). Como consecuencia, la implementación de estos métodos sería difícil en laboratorios ubicados en zonasrurales o con recursos limitados.
Métodos más simples y de menor costo han sido propuestos comoalternativas para el diagnóstico de la TB MDR, específicamente en lugares con recursos limitados. La nitrato reductasa, ha sido uno de los más estudiados, con rendimientos comparables a los métodos convencionales; con sensibilidad y especificidad superior al 95 %. Puede aplicarse tanto directamente sobre la muestra como enel aislamiento, este último requiriendo de dos a seis semanas adicionales. Recientemente se han publicado artículos en los que se ha implementado este ensayo en medios de cultivo líquido como el Middlebrook 7H9, disminuyendo el tiempo requerido para generarlos resultados, en diez días estaban disponibles el 56 % de los reportes con una concordancia del 99 % para la detección de la resistencia a medicamentos de primera línea. Sin embargo, estos datos contrastan con el riesgo aumentado de contaminación (7,6 %), aún incluyendo en el protocolo una mezcla antibiótica. Los cálculos preliminares indican que el costo del ensayo es, por lo menos, similar al costo del método de las proporciones múltiples (27,29-31).
Dentro de este mismo grupo de métodos de bajo costo, el MODS (Microscopic observation drug susceptibility) ha demostrado alta concordancia en la detección de aislamientos MDR incluso en pacientes que ya han recibido tratamiento antituberculoso, entregando resultados en un tiempo promedio de 21 días (15-29 días) (32,33). En un estudio publicado recientemente, la concordancia para la detección de aislamientos con resistencia a la Isoniazida fue del 95 % y 91 % en pacientes sin y con tratamiento previo respectivamente; y del 98 % y 91 % para la identificación de resistencia a la Rifampicina en estos mismos grupos. Sin embargo, el valor predictivo positivo del MODS en este estudio realizado en una región con alta incidencia de TB MDR fue del 81,8 %, por lo se concluye que se tiende a sobre diagnosticar la enfermedad causada por micobacterias MDR con esta técnica (33). Aunque no se conoce con certeza el costo del MODS, el empleo de la microscopía electrónica y del medio de cultivo líquido, podrían representar un incremento en el costo total de la prueba.
En el metanálisis publicado por Bwanga, se compara el rendimiento de la nitrato reductasa, MODS y Genotype® MTBDR plus en comparación con el método convencional (proporciones múltiples, MGIT® 960 o CIM). En este estudio la sensibilidad y especificidad de la nitrato reductasa fue igual a la reportada por la del método molecular (99 %), y ligeramente superior a la obtenida por el MODS para la identificación de la resistencia a la Rifampicina. En el caso de la detección de aislamientos resistentes a Isoniazida, el rendimiento fue ligeramente inferioren los tres métodos, siendo superior para MTBDR plus, seguido por la nitrato reductasa y por último el MODS (32).
Finalmente, el método diagnóstico de resistencia de M ta Isoniazida y Rifampicina, basado en el cultivo en agar de capa delgada propuesto y evaluado en este estudio, alcanzó un rendimiento del 100 % comparado con el método tradicional en la detección de aislamientos con resistencia a Isoniazida y Rifampicina; rendimiento superior incluso al de los métodos moleculares. Adicionalmente, el empleo de la capa delgada es menos costoso cuando se compara con el método tradicional (US$18 vs US$71), y ostensiblemente más barato que las demás técnicas referenciadas en esta revisión, con la ventaja de no requerir tecnología especial ni múltiples reactivos de alto costo. Al valorar la efectividad como el número mínimo de días necesarios para arrojar un resultado definitivo, el cultivo en capa delgada es superior al del método de proporciones múltiples; reduciéndolo a tan sólo 14 días (p=0,024) (Figura 1). Esto implica que el paciente diagnosticado como MDR por este método, a las dos semanas de haberse procesado su muestra ya puede recibir el tratamiento dirigido para MDR, sin tener que esperar las diez semanas que requiere el método de las proporciones múltiples para arrojar este mismo resultado.
Agradecimientos: Corporación para Investigaciones Biológicas, ESE Metrosalud, CIDI de la Universidad Pontificia Bolivariana mediante el apoyo al proyecto "Análisis de costo efectividad para el diagnóstico rápido de la resistencia a Isoniacida y Rifampicina en Mycobacterium tuberculosis" CIDI-UPB 707 A–12/10–S04. COLCIENCIAS, por la financiación del proyecto "Análisis de costo efectividad de seis alternativas para el diagnóstico rápido de TB MDR" código 2212-519-28921 convocatoria 519/2010.
Conflictos de interés: Los autores del presente estudio manifiestan que son independientes con respecto a las instituciones financiadoras y de apoyo, y que durante la ejecución del trabajo o la redacción del manuscrito no han incidido intereses o valores distintos a los que usualmente tiene la investigación. Los pacientes del estudio fueron aquellos que cumplían con los criterios de elegibilidad del estudio que consultaron a dos unidades intermedias de Metrosalud de la ciudad de Medellín; las muestras tomadas fueron procesadas y analizadas en el laboratorio de bacteriología y micobacterias de la Corporación para Investigaciones Biológicas (CIB), por tanto se especifica que se recibió apoyo por parte de estas dos instituciones.
REFERENCIAS
1. World Health Organization Report. Global Tuberculosis Control. WHO/HTM/TB/2010.7. [Internet]. Disponible en: http://www.who.int/es/. Consultado mayo 2012. [ Links ]
2. Ministerio de la Protección Social Colombia. Cuadros Indicadores de Salud Pública, Enfermedades Transmisibles; 2009. [Internet]. Disponible en: http://www.minsalud.gov.co/. Consultado Mayo 2012. [ Links ]
3. INS. Vigilancia de la resistencia de Mycobacterium tuberculosis a los medicamentos: Colombia 2004-2005. Bogotá: Ministerio de la Protección Social; 2006. [Internet]. Disponible en: http://www.minsalud.gov.co/. Consultado Mayo 2012. [ Links ]
4. Council of the Infectious Disease Society of America. Diagnostic Standards and Classification of Tuberculosis in Adults and Children. Am J Respir Crit Care Med. 2000; 161 (4 Pt1): 1376-95. [ Links ]
5. Lange C, Mori T. Advances in the diagnosis of tuberculosis. Respirology. 2010; 15:220-40. [ Links ]
6. Robledo JA, Mejia GI., Morcillo N., Chacón L., Camacho M., Luna J., Zurita J., Bodon A., Velasco M., Palomino JC., Maritn A., Portaels F. Evaluation of a rapid culture method for tuberculosis diagnosis: a Latin American multi-center study. Int J Tuberc Lung Dis. 2006; 10 (6): 613-9. [ Links ]
7. Mejia GI, Guzman A, Agudelo CA, Trujillo H, Robledo J. Five year experience with thin layer agar medium for rapid diagnosis of tuberculosis. Biomédica. 2004; 24 Supp 1: 52-9. [ Links ]
8. Furin JJ, Johnson JL. Recent advances in the diagnosis and management of tuberculosis. Curr Opin Pulm Med. 2005; 11 (3): 189-94. [ Links ]
9. Palomino JC. Newer diagnostics for tuberculosis and multi-drug resistant tuberculosis. Curr Opin Pulm Med. 2006; 12 (3): 172-8. [ Links ]
10. Biswas D, Deb A, Gupta P, Prassad R, Negi Ks. Evaluation of the usefulness of phage amplification technology in the diagnosis of patients with paucibacillary tuberculosis. Indian J Med Microbiol. 2008;26(1):75-8. [ Links ]
11. Batista G, Matteelli A, Cirillo D, Pai M. Diagnosis of multidrug-resistant tuberculosis and extensively drug-resistant tuberculosis: Current standards and challenges. Can J. Infect Dis Med Microbiol. 2008;19(2):169-72. [ Links ]
12. Ejigu GS, Woldea MY, Shah NS, Gebyehu M, Salassie A, Lemma E. Microscopic-observation drug susceptibility assay provides rapid and reliable identification of MDR-TB. Int J Tuberc Lung Dis. 2008; 12(3):332-7. [ Links ]
13. Martin A, Portaels F, Palomino JC. Colorimetric redox-indicator methods for the rapid detection of multidrug resistance in Mycobacterium tuberculosis: a systematic review and meta-analysis. J Antimicrob Chemother. 2007; 59(2):175-83. [ Links ]
14. Martin A, Panaiotov S, Portaels F, Hoffner S, Palomino JC, Angeby K. The nitrate reductase assay for the rapid detection of isoniazid and rifampicin resistance in Mycobacterium tuberculosis: a systematic review and meta-analysis. J Antimicrob Chemother. 2008;62(1):56-64. [ Links ]
15. Robledo J, Mejia G.I, Paniagua L, Martin A, Guzman A. Rapid detection of rifampicin and isoniazid resistance in Mycobacterium tuberculosis by the direct thin-layer agar method. Int. J. Tuberc. Lung Dis. 2008;12(12):1482-4. [ Links ]
16. Rigouts L, Hoza AS, De Rijk P, Torrea G, Chonde TM, Basra D, Zignol M, van Leth F, Egwaga SM, Van Deun A. Evaluation of the Genotype® MTBDR plus assay as a tool for drug resistance surveys. Int J Tuberc Lung Dis. 2011;15(7):959-65. [ Links ]
17. Boehme CC, Nabeta P, Hillermann D, NicolMP, Shenai S, Krapp F, et al. Rapid molecular detection of tuberculosis and rifampin resistance. N Engl J Med. 2010;363(11):1005-15. [ Links ]
18. Nathanson E, Nunn P, Uplekar M, Floyd D, Jaramillo E, Lonnroth K, Weil D, Raviglione M. MDR Tuberculosis – critical steps for prevention and control. N Engl J Med. 2010; 363(11)1050-8. [ Links ]
19. NCCLS. Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically. 6th Ed. Approved standart M7-A6. NCCLS; Wayne Pa. [ Links ]
20. Drummond MF, Sculpher, MJ, Torrance Gw, O'Brien BJ, Stoddart GL. Methods for the Economic Evaluation of Health Care Programmes. Third Edition. Oxford: Oxford University Press, New York; 2005. [ Links ]
21. Mejia A. Economic Evaluation of Health Programs and Services. Rev Gerenc Polit Salud. 2008; 7(15): 91-113. [ Links ]
22. Palomino JC. Nonconventional and new methods in the diagnosis of tuberculosis: feasibility and applicability in the field. Eur Respir J. 2005; 26:339-50. [ Links ]
23. Navarro-Reynoso F, Hernández-Solís A, Pérez-Romo A, Cicero-Sabido R. Costo-efectividad de los métodos de diagnóstico de la tuberculosis. Rev Inst Nal Enf Resp Mex. 2006; 19 (3):214-21. [ Links ]
24. Morgan M, Kalantri S, Flores L, PAI M. A commercial line probe assay for the rapid detection of rifampicin resistance in Mycobacterium tuberculosis: A systematic review and meta-analysis. BMC Infect Dis.2005;5:62. [ Links ]
25. Albert H, Bwanga F, Mukkada S, Nyesiga B, Ademun JP, LukyamuziG, et al. Rapid screening of MDR-TB using molecular Line Probe Assay is feasible in Uganda. BMC Infect Dis.2010;10:41. [ Links ]
26. Akpaka PE, Baboolal S, Clarke D, Francis L, Rastogi N. Evaluation of methods for rapid detection of resistance to isoniazid and rifampin in Mycobaterium tuberculosis isolates collected in the Caribbean. J ClinMicrobiol.2008;46(10):3426-8. [ Links ]
27. Hillemann D, Rüsch-Gerdes S, Richter E. Evaluation of the GenoType MTBDR plus assay for rifampin and isoniazid susceptibility testing of Mycobacterium tuberculosis strains and clinical specimens. J ClinMicrobiol.2007;45(8):2635-40. [ Links ]
28. Balabanova Y, Drobniewski F, Nikolayevskyy V, Kruuner A, Malomanova N, Simak T, et al. An integrated approach to a rapid diagnosis of tuberculosis and multidrug resistance using liquid culture and molecular methods in Russia. PLoS One.2009;4(9):e7129. [ Links ]
29.Martin A, Portaels F, Palomino JC. Colorimetric redox- indicator for the rapid detection of multidrug resistance in Mycobacterium tuberculosis: A systematic review and meta- analysis. J Antimicrob Chemother. 2007;59(2):175-83. [ Links ]
30. Affolabi D, Odoun M, Sanoussi N, Martin A, Palomino JC, Kestens L, et al. Rapid and inexpensive detection of multidrug-resistant Mycobacterium tuberculosis with the Nitrate Reductase assay using liquid medium and direct application to sputum samples. J ClinMicrobiol.2008;46(10):3243-5. [ Links ]
31. Martin A, Panaiotov S, Portaels F, Hoffner S, Palomino JC, Angeby K. The nitrate reductase assay for the rapid detection of isoniazid and rifampicin resistance in Mycobacterium tuberculosis: a systematic review and meta-analysis. J Antimicrob Chemother.2008;62(1):56-64. [ Links ]
32. Bwanga F, Hoffner S, Haile M, Joloba ML. Direct susceptibility testing for multi drug resistant tuberculosis: A meta-analysis. BMC Infect Dis.2009;9:67. [ Links ]
33. Moore DA, Mendoza D, Gilman RH, Evans CA, Hollm Delgado MG, Guerra J, et al. Microscopic Observation Drug Susceptibility assay, a rapid, reliable diagnostic test for multidrug-resistant tuberculosis suitable for use in resource-poor settings. J Clin Microbiol. 2004;42(10):4432-7. [ Links ]