Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de Salud Pública
versión impresa ISSN 0124-0064
Rev. salud pública vol.16 no.6 Bogotá nov./dic. 2014
https://doi.org/10.15446/rsap.v16n6.28848
Artículo/Investigación
Perfiles serológicos de hepatitis B en donantes de sangre con anti-HBc reactivos
Serological Profiles of Hepatitis-B HBcAb-Positive Blood donors Reactivos
Mauricio Beltrán-Durán1, Maritza Berrío-Pérez1, María I. Bermúdez-Forero1, Armando D. Cortés-Buelvas2, Gloria C. Molina-Guevara3, Bernardo A. Camacho-Rodríguez4 y Sonia P. Forero-Matiz4
1 Red Nacional de Bancos de Sangre. Instituto Nacional de Salud. Bogotá, Colombia. mbeltrand@ins.gov.co; mberrio@ins.gov.co, mbermudez@ins.gov.co
2 Hospital Universitario del Valle. Universidad del Valle. Cali, Colombia. acortes59@gmail.com
3 Cruz Roja Colombiana, Seccional Valle. Santiago de Cali, Colombia. gcrissmol@gmail.com
4 Hemocentro Distrital. Bogotá, Colombia. bacamacho@saludcapital.gov.co; bacamacho1@gmail.com; spforero@saludcapital.gov.co; patriciaforerom@hotmail.com
Recibido 3 Abril 2013/Enviado para Modificación 10 Octubre 2013/Aceptado 16 Junio 2014
RESUMEN
Objetivo Determinar los perfiles serológicos para el virus de hepatitis B, en donantes de sangre anti-HBc reactivo y antígeno de superficie no reactivo, provenientes de cuatro ciudades del país
Métodos Se realizó un estudio prospectivo transversal, durante un período de 17 meses, aplicando el perfil serológico completo de la hepatitis B, en muestras de donantes con anti-HBc reactivo y antígeno de superficie de hepatitis B no reactivo. Los resultados fueron analizados utilizando Microsoft® Excel y Epiinfo V 3.5.1.
Resultados Se encontró que el 75 % de los donantes reactivos para anti-HBc en los bancos de sangre, presentaban algún marcador adicional de exposición para el VHB; el 1,3 % de los donantes presentaban marcadores serológicos de infección crónica por hepatitis B y un caso que resultó reactivo solamente para antígeno de superficie de hepatitis B. Se halló perfil de vacunación en el 6,1 % de donantes, que fueron reactivos solamente para anticuerpo contra antígeno de superficie.
Conclusiones. Se ratifica la importancia de la tamización de anti-HBc, a los donantes de sangre.
Palabras Clave: Transfusión sanguínea, bancos de sangre, donantes de sangre, hepatitis B, inmunoensayo, Colombia (fuente: DeCS, BIREME).
ABSTRACT
Objective To assess the serological profiles for HBV in blood donors that were anti-HBc reactive and non-reactive to HBsAg in four Colombian cities
Materials and Methods A prospective transversal study was conducted during 17 months, applying a complete serological profile for HBV in samples from blood donors that were anti-HBc reactive and non-reactive to HBsAg, results were analyzed employing descriptive statistics using Microsoft Excel and Epiinfo V. 3.5.1.
Results From donors reactive to anti-HBc, 75.0 % shown some additional infection marker for HBV. 1.3 % of blood donors had serological markers for chronical infection with hepatitis B, and a case had reactivity only for hepatitis B surface antigen (HBsAg). 6.1 % of donors showed a vaccination serological profile, only with reactivity to anti-HBsAg antibodies.
Conclusions With this study, anti-HBc blood screening importance was confirmed.
Key Words: Blood transfusion, blood bank, blood donor, hepatitis B, immunoassay, Colombia (source: MeSH, NLM).
El Virus de la hepatitis B (VHB) es un importante problema de salud a nivel mundial (1), especialmente en Asia, África, el sur de Europa y América Latina (2,3), siendo en estas regiones una causa importante de morbilidad y mortalidad(4,5). Según la OMS, se estima que 2 000 millones de personas han sido infectadas y más de 360 millones son portadoras crónicas (2,6,7). Alrededor de 40 % de pacientes con infección crónica por el VHB, desarrollan complicaciones graves durante su vida (8).
El VHB se transmite por vía vertical, sexual y parenteral (9) siendo el primer virus confirmado transmisible por sangre y productos sanguíneos (10). La infección con el VHB, se determina generalmente por el hallazgo de antígenos virales y/o anticuerpos específicos en el suero (11), aunque en el diagnóstico pueden intervenir criterios clínicos, los resultados de las pruebas de laboratorio ayudan a confirmar la infección con el virus.
Existen 6 marcadores de infección con el VHB detectables serológicamente, que pueden ayudar a ubicar a un individuo en un estadio de infección. El antígeno de superficie (HBsAg), se usa como el marcador diagnóstico de infección con el VHB (12), su eliminación del suero se asocia con curación clínica y mejor sobrevida(13).
La resolución del HBsAg indica generalmente seroconversión al anticuerpo contra el antígeno de superficie del VHB (anti-HBs) y la consecuente remisión de la infección por el VHB (14), es importante determinar el nivel de anti-HBs en IU/L, para establecer la infectividad, títulos mayores de 100 IU/L indican generalmente que el individuo no es infectante (15).
El antígeno e del VHB (HBeAg), es un marcador de replicación viral activa, está presente en la fase temprana de la infección aguda y durante el estado de replicación de la HB crónica (11); más adelante, el HBeAg se sustituye por el anticuerpo contra el antígeno e (anti-HBe) que aparece cuando declina el primero y está asociado con pérdida de infectividad (11).
Los anticuerpos contra el antígeno core del VHB (anti-HBc) son un marcador de infección aguda, crónica o resuelta y pueden seguir siendo detectables de por vida, el anti-HBc puede ser detectado en cualquiera que haya sido infectado con el VHB (16).
Así mismo, pueden presentarse individuos en los que el anti-HBc de tipo IgG (anti-HBcIgG) es el único marcador de memoria positivo: resultados falso-positivos, pacientes que tuvieron la infección y se resolvió, pacientes que no han generado títulos de anti-HBs, pacientes con infección con el VHB que no presentan reactividad en el HBsAg, debido a la mutación del gen S, o en casos de replicación viral muy baja (14).
Antes del año 1970, alrededor de 6 % de los receptores multi-transfundidos adquirían el VHB transmitido por transfusión (TTVHB), pero desde la introducción de las pruebas para detección del HBsAg en el año 1971, el riesgo de TTVHB ha disminuido, gracias al desarrollo de pruebas para detección más sensibles, aplicación en algunos países de anti-HBc y mejoras en la selección de donantes voluntarios; sin embargo, el riesgo de TTVHB sigue siendo superior, comparado con el riesgo para el VHC o VIH-1 (1,17).
Incluso en países en donde la prevalencia del VHB es baja y se aplican ambas pruebas de detección (HBsAg y anti-HBc), el riesgo de ITT con el VHB sigue siendo superior, comparado con los principales virus transmitidos por vía sanguínea, en Canadá, el riesgo residual de ITT por VHB es de 1:153 000 (1), en Estados Unidos, de 1 en 277 000 y en Europa es de 1 entre 72 000 a 1 entre 1 100 000, debido a alta variación entre zonas de mediana y baja endemicidad para el VHB (18).
La seguridad de los componentes sanguíneos, depende de una apropiada selección de los donantes de sangre, complementada por una alta sensibilidad de las pruebas serológicas para excluir la transmisión de agentes infecciosos (19).
Para el control de la infección transfusional, en el año 1981 se hizo obligatoria en Colombia la tamización para la detección del HBsAg del VHB, en el año 1991 para VIH y entre el año 1993 (20) y 1996 se expidieron las normas que regulan las actividades de banco de sangre, las cuales incluyeron la detección de estos marcadores y además anticuerpos contra el virus de hepatitis C (VHC), Trypanosoma cruzi y sífilis (21).
El propósito de este trabajo fue determinar los perfiles serológicos para el VHB, presentes en los donantes de sangre que eran reactivos a la tamización inicial para anti-HBc y HBsAg no reactivos y provenientes de cinco bancos de sangre del país.
MATERIALES Y MÉTODOS
Entre mayo del 2008 y noviembre del 2009 se llevó a cabo un estudio descriptivo, prospectivo transversal que incluyó la colecta de muestras de donantes de 5 bancos de sangre ubicados en Cali, Bogotá, Barranquilla y Valledupar. Los criterios de inclusión establecían que las muestras fueran reactivas para anti-HBc y no reactivas para HBsAg, así como la intención de participar en el estudio.
En los bancos de sangre se recolectaron muestras de suero, para realizar pruebas serológicas, para detección de anti-HBc y HBsAg, mediante inmunoensayos con estuches comerciales: ELISA tercera generación de Biokit, ensayo de micropartículas (MEIA) de Abbott Laboratories y electroquimioluminiscencia de Roche. Los sueros fueron congelados y almacenados a-80°C.
Dichas muestras fueron remitidas a la Coordinación Red Nacional Bancos de Sangre, (CRNBS-INS) en donde nuevamente se realizó la tamización por inmunoensayo con la técnica de quimioluminiscencia amplificada (Vitros ECI de Ortho Clinical Diagnostic Johnson & Johnson) para los siguientes marcadores de HB: HBsAg, anti-HBc, HBcIgM (anticuerpo IgM contra el antígeno central), anti-HBs, HBeAg, anti-HBe.
Las muestras que fueron no reactivas a anti-HBc en la CRNBS-INS, fueron analizadas nuevamente por quimioluminiscencia (Architect, Abbott Laboratories) en un tercer laboratorio, las que resultaron reactivas, fueron consideradas reactivas para anti-HBc. Los resultados de las variables y pruebas serológicas fueron analizados con estadística descriptiva, usando proporciones y porcentajes utilizando Excel y Epiinfo V 3.5.1.
RESULTADOS
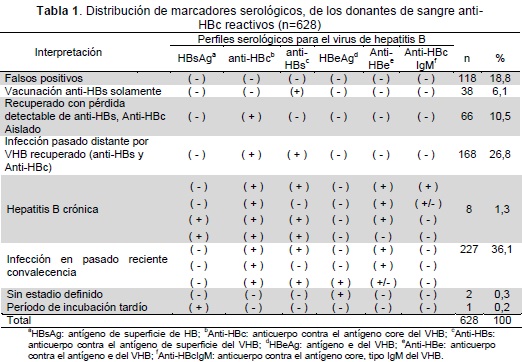
Este estudio fue realizado en total de 648 donantes de sangre, de cuatro ciudades del país; 20 muestras presentaron volumen insuficiente y fueron excluidas del estudio, quedando 628 muestras. El total de unidades que presentaron reactividad para anti-HBc, en los bancos de sangre, fueron descartadas e incineradas.
El 43,2 % de los donantes fueron mujeres; la edad promedio fue 39 años (18 a 65 años), no hubo diferencia significativa entre sexo con respecto a la edad (p>0,05). Las ciudades de Barranquilla y Valledupar presentaron un menor porcentaje de donantes del sexo femenino, comparado con Bogotá y Cali RR=4,83 (IC 2,25-10,37) RR=4,57 (IC 2,11-9,86).
En cuanto a tipo de donante: 534 (85,0 %) fueron voluntarios, 93 (14,8 %) de reposición y uno (0,2 %) dirigido, no se encontró diferencia estadísticamente significativas entre tipo de donante y presencia de marcador de exposición al VHB RR=1,10 (IC 0,99-1,10). Se encontró que 510 (81,2 %) muestras de donantes presentaron reactividad a algún marcador del VHB y 118 (18,8 %) fueron negativas para los marcadores serológicos.
De las 510 muestras reactivas: 38 (7,5 %) presentaron reactividad solamente para anti-HBs y 472 (92,0 %) muestras de donantes fueron positivas para diferentes marcadores serológicos.
La distribución según perfiles serológicos de exposición fue: 66 (10,5 %) presentaron anti-HBc solamente, 168 (26,8 %) reactivos para anti-HBc y anti-HBs, 227 (36,1 %) presentaron marcadores de infección en pasado reciente o convalecencia. Respecto a perfil con posible infección, se hallaron ocho (1,3%) donantes con marcadores de infección crónica, uno (0,2 %) presentó una posible Hepatitis B con reactividad solamente para HBsAg, dos (0,3 %) donantes no fueron clasificados en ningún estadio y sus muestras fueron doblemente reactivas para HBeAg (Tabla 1).
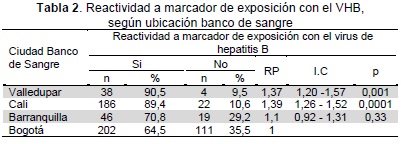
La distribución de las muestras de donantes con marcadores de exposición al VHB mostró que existe mayor probabilidad de hallar donantes reactivos a estos marcadores en los bancos de Valledupar y Cali comparado con Bogotá (p<0,05)(Tabla 2).
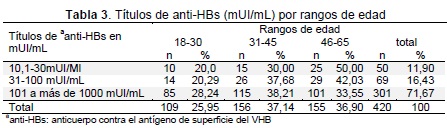
Fueron reactivos a anti-HBs con títulos superiores a 10 mUI/mL, un total de 420 donantes, incluyendo aquellos clasificados como vacunados, el mayor porcentaje de este grupo tenía rango de edad entre 31 y 45 años (37,1 %) (Tabla 3).
DISCUSIÓN
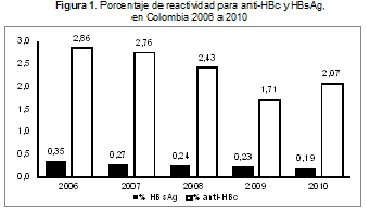
Entre 2006 a 2010, se observó el incremento en el número de donaciones de sangre, así como una disminución en la reactividad nacional de HBsAg que pasó de 0,4 % a 0,2 %; así mismo, el anti-HBc pasó de 2,9 % a 2,1 % (Figura 1). Esta disminución podría deberse a mayor especificidad de las pruebas utilizadas por los bancos de sangre y al incremento en el número de donantes habituales, que pasó de 8,4 % a 18,1 % entre 2006 y 2010 respectivamente.
Respecto a los perfiles serológicos, se clasificaron como falsos positivos a anti-HBc 118 donantes (18,8 %), que fueron negativos para todos los marcadores serológicos del VHB, incluido anti-HBc, estos hallazgos son similares a los encontrados en un estudio que utilizo 9 estuches comerciales para anti-HBc y halló una concordancia de 86,2 % (22).
Un total de 38 (6,1 %) muestras fueron reactivas para anti-HBs, concordando con el perfil serológico de vacunados con inmunidad para el VHB, la mayoría (52,6 %) tenían entre 18 y 30 años, es decir población joven lo cual podría relacionarse con la introducción de los programas de vacunación contra el VHB en infantes que llegó a una cobertura del 93 % en 2007 (23).
Se encontraron 472 donantes con algún marcador de exposición al VHB, de ellos 168 donantes que podrían clasificarse con infección por VHB pasada y recuperados; 227 donantes (36,2 %) presentaron perfil serológico de convalecencia, estos son congruentes con el elevado índice de infección por VHB que presentan los países de la cuenca amazónica de Brasil y regiones del Perú, Colombia, Venezuela, Haití y República Dominicana es alto (>8 %) (24).
El hallazgo de 8 donantes (7 hombres) con perfil de infección de VHB crónica y de tres donantes en posible fase aguda (dos reactivos a antígeno y uno a HBsAg), sugiere una elevada incidencia de infección por VHB, situación que es similar a lo reportado un informe epidemiológico de población general, que refiere que la incidencia de hepatitis B a la fecha de corte es de 1,83 casos por cada 100 000 habitantes (25).
Existen reportes de casos de hepatitis B oculta (HBO), en pacientes positivos para anti-HBc con infección crónica por VHB, en ellos el HBsAg desciende a un nivel indetectable que puede asociarse con la aparición de anti-HBs; este patrón serológico se produce a un ritmo del 0,7-1,3 % al año y se asocia con mayor edad y reactividad para anti-HBe, estos hallazgos ratifican la importancia de la tamización de anti-HBc en bancos de sangre en la reducción del riesgo de infección transfusional (26). La detección del anti-HBc, puede reducir el riesgo residual de infección por el VHB después de la transfusión (27).
Presentaron reactividad para anti-HBc aislado 10,5 % de donantes, datos similares a los reportados en donantes de Pakistán, con 12,4 % de anti-HBc (19). Algunos autores sugieren que la presencia de anti-HBc aislado, podría indicar infección con el VHB en el pasado y se produce cuando los títulos de anti-HBs caen por debajo de los niveles de detección (19,27). Estudios realizados en chimpancés indican que tan sólo unos pocos viriones 1-10, son infecciosos cuando se inoculan por vía intravenosa (19,24,28), lo que sugiere que la transfusión de una unidad de un donante con una PCR positiva-baja o intermitente puede contener suficiente inóculo para la infección (27). Un estudio realizado en Yucatán, en 158 muestras de donantes con anti-HBc como único marcador de infección, detectó ADN del VHB en 8,2 % de ellos (27).
La estrategia de seguridad transfusional, basada en la adecuada selección de donantes de sangre voluntarios, influye en la reducción de positividad para diferentes marcadores infecciosos como se ha demostrado en estudios: en Albania, sitio de alta prevalencia para VHB, una investigación muestra la diferencia en la prevalencia de HBsAg, siendo menor en donantes voluntarios no remunerados (8,1 %), comparado con los donantes de reposición (10,5 %) (10).
En los pasados diez años, se han realizado un gran número de estudios en áreas de baja, mediana y alta prevalencia de anti-HBc, para determinar la eficiencia de este tipo de prueba mediante la tamización de muestras de donantes anti-HBc-positivos para la presencia de ADN del VHB; la eficacia del anti-HBc, se examinó en áreas de baja prevalencia y muy pocas muestras contenían ADN del VHB; en contraste, en 10 estudios de 7 países de Asia, en donde la prevalencia de anti-HBc está en el rango entre 7 y 43 %, el 5% de las muestras anti-HBc reactivas contenían ADN del VHB (rango entre 0-18 %)(29).
En Bolivia entre 1992 y 1996 se realizó un estudio seroepidemiológico en población general, para determinar prevalencias de infección para varios agentes incluido el VHB, las poblaciones rurales andinas y dos poblaciones urbanas de alto riesgo tuvieron prevalencias de anti-HBc similares (11,2 % y 11,6 %, respectivamente) y tasas de portadores de HBsAg que pueden considerarse bajas (0,5 % y 1,0 %). Por el contrario, las comunidades de la Amazonia mostraron una alta prevalencia de anti-HBc (74 %) y una incidencia de portadores de HBsAg baja para la prevalencia encontrada 1,6 % en general y 2,3 % en los positivos a anti-HBc (30). Un estudio realizado en la región del sur occidente de Nigeria, en 1410 donantes de sangre aparentemente sanos, entre 18 y 64 años de edad, encontró una reactividad para HBsAg de 8,6 % (31).
Un estudio realizado entre pacientes VIH positivos, en la ciudad de Medellín Colombia, encontró marcadores de infección con el VHB en el 38,6 % de los pacientes, más de la mitad (59,8 %), presentaban marcadores de infección resuelta (anti-HBc positivo, anti-HBs positivo y HBsAg negativo); sin embargo, más de un tercio (37,1 %) eran anti-HBc positivo y anti-HBs, anti-HBcIgM y HBsAg negativo; la tasa de infección con el VHB, fue más alta que la de la población general, lo que puede explicarse por vía de transmisión (32). Un estudio de HBO, realizado en Colombia, a pacientes infectados con el VIH, negativos para HBsAg y positivos para anti-HBcIgG, mostró la presencia de ADN del virus en un 8,3 % (33).
420 (66,9 %) muestras de donantes fueron positivas para anti-HBs, (con o sin otro marcador serológico), con títulos superiores a 10 mUI/mL y 208 muestras fueron negativas para este marcador, indicando falta de títulos protectores a la infección con el VHB, personas que necesitan ser inmunizadas contra este.
Este es el primer estudio realizado en nuestro país, en donantes de sangre que caracterizó perfiles serológicos del VHB anti-HBc reactivos, HBsAg no reactivos y en él se evidencia que el 74,8 % de estas muestras presentaban algún marcador de infección para el VHB, lo cual ratifica la importancia de la tamización de anti-HBc en bancos de sangre ·
Agradecimientos: Trabajo realizado con el apoyo financiero de Colciencias, proyecto 2104-343-19190; al personal de los bancos de sangre: Hemocentro Distrital, Cruz Roja Seccional Valle, Fundación Grupo Estudio Barranquilla, Hospital Rosario Pumarejo, Hospital Universitario del Valle. A Sandra García Blanco, por la traducción del resumen.
Conflicto de interés: Ninguno.
REFERENCIAS
1. Chevrier MC, St-Louis M, Perreault J, Caron B, Castilloux C, Laroche J, et al. Detection and characterization of hepatitis B virus of anti-hepatitis B core antigen-reactive blood donors in Quebec with an in-house nucleic acid testing assay. Transfusion. 2007;47(10):1794-802. [ Links ]
2. Han GR, Cao MK, Zhao W, Jiang HX, Wang CM, Bai SF, et al. A prospective and open-label study for the efficacy and safety of telbivudine in pregnancy for the prevention of perinatal transmission of hepatitis B virus infection. J Hepatol. 2011;55(6):1215-21. [ Links ]
3. Ali M, Idrees M, Ali L, Hussain A, Ur Rehman I, Saleem S, et al. Hepatitis B virus in Pakistan: a systematic review of prevalence, risk factors, awareness status and genotypes. Virology J. 2011;8:102 [ Links ]
4. Eke AC, Eke UA, Okafor CI, Ezebialu IU, Ogbuagu C. Prevalence, correlates and pattern of hepatitis B surface antigen in a low resource setting. Virology J. 2011;8:12. [ Links ]
5. Li G, Li W, Guo F, Xu S, Zhao N, Chen S, et al. A novel real-time PCR assay for determination of viral loads in person infected with hepatitis B virus. J. Virol Methods. 2010;165(1):9-14. [ Links ]
6. Valsamakis A. Molecular testing in the diagnosis and management of chronic hepatitis B. Clin Microbiol Rev. 2007;20(3):426-39. [ Links ]
7. Lavanchy D. Worldwide epidemiology of HBV infection, disease burden, and vaccine prevention. J Clin Virol. 2005;34 Suppl 1:S1-3. [ Links ]
8. Guan R, Lui HF. Treatment of hepatitis B in decompensated liver cirrhosis. Int J Hepatol. 2011;2011:918017. [ Links ]
9. Alvarado-Esquivel C, Sifuentes-Álvarez A, Pérez-Ochoa J, García-Corral N, Rodríguez-Briones A, González-Castañeda J, et al. Serorreactividad al antígeno de superficie del virus de la hepatitis B en diversos grupos de población de la ciudad de Durango, México. Gac Méd Méx. 2008;144(6):481-4. [ Links ]
10. Durro V, Qyra S. Trends in prevalence of hepatitis B virus infection among Albanian blood donors, 1999-2009. Virology J. 2011;8:96. [ Links ]
11. Norder H, Arauz-Ruiz P, Blitz L, Pujol FH, Echevarria JM, Magnius LO. The T(1858) variant predisposing to the precore stop mutation correlates with one of two major genotype F hepatitis B virus clades. J Gen Virol. 2003;84(Pt 8):2083-7. [ Links ]
12. Chan HL, Thompson A, Martinot-Peignoux M, Piratvisuth T, Cornberg M, Brunetto MR, et al. Hepatitis B surface antigen quantification: Why and how to use it in 2011 - A core group report. J Hepatol. 2011;55(5):1121-31. [ Links ]
13. Reijnders JG, Rijckborst V, Sonneveld MJ, Scherbeijn SM, Boucher CA, Hansen BE, et al. Kinetics of hepatitis B surface antigen differ between treatment with peginterferon and entecavir. J Hepatol. 2011;54(3):449-54. [ Links ]
14. Almeida D, Tavares-Neto J, Trepo C, Almeida A, Mello C, Chemin I, et al. Occult B infection in the Brazilian northeastern region: a preliminary report. Braz J Infect Dis. 2008;12(4):310-2. [ Links ]
15. Allain JP, Candotti D. Diagnostic algorithm for HBV safe transfusion. Blood Transfusion. 2009;7(3):174-82. [ Links ]
16. Behzad-Behbahani A, Mafi-Nejad A, Tabei SZ, Lankarani KB, Torab A, Moaddeb A. Anti-HBc & HBV-DNA detection in blood donors negative for hepatitis B virus surface antigen in reducing risk of transfusion associated HBV infection. Indian J Med Res. 2006;123(1):37-42. [ Links ]
17. Comanor L, Holland P. Hepatitis B virus blood screening: unfinished agendas. Vox Sang. 2006;91(1):1-12. [ Links ]
18. Bihl F, Castelli D, Marincola F, Dodd RY, Brander C. Transfusion-transmitted infections. J Transl Med. 2007;5:25. [ Links ]
19. Bhatti FA, Ullah Z, Salamat N, Ayub M, Ghani E. Anti-hepatits B core antigen testing, viral markers, and occult hepatitis B virus infection in Pakistani blood donors: implications for transfusion practice. Transfusion. 2007;47(1):74-9. [ Links ]
20. Ministerio de Salud. República de Colombia. Decreto 1571 de 1993 "Sangre segura para todos". 1993. [ Links ]
21. Beltrán Durán M, Navas MC, Arbeláez MP, Donado J, Jaramillo S, De la Hoz F, et al. Seroprevalence of hepatitis B virus and human immunodeficiency virus infection in a population of multiply-transfused patients in Colombia. Biomedica. 2009 Jun;29 (2):232-43. [ Links ]
22. Schmidt M, Nübling CM, Scheiblauer H, Chudy M, Walch LA, Seifried E, et al. Anti-HBc screening of blood donors: a comparison of nine anti-HBc tests. Vox Sang. 2006 Oct;91(3):237-43. [ Links ]
23. De la Hoz F, Pérez L, De Neira M, Hall AJ. Eight years of hepatitis B vaccination in Colombia with a recombinant vaccine: factors influencing hepatitis B virus infection and effectiveness. Int J Infect Dis. 2008 Mar;12(2):183-9. [ Links ]
24. Idrovo V, Suárez C, Álvarez P. Epidemiología e historia natural de la hepatitis B. Rev Col Gastroenterol. 2009 Mar; 24(Suppl 1):4s-12s. [Internet]. Disponible en: http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0120-9572009000500003&lng=en. Consultado agosto de 2013 [ Links ]
25. Instituto Nacional de Salud. Subdirección de Vigilancia y Control en Salud Pública. Boletín epidemiológico Nacional. Semana epidemiológica No. 20. 2013:1-22. [Internet]. Disponible en: http://www.ins.gov.co/boletinepidemiologico/Boletn%20Epidemiolgico/2013%20Boletin%20epidemiologico%20Semana%2020.pdf. Consultado agosto de 2013. [ Links ]
26. Hollinger FB, Sood G. Occult hepatitis B virus infection: a covert operation. J Viral Hepat. 2010 Jan;17(1):1-15. [ Links ]
27. García-Montalvo BM, Farfan-Ale JA, Acosta-Viana KY, Puerto-Manzano F I. Hepatitis B virus DNA in blood donors with anti-HBc as a possible indicator of active hepatitis B virus infection in Yucatan, Mexico. Transfus Med. 2005 Oct;15(5):371-8. [ Links ]
28. Tabor E, Purcell RH, Gerety RJ. Primate animal models and titered inocula for the study of human hepatitis A, hepatitis B, and non-A, non-B hepatitis. J Med Primatol. 1983;12(6):305-18. [ Links ]
29. Allain JP, Cox L. Challenges in hepatitis B detection among blood donors. Curr Opin Hematol. 2011 Nov;18(6):461-6. [ Links ]
30. León P, Venegas E, Bengoechea L, Rojas E, Lopez JA, Elola C, et al. Prevalence of infections by hepatitis B, C, D and E viruses in Bolivia. Rev Panam Salud Pública. 1999 Mar;5(3):144-51. [ Links ]
31. Buseri FI, Muhibi MA, Jeremiah ZA. Sero-epidemiology of transfusion-transmissible infectious diseases among blood donors in Osogbo, south-west Nigeria. Blood Transfus. 2009 Oct;7(4):293-9. [ Links ]
32. Hoyos-Orrego A, Massaro-Ceballos M, Ospina-Ospina M, Gomez-Builes C, Vanegas-Arroyave N, Tobon-Pereira J, et al. Serological markers and risk factors for hepatitis B and C viruses in patients infected with human immunodeficiency virus. Rev Inst Med Trop Sao Paulo. 2006 Nov-Dec;48(6):321-6. [ Links ]
33. Ramírez IC, Cataño JC. Prevalencia de hepatitis B oculta en una cohorte prospectiva de pacientes con VIH. Iatreia. 2008;21(1):S10-S1. [ Links ]