Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Salud Pública
Print version ISSN 0124-0064
Rev. salud pública vol.17 no.1 Bogotá Jan./June 2015
https://doi.org/10.15446/rsap.v17n1.45716
http://dx.doi.org/10.15446/rsap.v17n1.45716
Artículo/Investigación
Susceptibilidad antimicrobiana de aislamientos de Salmonellaentérica obtenidos del pre-beneficio y de porcinos en Colombia
Antimicrobial susceptibility of Salmonella enterica isolated during the pre-harvest period in swine in Colombia
Sandy Pulecio-Santos1, Paula Bermúdez-Duarte1, Martha C. Suárez-Alfonso2
1 Universidad Nacional de Colombia. Bogotá, Colombia. lorena.pulecio@gmail.com; pmbermudezd@unal.edu.co
2 Grupo Genética Molecular de Patógenos GEMPA. Departamento de Ciencias para la Salud Animal, Laboratorio de Microbiología, Facultad de Medicina Veterinaria y de Zootecnia. Universidad Nacional de Colombia. Bogotá, Colombia. mcsuarezal@unal.edu.co
Recibido 2 Septiembre 2014/Enviado para Modificación 12 Noviembre 2014/Aceptado 16 Diciembre 2014
RESUMEN
Objetivo Determinar la susceptibilidad antimicrobiana de aislamientos de Salmonella enterica obtenidos durante la etapa de prebeneficio y de animales.
Método Se realizaron pruebas de susceptibilidad antimicrobiana con el método de difusión en agar a 333 aislamientos de Salmonella enterica obtenidos del prebeneficio de camiones de transporte y de corrales. Se obtuvieron heces en camión, heces en corral, nódulos linfáticos mesentéricos y contenido cecal. Los especímenes fueron obtenidos en cuatro plantas de beneficio porcino.
Resultados El 99,6 % (n=332) de las aislamientos mostró resistencia frente al menos un antimicrobiano. Se encontraron los siguientes porcentajes de resistencia: amoxacilina-ácido clavulánico 15,9 % (n=53), ampicilina 33,9 % (n=113), ceftiofur 41,4 % (n=138), ciprofloxacina 9 % (n=30), cloranfenicol 19,2 % (n=64), florfenicol 33 % (n=110), gentamicina 22,8 % (n=76), sulfametoxazol-trimetroprim 24,9 % (n=83), tetraciclina 93,1 % (n=310) y tilmicosina 73,8 % (n=246).
Conclusiones Los resultados muestran que es indispensable reforzar las medidas de contención para prevenir el desarrollo de resistencias antimicrobianas y fortaleciendo la capacitación de operarios, trabajadores y médicos veterinarios en la producción primaria durante el procesamiento del producto, durante la distribución y venta hasta el consumidor, garantizando un alimento inocuo.
Palabras Clave: Salmonelosis, carne, porcinos, farmacorresistencia microbiana, enfermedades transmitidas por los alimentos, inocuidad de los alimentos (fuente: DeCS, BIREME).
ABSTRACT
Objective To determine the antimicrobial susceptibility of isolates of Salmonella enterica isolated from animals and during the pre-slaughter period.
Method Antimicrobial susceptibility tests were performed using the agar diffusion method on 333 isolates of Salmonella enterica obtained from the pre-harvest period represented by transport trucks and pens. From the animals, isolates were obtained from the animals' feces in transport trucks and pens, mesenteric lymph nodes, and cecal content. The specimens were obtained from four slaughtering facilities.
Results The antimicrobial susceptibility tests were performed obtaining the following results: 99.6 % (n=332) of isolates showed resistance to at least one antimicrobial agent. The following resistance percentages were found: amoxicillin-clavulanic acid 15.9 % (n=53), ampicillin 33.9 % (n=113), ceftiofur 41.4 % (n=138), ciprofloxacin 9 % (n=30 ), chloramphenicol 19.2 % (n=64), florfenicol 33 % (n=110), gentamicin 22.8 % (n=76), sulfamethoxazole-trimethoprim 24.9 % (n=83), tetracycline 93.1 % (n=310) and tilmicosin 73.8 % (n=246).
Conclusion The results show that it is essential to reinforce containment measures to prevent the development of antimicrobial resistances and improve training of the operators, workers, and veterinarians in Colombia involved in the primary production, product processing, distribution, and sale to the consumer, thereby guaranteeing a safe food product and the effectiveness of antimicrobial agents in human and veterinary medicine.
Key Words: Salmonella Infections, meat, swine, drug resistance, microbial, foodborne diseases, food safety (source: MeSH, NLM).
El género Salmonella reúne alrededor de 2 579 serovariedades (1) y está conformado por bacilos Gram-negativos, no esporoformadores de la familia Enterobacteriaceae (2), en su mayoría agentes causales de enfermedades zoonóticas, transmitidas por alimentos de origen animal (3). La salmonelosis no tifoidea en humanos puede manifestarse como gastroenteritis, septicemia o estado portador asintomático. La presencia de Salmonella spp. en cerdos es de gran impacto para la industria porcícola, por las pérdidas económicas que genera y por constituir una barrera no arancelaria para la comercialización de alimentos y su presencia en la carne de cerdo constituye un grave problema de salud pública (4,5).
La transmisión de Salmonella spp. a través de alimentos está asociada al consumo de frutas y verduras contaminadas (6) así como al consumo de pollo, carne de res y cerdo y sus derivados (7,8). Las infecciones por Salmonella resultan en una enfermedad moderada auto limitante, que puede resolverse entre tres y cuatro días sin requerir tratamiento antimicrobiano (9). Sin embargo las manifestaciones clínicas pueden variar si los serovariedades involucradas son tifoideas (Salmonella typhi y S. Paratyphi– serovariedades especificas del humano-) o no tifoideas. El cuadro de fiebre tifoidea es mucho más grave e incluso mortal (10). La salmonelosis no tifoidea se caracteriza por un cuadro febril, acompañado de diarrea y dolores abdominales como síntomas primarios, pudiéndose presentar signos más severos como bacteriemia y meningitis principalmente en pacientes inmunocomprometidos, grupos etarios vulnerables como ancianos y niños o debida a aislamientos resistentes, en los que el tratamiento puede no ser efectivo (9). El tratamiento de primera elección son las quinolonas en adultos y las cefalosporinas de tercera generación en niños y personas con inmunocompromiso (5). Adicionalmente, los antimicrobianos son usados frecuentemente en humanos y animales, con fines profilácticos, terapéuticos o como promotores de crecimiento en animales (11), de manera que su uso no adecuado puede favorecer el desarrollo de resistencias bacterianas. Éste hecho cobra mayor relevancia en salud pública cuando las resistencias antimicrobianas se diseminan de animales a humanos a través de las cadenas productivas (12).
El desarrollo de resistencias antimicrobianas se asocia con variaciones en la virulencia de los aislamientos, pudiéndose generar complicaciones en el tratamiento de enfermedad, hospitalizaciones y muertes, en especial en aquellos casos en que se realizan tratamientos sin conocer previamente la susceptibilidad del patógeno involucrado, lo cual puede resultar en una pobre respuesta a la terapia, deterioro en la evolución y resolución clínica de la enfermedad (13-15). Los mecanismos de resistencia de Salmonella spp. han sido reportados desde hace más de tres décadas (16), así como un incremento en su resistencia, específicamente en Salmonella typhimurium DT104 la resistencia frente a tetraciclinas se han incrementado desde 0 % en 1948 a 98 % en 1998 en ciertas poblaciones (17). Las multiresistencias que fueron detectadas inicialmente a mediados de la década de los 80 en animales y a mediados de la década de los 90 en humanos, han ido en aumento y, el vínculo entre poblaciones de bacterias animales y humanas ha sido documentado como fuente probable de transmisión de dichas multiresistencias (18).
El microorganismo y su susceptibilidad antimicrobiana se estudió en el prebeneficio (transporte de los animales y período de espera en corrales en la planta de beneficio) y en especímenes de origen animal durante el beneficio porcino, entendido este último, como el conjunto de procedimientos que involucran el sacrificio del animal y su posterior alistamiento (faenado), hasta obtener el producto terminado, en este caso la canal del cerdo (19,20).
MATERIALES Y MÉTODOS
Aislamientos. Se evaluaron 333 aislamientos provenientes del repositorio del Laboratorio de Microbiología de la Facultad de Medicina Veterinaria y de Zootecnia de la Universidad Nacional de Colombia, Sede Bogotá, obtenidos del prebeneficio en camiones de transporte, corrales y durante el beneficio de ganglios linfáticos mesentéricos y contenido cecal.
Camiones. El muestreo se realizó en camiones que movilizaban un número superior a 35 cerdos. Posterior al descenso de los animales y mediante frotación con una esponja previamente humedecida con 10 ml de agua peptonada tamponada, se muestrearon cuatro puntos de pisos y paredes al interior del camión, desde afuera hacia el interior.
Corrales. Los corrales en que serían ubicados los animales antes del beneficio, fueron visitados previamente. Las muestras fueron obtenidas antes del ingreso, frotando la superficie con una esponja humedecida con 10 ml de agua peptonada tamponada. Se tomaron cuatro puntos de pisos y cuatro puntos de las paredes distribuidos en la totalidad del corral. Muestras de aguas residuales acumuladas en los pisos del corral fueron obtenidas permitiendo que la esponja absorbiera el líquido del suelo. Después de al menos cuatro horas de permanencia de los cerdos en el corral, se procedió a realizar el muestreo de pisos y paredes en los mismos puntos en que fueron tomadas inicialmente.
Animales. El muestreo de heces de camión se realizó posterior al descenso de los cerdos, desde el exterior al interior del camión, tomando heces de al menos 3 diferentes puntos hasta conseguir un peso de 50 gramos aproximadamente que fueron depositados en una bolsa y debidamente homogenizados. Las heces de corral fueron obtenidas aproximadamente cuatro horas después del ingreso de los animales al corral, tomando al menos tres especímenes. Durante el beneficio, con instrumental estéril, se obtuvieron 25 gramos de tejido de ganglios, el contenido cecal se obtuvo anudando una porción de seis a siete centímetros de intestino.
Aislamientos bacterianos. El aislamiento e identificación del microorganismo se realizó según la norma ISO 6579:2002; la confirmación con el sistema automatizado VITEK® 2 Compact System, y mediante aglutinación en placa con antisuero Poly A-I & Vi (BD-Difco®). Los aislamientos fueron almacenados a -70°C.
Evaluación de la susceptibilidad antimicrobiana. La susceptibilidad antimicrobiana se determinó con el método de difusión en disco (Kirby-Bauer, 1966) (21), según recomendaciones del Clinical Laboratory Estándar Institute (CLSI) para aislamientos de origen animal (22).
Los agentes antimicrobianos se seleccionaron con base en los siguientes criterios: Antimicrobianos usados en porcicultura y registrados en el Instituto Agropecuario Colombiano (ICA) en Colombia, considerados de importancia veterinaria por la Organización Mundial de Sanidad Animal (OIE, Resolución No. XXVIII, 2007) (23), y utilizados en el sistema EQUAS (The external quality Assurance System of the WHO Global Salm-Surv, 2008) para la vigilancia mundial de las resistencias de Salmonella spp., así como los antimicrobianos reseñados en los protocolos del CLSI para su interpretación.
Los antimicrobianos fueron: Amoxacilina-Ácido clavulánico (AMC; 20/10 ug), Ampicilina (AMP; 10 ug), Ceftiofur (EFT; 30ug), Ciprofloxacina (CIP; 5 ug), Cloranfenicol (C; 30 ug), Florfenicol (FFC; 30 ug), Gentamicina (GN; 10 ug), Sulfametoxazol/trimetroprim (SXT; 25 ug), Tetraciclina (TE; 30 ug) y Tilmicosina (TIL; 15 ug).
Un aislamiento se consideró resistente cuando mostró resistencia o sensibilidad intermedia, y multiresistente si exhibió resistencia a 3 o más agentes. El control de calidad se realizó con la cepa de Escherichia coli ATCC 25922.
Análisis Estadístico. Se realizó estadística descriptiva usando Microsoft Excel versión 2010 (Software PC), determinando proporciones de resistencia según el punto de muestreo, así como patrones de multiresistencia.
RESULTADOS
Prebeneficio
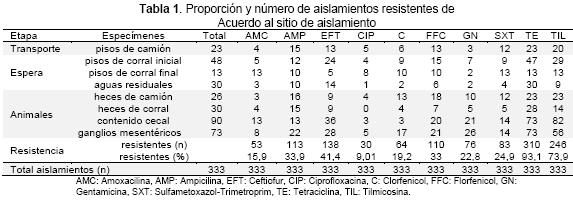
Camiones. Las aislamientos de pisos de camión (n=23) presentaron con mayor frecuencia los patrones de resistencia a ampicilina, ceftiofur, cloranfenicol, florfenicol, tetraciclina y tilmicosina (n=3), seguidos de ampicilina, tetraciclina, tilmicosina y sulfametoxazol-trimetroprim (n=2), ampicilina, cloranfenicol, florfenicol, tetraciclina, tilmicosina y
sulfametoxazol-trimetroprim (n=2) y amoxicilina, ceftiofur, florfenicol y tetraciclina (n=2).
Corrales. Las aislamientos de pisos de corral inicialmente (n=48) presentaron como patrones más comunes de resistencia ceftiofur y tetraciclina (n=4), ceftiofur, tetraciclina, tilmicosina (n=4), tetraciclina, tilmicosina (n=3), gentamicina, tetraciclina, tilmicosina (n=3) y tetraciclina, tilmicosina, sulfametoxazol-trimetroprim (n=2). En los pisos de corral final (n=13) el patrón hallado con más frecuencia fue ampicilina, ciprofloxacina, clorfenicol, florfenicol, tetraciclina, tilmicosina, sulfametoxazol-trimetroprim (n=5), seguido de ampicilina, ceftiofur, ciprofloxacina, clorfenicol, florfenicol, tetraciclina, tilmicosina, sulfametoxazol-trimetroprim (n=2), ceftiofur, ciprofloxacina, clorfenicol, florfenicol, tetraciclina, tilmicosina, sulfametoxazol-trimetroprim (n=2).
Los aislamientos de pisos de corral final (n=13) presentaron como patrón más común de multiresistencia ampicilina, ciprofloxacina, clorfenicol, florfenicol, tetraciclina, tilmicosina, sulfametoxazol-trimetroprim (n=5), seguido de ceftiofur, ciprofloxacina, clorfenicol, florfenicol, tetraciclina, tilmicosina, sulfametoxazol-trimetroprim (n=2) y ampicilina, ceftiofur, ciprofloxacina, clorfenicol, florfenicol, tetraciclina, tilmicosina, sulfametoxazol-trimetroprim (n=2).
De las muestras de aguas residuales de los corrales se tomaron 30 aislamientos y el patrón de resistencia de presentación más frecuente fue ceftiofur, tetraciclina (n=4), seguido de amoxicilina, ampicilina, ceftiofur, tetraciclina (n=2).
Animales
Heces de Camión. De heces tomadas del camión (n=26) el patrón de multiresistencia hallado con mayor frecuencia fue ampicilina, clorfenicol, florfenicol, tetraciclina, tilmicosina (n=3), seguido por gentamicina, tetraciclina, tilmicosina (n=2), ampicilina, clorfenicol, florfenicol, tetraciclina, tilmicosina (n=2) y ampicilina, ceftiofur, clorfenicol, florfenicol, tetraciclina, tilmicosina, sulfametoxazol-trimetroprim (n=2).
Heces de Corral. De las heces de corral (n=30) se presentaron varios patrones de multiresistencia sin repetición, y dos de las aislamientos mostraron resistencia simultánea a Ampicilina y Tetraciclina.
Contenido Cecal. En contenido cecal (n=90) se encontró el patrón de gentamicina, tetraciclina, tilmicosina (n=15) como el patrón de multiresistencia más frecuente, ceftiofur, tetraciclina, tilmicosina (n=4), ceftiofur, gentamicina, tetraciclina, tilmicosina (n=4) y ampicilina, ceftiofur, tilmicosina (n=4) fueron los siguientes patrones más frecuentes.
Ganglios Linfáticos. De los aislamientos de muestras de ganglios linfáticos mesentéricos (n=73) el patrón más frecuentemente encontrado fue gentamicina, tetraciclina, tilmicosina (n=11), seguido de ampicilina, clorfenicol, florfenicol, tetraciclina, tilmicosina, sulfametoxazol-trimetroprim (n=5), ceftiofur, tetraciclina, tilmicosina (n=3), ceftiofur, gentamicina, tetraciclina, tilmicosina (n=3) fueron los siguientes patrones de mayor presentación.
En los 333 aislamientos estudiados se encontró que 0,3 % (n=1) presentó sensibilidad a todos los agentes antimicrobianos, mientras que el 99,7 % (n=332) fue resistente al menos a uno de los agentes antimicrobianos evaluados. La resistencia a dos antimicrobianos simultáneamente fue de 17,1 % (n=57), de 11,4 % (n=38) a tres antimicrobianos, mientras que 23,1 % (n=77) fue resistente a cuatro, 16,2 % (n=54) a cinco, 9,3 % (n=31) a seis, 9,9 % (n=33), 7,8 % (n=26), 3,9 % (n=13), 0,3 % (n=1) y 0,6 % (n=2) para siete, ocho, nueve y diez antimicrobianos respectivamente.
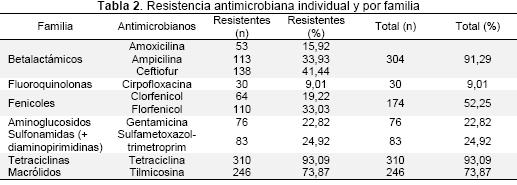
Al considerar el porcentaje de resistencia frente a cada antimicrobiano de manera individual el mayor porcentaje de resistencia encontrado fue de 93 % (n=310) frente a tetraciclina, seguido por 73,8 % (n=246) a tilmicosina, 41,4 % (n=138) a ceftiofur, 33,9 % (n=113) a ampicilina, 33 % (n=110) a florfenicol, 24,9 % (n=83) presentó resistencia a sulfametoxazol-trimetroprim, 22,8 % (n=76) fue resistente a gentamicina, 19,2 % (n=64) a cloranfenicol, 15,9 % (n=53) a amoxacilina y a ciprofloxacina 9 % (n=30). Estos porcentajes de resistencia variaron de acuerdo al sitio de aislamiento (Tabla 1). Las resistencias globales a los agentes antimicrobianos empleados de acuerdo a la familia a la cual pertenecen se compilan en la Tabla 2.
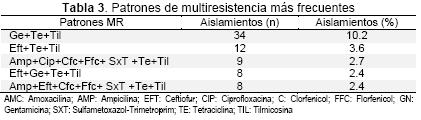
El patrón de multiresistencia más común encontrado en este estudio fue gentamicina, tetraciclina y tilmicosina con un total de 34 aislamientos equivalente al 10,2 % de las muestras estudiadas, seguido por ceftiofur, tetraciclina y tilmicosina con 3,6 % de multiresistencia. El siguiente patrón encontrado en mayor proporción fue ampicilina, ciprofloxacina, clorfenicol, florfenicol, sulfatrimetroprim, tetraciclina y tilmicosina con el 2,7 %. (Tabla 3). Sin embargo la frecuencia de estos patrones varió según el sitio de aislamiento.
DISCUSIÓN
En el ámbito mundial, en especial en los países en vía de desarrollo, las infecciones por Salmonella spp. representan un problema de salud pública, por tal razón su monitoreo contribuye a orientar medidas de prevención y control (24). De igual manera es fundamental entender los mecanismos de diseminación del microorganismo para desarrollar estrategias de vigilancia y control específicas (25). Estudios anteriores han reportado aislamientos provenientes de ganglios linfáticos íleo cecocólicos y de íleon relacionándolos con el estado portador en cerdos. Vieira pinto et al., en el 2005 encontraron un 27,7 % (27/101) de cerdos positivos al microorganismo, lo cual permite vislumbrar la importancia de la carne de cerdo en la transmisión del patógeno. (26). Adicionalmente durante el beneficio existe un riesgo de contaminación cruzada, que podría aumentar el riesgo de transmisión al consumidor (27).
La presencia de Salmonella spp., previo al beneficio, puede originarse en la producción primaria o relacionarse con una infección del animal adquirida en la planta de beneficio durante el periodo de espera (28,29). Los aislamientos obtenidos en planta pueden provenir de la granja o pueden relacionarse con inadecuado manejo sanitario durante el transporte y permanencia en la planta. Adicionalmente los cerdos pueden ser portadores sanos del microorganismo y el estrés asociado al transporte y espera puede hacer que estos portadores se conviertan en excretores activos de la bacteria (30,31). La contaminación de los camiones puede ser debido a: 1. Inadecuada limpieza de restos de material fecal; 2. Baja concentración de productos de limpieza o desinfectantes o temperaturas inadecuadas. y; 3. Uso de agua reutilizada para remojar los camiones (32).
Se ha demostrado que la contaminación de camiones y el entorno de la planta de beneficio pueden resultar en la contaminación del producto final, de manera que los procesos de limpieza y desinfección adecuados son importantes para asegurar la disminución en la carga bacteriana de las canales (33).
En Europa como en el resto del mundo se ha modificado la infraestructura para disminuir los riesgos de contaminación, sin embargo, la implementación de buenas prácticas desde la movilización de los animales a la planta, la descontaminación final y la instauración de protocolos de limpieza y desinfección apropiados en cada una de las etapas del beneficio porcino, son alternativas de gran valor para prevenir la diseminación de la bacteria (34).
En un estudio publicado en 2004 en el que se evaluó la susceptibilidad antimicrobiana de aislamientos provenientes de carne de cerdo comprada en Estados Unidos y en la República Popular de China, se encontraron genes e integrones asociados a resistencias en los aislamientos evaluados (n=133), 82 % (n=73) de estos aislamientos fueron resistentes a al menos un agente antibiótico. Se presentó resistencia a tetraciclina en un 68 %, a sulfametoxazol en 42 % y a ampicilina en 29 % de los aislamientos (35). En contraste en este estudio el 99,6 % (n=332) de las aislamientos fueron resistentes al menos un antibiótico, y presentando porcentajes de resistencia de 93,1 % a tetraciclina, sulfametoxazol en un 24 % y a ampicilina en 33,9 % de los aislamientos.
En un estudio realizado en México en 1997, se encontró que en muestras aisladas de excrementos porcinos (n=30) un total de 13,3 % (n=22) de los aislamientos presentaron resistencia al menos un agente antimicrobiano, un 73,3 % a tetraciclina, 30 % a cloranfenicol, 10 % a ampicilina, 10 % a sulfametoxazol-trimetroprim y 3,3 % a gentamicina (36). Estos resultados podrían asociarse a particularidades de los aislamientos locales, al tamaño de la muestra o al incremento global de las resistencias antimicrobianas. Las resistencias encontrados en el actual estudio son compatibles con los reportes de un incremento de resistencia para el caso de aislamientos de Salmonella Typhymurium que progreso desde cero en 1948 a 98 % en 1998 (17).
La resistencia encontrada a ceftiofur reportada en aislamientos de origen animal en Estados Unidos varió de 4 % en 1999 a 18,8 % en 2003, mientras que la resistencia aquí encontrada ante ceftiofur llegó a 41,4 % (n=138/333) siendo considerablemente mayor a la reportada por Frye G. et al. y de importancia en salud pública pues las cefalosporinas de tercera generación, como el ceftiofur y que son antibióticos de elección en salmonelosis en niños (37), con respecto a otros antimicrobianos Helms et al., en 2002 reportó que pacientes humanos infectados con aislamientos resistentes a ampicilina, cloranfenicol, estreptomicina, sulfonamidas y tetraciclina tienen una probabilidad de morir 4,8 veces mayor que aquellos infectados con aislamientos que no lo son (38). La asociación directa entre canales positivas a Salmonella enterica y casos asociados a consumo de cerdo en los países bajos, deja en evidencia la necesidad de reducir dicha prevalencia, en la producción y procesamiento para disminuir la presentación de salmonelosis asociadas a consumo de carne de cerdo (34).
Una estrategia de prevención que ha mostrado efectividad, es la implementada en Dinamarca que se ocupa tanto de los cerdos como de la carne cerdo, lo que ha llevado a la notable reducción de la prevalencia de salmonelosis en humanos, al tener como objetivo principal el monitoreo,
prevención y control en granja y en la etapa previa al beneficio se reduce el riesgo ambiental de diseminación de la bacteria; por otra parte, la intervención en las plantas de beneficio enfocado a disminuir la carga de Salmonella spp. podría además disminuir la prevalencia de otros agentes patógenos de carácter zoonótico (39). Es necesario tener en cuenta que la aplicación de medidas de control durante la etapas productivas (reproducción, cría, levante) y durante el transporte previo pueden ser infructuosa sino se instauran medidas en el beneficio, incluso si los cerdos en pie tienen una baja prevalencia o son negativos a Salmonella spp., el paso por la planta puede ser suficiente para contaminar la carne, representado un riesgo para inocuidad del producto y por ende para la salud humana (40).
Entonces, el registro de enfermedades y problemas sanitarios en granja, y la comunicación adecuada entre el médico veterinario, los operarios y las plantas de beneficio son esenciales para establecer una cultura de producción enfocada a la producción de alimentos inocuos, además de la implementación de sanciones económicas a las granjas con animales positivos a Salmonella (41). Debido a que se ha demostrada la relación del uso de antibióticos en veterinaria con la aparición de resistencias antimicrobianas en enteropatógenos y que dicha relación parece ser la principal causa de expansión de la resistencia antibiótica a Salmonella spp., debido a tratamientos incorrecto ya sea por la dosis o la duración del mismo. (42,43).
Es importante tener en cuenta que dada la naturaleza dinámica de la producción porcina, un concepto sobre el estado de Salmonella spp. debe basarse en una evaluación periódica, la cual es necesaria para que los productores, asesores y autoridades puedan conocer el aumento repentino de la prevalencia de Salmonella en un rebaño (19), aspecto que debe ser reforzado en Colombia. De igual manera las perspectivas en nuestro país deberían estar direccionadas y basadas en una evaluación de riesgo, con enfoque de cadena productiva, identificando los factores que afectan la probabilidad y las consecuencias de la ocurrencia de un evento indeseado, haciendo prioritariamente un control sobre el uso de antimicrobianos e implementando los sistemas de gestión de calidad e inocuidad garantizando la aplicación de medidas de prevención y control que puedan ser benéficas para la población animal y la población humana (43,44).*
REFERENCIAS
1. Grimont P, Weill F. Antigenic formulae of the Salmonella serovars". WHO Collaborating Centre for Reference and Research on Salmonella; 2007. [ Links ]
2. Dunkley KD, Callaway TR, Chalova VI, McReynolds JL, Hume ME, Dunkley CS, et al. Foodborne Salmonella ecology in the avian gastrointestinal tract. Anaerobe. 2009; 15:26-35. [ Links ]
3. Hur J, Jawale C, Lee JH. Antimicrobial resistance of Salmonella isolated from food animals: A review. Food Res. Int. 2012; 45(2):819-830. [ Links ]
4. Rodríguez D, Suárez MC Salmonella spp. in the pork supply chain: a risk approach Rev Col Cienc P. 2014; 27(2): 65-75. [ Links ]
5. Guerrant RL, Van Gilder T, Steiner TS, Thielman NM, Slutsker L, Tauxe RV, et al. Practice guidelines for the management of infectious diarrhea. Clin. Infect. Dis. 2001;32(3):331-51. [ Links ]
6. Zhao S, White DG, Friedman SL, Glenn A, Blickenstaff K, Ayers SL, et al. Antimicrobial resistance in Salmonella enterica serovar Heidelberg isolates from retail meats, including poultry, from 2002 to 2006. Appl. Environ. Microbiol. 2008;74(21):6656-62. [ Links ]
7. Murray CJ. Salmonella in the environment. Rev. Sci. Tech. 1991;10(3):765-85. [ Links ]
8. Wong DLF, Hald T. Epidemiology and control measures for Salmonella in pigs and pork. Livest. Prod. 2002;76:215-222. [ Links ]
9. Martin LJ, Fyfe M, Doré K, Buxton JA, Pollari F, Henry B et al. Increased burden of illness associated with antimicrobial-resistant Salmonella enterica serotype typhimurium infections. J. Infect. Dis. 2004;189(3):377-84. [ Links ]
10. Gil-Setas A, Mazón-Ramos A, Martín-Salas C, Urtiaga-Domínguez M, Inza-Elia ME. Salmonelosis no tifoidea en un área de salud de navarra, España. Rev. Esp. Salud Pública. 76(1):49-56. [ Links ]
11. Travers K, Barza M. Morbidity of infections caused by antimicrobial-resistant bacteria. Clin. Infect. Dis. 2002;34 Suppl 3(Suppl 3):S131-4. [ Links ]
12. Cosgrove SE. The relationship between antimicrobial resistance and patient outcomes: mortality, length of hospital stay, and health care costs. Clin. Infect. Dis. 2006;42 Suppl 2(Suppl 2):S82-9. [ Links ]
13. Angulo FJ, Baker NL, Olsen SJ, Anderson A, Barrett TJ. Antimicrobial use in agriculture: controlling the transfer of antimicrobial resistance to humans. Semin. Pediatr. Infect. Dis. 2004;15(2):78-85. [ Links ]
14. Hur J, Kim JH, Park JH, Lee YJ, Lee JH. Molecular and virulence characteristics of multi-drug resistant Salmonella Enteritidis strains isolated from poultry. The Veterinary Journal. doi:10.1016/j.tvjl.2010.07.017 citado en: Hur J, Jawale C, Lee JH. Antimicrobial resistance of Salmonella isolated from food animals: A review. Food Res. Int. 2012;45(2):819-830. [ Links ]
15. European Medicines Agency (EMA). Assessment QR. Antibiotic Resistance in the European Union Associated with Therapeutic Use of Veterinary Medicines Report and Qualitative Risk Assessment by the Committee for Veterinary Medicinal Products. 1999; (July). [Internet]. Available at: http://www.ema.europa.eu/docs/en_GB/document_library/Report/2009/10/WC500005166.pdf. Consulted june de 2014. [ Links ]
16. Parry CM, Threlfall EJ. Antimicrobial resistance in typhoidal and nontyphoidal Salmonellae. Curr. Opin. Infect. Dis. 2008;21(5):531-8. [ Links ]
17. Teuber M. Spread of antibiotic resistance with food-borne pathogens. Cell. Mol. Life Sci. 1999;56(9-10):755-63. [ Links ]
18. Prendergast DM, Duggan SJ, Fanning S, Cormican M, Gonzales-Barron U, Butler F, et al. Prevalence and numbers of Salmonella enterica. and Enterobacteriaceae on pork cuts in abattoirs in the Republic of Ireland. J. Appl. Microbiol. 2008;105(4):1209-19. [ Links ]
19. Collignon P, Powers JH, Chiller TM, Aidara-Kane A, Aarestrup FM. World Health Organization ranking of antimicrobials according to their importance in human medicine: A critical step for developing risk management strategies for the use of antimicrobials in food production animals. Clin. Infect. Dis. 2009;49(1):132-41. [ Links ]
20. Lo Fo Wong DM, Dahl J, Stege H, van der Wolf PJ, Leontides L, von Altrock A, et al. Herd-level risk factors for subclinical Salmonella infection in European finishing-pig herds. Prev. Vet. Med. 2004;62(4):253-66. [ Links ]
21. Sorensen LL, Alban L, Nielsen B, Dahl J. The correlation between Salmonella serology and isolation of Salmonella in Danish pigs at slaughter. Vet. Microbiol. 2004;101(2):131-41. [ Links ]
22. Pasterán F, Galas M. 2008. Manual de Procedimientos. Sensibilidad a los antimicrobianos en Salmonella, Shigella y E. coli. Departamento de Bacteriología Instituto Nacional de Enfermedades Infecciosas A.N.L.I.S. Dr. Carlos G. Malbrán. WHO-Global Salm Surv. [Internet]. Disponible en: http://bvs.panalimentos.org/local/File/manual_sensibilidad_salmshigecoli_2008.pdf. Consultado junio de 2014. [ Links ]
23. Clinical Laboratory and Standards Institute - CLSI. 2008. Performance Standards for Antimicrobial Disk and Dilution Susceptibility Tests for Bacteria Isolated From Animals. Third Edition. M31-A3. [ Links ]
24. World Organisation for Animal Health - OIE. 2007. Manual of Diagnostic Tests and Vaccines for Terrestrial Animals Resolution No. XXVIII. [Internet]. Available at: http://www.oie.int/es/manual-de-las-pruebas-de-diagnostico-y-de-las-vacunas-para-los-animales-terrestres/. Consulted june de 2014. [ Links ]
25. Sánchez-Vargas FM, Abu-El-Haija M A, Gómez-Duarte OG. Salmonella infections: an update on epidemiology, management, and prevention. Travel Med. Infect. Dis. 2011;9(6):263-77. [ Links ]
26. Van TTH, Nguyen HNK, Smooker PM, Coloe PJ. The antibiotic resistance characteristics of non-typhoidal Salmonella enterica isolated from food-producing animals, retail meat and humans in South East Asia. Int. J. Food Microbiol. 2012;154(3):98-106. [ Links ]
27. Vieira-Pinto M, Temudo P, Martins C. Occurrence of Salmonella in the ileum, ileocolic lymph nodes, tonsils, mandibular lymph nodes and carcasses of pigs slaughtered for consumption. J. Vet. Med. B. Infect. Dis. Vet. Public Health. 2005;52(10):476-81. [ Links ]
28. Berends BR, Urlings HA, Snijders JM, Van Knapen F. Identification and quantification of risk factors in animal management and transport regarding Salmonella enterica. in pigs. Int. J. Food Microbiol. 1996;30(1-2):37-53. [ Links ]
29. Hurd HS, McKean JD, Wesley IV, Karriker LA. The effect of lairage on Salmonella isolation from market swine. J. Food Prot. 2001;64(7):939-44. [ Links ]
30. Fedorka-Cray PJ, Kelley LC, Stabel TJ, Gray JT, Laufer JA. Alternate routes of invasion may affect pathogenesis of Salmonella typhimurium in swine. Infect. Immun. 1995;63(7):2658-64. [ Links ]
31. Hansen R, Rogers R, Emge S, Jacobs Nj. Incidence Of Salmonella In The Hog Colon As Affected By Handling Practices Prior To Slaughter. J. Am. Vet. Med. Assoc. 1964;145:139-40. [ Links ]
32. Rajkowski KT, Eblen S, Laubauch C. Efficacy of washing and sanitizing trailers used for swine transport in reduction of Salmonella and Escherichia coli. J. Food Prot. 1998;61(1):31-5. [ Links ]
33. Corry JEL, Allen VM, Hudson WR, Breslin MF, Davies RH. Sources of Salmonella on broiler carcasses during transportation and processing: modes of contamination and methods of control. J. Appl. Microbiol. 2002;92(3):424-32. [ Links ]
34. Rasschaert G, Houf K, De Zutter L. Impact of the slaughter line contamination on the presence of Salmonella on broiler carcasses. J. Appl. Microbiol. 2007;103(2):333-41. [ Links ]
35. Berends BR, Van Knapen F, Mossel DA, Burt SA, Snijders JM. Impact on human health of Salmonella enterica. on pork in The Netherlands and the anticipated effects of some currently proposed control strategies. Int. J. Food Microbiol. 1998;44(3):219-29. [ Links ]
36. Chen S, Zhao S, White D. Characterization of multiple-antimicrobial-resistant Salmonella serovars isolated from retail meats. Appl. Environ. Microbiol. 2004;70(1):1-7. [ Links ]
37. Alaniz R, de Lourdes Ríos-lbarra M, Rosas-Barbosa BT, Juan-Morales, A Resistencia a antimicrobianos de cepas de Salmonella aisladas de fuentes animales. Vet. Méx, 1997; 28(3): 215-220. [ Links ]
38. Frye JG, Fedorka-Cray PJ. Prevalence, distribution and characterisation of ceftiofur resistance in Salmonella enterica isolated from animals in the USA from 1999 to 2003. Int. J. Antimicrob. Agents. 2007;30(2):134-42. [ Links ]
39. Helms M, Vastrup P, Gerner-Smidt P, Mølbak K. Excess mortality associated with antimicrobial drug-resistant Salmonella typhimurium. Emerg. Infect. Dis. 2002;8(5):490-5. [ Links ]
40. Alban L, Baptista FM, Møgelmose V, Sørensen LL, Christensen H, Aabo S et al. Salmonella surveillance and control for finisher pigs and pork in Denmark - A case study. Food Res. Int. 2012;45(2):656-665. [ Links ]
41. Alban L, Stärk KDC. Where should the effort be put to reduce the Salmonella prevalence in the slaughtered swine carcass effectively? Prev. Vet. Med. 2005;68(1):63-79. [ Links ]
42. Rasmussen B, Borch K, Stärk K. Functional modelling as basis for studying individual and organisational factors-application to risk analysis of Salmonella in pork. Food Control. 2001;12. [ Links ]
43. Mølbak K. Human health consequences of antimicrobial drug-resistant Salmonella and other foodborne pathogens. Clin. Infect. Dis. 2005;41(11):1613-20. [ Links ]
44. Wassenaar TM. Use of antimicrobial agents in veterinary medicine and implications for human health. Crit Rev Microbiol. 2005;31(3):155-69. [ Links ]