Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Salud Pública
Print version ISSN 0124-0064
Rev. salud pública vol.18 no.4 Bogotá July/Aug. 2016
https://doi.org/10.15446/rsap.v18n4.47769
http://dx.doi.org/10.15446/rsap.v18n4.47769
Doble carga de malnutrición durante el crecimiento: ¿una realidad latente en Colombia?
Double burden malnutrition during growth: is becoming a reality in Colombia?
Gustavo Cediel-Giraldo1, Erika Castaño-Moreno1, Diego Gaitán-Charry2
1 Universidad de Chile, Instituto de Nutrición y Tecnología de los Alimentos. Santiago de Chile. Chile. cedielgiraldo@gmail.com; eycm15@gmail.com
2 Escuela de Nutrición y Dietética, Universidad de Antioquia. Medellín, Colombia. diego.gaitan@udea.edu.co
Recibido 12 Diciembre 2014/Enviado para modificación 3 Octubre 2015/Aceptado 4 Febrero 2016
RESUMEN
Sucesivos reportes en la última década describen la coexistencia de la malnutrición por exceso con el déficit de micronutrientes en países desarrollados y en vía de desarrollo. Esta condición puede ser especialmente deletérea en niños y adolescentes con consecuencias en el riesgo metabólico y en el crecimiento desde edades tempranas. En este trabajo se muestra la evidencia sobre la doble carga de malnutrición durante el periodo de crecimiento con enfoque en 8 nutrientes (hierro, zinc, calcio, vitamina D, vitamina A, sodio, ácido fólico y vitamina B12) y su posible mecanismo de acción en el desarrollo de enfermedades crónicas en las diferentes etapas de la vida. En Colombia, según las dos últimas encuestas nacionales de la situación nutricional (ENSIN 2005 y 2010), se ha dado un aumento rápido de la obesidad en todas las edades, que se acompaña de cifras alarmantes de déficit de zinc, vitamina A y anemia, en menores de 5 años. Esta realidad de doble carga de malnutrición debe considerarse de manera urgente en la agenda de salud pública y actuar de manera efectiva implementando estrategias sólidas y adaptadas a la realidad del país, basadas en la evidencia científica, para prevenir la morbimortalidad atribuida a esta condición.
Palabras Clave: Colombia, crecimiento, obesidad, micronutrientes (fuente: DeCS, BIREME).
ABSTRACT
Several reports have described in the last decade the coexistence of accelerated increase of obesity with micronutrient deficiencies in developed countries, and is becoming evident in developing nations. This condition may be especially deleterious in children and adolescents with consequences in metabolic risk and growth since early in life. This review describes the evidence of double burden malnutrition during growth period focused on six nutrients (iron, zinc, calcium, vitamin D, vitamin A, sodium, folic acid and vitamin B12) and its biological mechanisms associated with non-communicable disease through span life. In Colombia, according to the last national health and nutrition surveys (2005 vs. 2010), there is an increase in the prevalence of obesity in all age groups; that is accompanied with alarming figures of zinc and vitamin A deficiency and anemia in children under 5 years. This reality of double burden malnutrition should be considered urgently on the public health agenda, implementing robust strategies adapted to the reality of the country based on scientific evidence to prevent mobility and mortality associated with this condition.
Key Words: Colombia, growth, obesity and micronutrients (source: MeSH, NLM).
En países desarrollados y en vía de desarrollo, la obesidad y las enfermedades crónicas (EC) aumentan rápidamente coexistiendo con el déficit de micronutrientes (1). Esta condición se relaciona con el aumento de años perdidos por enfermedad temprana, discapacidad o muerte prematura (2). Actualmente, es necesario incluir en la agenda de salud pública la implementación de acciones costo-efectivas para prevenir y revertir la "doble carga de malnutrición" y discutir si las políticas y los programas instaurados en tiempos de recesión económica son posibles contribuidores al aumento de obesidad y EC en países en vía de desarrollo (3). Recientemente, una revisión de la situación de doble carga de malnutrición en América Latina muestra la coexistencia de baja talla para la edad en niños menores de 5 años, anemia y además un acelerado aumento en la prevalencia de obesidad en niños y mujeres adultas en gran parte de los países de la región (4). El objetivo de este trabajo fue realizar una revisión temática de la información disponible acerca de relación/interacción entre la malnutrición por exceso y el déficit o exceso de micronutrientes considerados de interés en salud pública (hierro, zinc, calcio, vitamina A y D, acido fólico, vitamina B12 y sodio) durante el crecimiento, dando al final del escrito un enfoque a la situación actual en Colombia. La búsqueda de la información se realizo a través de las bibliotecas virtuales "Pubmed", "Scielo", "Lilacs", "Medline" utilizando los descriptores "Doble carga de malnutrición", "niños y adolescentes", "crecimiento" y sus respectivos términos en ingles "Double burden malnutrition", "children and adolescents" and "growth". Se dio prioridad a la información proveniente de meta análisis, ensayos controlados randomizados, estudios longitudinales y muestras representativas en el caso de estudios observacionales transversales publicados recientemente.
Relación entre el exceso de grasa corporal y el déficit o exceso de nutrientes específicos
Varios estudios han encontrado una relación inversa entre el exceso de grasa corporal y el déficit de nutrientes como hierro, zinc, calcio, vitamina D, vitamina A, acido fólico, vitamina B12 y sodio. Aunque la direccionalidad de estas relaciones no está clara, se han postulado algunos mecanismos involucrados: 1.Redistribución de minerales bivalentes desde el plasma hacia los tejidos por efecto de la inflamación crónica presente en la obesidad (5); 2. Dilución/secuestro de vitaminas liposolubles en el tejido adiposo, y; 3. Posible rol activo de micronutrientes en la regulación de genes relacionados con la adipogénesis, inflamación y el metabolismo energético (6).
Doble carga de malnutrición por déficit y exceso durante el crecimiento
Actualmente se investigan las implicaciones en salud de la doble carga de malnutrición por déficit y exceso, a nivel poblacional durante el crecimiento. Estudios revelan que la ganancia excesiva de peso en edades tempranas se relaciona con un aumento en la prevalencia de hiperinsulinemia, colesterol total, LDL-c y triglicéridos (7). Resultados del estudio de la cohorte chilena de crecimiento y obesidad muestran que el aumento excesivo en el IMC para la edad después de los 6 meses de edad se asocia con riesgo cardiometabólico a los 4 años (βstd=0,3 IC 95 %: 0,2–0,5) (8). Sumado a estos riegos atribuidos a la obesidad, hay que tener en cuenta aquellos relacionados con el déficit de micronutrientes ya sea por baja ingesta o como consecuencia de los cambios en el metabolismo de los nutrientes asociados a la alta adiposidad (6).
Hierro
Los primeros datos reportados sobre la relación entre deficiencia de hierro y adiposidad se remontan a los años 60, cuando Wenzel en 1962 (9) y Seltzer en 1963 (10) encontraron en adolescentes obesos menores niveles plasmáticos de hierro, comparados con los no obesos. Posteriormente, la encuesta nacional de salud de los Estados Unidos (NHANES III 1988-1994) en 9 689 niños y adolescentes, encontró dos veces más riesgo de déficit de hierro en niños con sobrepeso (OR: 2,3 IC 95 %: 1,4-3.9) comparado con grupo normopeso (11). Similares resultados se encontraron en una muestra de 740 adolescentes en Irán (OR: 2,6 IC 95 % 1,4–4,6) (12). Además, estudios han relacionado el IMC/edad como un indicador de pobre estado de hierro en países desarrollados (9–11,13) y en vía de desarrollo (14). Las posibles explicaciones de la deficiencia de hierro en individuos obesos son la baja ingesta, la reducción de la absorción, alteración en los mecanismos de regulación de disponibilidad del hierro corporal; aumento de los requerimientos por la expansión del volumen sanguíneo (14,15) y/o al efecto de la inflamación crónica por alta acumulación de tejido adiposo (16).
En un estudio reciente, Richardson (17) encontró en una muestra de 107 niños los niveles de proteína C reactiva ultrasensible (us-PCR) los niveles séricos de hierro (r=-0,3 p=0,02), saturación de transferrina (r=-0,2 p=0,03) y hemoglobina (r=-0,2 p=0,04). El posible mecanismo que explica esta condición se relaciona con el incremento en los niveles sanguíneos de la hepcidina, el principal regulador en la homeostasis del hierro. Esta proteína producida en el hígado y el tejido adiposo reduce los niveles plasmáticos del mineral a través de la disminución de la absorción intestinal y el aumento en el almacenamiento en los macrófagos (18).
Zinc
La relación entre zinc y obesidad es más discutida, Marreiro (19) en niños y adolescentes brasileños entre los 7 y 14 años encontraron menores valores del mineral en obesos (n=23-76 ug/dl) comparado con los normo-peso (n=21 -89 ug/dl), p<0,05. Di Toro demuestra que las intervenciones dietarías de reducción de peso podrían normalizar los niveles plasmáticos de zinc en sujetos obesos (20). Algunos trabajos han evaluado la relación entre los niveles de zinc y factores de riesgo metabólico en niños y adolescentes, en Finlandia se encontró en 3 373 adolescentes una asociación positiva entre los niveles plasmáticos de zinc y el colesterol total, HDL y LDL (21). En niños y adolescentes de Brasil se encontró una asociación negativa (r=-0,2 p<0,05) entre los niveles plasmáticos de zinc y los niveles de insulina (22).
Calcio
La mayoría de estudios que evalúan la relación entre calcio y obesidad han trabajado con la ingesta inadecuada del mineral. En el año 2000 Zemel (23), encontró una asociación inversa (R2=-0,4 p<0,001) entre el riesgo relativo de obesidad y la ingesta de calcio en los individuos que participaron en la NHANES III, estos resultados han sido reportados en otros estudios en niños (24,25). Adicionalmente, el bajo consumo de calcio se ha relacionado con el síndrome metabólico. Czerwonogrodzka reportó en 150 niños obesos con edades entre los 7-18 años y bajo consumo de calcio, valores elevados en: porcentaje de grasa, presión arterial, perfil lipídico, glucosa en ayunas, circunferencia de cintura, insulina en sangre y tolerancia a la glucosa (26). Según la evidencia, la baja ingesta de calcio aumenta la forma activa de la vitamina D en el plasma, lo que genera una cascada de señalizaciones vía receptor de calcio, liderando la expresión de marcadores lipogénicos, disminución en la expresión de enzimas lipolíticas y un aumento de marcadores pro-inflamatorios en la grasa visceral contribuyendo a las complicaciones de la obesidad (27,28).
Vitamina D
La evidencia en niños y adolescentes es menor y con resultados controversiales. Algunos estudios muestran una relación inversa entre Vitamina D, adiposidad y algunos marcadores metabólicos (29–33), y otros no encuentran esta relación (34,35). Villamor, en un seguimiento de niños escolares en la cuidad de Bogotá, Colombia, encontró una mayor ganancia de IMC (0,1/año), masa grasa (pliegue tricipital: 0,03 mm/año) y circunferencia de cintura (0,8 cm/año) en niños con inadecuación en la vitamina D (< 30ng/ml) en comparación con sus contrapartes (36). Los mecanismos biológicos involucrados se relacionan con el secuestro/dilución de la vitamina D en el tejido adiposo dada su naturaleza liposoluble y/o un posible rol activo de la vitamina dentro de este tejido regulando genes relacionados con adipogénesis, inflamación y regulación de la glucosa (37,38).
Vitamina A
Se ha sugerido que la vitamina A podría cumplir un rol importante en la regulación de la obesidad. Un análisis de la encuesta nacional de nutrición de los EEUU (NHANES III) en 6 139 niños y niñas entre los 6-19 años encontró concentraciones significativamente menores de beta caroteno en el grupo de obesos comparado con el grupo normo-peso (0.2 μmol/L vs 0.3 μmol/L, P <0.001) (39). Además, también se ha observado una relación inversa entre concentraciones de retinol, peso corporal, IMC y perímetro de cintura (40). Según la evidencia, la vitamina A podría reducir la adiposidad por mecanismos relacionados con la inhibición de la adipogénesis en etapas tempranas de la diferenciación celular (41) y mejorar la apoptosis de los adipocitos (42). Además, el retinol también podría controlar la producción de múltiples adipoquinas incluyendo la leptina y la resistina, las cuales son importantes en la regulación de la ingesta de alimentos, gasto de energía y composición corporal (43).
Folato/Ácido Fólico y Cobalamina (B12)
Recientemente se ha explorado el rol del Folato/Ácido Fólico (F/AF) y la Vitamina B12 en las enfermedades crónicas no transmisibles. En el estudio cohorte PUNE de la India, los hijos (a los 6 años) de madres con mayores concentraciones de folato eritrocitario (>1.269 nmol/L) medido a las 28 semanas de gestación presentaron mayor adiposidad (3,4 ± 1,1 kg) y HOMA (0,8 RIQ 0,5-1,2) comparado con aquellos niños de madres con menores concentraciones de folato (<734 nmol/L) p=<0,001. Además, los hijos de madres con bajas concentraciones de B12 (<103 pmol/L) a las 18 semanas de gestación, presentaron mayor HOMA (0,78 RIQ 0,4–1,3) p=0.03 (44). Otro estudio de cohorte en la India mostró que las concentraciones de folato materno (n=647) se asociaron con mayor índice HOMA en los niños a los 9 y 13 años (p=0,03), incluso después de ajustar por otras variables incluyendo la B12 (45). Estudios en niños y mujeres gestantes en Colombia, indican una importante prevalencia de deficiencia de vitamina B12 (46–48), adicionalmente menores niveles de Vitamina B12 en niños escolares se relaciona con mayor riesgo de repetición del grado escolar y ausentismo (49). Otros trabajos realizados en Chile evidenciaron mayores niveles de folatos y menores de B12 en cordón umbilical de recién nacidos a término pequeños para la edad gestacional- PEG en comparación con los nacidos con peso adecuado para la edad gestacional–AEG (50). El mecanismo del desarrollo de enfermedades crónicas vinculado al ambiente intrauterino, se asocia a una alteración en la provisión a la célula de donantes de grupos metilo como folato y B12, interrumpiendo o modificando la metilación del DNA induciendo futuros cambios adversos en el fenotipo de la descendencia por un cambio en la expresión de diferentes genes (51).
Sodio: control del consumo excesivo
Al contrario a lo descrito en los micronutrientes antes mencionados, la problemática actual respecto al sodio está relacionada con el alto consumo del nutriente principalmente a través de la adición a los alimentos de sal en la mesa (52). Se estima que el consumo de sal en países occidentalizados está entre 9-12 g/día (∼3,5-4,7 g sodio/d), mientras que en países de Europa oriental y del continente Asiático la ingesta diaria llega hasta los 16 g/día (∼6,3 g sodio/d) (53), en las Américas la información disponible estima una ingesta elevada que fluctúa entre 9-11 gr/día en los países con datos disponibles (54,55). Recientemente, la Organización Mundial de la Salud (OMS) recomendó una ingesta de sodio menor a 2 g/d (5 g de sal/d) en adultos, con el fin de disminuir las cifras de presión arterial y el riesgo cardiovascular asociado. En niños, la Organización Mundial de la Salud recomienda ajustar la cifra anterior a la ingesta energética total, con el fin de reducir las cifras de presión arterial (56,57).
Situación en Colombia
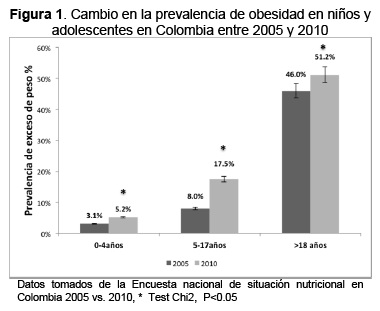
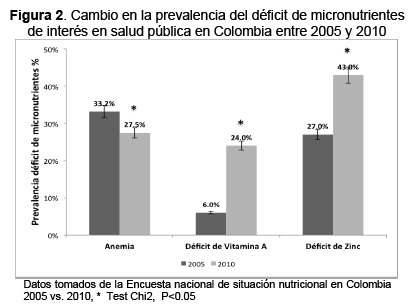
Al comparar las últimas dos Encuestas Nacionales de la Situación Nutricional en Colombia (2005 y 2010), se observa en niños de 0 a 4 años una reducción leve en la desnutrición aguda de 1,3 % a 0,9 % y en la baja talla para la edad (< 2 DE) de 15,9 % a 13,2 %. Además, existe un aumento en la prevalencia de exceso de peso en ambos sexos siendo en niños entre 0-4 años de 3,1 % a 5,2 %, de 5 a 17 años de 8 % a 17,5 % y en mayores de 18 años de 46 % a 51,2 % (58,59) (Figura 1), acompañado de un incremento en la prevalecía del déficit en micronutrientes de interés en salud publica en niños menores de 5 años: zinc de 27 % a 43 %; vitamina A de 6 % a 24 %, con una reducción en la anemia de 33,2 % a 27,5 % (Figura 2). Lo que sugiere la presencia de doble carga de malnutrición por déficit y exceso en poblaciones vulnerables de Colombia. Reportes previos también muestran un patrón similar en países vecinos como Chile, México, Guatemala y Ecuador (4,60–63). Estos países han identificado algunas causas atribuibles a la condición de doble carga nutricional, entre los cuales se encuentran: la poca actividad física, los inadecuados hábitos alimentarios, el estado nutricional de la madre en el embarazo, el peso al nacer, el déficit de micronutrientes y la nutrición temprana. Actualmente la mayoría de intervenciones se han focalizado en la reducción de la desnutrición por déficit de energía, instauradas en tiempos de recesión económica. A nivel dietario las publicaciones atribuyen el aumento de peso después de los 6 meses a la alta ingesta proteica (64), de lípidos y carbohidratos (65–67) y consumo frecuente de productos procesados con alto contenido de azúcar, sal y grasas saturadas y grasas trans (68,69). Es importante realizar una adaptación enfocada a implementar programas en los que se fortalezca el mensaje de consumir una alimentación con mayor densidad de nutrientes (especialmente aquellos en condición de déficit en la población como zinc, vitamina A y hierro) y adecuado aporte energético a través de estrategias sólidas basadas en la evidencia.
Esta nueva doble condición de riesgo de malnutrición por déficit y exceso durante las etapas de crecimiento y desarrollo acarrean una señal de alarma en la agenda de salud pública en Colombia. Se requieren acciones inmediatas para prevenir el aumento en los índices de morbimortalidad asociada a la obesidad y al déficit de micronutrientes •
Agradecimientos: A María Catalina Hernández Rodas, por sus comentarios en la revisión de este manuscrito. Al programa Enlaza Mundos de la Alcaldía de Medellín–Sapiencia, por su aporte en la formación académica de GC y EC. A Colfuturo por su aporte en la formación académica de GC.
REFERENCIAS
1. Monteiro CA, Conde WL, Popkin BM. Income-specific trends in obesity in Brazil: 1975-2003. American journal of public health. 2007 Oct;97(10):1808-12. [ Links ]
2. Garmendia ML, Corvalan C, Uauy R. Assessing the public health impact of developmental origins of health and disease (DOHaD) nutrition interventions. Annals of nutrition & metabolism [Internet]. 2014 Jan [cited 2014 Dec 9];64(3-4):226-30. Available from: http://www.ncbi.nlm.nih.gov/pubmed/25300264. [ Links ]
3. Uauy R, Garmendia M, Corvalán C. Addressing the Double Burden of Malnutrition with a Common Agenda. Nestlé Nutrition Institute workshop series. [Internet]. 2014 Jan [cited 2014 Nov 15];78:39-52. Available from: http://www.ncbi.nlm.nih.gov/pubmed/24504205. [ Links ]
4. Rivera JA, Pedraza LS, Martorell R, Gil A. Introduction to the double burden of undernutrition and excess weight in Latin America. The American journal of clinical nutrition. [Internet]. 2014 Dec [cited 2014 Nov 28];100(6):1613S - 6S. Available from: http://www.ncbi.nlm.nih.gov/pubmed/25411302. [ Links ]
5. Cediel G, Olivares M, Araya M. Efecto de la inflamación subclinica sobre el estado nutricional de hierro, cobre y zinc en adultos. Rev Chil Nutr. 2009;36(1). [ Links ]
6. Garcia OP, Long KZ, Rosado JL. Impact of micronutrient deficiencies on obesity. Nutr Rev. [Internet]. 2009/09/30 ed. 2009;67(10):559-72. Available from: http://www.ncbi.nlm.nih.gov/pubmed/19785688. [ Links ]
7. Burrows R, Gattas V, Leiva L, Barrera G, Burgueño M. Biological, familial and metabolic characteristics of infantile and juvenile obesity. Revista Médica de Chile. 2001 Oct;129(10):1155-62. [ Links ]
8. Corvalán C, Uauy R, Stein AD, Kain J, Martorell R. Effect of growth on cardiometabolic status at 4 y of age. The American journal of clinical nutrition. 2009 Sep;90(3):547-55. [ Links ]
9. Wenzel BJ, Stults HB, Mayer J. Hypoferraemia in obese adolescents. Lancet. [Internet]. 1962 Aug 18 [cited 2014 May 5];2(7251):327-8. Available from: http://www.ncbi.nlm.nih.gov/pubmed/14006157. [ Links ]
10. Seltzer CC, Mayer J. Serum iron and iron-binding capacity in adolescentes. II. Comparison of obese and non-obese subjects. The American journal of clinical nutrition. [Internet]. 1963 Dec [cited 2014 Jan 10];13:354-61. Available from: http://www.ncbi.nlm.nih.gov/pubmed/14101396. [ Links ]
11. Nead KG, Halterman JS, Kaczorowski JM, Auinger P, Weitzman M. Overweight children and adolescents: a risk group for iron deficiency. Pediatrics. [Internet]. 2004 Jul [cited 2014 May 5];114(1):104-8. Available from: http://www.ncbi.nlm.nih.gov/pubmed/15231915. [ Links ]
12. Moayeri H, Bidad K, Zadhoush S, Gholami N, Anari S. Increasing prevalence of iron deficiency in overweight and obese children and adolescents (Tehran Adolescent Obesity Study). European journal of pediatrics. 2006 Nov;165(11):813-4. [ Links ]
13. Brotanek JM, Gosz J, Weitzman M, Flores G. Iron deficiency in early childhood in the United States: risk factors and racial/ethnic disparities. Pediatrics. [Internet]. 2007 Sep [cited 2014 May 5];120(3):568-75. Available from: http://www.ncbi.nlm.nih.gov/pubmed/17766530. [ Links ]
14. Zimmermann MB, Zeder C, Muthayya S, Winichagoon P, Chaouki N, Aeberli I, et al. Adiposity in women and children from transition countries predicts decreased iron absorption, iron deficiency and a reduced response to iron fortification. International journal of obesity. (2005) [Internet]. 2008 Jul [cited 2014 May 3];32(7):1098-104. Available from: http://www.ncbi.nlm.nih.gov/pubmed/18427564. [ Links ]
15. Pinhas-Hamiel O, Newfield RS, Koren I, Agmon A, Lilos P, Phillip M. Greater prevalence of iron deficiency in overweight and obese children and adolescents. International journal of obesity and related metabolic disorders: journal of the International Association for the Study of Obesity. [Internet]. 2003 Mar [cited 2014 May 5];27(3):416-8. Available from: http://www.ncbi.nlm.nih.gov/pubmed/12629572. [ Links ]
16. McClung JP, Karl JP. Iron deficiency and obesity: the contribution of inflammation and diminished iron absorption. Nutrition reviews. [Internet]. 2009 Feb [cited 2014 Jan 10];67(2):100-4. Available from: http://www.ncbi.nlm.nih.gov/pubmed/19178651. [ Links ]
17. Richardson MW, Ang L, Visintainer PF, Wittcopp CA. The abnormal measures of iron homeostasis in pediatric obesity are associated with the inflammation of obesity. International journal of pediatric endocrinology. 2009 Jan;2009:713269. [ Links ]
28. Mujica-Coopman MF, Brito A, López de Romaña D, Pizarro F, Olivares M. Body mass index, iron absorption and iron status in childbearing age women. Journal of trace elements in medicine and biology: organ of the Society for Minerals and Trace Elements. (GMS) [Internet]. 2014; Available from: http://www.sciencedirect.com/science/article/pii/S0946672X14000546. [ Links ]
19. Marreiro D do N, Fisberg M, Cozzolino SMF. Zinc nutritional status in obese children and adolescents. Biological trace element research. 2002 May;86(2):107-22. [ Links ]
20. Di Toro A, Marotta A, Todisco N, Ponticiello E, Collini R, Di Lascio R, et al. Unchanged iron and copper and increased zinc in the blood of obese children after two hypocaloric diets. Biological trace element research. 1997 May;57(2):97-104. [ Links ]
21. Laitinen R, Vuori E, Viikari J. Serum zinc and copper: associations with cholesterol and triglyceride levels in children and adolescents. Cardiovascular risk in young Finns. Journal of the American College of Nutrition. 1989 Oct;8(5):400-6. [ Links ]
22. Marreiro DDN, Fisberg M, Cozzolino SMF. Zinc nutritional status and its relationships with hyperinsulinemia in obese children and adolescents. Biological trace element research. 2004 Aug;100(2):137-49. [ Links ]
23. Zemel MB, Shi H, Greer B, Dirienzo D, Zemel PC. Regulation of adiposity by dietary calcium. FASEB journal: official publication of the Federation of American Societies for Experimental Biology. 2000 Jun;14(9):1132-8. [ Links ]
24. Goldberg TBL, da Silva CC, Peres LNL, Berbel MN, Heigasi MB, Ribeiro JMC, et al. Calcium intake and its relationship with risk of overweight and obesity in adolescents. Archivos latinoamericanos de nutrición. 2009 Mar;59(1):14-21. [ Links ]
25. Carruth BR, Skinner JD. The role of dietary calcium and other nutrients in moderating body fat in preschool children. International journal of obesity and related metabolic disorders: journal of the International Association for the Study of Obesity. 2001 Apr;25(4):559-66. [ Links ]
26. Czerwonogrodzka A, Pyrzak B, Majcher A, Rumińska M, Rymkiewicz-Kluczyńska B, Jeznach-Steinhagen A. [Assessment of dietary calcium intake on metabolic syndrome frequency in obese children and adolescents]. Pediatric endocrinology, diabetes, and metabolism. 2008 Jan;14(4):231-5. [ Links ]
27. Villarroel P, Villalobos E, Reyes M, Cifuentes M. Calcium, obesity, and the role of the calcium-sensing receptor. Nutrition reviews. [Internet]. 2014 Oct [cited 2014 Nov 17];72(10):627-37. Available from: http://www.ncbi.nlm.nih.gov/pubmed/25182976. [ Links ]
28. Zemel MB. Role of calcium and dairy products in energy partitioning and weight management. The American journal of clinical nutrition. 2004 May;79(5):907S - 912S. [ Links ]
29. Cediel G, Corvalán C, Aguirre C, de Romaña DL, Uauy R. Serum 25-Hydroxyvitamin D associated with indicators of body fat and insulin resistance in prepubertal Chilean children. International journal of obesity (2005) [Internet]. 2016 Aug 12 [cited 2015 Aug 17];40(1):147-52. Available from: http://www.ncbi.nlm.nih.gov/pubmed/26264757. [ Links ]
30. Reyman M, Verrijn Stuart AA, van Summeren M, Rakhshandehroo M, Nuboer R, de Boer FK, et al. Vitamin D deficiency in childhood obesity is associated with high levels of circulating inflammatory mediators, and low insulin sensitivity. International journal of obesity. (2005) [Internet]. 2013 May 20 [cited 2013 Jul 8]; Available from: http://www.ncbi.nlm.nih.gov/pubmed/23736361. [ Links ]
31. Jang HB, Lee H-J, Park JY, Kang J-H, Song J. Association between serum vitamin d and metabolic risk factors in korean schoolgirls. Osong public health and research perspectives. [Internet]. 2013 Aug [cited 2013 Oct 27];4(4):179-86. Available from: http://www.ncbi.nlm.nih.gov/pubmed/24159553. [ Links ]
32. Oliveira RMS, Novaes JF, Azeredo LM, Azeredo LM, Cândido APC, Leite ICG. Association of vitamin D insufficiency with adiposity and metabolic disorders in Brazilian adolescents. Public health nutrition. [Internet]. 2014 Apr [cited 2014 Sep 30];17(4):787-94. Available from: http://www.ncbi.nlm.nih.gov/pubmed/23659537. [ Links ]
33. Kolokotroni O, Papadopoulou A, Yiallouros PK, Raftopoulos V, Kouta C, Lamnisos D, et al. Association of vitamin D with adiposity measures and other determinants in a cross-sectional study of Cypriot adolescents. Public health nutrition. [Internet]. 2014 Jan 17 [cited 2014 Oct 17];1-10. Available from: http://www.ncbi.nlm.nih.gov/pubmed/24476931. [ Links ]
34. Creo AL, Rosen JS, Ariza AJ, Hidaka KM, Binns HJ. Vitamin D levels, insulin resistance, and cardiovascular risks in very young obese children. Journal of pediatric endocrinology & metabolism: JPEM. [Internet]. 2013 Jan [cited 2014 Jan 13];26(1-2):97-104. Available from: http://www.ncbi.nlm.nih.gov/pubmed/23382301. [ Links ]
35. Torun E, Gönüllü E, Ozgen IT, Cindemir E, Oktem F. Vitamin d deficiency and insufficiency in obese children and adolescents and its relationship with insulin resistance. International journal of endocrinology. [Internet]. 2013 Jan [cited 2013 Apr 30];2013:631845. Available from: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=3623428&tool=pmcentrez&rendertype=abstract. [ Links ]
36. Gilbert-Diamond D, Baylin A, Mora-Plazas M, Marin C, Arsenault JE, Hughes MD, et al. Vitamin D deficiency and anthropometric indicators of adiposity in school-age children: a prospective study. The American journal of clinical nutrition. [Internet]. 2010 Dec [cited 2013 Nov 11];92(6):1446-51. Available from: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=3131841&tool=pmcentrez&rendertype=abstract. [ Links ]
37. Wortsman J, Matsuoka LY, Chen TC, Lu Z, Holick MF. Decreased bioavailability of vitamin D in obesity. American Journal of Clinical Nutrition. [Internet]. 2000;72(3):690-3. Available from: http://www.ncbi.nlm.nih.gov/pubmed/10966885. [ Links ]
38. Drincic AT, Armas LAG, Van Diest EE, Heaney RP. Volumetric dilution, rather than sequestration best explains the low vitamin D status of obesity. Obesity. (Silver Spring, Md) [Internet]. 2012 Jul [cited 2013 May 13];20(7):1444-8. Available from: http://www.ncbi.nlm.nih.gov/pubmed/22262154. [ Links ]
39. Strauss RS. Comparison of serum concentrations of alpha-tocopherol and beta-carotene in a cross-sectional sample of obese and nonobese children (NHANES III). National Health and Nutrition Examination Survey. The Journal of pediatrics. [Internet]. 1999 Feb [cited 2014 Dec 9];134(2):160-5. Available from: http://www.ncbi.nlm.nih.gov/pubmed/9931523. [ Links ]
40. Viroonudomphol D, Pongpaew P, Tungtrongchitr R, Changbumrung S, Tungtrongchitr A, Phonrat B, et al. The relationships between anthropometric measurements, serum vitamin A and E concentrations and lipid profiles in overweight and obese subjects. Asia Pacific journal of clinical nutrition. [Internet]. 2003 Jan [cited 2014 Dec 9];12(1):73-9. Available from: http://www.ncbi.nlm.nih.gov/pubmed/12737014. [ Links ]
41. Xue JC, Schwarz EJ, Chawla A, Lazar MA. Distinct stages in adipogenesis revealed by retinoid inhibition of differentiation after induction of PPARgamma. Molecular and cellular biology. [Internet]. 1996 Apr [cited 2014 Dec 9];16(4):1567-75. Available from: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=231142&tool=pmcentrez&rendertype=abstract. [ Links ]
42. Kim HS, Hausman DB, Compton MM, Dean RG, Martin RJ, Hausman GJ, et al. Induction of apoptosis by all-trans-retinoic acid and C2-ceramide treatment in rat stromal-vascular cultures. Biochemical and biophysical research communications. [Internet]. 2000 Apr 2 [cited 2014 Dec 9]; 270(1):76-80. Available from: http://www.ncbi.nlm.nih.gov/pubmed/10733907. [ Links ]
43. Menendez C, Lage M, Peino R, Baldelli R, Concheiro P, Dieguez C, et al. Retinoic acid and vitamin D(3) powerfully inhibit in vitro leptin secretion by human adipose tissue. J Endocrinol. [Internet]. 2001/08/02 ed. 2001;170(2):425-31. Available from: http://www.ncbi.nlm.nih.gov/pubmed/11479138. [ Links ]
44. Yajnik CS, Deshpande SS, Jackson AA, Refsum H, Rao S, Fisher DJ, et al. Vitamin B12 and folate concentrations during pregnancy and insulin resistance in the offspring: the Pune Maternal Nutrition Study. Diabetologia. 2008 Jan;51(1):29-38. [ Links ]
45. Krishnaveni G V, Veena SR, Karat SC, Yajnik CS, Fall CHD. Association between maternal folate concentrations during pregnancy and insulin resistance in Indian children. Diabetologia. 2014 Jan;57(1):110-21. [ Links ]
46. Herrán OF, Ward JB, Villamor E. Vitamin B 12 serostatus in Colombian children and adult women: results from a nationally representative survey. 2014;(8). [ Links ]
47. Arsenault JE, Mora-Plazas M, Forero Y, Lopez-Arana S, Baylin A, Villamor E. Hemoglobin concentration is inversely associated with erythrocyte folate concentrations in Colombian school-age children, especially among children with low vitamin B12 status. European journal of clinical nutrition. Nature Publishing Group; 2009 Jul;63(7):842-9. [ Links ]
48. Caicedo O, Villamor E, Forero Y, Ziade J, Pérez P, Quiñones F, et al. Relation between vitamin B12 and folate status, and hemoglobin concentration and parasitemia during acute malaria infections in Colombia. Acta tropica. 2010;114(1):17-21. [ Links ]
49. Duong M-C, Mora-Plazas M, Marín C, Villamor E. Vitamin B-12 Deficiency in Children Is Associated with Grade Repetition and School Absenteeism, Independent of Folate, Iron, Zinc, or Vitamin A Status Biomarkers. The Journal of nutrition. 2015 Jul;145(7):1541-8. [ Links ]
50. Caviedes L, Iñiguez G, Hidalgo P, Castro JJ, Castaño E, Llanos M, et al. Relationship between folate transporters expression in human placentas at term and birth weights. Placenta. Elsevier; 2016 Feb;38:24-8. [ Links ]
51. Finer S, Saravanan P, Hitman G, Yajnik C. The role of the one-carbon cycle in the developmental origins of Type 2 diabetes and obesity. Diabetic medicine: a journal of the British Diabetic Association. 2014 Mar;31(3):263-72. [ Links ]
52. Mattes RD, Donnelly D. Relative contributions of dietary sodium sources. Journal of the American College of Nutrition. [Internet]. 1991 Aug [cited 2014 Dec 9];10(4):383-93. Available from: http://www.ncbi.nlm.nih.gov/pubmed/1910064. [ Links ]
53. Brown IJ, Tzoulaki I, Candeias V, Elliott P. Salt intakes around the world: implications for public health. International journal of epidemiology. [Internet]. 2009 Jun [cited 2014 Jul 9]; 38(3):791-813. Available from: http://www.ncbi.nlm.nih.gov/pubmed/19351697. [ Links ]
54. Gaitán D, Chamorro R, Cediel G, Lozano G, Gomes S. Sodio y Enfermedad Cardiovascular: Contexto en Latinoamérica. Archivos Latinoamericanos de Nutrición. 2015;65(8):206-15. [ Links ]
55. PAHO/WHO urges countries to reduce salt intake to prevent hypertension and heart disease. 2014 Jul 11 [cited 2014 Dec 9]; Available from: http://www.paho.org/hq/index.php?option=com_content&view=article&id=9770&Itemid=2&lang=en. [ Links ]
56. Legetic B, Campbell N. Reducing salt intake in the Americas: Pan American Health Organization actions. Journal of health communication. [Internet]. 2011 Aug [cited 2014 Dec 9];16 Suppl 2:37-48. Available from: http://www.ncbi.nlm.nih.gov/pubmed/21916712. [ Links ]
57. He FJ, Campbell NRC, MacGregor GA. Reducing salt intake to prevent hypertension and cardiovascular disease. Revista panamericana de salud pública = Pan American journal of public health. [Internet]. 2012 Oct [cited 2014 Dec 9];32(4):293-300. Available from: http://www.ncbi.nlm.nih.gov/pubmed/23299291. [ Links ]
58. ICBF. Instituto Colombiano de Bienestar Familiar. ENSIN - Encuesta Nacional de Situación Nutricional en Colombia. 2010. [ Links ]
59. Sarmiento OL, Parra DC, González SA, González-Casanova I, Forero AY, Garcia J. The dual burden of malnutrition in Colombia. The American journal of clinical nutrition. [Internet]. 2014 Dec [cited 2014 Nov 25];100(6):1628S-35S. Available from: http://www.ncbi.nlm.nih.gov/pubmed/25411305. [ Links ]
60. Atalah E, Amigo H, Bustos P. Does Chile's nutritional situation constitute a double burden? The American journal of clinical nutrition. [Internet]. 2014 Dec [cited 2014 Nov 25];100(6):1623S - 7S. Available from: http://www.ncbi.nlm.nih.gov/pubmed/25411304. [ Links ]
61. Ramirez-Zea M, Kroker-Lobos MF, Close-Fernandez R, Kanter R. The double burden of malnutrition in indigenous and nonindigenous Guatemalan populations. The American journal of clinical nutrition. [Internet]. 2014 Dec [cited 2014 Nov 26];100(6):1644S - 51S. Available from: http://www.ncbi.nlm.nih.gov/pubmed/25411307. [ Links ]
62. Kroker-Lobos MF, Pedroza-Tobías A, Pedraza LS, Rivera JA. The double burden of undernutrition and excess body weight in Mexico. The American journal of clinical nutrition. [Internet]. 2014 Dec [cited 2014 Nov 25];100(6):1652S - 8S. Available from: http://www.ncbi.nlm.nih.gov/pubmed/25411308. [ Links ]
63. Freire WB, Silva-Jaramillo KM, Ramírez-Luzuriaga MJ, Belmont P, Waters WF. The double burden of undernutrition and excess body weight in Ecuador. The American journal of clinical nutrition. [Internet]. 2014 Dec [cited 2014 Nov 26];100(6):1636S - 43S. Available from: http://www.ncbi.nlm.nih.gov/pubmed/25411306. [ Links ]
64. Koletzko B, von Kries R, Closa R, Escribano J, Scaglioni S, Giovannini M, et al. Lower protein in infant formula is associated with lower weight up to age 2 y: a randomized clinical trial. The American journal of clinical nutrition. 2009 Jun;89(6):1836-45. [ Links ]
65. Rolland-Cachera MF, Deheeger M, Akrout M, Bellisle F. Influence of macronutrients on adiposity development: a follow up study of nutrition and growth from 10 months to 8 years of age. Int J Obes Relat Metab Disord. [Internet]. 1995/08/01 ed. 1995;19(8):573-8. Available from: http://www.ncbi.nlm.nih.gov/pubmed/7489029. [ Links ]
66. Stunkard AJ, Berkowitz RI, Schoeller D, Maislin G, Stallings VA. Predictors of body size in the first 2 y of life: a high-risk study of human obesity. International journal of obesity and related metabolic disorders: journal of the International Association for the Study of Obesity. 2004 Apr;28(4):503-13. [ Links ]
67. Thorsdottir I, Gunnarsdottir I, Palsson GI. Birth weight, growth and feeding in infancy: relation to serum lipid concentration in 12-month-old infants. Eur J Clin Nutr. [Internet]. 2003/10/25 ed. 2003;57(11):1479-85. Available from: http://www.ncbi.nlm.nih.gov/pubmed/14576762. [ Links ]
68. Straker LM, Howie EK, Smith KL, Fenner AA, Kerr DA, Olds TS, et al. The Impact of Curtin University's Activity, Food and Attitudes Program on Physical Activity, Sedentary Time and Fruit, Vegetable and Junk Food Consumption among Overweight and Obese Adolescents: A Waitlist Controlled Trial. PloS one. [Internet]. 2014 Jan [cited 2014 Dec 9]; 9(11):e111954. Available from: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=4222962&tool=pmcentrez&rendertype=abstract. [ Links ]
69. Jackson P, Romo MM, Castillo MA, Castillo-Durán C. [Junk food consumption and child nutrition. Nutritional anthropological analysis]. Revista médica de Chile. [Internet]. 2004 Oct [cited 2014 Dec 9];132(10):1235-42. Available from: http://www.ncbi.nlm.nih.gov/pubmed/15631213. [ Links ]