La enfermedad por Coronavirus 2019 (COVID-19) es una afección provocada por el virus del síndrome respiratorio agudo de coronavirus 2 (SARS-CoV-2), considerado por la Organización Mundial de la Salud (OMS) como pandemia, desde marzo de este año 1. Al inicio, los reportes se centraban en los hallazgos de falla respiratoria hipoxémica con ventilación invasiva. Empero, actualmente se reportan complicaciones hemostáticas súbitas con tendencia al aumento de mortalidad. Por ello, muchos centros clínicos han diseñado guías de tratamiento basadas en opinión de expertos con opciones terapéuticas eficaces, pero mínimamente costo-eficientes, para sistemas de salud en países en desarrollo.
Esta revisión busca demostrar, a partir de la evidencia recolectada, este mortal fenómeno procoagulante del SARS-CoV-2 y proponer una orientación terapéutica manteniendo un estándar de sostenibilidad.
MÉTODO
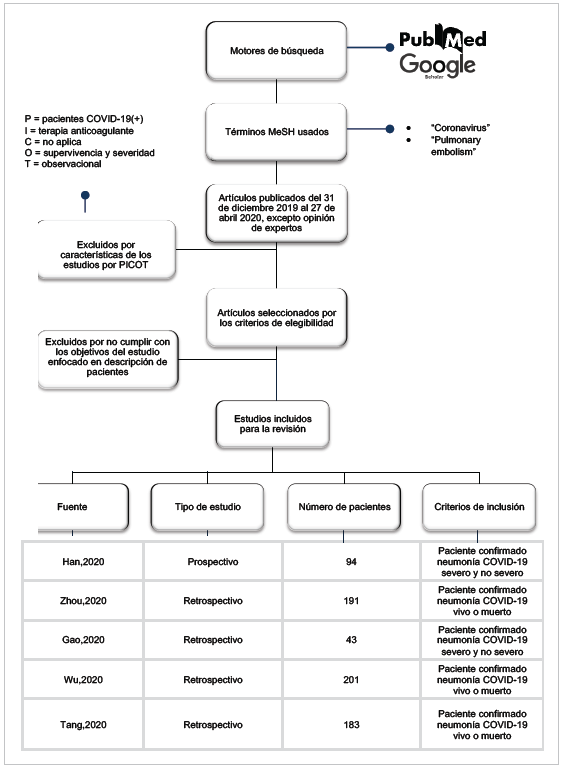
Para determinar el pronóstico de mortalidad y severidad se desarrolló una revisión sistemática utilizando los motores de búsqueda PubMed y Google Scholar. Los términos MeSH usados fueron "Coronavirus" y "Pulmonary embolism". En dicha búsqueda se hallaron 71 artículos publicados que abarcaban el período comprendido entre el 31 de diciembre 2019 y el 27 de abril 2020, con excepción de los resultados obtenidos de la opinión de expertos. Refiérase a la Figura 1 para explorar el proceso de selección sin considerar la intervención según PICOT.
De los cinco estudios seleccionados para esta revisión, uno de ellos fue de tipo prospectivo, mientras que los cuatro restantes fueron retrospectivos, todos de procedencia china. Tres de cinco estudios fueron realizados en Wuhan, (Han H, Zhou F, Wu C), 1 de 5 en Fuyang (Gao Y) y 1 de 5 en Tongji (Tang N). El estudio de Han H añadió un grupo control a su análisis utilizando una recolección prospectiva. Dicho estudio, por su naturaleza, tiende a un sesgo de seguimiento, pero se descarta por la condición intrahospitalaria. Los demás son estudios de cohortes retrospectivos que pueden presentar sesgos de memoria, descartados al optar por variables objetivas no dependientes del paciente.
En sus estudios, Han H, Zhou F, Gao Y, Wu C y Tang N incluyeron 94, 191, 43, 201 y 183 pacientes respectivamente. Ellos incluyeron pacientes mayores de edad (≥ 18 años) con diagnóstico confirmado de COVID-19 por RT-PCR.
RESULTADOS
Los resultados de interés en estos estudios mostraron datos relevantes sobre el valor predictivo-pronóstico de los marcadores de coagulación en cuanto a muerte o severidad por coviD-19. Tanto el dímero D como el tiempo de protrombina (TP) figuraron en los estudios mostrando cambios significativos.
Tres de cinco estudios demostraron mortalidad relacionada con dímero D (Tabla 1). Todos los estudios fueron significativos (p≤0,05) para discriminación de severidad y mortalidad según niveles del dímero D. Han H mostró valores polarizados, con los que se halló una media de 19,1 μg/mL en pacientes en estados severos (DE 35, 48) en contraste con la media de 2,1 μg/mL de pacientes en estados no severos (DE 2,88). Todas las referencias concordaron con el dímero D como estimador de severidad y mortalidad.
Tabla 1 Resumen estadístico que compara parámetros bioquímicos significativos según mortalidad y severidad
| Han,20201 (N=94) | Zhou,20202 (N=191) | Gao,20203 (N=43) | Wu,20204 (N=201) | Tang,20205 (N=183) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Parámetros | Severo | No severo | Muerto | Vivo | Severo | No severo | Muerto | Vivo | Muerto | Vivo |
| Dímero D (μg/mL) | 19,1 ± 35,5 | 2,1 ± 2,9 | 5,2 IQR (1,5 - 21,1) | 0,6 IQR (0,3 - 1,0) | 0,5 IQR (0,3 - 0,9) | 0,2 IQR (0,2 - 0,3) | 4,0 IQR (1,0 - 11,0) | 0,5 IQR (0,3 - 1,2) | 2,1 IQR (0,8 - 5,3) | 0,6 IQR (0,4 - 1,3) |
| p<0,0001 | p=0,0007 | p=0,001 | p<0,001 | |||||||
| Tiempo de protrombina (segundos) | 12,7 ± 1,1 | 12.2 ± 0,9 | 12,1 IQR (11,2 - 13,7) | 11,4 IQR (10,4 - 12,6) | 11,3 ± 1,4 | 12,0 ± 1,2 | 11,6 IQR (11,1 - 12,5) | 11,8 IQR (11,0 - 12,5) | 15,5 IQR (14,4 - 16,3) | 13,6 IQR (13,0 - 14,0) |
| p=0,0004 | p=0,068 | p=0,87 | p<0,001 | |||||||
1Han H, Yang L, Liu R, Liu F, Wu K, Li J et al. Prominent changes in blood coagulation of patients with SARS-CoV-2 infection. Clinical Chemistry and Laboratory Medicine (CCLM).2020;0(0); 2Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. TheLancet.2020; 395(10229):1054-1062: 3Gao Y, Li T, Han M, Li X, Wu D, Xu Y et al. Diagnostic Utility of Clinical Laboratory Data Determinations for Patients with the Severe COVID-19. Journal of MedicalVirology.2020; 4Wu C, Chen X, Cai Y, Xia J, Zhou X, Xu S et al. Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA InternalMedicine.2020; 5Tang, N., Bai, H., Chen, X., Gong, J., Li, D., & Sun, Z. (2020). Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. Journal of Thrombosis and Haemostasis
Hubo dos de cinco estudios que coincidieron con que el TP fue significativo (p ≤ 0,05) para discriminar mortalidad. Igualmente, hubo discrepancia en 1 de 5 estudios, pero ninguno demostró diferencias significativas entre los pacientes severos vs. no severos. Zhou ilustra que TP ≥16 s es factor de riesgo asociado a muerte intrahospitalaria (OR 4,6 p<0,019).
DISCUSIÓN
El dímero D mostró ser un predictor de activación excesiva de la coagulación, alcanzando valores de sensibilidad del 76,9% y especificidad del 94,9% cuando se usa un valor de corte de 3,0 μg/mL 2. Como predictor de mortalidad intrahospitalaria, el valor óptimo de corte es 2,0 μg/mL, con una sensibilidad y especificidad de 92,3% y 83,3% 3. Sobre el TP se recomienda cercana observación en pacientes de alto riesgo. Los resultados muestran que los marcadores hemostáticos tienen un valor predictivo-pronóstico que es relevante para la muerte o severidad de pacientes con neumonía por COVID-19. Partiendo de los resultados y de una revisión exhaustiva de evidencia, se proponen medidas terapéuticas sostenibles.
Intervención por perfil de coagulación del paciente COVID-19
Perfil hemostático en pacientes COVID-19
La inflamación severa que presentan los pacientes coviD-19 facilita el estado de hipercoagulabilidad 4. En los infectados manejados con anticoagulantes, la incidencia de tromboembolismo pulmonar (TEP) sigue reflejando alta trombogenicidad 5. Los dos mecanismos establecidos son los siguientes: primero, activación del sistema hemostático como efecto colateral del reconocimiento viral y disfunción endotelial producto de la inflamación y/o eventos mecánicos 4,6. Adicionalmente, las evidencias muestran una alteración en el perfil de coagulación de pacientes con coviD-19 que supondría una triplicación del dímero D 5,7. Sin embargo, existe controversia en su uso para diagnosticar TEP en pacientes que solo presentan fiebre, tos, disnea y están hospitalizados en Unidad de Cuidados Intensivos (UCI) 8. Otros hallazgos asociaron dímero (D > 1,0 μg/mL) y alto puntaje de la escala SOFA con mayor mortalidad, lo que cuestiona la causa de estas muertes 4. Asimismo, el TP aumentó hasta 14% sobre los valores normales 7,9 y el fibrinógeno se elevó hasta tres veces desde su valor basal 5. También se reportaron plaquetas en el punto superior del rango, pero un metaanálisis reveló disminución de hasta cinco veces en enfermedad grave 6,9.
Terapia farmacológica por anticoagulación
Las recomendaciones actuales de tromboprofilaxis en pacientes COVID 19 se basan en guías clínicas de embolismo pulmonar. El uso de anticoagulantes resultó conveniente para disminuir mortalidad y mejora del pronóstico en pacientes severos 10.
Múltiples estudios reflejan beneficios al usar heparina de bajo peso molecular (HBPM), que demuestra mejores resultados que los de la heparina no fraccionada (HNF) a corto plazo 11. En términos de costo-beneficio, la HNF ha requerido el consumo de US$88,4 vs. US$69,1 de HBPM 12. Sabiendo esto, la dosis de HBPM varía según conteo plaquetario. Para pacientes entre 50-100 x 109/L se recomienda dosis terapéutica y aquellos entre 30-50 x 109/L requerirían una reducción del 50%. Por debajo de 30 x 109/L se recomienda HBPM en dosis profiláctica y transfusión plaquetaria 13. Por el contrario, estudios niegan beneficio de HBPM en prevención de TEP 14.
Anticoagulación profiláctica en contexto dímero D normal/elevado
Según la guía del Hospital General de Massachusetts, todo paciente hospitalizado por coviD-19, confirmado o sospechoso, debe recibir tromboprofilaxis con HBPM en ausencia de contraindicaciones. HBPM es recomendada sobre HNF para minimizar complicaciones como trombocitopenia y exposición al proveedor de atención médica 15, a pesar de que estudios no demuestran diferencias en eficacia (OR 0,7; IC 95%, 0,3-1,8) entre ambos en TEP y trombosis venosa profunda (TVP). La sugerencia de HNF para países en vías de desarrollo se debe a una mayor disponibilidad para su reversión, aunque demande mayor monitorización 16,17. Para su uso, es importante considerar anomalías en la coagulación y la presencia de sangrado activo, como sugiere la Sociedad Americana de Hematología en coviD-19, suspendiendo solo si el recuento plaquetario es inferior a 25 x 109/L, o fibrinógeno menor a 0,5 g/L 18.
Anticoagulación terapéutica en contexto dímero D elevado
Un estudio de limitada validez observó alta incidencia de TVP y TEP en pacientes severos con dímero D elevado. Mantuvo menor valor aquel grupo que recibió tratamiento en dosis terapéutica vs. profiláctica; considerándose la instauración de régimen terapéutico lo antes posible 5.
Aunque HNF demostró un perfil terapéutico parecido a HBPM, la necesidad de monitorización, mayor tasa de sangrado y riesgo a exposición por parte del personal de salud, lo delegan como fármaco de segunda línea 19,20. La dosis de mantenimiento a infusión continua consiste en administración intravenosa de 5000 U inicial y 20 000 a 40 000 U por 24 h. La dosis de mantenimiento a infusión seriada es 10 000 U inicial y 5000 a 10 000 U c/4 - 6 h 21.
El monitoreo de heparina depende del tiempo de tromboplastina parcial activada (TPT). De hecho, el ajuste de dosis de heparina influye en el rango objetivo del TPT 22. De igual forma, estudios han concluido que la anticoagulación terapéutica con anti-Xa es beneficiosa. Sin embargo, el TPT representa una medida costo-eficiente a pesar de sus limitaciones para controlar la idoneidad del tratamiento con heparina 23,24.
Medidas para la reversión de heparina
La protamina es el antídoto de la HNF, que la neutraliza en aproximadamente cinco minutos 25. Visto esto, pacientes adultos contemplan esquemas de 1,0 a 1,5 mg por 100 U de heparina sin exceder 50 mg, siendo monitorizados cada 24 h 26. Para disminuir el riesgo de sangrado, si hubo cambios en la terapia, se debe esperar entre 12 h y 24 h, dependiendo de la frecuencia de administración de heparina y el TPT. Se debe tener en cuenta el tiempo entre la aplicación de heparina y la administración de protamina, puesto que demandará una dosificación distinta según el intervalo. De 1-2 h entre los eventos requerirán 1,0-1,5 mg/100 U de heparina, 30-120 minutos demandaría 0,5-0,75 mg/100 U de heparina y >2 h necesitaría 0,25-0,375 mg/100 U de heparina, siempre considerando sus efectos adversos 27,28.
Sospecha de TVP en paciente COVID-19
Abordaje del paciente COVID-19
Para diagnosticar TVP debe existir evidencia clínica sugestiva, confirmación con ecografía venosa Doppler y ecocardiografía. El Doppler venoso resulta beneficioso en pacientes coviD-19 que yacen en cama por más de 3 días con dolor asimétrico en miembros inferiores e hinchazón unilateral o bilateral 4. A los pacientes con coviD-19 estables y controlados que tengan aumento súbito de los niveles de dímero D se les debe confirmar TVP por ecografía venosa Doppler en miembros inferiores bilateralmente 4,8.
La HBPM se considera en el tratamiento inicial de los pacientes con TVP. Ensayos clínicos demostraron los beneficios del uso de heparina por peso del paciente; entre ellos, se destaca que, tras su administración, se alcanzó un umbral terapéutico más rápido y los pacientes presentaron menor cantidad de complicaciones (29). Además, disminuye la incidencia de eventos si es utilizado como medida profiláctica para TVP (11); asimismo, posee similar efectividad y tolerancia que la HNF intrahospitalaria para el tratamiento de TVP 20. Dentro de los fármacos de primera línea se recomienda la enoxaparina 1,0 mg/kg c/12 h o 1,5 mg/kg c/24 h.
Por otro lado, las dosis se deben ajustar a las medidas terapéuticas. Para pacientes ambulatorios con TVP sin datos de TEP, es recomendable 1,0 mg/kg SC cada 12 h, por al menos 5 días. Actualmente no se ha encontrado diferencia significativa en eficacia o seguridad en el uso de enoxaparina cada 12 o 24 h en pacientes ambulatorios con bajo riesgo de TVP. Ahora bien, si el paciente está hospitalizado con TVP, teniendo o no TEP, se recomienda 1,0 mg/kg SC c/12 h o 1,5 mg/kg SC c/24 h, por al menos 5 días 30-32.
Sospecha de TEP en paciente COVID-19
Abordaje del paciente con TEP
Hipoxemia desproporcionada, disfunción aguda del ventrículo derecho o dilatación ventricular derecha evidenciada por ecocardiografía son algunos de los signos que aumentan la sospecha de TEP 7. Además, hay evidencias de pacientes coviD-19 positivos para TEP que son asintomáticos. Los pacientes que presentan mejora en la infección y que súbitamente se les empeora el cuadro con hipotensión o paro cardiorrespiratorio (así como con eco-grafía transtorácica sugestiva de sobrecarga ventricular derecha o hipertensión pulmonar) deben recibir trombólisis de manera inmediata 4.
Posterior a la identificación clínica de TEP, la patología se diagnostica objetivamente a partir de estudios de imágenes. Hay autores que no lo recomiendan debido al riesgo de transmisión por contaminación, así como por la inestabilidad de los pacientes afectados, la cual hace difícil llevarlas a cabo 7. El uso de tomografía computarizada no es específico sin aplicar medio de contraste, pero usarlo aumenta el riesgo de nefropatía inducida por contraste facilitado por disfunción renal previa 8.
El uso de enoxaparina en lugar de HNF resultó en una menor recurrencia de TVP (1,3% vs. 5,4%; p=0,060) y TEP (1,3% vs. 4,1%; p=0,17), así como una disminución en las complicaciones de los pacientes (2,7% vs. 8,8%; p=0,026) (20). Para manejar el TEP, se sugiere enoxaparina 1,0 mg/kg c/12 h o 1,5 mg/kg c/24 h.
Estratificación de riesgo en pacientes con TEP
Los pacientes con alto riesgo de embolismo pulmonar masivo presentan inestabilidad hemodinámica, troponinas elevadas y disfunción ventricular derecha, síntomas asociados a alta mortalidad 32,33. Aquellos con un peso >65 kg deben usar 10 mg de alteplase en bolo y 90 mg en infusión continua durante 2 horas como parte de la terapia fibrinolítica. Para aquellos pacientes <65 kg se sugiere ajustar la dosis por peso. Como alternativa, se puede utilizar estreptoquinasa, 1,5 millones UI en 2 horas; su menor costo la hace más asequible para la población 34.
El tratamiento convencional con activadores recombinantes del plasminógeno tisular (rtPA, por sus siglas en inglés), 100 mg por 2 horas, es otro régimen fibrinolítico disponible para estos pacientes. De igual manera, la estreptoquinasa con dosis de carga de 250 000 unidades por 30 min y luego 100 000 por 12-24 h. En caso de necesitar tratamiento acelerado de las drogas previas, se recomienda rtPA 0,6 mg/ kg por 15 minutos (máxima dosis de 50 mg), así como 1,5 millones de UI de estreptoquinasa por 2 horas 35.
Para pacientes con embolismo pulmonar submasivo de riesgo intermedio, caracterizados por estabilidad hemodinámica, troponinas elevadas y disfunción ventricular derecha, usar trombolíticos sistémicos es controversial, por ausencia de estudios con población suficiente, consenso de guías y análisis de riesgo-beneficio. Pacientes >65 kg pueden usar alteplase 10 mg iv en bolo y 40 mg iv en infusión por 2 h. En caso de que el paciente sea <65 kg, se recomienda ajustar dosis por peso 32,34.
Los pacientes con embolismo pulmonar no masivo o de bajo riesgo son caracterizados por parámetros clínicos con o sin disfunción ventricular derecha y elevación de las troponinas; para ellos, se recomienda un tratamiento anticoagulante ambulatorio 36.
Observaciones generales
Interacción con fármacos COVID-19
Se hace necesario valorar posibles interacciones farmacológicas entre la terapia experimental para el virus y el tratamiento de posibles complicaciones. En la Tabla 2 se presentan interacciones de fármacos empleados en el algoritmo de tratamiento de anticoagulación.
Tabla 2 Interacciones farmacológicas de terapia anticoagulante con fármacos COVID-19 activos
| Atazanavir | Lopinavir/ritonavir* | Remdesivir | Favipravir | Cloroquina* | Hidroxicloroquina* | Ribavirina | Tocilizumab | Interferón-beta | |
|---|---|---|---|---|---|---|---|---|---|
| Apixabán/rivaroxabán | ↑↑ | ↑↑ | ↔ | ↔ | ↑‡ | ↑‡ | ↔ | ↓‡ | ↔ |
| Enoxaparina | ↔ | ↔ | ↔ | ↔ | ↔ | ↔ | ↔ | ↔ | ↔ |
| Heparina | ↔ | ↔ | ↔ | ↔ | ↔ | ↔ | ↔ | ↔ | ↔ |
| Estreptoquinasa | ↔ | ↔ | ↔ | ↔ | ↔ | ↔ | ↔ | ↔ | ↔ |
| Alteplase | ↔ | ↔ | ↔ | ↔ | ↔ | ↔ | ↔ | ↔ | ↔ |
↑Posible aumento a la exposición frente a la co-medicación; ↓Posible disminución a la exposición frente a la co-medicación; ↔No efecto significativo; *Incrementan intervalo QT; †No deberían ser co-administradas; ‡Pueden tener interacción débil.
Transfusión en contexto de trombocitopenia
Pacientes con COVID-19 sin datos de sangrado y recuento plaquetario < 20X109/L califican para transfusión plaquetaria. En caso de ser sometidos a una punción lumbar o presentar sangrado activo, se debe realizar transfusión plaquetaria con recuento de <50X109/L. En caso de infección severa y terapia de oxigenación por membrana extracorpórea, se recomienda la transfusión plaquetaria con <80X109/L 37,38. En caso de sangrado incesante y parámetros que indiquen coagulación disminuida, considérese detener transfusión y administrar factor VII recombinante 39,40.
Uso de anticoagulantes orales en pacientes COVID-19
Se ha descrito que el uso de anticoagulantes orales de acción directa (ACOD) promueve mayor adherencia al tratamiento. Tienen un perfil terapéutico similar a otros anticoagulantes parenterales, aunado a menor mortalidad en pacientes con eventos tromboembólicos agudos 33,41. Estudios proponen que el rivaroxabán es mejor que la enoxaparina para tromboprofilaxis en pacientes graves, pues el primero reduce el riesgo de TEP, pero aumenta el riesgo de sangrado 42. Su dosis recomendada es 15 mg cada 12 horas por tres semanas y luego ajustar a 20 mg cada 24 horas, así como el uso de apixabán 10 mg cada 12 h por siete días y luego 5 mg cada 12 horas 35. En cuanto a warfarina, su uso aislado ha sido desplazado por ACOD en el tratamiento de TEP 43. No obstante, en pacientes COVID-19 se prefiere la anticoagulación parenteral en lugar de los ACOD y anticoagulantes dependientes de vitamina K (AVK). Estos últimos mostraron inestabilidad de TP e INR debido a variabilidad del metabolismo de vitamina K, dieta, ayuno, medicamentos, insuficiencia hepática e insuficiencia cardíaca 44,45. La interrupción del tratamiento anticoagulante se asocia a mayor mortalidad y complicación tromboembólica de rebote 46.
Situaciones especiales
Dentro de las situaciones que pueden demandar modificación del tratamiento están: falla renal, según aclara-miento de creatinina (CrCL), falla hepática por criterio Child-Pugh y obesidad conforme al índice de masa corporal (IMC). La Tabla 3 ofrece un desglose detallado de las consideraciones y recomendaciones para cada situación.
Tabla 3 Ajuste de terapia farmacológica según complicaciones del paciente
| Falla renal | Falla hepática | Obesidad | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Fármaco | Dosis | Leve 50-80 mL/min | Moderada 30-50 mL/min | Severa <30 mL/ min | Leve Child-Pugh Clase-A | Moderada Child-Pugh Clase-B | Severa Child-Pugh Clase-C | Leve-moderada Clase 1-2 30-40 IMC | Mórbida Clase 3 ≥40 IMC |
| Trombosís | |||||||||
| Alteplase | 10 mg IV en bolo + 90 mg IV en infusión por 2 h. | c ajuste dosisa | †No ajuste dosisa | †No ajuste dosisa | †No ajuste dosisa | †No ajuste dosisa | †No ajuste dosisa | †No ajuste dosisg (0.9 mg/kg) | ε |
| Heparinas | |||||||||
| Hnf | T: DC: 80 U/kg IV; DM: 18/U/kg/h IV | †No ajuste dosisa | †No ajuste dosisa | †No ajuste dosisa | ε | ε | ‡No ajuste dosisf | †No ajuste dosisg | †7,500 U SC c/8 hg. |
| Enoxaparina | P: 1mg/kg SC c/24 h T: 1.5 mg/kg SC c/24 h |
No ajuste dosisa | ‡No ajuste dosisb | †1 mg/kg SC c/24 h; 0.66 mg/kg c/12 ha | ‡No ajuste dosisd | ‡No ajuste dosisa | ‡No ajuste dosisf | ‡P: 0.4-0.5 mg/kg c/24 h; 0.5 mg/ kg c/12 hh 40 mg SCc/12 hg ‡T: 1mg/kg c/8 hh | ‡P: 0.75 mg/ kg c/12 h 60 mg c/12 hg |
| ACOD | |||||||||
| Apixabán | P: 2.5 mg VO c/12 h T: 10 mg VO c/12 h | †No ajuste dosisa | †No ajuste dosisa | †No recomendadoc | †No ajuste dosise,f | †No ajuste dosise,f | ΦContra-indicadoa,e,f | ‡No ajuste dosisi | ε |
| Rivaroxabán | P: 10 mg VO c/24 h T: 15 mg VO c/12 h | †No ajuste dosisa | ‡P: 7.5 mg VO c/24 hb | ‡No recomendadoc | †No ajuste dosis' | ‡Contra-indicadoa,f | ΦContra-indicadoa,f | ‡No ajuste dosisi | ‡No recomendadoi |
†Corrección aceptada: t-Datos contradictorios en diversos estudios; eDatos insuficientes; cPContraindicación aceptada.
aRibic C, Crowther M. Thrombosis and anticoagulation in the setting of renal or liver disease. Hematology.2016;2016(1):188-195
bSpyropoulos, A. C., Ageno, W., Albers, G. W., Elliott, C. G., Halperin, J. L., Hiatt, W. R., et al.(2018). Rivaroxaban for Thromboprophylaxis after Hospitalization for Medical Illness. New England Journal of Medicine.
cKearon C, Akl E, Ornelas J, Blaivas A, Jimenez D, Bounameaux H et al. Antithrombotic Therapy for VTE Disease. Chest.2016;149(2):315-352.
dTurco, L., de Raucourt, E., Valla, D.-C., & Villa, E. (2019). Anticoagulation in the cirrhotic patient. JHEP Reports.
eByon, W., Garonzik, S., Boyd, R. A., & Frost, C. E. (2019). Apixaban: A Clinical Pharmacokinetic and Pharmacodynamic Review. Clinical Pharmacokinetics.
fQamar A, Vaduganathan M, Greenberger N, Giugliano R. Oral Anticoagulation in Patients With Liver Disease. Journal of the American College of Cardiology. 2018;71 (19):2162-2175
gRocca, B., Fox, K. A. A., Ajjan, R. A., Andreotti, F., Baigent, C., Collet, J.-P., et al. (2018).Antithrombotic therapy and body mass: an expert position paper of the ESC Working Group on Thrombosis. European Heart Journal,39(19),1672-1686f.
hSherkat Masoum, M., & Emmerton, L. M. (2019). Enoxaparin for thromboprophylaxis in overweight and obese patients: a prescribing audit at a tertiary hospital. Journal of Pharmacy Practice and Research,49(4),376-379.
Rumbaugh K, Schmidt L. Venous Thromboembolism Prophylaxis Guidelines[Internet]. Vumc.org. 2018. Available from: https://www.vumc.org/trauma-and-scc/sites/vumc.org.trauma-andscc/files/public_files/Manual/VTE%20Prophylaxis%20Guideline%20Update%20-%20Final%20Sept%202018.p
La infección por SARS-CoV-2 demuestra una importante actividad procoagulante y su tratamiento oportuno podría alterar drásticamente el pronóstico. Dentro de las opciones terapéuticas, la evidencia descrita avala métodos costo-eficientes para consideración individualizada de los casos. Esto promueve una gobernanza de sistemas de salud pública vulnerables con equidad basada en evidencia 49 ♣