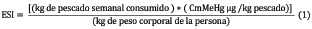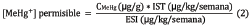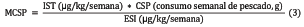El consumo de pescado se revela como fuente de exposición humana al metilmercurio 1,2. Por esta razón, la evaluación de los niveles de mercurio y metilmercurio representa un factor importante desde el punto de vista toxicológico para la estimación de los impactos potenciales sobre la salud pública. La forma más peligrosa del mercurio para la salud humana es el metilmercurio, que origina daños en el sistema nervioso central (por ejemplo, una ataxia) junto con disartria, parestesia, pérdida de la audición, disminución en la visión, pérdida de la conciencia y muerte 3,4. Este contaminante cruza tanto la barrera hematoencefálica como la placentaria y puede causar daño neurológico a fetos y niños. En ellos, el sistema nervioso está aún en desarrollo, con lo cual podrían desarrollarse enfermedades como microcefalia, retardo en el desarrollo, deterioro cognitivo y trastornos neurológicos 5.
Los productos marinos son considerados como la fuente primaria de exposición humana a mercurio y el contenido de este contaminante en los diferentes productos depende de diversos factores como especie, tamaño, nivel trófico y localización de su hábitat 6,7. El pescado y los productos marinos son considerados una fuente saludable de proteínas, ácidos grasos, omega 3 y vitamina D. Asimismo, durante su consumo, aportan niveles bajos de colesterol 8,9. Entre estos productos, uno de los más populares en la dieta humana, por su conservación, disponibilidad, sabor, beneficios proteicos y economía es el atún enlatado 5. El atún es una especie predadora con un alto nivel en la cadena trófica; por ello, los niveles de mercurio alcanzándose biomagnifican y alcanzan altas concentraciones 10.
A pesar de los beneficios potenciales de la ingesta de pescado en la salud, los contaminantes químicos que contiene este alimento (como el metilmercurio) se han convertido en un tema de preocupación, especialmente para los consumidores regulares de pescado, los cuales, generalmente, no son conscientes de los posibles riesgos que este producto puede representar para su salud. Por esta razón, el objetivo del presente estudio fue determinar el contenido de mercurio total (HgT) y metilmercurio (MeHg) en diversas marcas de atún enlatado comercializado en Montería, Colombia, además de estimar el posible riesgo a la salud debido a la exposición al contaminante a través de su consumo.
MATERIALES Y MÉTODOS
Recolección de muestras
Muestras de atún de cuatro marcas diferentes, procedente de China (A), Ecuador (B y C) y Colombia (D) se compraron en supermercados locales ubicados en la ciudad de Montería, Colombia, entre los meses de agosto y noviembre de 2017. Las muestras se seleccionaron de acuerdo con las marcas de atún certificadas por el Instituto Nacional de Control de Alimentos y Medicamentos 11 con registro de salud existente, presencia en el mercado durante todo el año y alta oferta comercial. Cada mes se recolectaron cinco (5,0) latas de atún, tanto en agua como en aceite, de las diferentes marcas. Las latas fueron abiertas y el contenido líquido (aceite o aguas) drenado. La carne se homogeneizó a fondo usando un mezclador de alimentos (cuchilla de acero inoxidable). Todas las muestras se almacenaron a -20 °C hasta el análisis.
Análisis de muestras
Mercurio total (HgT)
El método analítico utilizado para determinar la concentración de HgT en las muestras de atún (30 mg) se basó en la descomposición térmica detectada por espectrometría de absorción atómica, utilizando un equipo DMA-80, marca Milestone (analizador directo de mercurio) 12. El control de calidad analítico del método se realizó con material de referencia certificado IAEA 407 (HgT: 0,222 μg/g). El porcentaje de recuperación para HgT fue de 98,0 ± 0,4. El límite de detección fue 0,01 μgHgT/g, calculado como la media más tres veces la desviación estándar del blanco (SD) 13.
Metilmercurio (MeHg)
El análisis de MeHg se realizó por cromatografía de gases con detector captura de electrones. Las muestras de atún (0,2 a 0,3 g) fueron digeridas con HCl, NaBr y tolueno; Luego, se realizó una centrifugación y extracción con cisteína. La fase orgánica fue analizada empleando un cromatógrafo de gases (Perkin Elmer Autosystem XL). El límite de detección para MeHg fue 0,05 ug/g, calculado a partir de la desviación estándar de diez blancos y con una desviación estándar relativa <10%. El control de calidad analítico del método se evaluó por triplicado con material de referencia certificado DORM-2 (4,09 ± 0,33 μg/g), y el porcentaje de recuperación fue del 95-103%.
Evaluación de riesgos para la salud humana
El posible riesgo para la salud asociado con Hg se calculó asumiendo pesos corporales de 70 kg y 35 kg para adultos y niños, respectivamente 14, y una ingesta semanal de pescado de 0,372 kg para atún en conserva, basado en una encuesta de dieta (n=180). Se realizaron encuestas aplicadas a personas que se encontraban en diferentes puntos de venta (supermercados) de las marcas de atún en la ciudad de Montería, Colombia, para conocer la cantidad consumida, frecuencia y forma de consumo. Las encuestas fueron tabuladas en hoja de cálculo de Microsoft Excel, analizadas en tres grupos poblacionales: niños (5 a 17 años), mujeres en edad fértil (16 a 45 años) y adultos de la población en general.
La evaluación del riesgo potencial se realizó a partir de la ingesta semanal estimada de MeHg (ESI) por kilogramo de peso corporal de la persona expuesta aplicando la ecuación que se describe a continuación, utilizada por UNEP 15:
Donde CmMeHg es la cantidad promedio de metilmercurio. Además, se cuantificó la concentración permisible de MeHg a fin de evitar exceder la ingesta semanal estimada 16. Para ello se consideraron los valores de ESI y la cantidad de atún consumido por semana, utilizando la siguiente ecuación:
Donde [MeHg] es la concentración de MeHg permisible; IST es la ingesta semanal tolerable provisional con valor de referencia establecido por el Comité de Expertos en Aditivos Alimentarios de la FAO/WHO en el año 2006.
Los valores de ingesta semanal total permisible (PTWI) para MeHg son de 1,6 μg/kgpc/semana para grupos sensibles como las mujeres en edad fértil (MEF) y los niños (N), a diferencia de miembros o adultos de la población en general (APG) que es de 3,2 μg/kgpc/semana 17.
Finalmente, se calculó la cantidad máxima de atún que se puede consumir semanalmente por persona (MCSP), sin efectos perjudiciales para la salud, mediante la ecuación:
Análisis estadístico
Los resultados para cada muestra se calcularon como la media ± la desviación estándar de las determinaciones por triplicado. La prueba Kolmogorov-Smirnov mostró que los resultados no presentan una distribución normal. Para evaluar diferencias significativas entre las diferentes marcas de atún se realizó la prueba no paramétrica de Mann-Whitney. El análisis de correlación de Spearman se utilizó para establecer la asociación entre las concentraciones de HgT y MeHg. El análisis estadístico se desarrolló con el programa estadístico SPSS 10.5, con el cual se estableció un nivel de significación de p<0,05.
RESULTADOS
El largo tiempo de residencia del mercurio (Hg) en los océanos (aproximadamente 30 años) y la alta toxicidad de su forma orgánica, metilmercurio (MeHg), hacen que sea particularmente importante estudiar la distribución de Hg en especies marinas. El atún está expuesto principalmente a Hg a través de rutas dietéticas, donde el MeHg se une fuertemente a las moléculas de grasa y se absorbe fácilmente en el tracto digestivo de estos animales. La fuerte afinidad MeHg por los lípidos produce tasas de eliminación lentas, en comparación con las formas inorgánicas de Hg (p. Ej. Hg 2+ y Hg0), lo que contribuye a la acumulación general a lo largo de la vida útil del organismo. El metil-Hg es altamente venenoso y la toxicidad varía según la ruta de ingesta, la cantidad de exposición y la susceptibilidad individual.
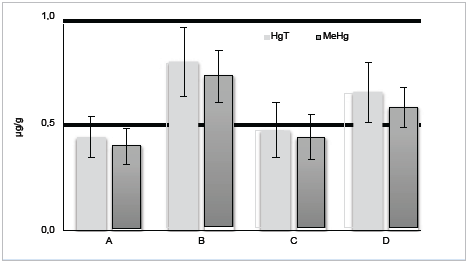
La Figura 1 muestra concentraciones de 0,589 ± 0,163 y 0,541 ± 0,156 μg/g, de HgT y MeHg en atún respectivamente. El promedio de HgT y MeHg en sus presentaciones en agua y en aceite no presentan diferencias estadísticamente significativas.
La Tabla 1 muestra la comparación de este estudio con otros realizados en diferentes lugares.
Tabla 1 Comparación de la concentración de mercurio con otros estudios
| Referencia | País | Especie | Hg (Mg /g) | |
|---|---|---|---|---|
| Ma ± Sb | Rango | |||
| Burger y Gochfeld, 2004 | United States | Thunnus germo | 0,430 | - |
| Storelli et al. 2010 | Italy | Tuna not specified | 0,410 | 0,04 -1,79 |
| Mol, 2011 | Turkey | Tuna not specified | 0,140 | - |
| Ruelas et al. 2011 | Mexico | Thunnus albacares | 0,362 | - |
| Olmedo et al. 2013 | Spain | Thunnus albacares | 0,222 | 0,035 - 0,894 |
| Hosseini et al. 2013 | Iran | Thunnus albacares | 0,143 | - |
| Bosch et al. 2015 | South Africa | Thunnus albacares | 0,654 ± 0,209 | 0,23 -1,24 |
| Okyere et al. 2015 | Ghana | Tuna not specified | 0,16 ± 0,030 | 0,12- 0,20 |
| Araújo y Cedeño, 2016 | Ecuador | Thunnus albacares | 1,4 ± 1,3 | 0,005 - 6,0 |
| García et al 2016 | Spain | Thunnus albacares | 0,306 ± 0,160 | 0,08 - 0,715 |
| Alcala et al. 2017 | Colombia | Tuna not specified | 0,66 ± 0,05 | - |
| Este estudio | Colombia | Thunnus albacares | 0,589 ± 0,163 | 0,092-1,016 |
a: media, b: desviación.
Riesgo potencial
La Tabla 2 muestra los resultados de la estimación del riesgo potencial de la población. Para todos los grupos de población, el valor más alto de ESI se registró en el atún enlatado marca B (5,91 μg/kg/semana) y grupo poblacional N, aproximadamente cuatro veces la IST. El valor más bajo se presentó en el grupo poblacional APG en la marca A (1,51 μg/kg/semana), con una relación menor en comparación al grupo N de aproximadamente 4 veces. Además, no representa una amenaza para la población general al presentar valores menores al IST.
Tabla 2 Riesgo potencial para la población por consumo de atún
| Marca | ESIc (ug/g/semana) | MeHg (ug/g) | MCSP (g) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| N | MEF | APG | N | MEF | APG | N | MEF | APG | |
| Atún (A) | 4,08 | 1,63 | 1,51 | 0,23 | 0,44 | 0,96 | 143,2 | 433,0 | 969,4 |
| Atún (B) | 5,91 | 2,86 | 2,82 | 0,23 | 0,44 | 0,96 | 53,7 | 208,2 | 496,0 |
| Atún (C) | 4,89 | 2,10 | 1,98 | 0,23 | 0,44 | 0,96 | 99,2 | 319,2 | 725,6 |
| Atún (D) | 4,24 | 1,81 | 1,71 | 0,23 | 0,44 | 0,96 | 125,5 | 372,9 | 853,7 |
c: IST: 1,6 μg/kg /semana para niños (N) y mujeres en edad fértil (MEF); IST: 3,2 μg/kg/semana para adultos (APG).
En función de las encuestas realizadas, la cantidad de atún consumida semanalmente fue 372 g/semana, cercana al promedio general de los grupos (400 g) y superior a la cantidad promedio calculada de atún permitido semanalmente (MCSP) para los grupos poblacionales N (media: 105,4 g) y MEF (media:333,3 g) (Tabla 2). Con base en los resultados, la marca de atún que puede tener mayor consumo por semana para los grupos poblacionales N y MEF es la A y la de menor consumo, la marca B. Es decir que los grupos deberían consumir 143,2 g (N) y 433 g (MEF) por semana de atún enlatado si eligen la marca A. Mientras que para la marca B deberían consumir por semana 53,7 g y 208,2 g, respectivamente, a diferencia del grupo poblacional APG, en el cual la MCSP puede ser mayor al presentar valores más altos en comparación con los otros grupos poblacionales y resultados obtenidos en función de la encuesta realizada a los diferentes participantes. Cabe resaltar que el grupo poblacional más vulnerable es N, al presentar MCSP >372 g/semana para todas las marcas de atún. Por esta razón, al considerar que el peso neto de una lata regular de atún corresponde a 160 g, los resultados sugieren que los niños no deben consumir ninguna lata de atún.
Las mujeres embarazadas no deben consumir más de dos latas de atún por semana de la marca B, y solo una si es de la marca A, C y D. El grupo APG no debe consumir más de cinco latas si eligen la marca B.
DISCUSIÓN
Para las concentraciones de HgT y MeHg en las diferentes marcas de atún se presenta diferencia significativa (p< 0,05). Esto se atribuye posiblemente al hecho de que el atún proviene de diferentes lugares, cuyo grado de contaminación se desconoce. La información proporcionada en la etiqueta no especifica si la zona de procesamiento corresponde a la misma zona de captura. El atún es reconocido como un depredador capaz de concentrar grandes cantidades de Hg, cuya cuyos niveles de Hg pueden variar 18-20. El contenido de MeHg representa 91,9% del contenido de HgT. Además, presenta correlación altamente significativa con los niveles de HgT (r=0,99; p<0,05).
Lo anterior demuestra que la forma orgánica neurotóxica metilada de Hg es predominante en las muestras de atún, lo que puede generar riesgo potencial en la población.
Las concentraciones de Hg reportadas en este estudio son superiores, si se comparan con las de otros (Tabla 1), con excepción de las reportadas en Sudáfrica 21, Ecuador 22 y Colombia (en la ciudad de Cartagena) 23. Lo anterior demuestra mayor riesgo potencial en comparación con otros países, debido a la falta de controles más estrictos en los sitios de producción local y productos importados antes de su distribución en el mercado. Cabe resaltar que estos resultados se convierten en puntos de referencia nacional para su legislación y comercialización.
La disminución de las capturas marinas y de agua dulce en los últimos años en Colombia ha llevado a un aumento en la compra de pescado importado. Las importaciones totales de productos pesqueros aumentaron casi siete veces en el lapso de los años 2004 a 2013. Las importaciones provienen principalmente de Vietnam, Chile, Ecuador, Senegal, China, Sudáfrica y, desde 2013, Estados Unidos. En algunos de estos países se han registrado problemas de contaminación por Hg en atún, al superar los límites establecidos internacionalmente 24,25.
Datos reportados por el Departamento Administrativo Nacional de Estadísticas (DANE) indican que las importaciones en el sector pesquero y acuícola del país registraron un crecimiento de 1,8% entre los años 2015 y 2016. En el año 2016 el principal producto pesquero importado fue el pescado (fresco y congelado), con un total de 71 000 toneladas y 52 159 toneladas enlatadas. La tendencia más notable es la importación de pescado fresco y atún enlatado, productos que tienen una gran demanda ya que son productos de acuicultura competitivos y de bajo costo de importación con un precio de mercado bajo. Diferentes estudios realizados a nivel nacional, en especial en la costa Caribe, evidencian la problemática de contaminación de Hg en atún enlatado 23,26. Por esta razón, se deben establecer estrategias para abordar el consumo de atún en Colombia, aunque los niveles de Hg no sobrepasen el límite máximo permisible establecido en la Resolución 122 del Ministerio de Salud y Protección Social de Colombia 27.
La frecuencia de consumo genera riesgo potencial en la salud en la población al superar MCSP para algunas marcas de atún distribuidas en el mercado. Además, se debe tener en cuenta que el Hg es un contaminante que se bioacumula en los organismos, por lo cual la Agencia de Protección Ambiental (EPA) y la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) recomiendan que personas sensibles (como las mujeres embarazadas y las madres que amamantan niños pequeños) eviten comer atún, porque generalmente contienen altos niveles de Hg.
A nivel nacional, la Resolución 122 del Ministerio de Salud y Protección Social de Colombia 27 establece límites permisibles para consumo humano de (0,5 μg/g de Hg) para productos de la pesca, especialmente pescados y mariscos, pero para peces como el atún, un límite de 1 ug/g está permitido. Lo anterior indica que las concentraciones de Hg en las muestras de atún no superan el límite permisible. Además, son inferiores a los recomendados por la Comisión del Codex Alimentarius y Agencia de Alimentos y Medicamentos de EE. UU. (FDA) como límite de tolerancia aceptable para el consumo humano en peces depredadores, pescados y mariscos 28. Sin embargo, supera el valor establecido como permisible por la Unión Europea de 0,5 μg/g en productos pesqueros 29 y países como Japón, donde se acepta como límite permisible 0,4 μg THg (0,3 μg MeHg/g) en peces 30.
Los resultados de este estudio mostraron que, para la época en que se realizó, el atún distribuido en la ciudad de Montería presentó niveles de concentración altos, en la marca A, de HgT y MeHg. Las otras marcas estudiadas presentaron valores inferiores a los límites establecidos por organizaciones nacionales e internacionales.
Los valores obtenidos para ESI indican un posible riesgo para la salud del grupo poblacional de niños y mujeres en edad fértil, al superar el valor de referencia IST. A diferencia el grupo de adultos no presenta riesgo (ESI < IST). A nivel mundial, es necesario un mejoramiento continuo en los estándares nacionales e internacionales de inocuidad y calidad de los alimentos enlatados a partir del pescado, con medidas regulatorias, teniendo en cuenta la cantidad de latas consumidas por semana.
Es importante considerar los fenómenos de bioacumulación de Hg en los habitantes a largo plazo debido al considerable consumo de atún en esta ciudad costera y al alto nivel de comercialización de este producto ♦