La leishmaniosis visceral canina (LVC) es causada por Leishmania infantum y transmitida por la especie Lutzomyia longipalpis, que se alimenta sobre un gran número de huéspedes 1. En el área urbana, el perro común es la principal fuente de infección, lo cual es un problema grave de salud pública en los países en desarrollo 2. La enzootia canina precede la aparición de casos humanos y, por lo general, la infección de los perros se mantiene más prevalente que en humanos 3. La LVC es una infección multisistémica variable, que suele mostrar signos clínicos inespecíficos o una alta proporción de perros asintomáticos, lo cual favorece la subnotificación de casos positivos. Los perros seropositivos asintomáticos están en riesgo de desarrollar la enfermedad clínica a lo largo de sus vidas y permanecer como reservorios del parásito, pues pasan desapercibidos. Por lo tanto, la detección rápida de LVC es muy importante para controlar casos humanos de zonas endémicas, sobre todo como consecuencia de la prevalencia alta y el incremento de perros infectados tanto en zonas urbanas como periurbanas 4,5.
En Paraguay, la leishmaniosis visceral (LV) se ha dispersado entre estas zonas y factores como la presencia de perros domésticos y dispersión de L. longipalpis (karachã, en guaraní), han mantenido la circulación del parásito 6,7.Las condiciones sociales, aunadas al desconocimiento de los pobladores y la presencia de perros sin propietarios -los cuales suelen vagar en la periferia de áreas urbanas-, sirven como amplificadores de la infección 8,9. En las zonas periurbanas y rurales es muy común ver las viviendas ubicadas en lugares inapropiados, con áreas boscosas muy densas en torno al peridomicilio, algunas veces con varios animales, lo cual puede favorecer la permanencia de vectores en la zona.
Así, la emergencia y propagación de la LV puede relacionarse con varios factores desencadenantes, tal como ocupación urbana desordenada, falta de servicios básicos de saneamiento y tenencia no responsable de animales domésticos 10. Estas condiciones contribuyen a la presencia de vectores y animales infectados en áreas urbanas, incrementando de esa forma la capacidad de transmisión de la leishmaniosis 11.
El perro es un hospedador muy afectado en esta parasitosis y, por ello, el manejo de la enfermedad considera los aspectos clínicos y epidemiológicos del animal como fuente de transmisión para los humanos 12. El Centro Antirrábico Nacional del Ministerio de Salud de Paraguay ha reportado el 19,4% de seropositividad canina para el Departamento Caaguazú en el periodo 2011. La prueba serológica recomendada por el Programa Nacional de Leishmaniosis es la inmunocromatografía con el antígeno rK39, el cual ha mostrado altos valores de sensibilidad (88%-96%) y especificidad (96%-100%) 7,13. La visualización directa del parásito en aspirado de ganglio o médula ósea es recomendada para fines confirmatorios 7.
Por todas las razones como el efecto de la presencia de LVC en la salud pública, el papel de los perros como reservorios del parásito y la escasa información disponible para el departamento de Caaguazú, se propuso investigar la presencia de LVC, sus características clínicas y epidemiológicas relacionadas con la transmisión de la leishmaniosis canina en tres municipios del departamento de Caaguazú, Paraguay.
MATERIALES Y MÉTODOS
Área geográfica
El área de estudio correspondió al sur oeste del departamento de Caaguazú, Paraguay, en el que se abarcaron los municipios (distritos) Coronel Oviedo (25° 27' 30" sur y 56° 25' 17" oeste), Caaguazú (25° 28' 21" sur y 55° 59' 45" oeste) y San José de los Arroyos (25° 32' 18" sur y 56° 43' 52" oeste). Los puntos seleccionados para la colocación de las trampas se muestran en la Figura 1. Esta zona presenta características de clima templado con abundantes lluvias 14.
Diseño y abordaje del estudio
Se diseñó un estudio descriptivo, observacional de corte transversal. La población estuvo conformada por 324 pacientes caninos de viviendas particulares de tres distritos del departamento Caaguazú. La toma de muestra se realizó entre julio 2017 y noviembre 2018, acorde al criterio de selección establecido, con muestreo consecutivo de tres perros alrededor de cada trampa de flebótomo. Las viviendas fueron seleccionadas considerando el concepto del "peor escenario", en grillas de 400mx400m de distancia 15. Se muestrearon 86 grillas en Coronel Oviedo y Caaguazú y 22 grillas en San José. En cada vivienda se colocó una trampa tipo CDC y, en caso de que la vivienda trampeada no tuviera perros, la toma de muestra se realizó de caninos que residían en viviendas próximas a la trampa. Para la validación del instrumento, se aplicó una prueba piloto en 14 viviendas de Coronel Oviedo, a fin de evaluar aspectos técnicos, mejorar flujos de variables y corregir las dificultades detectadas.
Selección y toma de muestra
Durante la visita a los hogares y después de obtener el consentimiento de los propietarios, un total de 110 familias fueron encuestadas para detectar características demográficas, costumbres y cuidados que reciben los perros tales como visita al veterinario, uso de repelentes y otros aspectos que pudieran asociarse con la presencia/ausencia de la infección. En el examen clínico se verificó la apariencia general del animal, crecimiento de uñas, presencia de lesiones o síntomas de sospecha de leishmaniosis (úlceras, áreas alopécicas, lesiones eritematosas). Los animales fueron sometidos a venopunción para la obtención de sangre completa y posterior prueba serológica. Por punción y aspirado de ganglio poplíteo de la población canina, se tomó una muestra que, extendida en una lámina, se coloreó con Giemsa para realizar el examen parasitológico directo con microscopio óptico (400X).
El procedimiento con los animales fue incluido como parte del protocolo de investigación del proyecto, el cual fue aprobado por el Comité de ética de investigación de la Universidad Nacional de Caaguazú según dictamen No. 01/18. Para todos los casos fueron consideradas las normas y procedimientos adecuados de bioseguridad y humanización que evita sufrimiento del animal.
La lectura y el análisis de las muestras se llevaron a cabo en el laboratorio de Leishmaniosis Visceral del Departamento de Zoonosis de la V Región Sanitaria del Ministerio de Salud Pública y Bienestar Social de la ciudad de Coronel Oviedo, Caaguazú.
Pruebas diagnósticas para leishmaniosis en caninos
Prueba serológica. Se utilizó la prueba inmunocroma-tografía rápida con antígeno comercial recombinante rK39 de marca (InBios), fundamentada en el revelado de los anticuerpos específicos de Leishmania 16. La aparición de dos líneas en las tiras reactivas representó una reacción positiva para LVC. Una sola línea en la parte superior correspondió al control y significó una prueba negativa.
Prueba directa. Se realizaron frotis del material obtenido del ganglio, lo suficientemente finos, para lograr la individualización de las formas parasitarias y su mejor observación. Las láminas fueron secadas a temperatura ambiente para la posterior coloración con Giemsa y su observación al microscopio (400X).
Gestión y análisis de datos. Los datos fueron consignados en la planilla electrónica de Microsoft Excel para su análisis mediante estadística descriptiva y se obtuvieron valores de frecuencias y proporciones.
RESULTADOS
La población canina estuvo conformada por 324 perros domésticos a razón de hasta 3 caninos por vivienda. El 100% de las familias visitadas permitió la evaluación clínica y de laboratorio de sus perros. Los datos generales como sexo, raza y lugar de residencia de los animales aparecen en la Tabla 1.
Tabla 1 Frecuencia y proporción de la población canina seleccionada para el estudio de leishmaniasis visceral canina en tres distritos del departamento Caaguazú, Paraguay; 2017-2018
| Características | Frecuencia | Porcentaje (%) |
|---|---|---|
| Lugar de Residencia | ||
| Cnel. Oviedo | 131 | 40,4 |
| Caaguazú | 127 | 20,4 |
| San José | 66 | 39,2 |
| Raza | ||
| Mestiza | 291 | 39,2 |
| Otras razas | 33 | 10,2 |
| Sexo | ||
| Macho | 184 | 56,8 |
| Hembra | 140 | 43,2 |
| Total | 324 | 100 |
La prevalencia de seropositivos para leishmaniosis canina fue 4,9% (16/324). Las frecuencias de seropositividad (valores absolutos y relativos) obtenidas para cada distrito (Coronel Oviedo, San José y Caaguazú) (Figura 2).
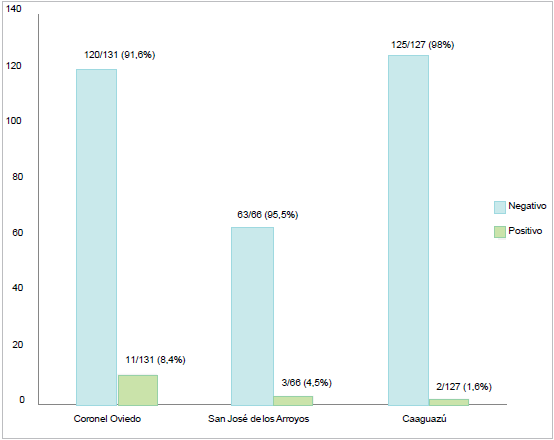
Referencia: Barra color negro = Frecuencia de perros positivos por distrito. Barra color gris = Frecuencia de perros negativos por distrito. Eje X= Distritos; Eje Y = No. de perros.
Figura 2 Prevalencia serológica de infección con leishmaniosis visceral canina de perros procedentes de tres distritos de Caaguazú, Paraguay. (2017-2018), utilizando el método inmunocromatográfico de tiras de rK39
Mediante la prueba de Chi2 (p=0,04) se encontraron diferencias significativas entre las poblaciones de perros estudiadas para los tres municipios al analizar los datos de seropositividad: 8,4% (11/131) para Coronel Oviedo; 4,5% (3/66) para San José, y 1,6% (2/127) para Caaguazú.
Por otra parte, mediante el estudio de frotis directo de muestras de ganglios, se obtuvo menor cantidad de canes positivos (4,3%; 14/324) y no se observaron diferencias significativas con la prueba de Chi2 (p>0,05) al comparar los municipios de residencia de los animales y los resultados positivos obtenidos por este método (Tabla 2).
Tabla 2 Prevalencia de leishmaniosis visceral canina de perros procedentes de tres distritos del departamento Caaguazú, Paraguay, mediante frotis directo de muestras de ganglios linfáticos (coloración Giemsa)
| Municipio | Perros (N) | Perros positivos (%) | Valor p |
|---|---|---|---|
| Cnel. Oviedo | 131 | 9 (6,8) | |
| Caaguazú | 127 | 3 (2,4) | 0,1* |
| San José | 66 | 2 (3,0) | |
| Total | 324 | 14(4,3) |
*Análisis con la prueba Chi2 para determinar asociación entre municipios e infección con Leishmania sp. El valor obtenido mediante la prueba no fue estadísticamente significativo (p>0.05).
La Tabla 3 muestra que las características de la pobla ción canina estudiada, como sexo, raza, edad y presencia o ausencia de signos clínicos, no fueron estadísticamente significativas (p>0,05) al buscar una asociación de estas con la ocurrencia de infección de los caninos (seroposi tividad para LVC).
Tabla 3 Diagnóstico de Infección con Leishmania sp. y factores asociados con la seropositividad en la población canina estudiada del departamento de Caaguazú, Paraguay (años 2017-2018)
| Parámetros | Perros positivos Nro. (%) | Perros negativos Nro. (%) | Nro. Total perros | Valor p |
|---|---|---|---|---|
| Raza | ||||
| Mestizo | 14 (4,8) | 277 (95,2) | 291 | |
| Caniche | 2 (11,1) | 16 (88,9) | 18 | |
| Pastor Alemán | 0 (0) | 3 (100) | 3 | 0,7* |
| Perdiguero | 0 (0) | 3 (100) | 3 | |
| Otras razas | 0 (0) | 9 (100) | 9 | |
| Edad | ||||
| < 2 años | 1 (1,2) | 85 (98,8) | 86 | |
| 2 a 4 años | 8 (5,7) | 133 (94,3) | 141 | |
| 5 a 9 años | 5 (6,3) | 75 (93,8) | 80 | 0,2* |
| > 10 años | 2 (11,8) | 15 (88,2) | 17 | |
| Sexo | ||||
| Hembra | 6 (4,3) | 134 (95,7) | 140 | |
| Macho | 10 (5,4) | 174 (94,6) | 184 | 0,4** |
| Signos Clínicos | ||||
| Sin signos | 10 (4,5) | 213 (95,5) | 223 | |
| Con signos | 6 (5,9) | 95 (94,1) | 101 | 0,3** |
| Total | 16 | 308 | 324 |
*Análisis de asociación entre variables mediante la prueba de Chi2 y ** análisis de asociación por prueba exacta de Fisher. Las asociaciones entre las variables raza, edad, sexo y presencia o ausencia de signos en los perros con la infección por leishmaniosis no resultaron en valores estadísticamente significativos (p>0,05).
Así mismo, la Tabla 3 evidencia que la población de estudio estuvo conformada en su mayoría por perros de raza mestiza (n=291), machos (n=184) y la edad más frecuente fue entre 2 y 4 años (n=141). En este rango de edad, el 5,7% de los animales resultaron ser seropositivos por rK39.
Respecto a las características clínicas presentes en los caninos, se determinó que los signos clínicos encontrados de forma más frecuente fueron: adelgazamiento, onicogrifosis y caída de pelo (alopecia). Estas características están presentes en 25% (4/16) de la población de los perros positivos. En la Tabla 4 se presentan los signos clínicos observados y la asociación de estos con la seropositividad de los animales.
Tabla 4 Análisis de las características clínicas consideradas para la asociación con la presencia de leishmaniosis visceral canina en 324 perros de tres municipios del departamento Caaguazú, 2017-2018
| Signos clínicos | Perros positivos | Perros negativos | Total perros | Valor p |
|---|---|---|---|---|
| Nro. (%) | Nro. (%) | Nro. (%) | ||
| Pérdida de peso | 4(1,2) | 22 (6,8) | 26 (8) | 0,03* |
| Sin pérdida de peso | 12 (3,7) | 286 (88,3) | 298 (92) | |
| Caída de pelos | 4 (1,2) | 66 (20,4) | 70(21,6) | 0,5 |
| Sin caída de pelos | 12 (3,7) | 242 (74,7) | 254(78,3) | |
| Conjuntivitis | 1(0,3) | 1(0,3) | 2(0,6) | 0,09 |
| Sin conjuntivitis | 15 (4,6) | 307(94,8) | 322(99) | |
| Apatía | 2 (0,6) | 5 (1,5) | 7(2,16) | 0,04* |
| Sin apatía | 14 (4,3) | 303(93,5) | 317(97,8) | |
| Onicogrifosis | 4 (1,2) | 16(4,9) | 20(6,2) | 0,01* |
| Sin onicogrifosis | 12(3,7) | 292(90,1) | 304(93,8) | |
| Úlceras cutáneas | 1(0,3) | 3(0,9) | 4(1,2) | 0,2 |
| Sin úlceras cutáneas | 15(4,6) | 305(94,1) | 320(98,7) | |
| Úlceras en la oreja | 0 (0) | 2 (0,6) | 2(0,6) | 0,9 |
| Sin úlceras en la oreja | 16(4,9) | 306 (94,4) | 322(99,3) |
*Análisis de asociación entre variables clínicas y seropositividad de caninos que resultaron en valores estadísticamente significativos, obtenidos mediante la prueba exacta de Fisher.
Otras características epidemiológicas de riesgo
Se identificaron otras características que pudieran estar relacionadas con el riesgo de transmisión de leishmaniosis obtenidas a partir de respuestas enfocadas hacia el cuidado de los perros. Se registró que entre las familias que poseen uno o más perros, existe un alto porcentaje (45%) de propietarios que no llevan a su perro al control veterinario y el 77,5% de los dueños de los canes admitió que nunca utilizó repelentes para protección canina. Entre los propietarios, 69% afirmó que sus perros salen a la calle y ya no son controlados por ellos, debido a que los caninos duermen fuera de la casa (85%). Por otra parte, 86% de la población de propietarios de los canes indicaron que, de forma frecuente, en la zona se ha observado presencia de perros sin dueños (callejeros) que circulan por el barrio y entran a sus viviendas. Se determinó que la migración de perros a partir de otros municipios no es una práctica frecuente en la zona y que eventualmente existen traslados de estos a otros lugares (6,9%).
DISCUSION
Hasta la actualidad, los estudios de LVC en Paraguay son escasos y fragmentados. Este trabajo proporcionó los primeros datos de un área reconocida, pero no publicada como endémica para LVC. Se han realizado estudios sobre la importancia del perro como reservorio de L. infantum con el objetivo de determinar la prevalencia de la infección en áreas endémicas y no endémicas.
La incidencia de LVC es alta en nuestro país a pesar de la disminución de casos a partir del 2017. En años anteriores, se ha reportado el aumento continuo de casos, llegando hasta 50% de canes infectados/año en áreas urbanizadas alrededor de la capital, según datos obtenidos por el Centro Antirrábico Nacional 17. Considerando que las áreas urbanizadas acceden más fácilmente a los servicios de atención y diagnóstico, se supone que existen subregistros y falta de notificaciones en las zonas del interior del país.
En nuestro estudio se halló 4,9% de seropositividad para LVC, lo cual implica un porcentaje de incidencia reducido frente a la seropositividad hallada de 28,4% en 41 776 sueros de caninos, provenientes de muestras remitidas de búsqueda activa e intervenciones de focos de casos humanos; esto, reportado entre 2005 y 2010 por el Centro Antirrábico Nacional del Ministerio de Salud 18.
En Coronel Oviedo se registró disminución de sero-positividad canina encontrada: en el 2015 fue del 20% y en 2017, del 12% (datos aún no publicados). En otro trabajo llevado a cabo en zonas urbanas del departamento Central (Limpio, Luque y Asunción), se reportó 10% de casos humanos e infección canina 19,13. Así mismo, se determinó seropositividad canina en 4,3% de 463 perros en un área fronteriza con Brasil y Argentina (datos no publicados), lo cual concuerda con nuestros resultados y coincide además con algunos reportes realizados para Brasil: en Guaratuba (6,2%) y en Belo Horizonte (5,2%) 20,21. La similitud en los datos corrobora la endemicidad de la parasitosis en el área, a pesar de que el estudio abarcó solo tres distritos de Caaguazú y la muestra fue tomada en un máximo de tres perros por vivienda.
A su vez, esta metodología ya fue utilizada por otros autores 22,23. El examen parasitológico directo presentó diferencias en resultados con respecto al recom-binante rK39, con un resultado de un número menor de caninos positivos para Coronel Oviedo por el método directo, confirmando así la baja sensibilidad de la técnica. En este sentido, otros autores han sugerido aplicar el método directo junto al examen físico del animal y otros métodos diagnósticos 24.
La circulación de la infección en la zona se puede relacionar con elementos que facilitan la transmisión, por ejemplo, condiciones adecuadas para el desarrollo de flebótomos, viviendas muy próximas a áreas boscosas y presencia de una gran cantidad de caninos en las comunidades, con o sin propietarios, los cuales mantienen los ciclos de transmisión en áreas infestadas. Marzochi et al. 25 mencionan que la enzootia canina precede a la ocurrencia de infecciones humanas y se ha estimado una relación de 20 casos caninos por cada caso humano 25.
Así mismo, la zona urbana de Coronel Oviedo presentó mayor infección canina (8,4%), probablemente relacionada con el desplazamiento de los pobladores y sus animales hacia áreas de cultivos e industrias de la madera ubicadas en la periferia de la ciudad. El desplazamiento de las personas acompañadas por sus perros para ir hasta el lugar de trabajo, es un factor que podría jugar un rol importante para el transporte y la transmisión de la infección desde áreas periurbanas hacia áreas urbanas, fenómeno observado también en otros países como Brasil 21.
Por otra parte, Nascimento et al. 26 argumentan que la urbanización de la infección es un hecho frecuente, debido a que el control parece ser más dificultoso en estas áreas. Nuestro estudio corrobora mayor frecuencia de perros infectados en el área más urbanizada, siendo estos resultados antagónicos con aquellos que afirman que los barrios rurales tienen la tasa de infección canina más alta 27. En nuestro trabajo, 95,2% de los perros no tenían ascendencia conocida y la infección en los mestizos fue de 4,8%; no se conoce aún con certeza qué mecanismos son responsables de la susceptibilidad o resistencia de los canes frente a la infección 28.
Algunas razas como Pitbull, Caniche y el grupo de Pastores parecen ser más susceptibles al desarrollo de la enfermedad 29, sin embargo nuestro estudio no pudo probar esta afirmación, pues la población canina estudiada era de raza mestiza en su mayoría. A pesar de esto, las pruebas estadísticas infieren que esta variable no estaría asociada con el riesgo de adquirir la infección. De igual manera, características como sexo, edad, presencia o no de signos clínicos no estuvieron asociadas con la seropositividad.
Con respecto a la variable sexo, nuestro estudio concuerda con un trabajo epidemiológico que no ha reportado predisposición del sexo como un factor de riesgo para la LVC 30, antagónico a aquellos que han reportado alto riesgo de la enfermedad en canes machos en relación a las hembras 31.
En cuanto a la edad, se encontró infección canina con más frecuencia en animales entre 2 y 4 años de edad, similar a un resultado previo realizado en la zona capitalina por Schinini et al. 32 y en Ñeembucú por López et al. 33; ambos estudios han argumentado que la edad promedio adecuada para la infección en caninos es de 4 años, pero este hecho no excluye que otras franjas etarias tengan la misma probabilidad de contraer al agente parasitario y sufrir LVC 34,35.
El diagnóstico de la LVC es complejo por las particularidades epidemiológicas y clínicas, especialmente en regiones endémicas, y por las limitaciones de la serología por la incapacidad de diferenciar entre enfermedad activa e infección asintomática 7. De los 16 perros encontrados positivos, solo 6 mostraron signos clínicos compatibles con leishmaniosis canina, lo que determinó que 62,5% de los perros encontrados infectados fueron asintomáticos.
En estudios previos con caninos de zonas endémicas de otros países, también se han observado bajos porcentajes de caninos positivos con síntomas, siendo mayor el porcentaje de los perros infectados que no mostraron evidencia clínica de la infección 21,34. Esto se explicaría por la naturaleza y el amplio espectro clínico que abarca la infección, que va desde casos asintomáticos hasta casos muy graves. Otro estudio ha reportado hasta 65% de animales positivos asintomáticos, lo que dificulta el diagnóstico de la enfermedad y facilita su transmisión entre la población canina y humana 24. Debido a esta característica, por la ausencia de lesiones aparentes, es importante que el diagnóstico serológico sea valorado cuando se encuentre asociado a la clínica y la epidemiología.
Los signos clínicos encontrados con mayor frecuencia en este trabajo (pérdida de peso, alopecias y crecimiento de uñas) mostraron asociación significativa con la sero-positividad, resultado que está acorde con un estudio que muestra que los signos observados con mayor frecuencia fueron onicogrifosis, caquexia y alopecia 36. Otros autores refieren que además de los signos mencionados como frecuentes, se halla el adelgazamiento del animal 37.
En este estudio se observaron otros signos clínicos en menor frecuencia tales como úlceras en orejas y piel, conjuntivitis, apatía y decaimiento general, incluso en perros sanos, lo cual denota las malas condiciones de mantenimiento del animal y la falta de atención médico-veterinaria oportuna. Esto fue manifestado por los mismos propietarios, quienes afirmaron nunca haber llevado a sus perros a un control, probablemente debido a las condiciones socioeconómicas reducidas observadas de la zona.
El cuidado oportuno de los animales por sus propietarios puede ser un método importante de prevención, si bien también se observó que el 77,5% de los pobladores no utilizan repelente para la protección canina. Vélez et al. 38 argumentan que la falta de utilización de métodos preventivos de insecticidas generalistas contra artrópodos es un factor de riesgo para la infección por L. infantum y está descrito que el uso de insecticidas tópicos en los perros ha reducido la incidencia de LVC 38.
En nuestro medio rural es común que los perros permanezcan fuera de las casas, incluso durante la noche y esto hace que el animal constantemente circule por las calles y sus alrededores, adquiriendo así mayor riesgo para la infección. Santos et al. 39 afirman que el entorno local y los factores de riesgo pueden variar de una región a otra y destaca el modo de vida de los animales como uno de los aspectos más importantes para adquirir la infección.
En este sentido, se puede pensar que en las áreas del interior del país se han mantenido los procesos desordenados de ocupación urbana que resultan en condiciones precarias y destrucción ambiental, pudiendo esta situación haber influenciado en una mayor distribución de la infección, aunado además a la condición socioeconómica observada entre niveles intermedios a bajos.
Otra característica encontrada es la falta de conocimiento de la zoonosis por parte de los habitantes, que nos lleva a pensar que por esta misma situación los dueños de los animales no acuden a un control veterinario de sus perros y, como consecuencia, existe escaso reporte de LVC en el departamento Caaguazú. En nuestro caso, la frecuencia de infección encontrada (4,9%) afirma la endemicidad de Leishmaniosis en el departamento, lo que hace necesario fortalecer la vigilancia epidemiológica y la búsqueda activa de casos de LVC en todos los distritos de Caaguazú.
Se recomienda, entonces, fomentar la investigación, la actualización de los trabajadores de salud en capacitaciones sobre leishmaniasis, la elaboración de mejores estrategias de control sanitario y de herramientas preventivas, considerando la poca estandarización de información de la enfermedad y las nuevas corrientes de pensamiento que van surgiendo para encarar las acciones profilácticas y terapéuticas más actuales ♣