Aproximadamente 37,9 millones de personas tenían VIH en el mundo a finales de 2018 1. En Colombia, para este mismo año, se registró una incidencia de 26,6 casos por 100 000 habitantes, la cual ha venido en aumento 2. Más del 90% de los pacientes con diagnóstico de VIH desarrollan alguna manifestación en piel durante el curso de la enfermedad; algunas de ellas pueden ser marcadoras del estado inmunológico del paciente 3 y afectar de forma significativa su calidad de vida 4.
Se han descrito las manifestaciones dermatológicas de pacientes con infección por VIH en diferentes regiones del mundo. Estas enfermedades varían de un país a otro, lo que puede atribuirse al clima, las patologías endémicas y los estándares de higiene, así como a factores sociales, económicos y culturales 5. Es el caso de las dermatosis infecciosas, en el que los estudios han registrado algunas variaciones geográficas. En una población de Estados Unidos, las infecciones más prevalentes fueron foliculitis y condilomas acuminados 6, mientras que al noroeste de África, en estudios realizados en Marruecos y Mauritania predominaron las infecciones por hongos dermatofitos 7,8 y en Turquía la infección cutánea más prevalente fue candidiasis oral 9.
Contamos con poca información acerca de cuáles condiciones mucocutáneas se presentan en la población con diagnóstico de infección por VIH en nuestro país 10, y no hay datos en población bogotana.
El objetivo de este estudio es describir los hallazgos en piel de pacientes adultos con diagnóstico de infección por VIH, atendidos por el servicio de dermatología en un centro de remisión para la atención de estos pacientes en la ciudad de Bogotá, así como sus características clínicas y sociodemográficas, según el conteo de linfocitos CD4+.
MÉTODOS
Se realizó un estudio observacional descriptivo, en el que se incluyeron pacientes adultos (con edad mayor o igual a 18 años) con diagnóstico de infección por VIH atendidos en el Hospital Universitario San Ignacio de Bogotá, Colombia, el cual cuenta con un programa de atención a pacientes con VIH desde el año 2014, con 941 pacientes vinculados actualmente (datos hasta el 28 de enero de 2019); por lo tanto, es considerado un centro de remisión para este grupo de pacientes.
Los pacientes fueron valorados por dermatología en cualquiera de los siguientes escenarios: 1) pacientes asintomáticos de la piel, remitidos a dermatología como parte de su evaluación inicial integral del programa de Infectología, 2) pacientes remitidos a consulta externa de dermatología por alguna lesión cutánea, 3) pacientes a quienes en el contexto de hospitalización o atención por servicio de urgencias se les solicitó interconsulta al servicio de dermatología. Se excluyeron pacientes que no contaran con un reporte de conteo de linfocitos CD4+ y carga viral tomados dentro de los 6 meses previos al momento de la valoración. El periodo de reclutamiento fue de 10 meses (de abril de 2019 a febrero de 2020). Dada la connotación del diagnóstico, se diligenció consentimiento informado para la participación en el estudio, aprobado por el comité de ética de la institución.
La recolección de los datos constó de 3 partes: 1) Se realizó un interrogatorio para obtener datos demográficos (edad, orientación sexual, estado civil, ocupación, escolaridad, tipo de aseguramiento en salud, dependencia económica) y antecedentes de exposición (tabaquismo activo, consumo de sustancias psicoactivas); 2) Un examen físico dermatológico completo por parte de un médico especialista en dermatología a partir del cual se registraron los hallazgos y diagnósticos definidos clínicamente (fototipo, xerosis, moluscos contagiosos, acné, dermatitis seborreica, pitiriasis versicolor, queratosis pilaris, condilomas genitales, condilomas perianales, herpes genital, herpes oral, candidiasis oral, herpes zoster, prurigo, escabiosis, urticaria, alopecia areata); condiciones infecciosas definidas por confirmación micro-biológica (sífilis, tiña ungueum) y diagnósticos tumorales malignos definidos por confirmación histopatológica (melanoma, carcinoma basocelular, carcinoma escamo-celular y sarcoma de Kaposi); 3) Se revisaron las historias clínicas para extraer datos de antecedentes médicos (hipotiroidismo, diabetes mellitus), terapia antirretroviral recibida y último conteo de linfocitos CD4+ y carga viral para VIH (tomado en el periodo de los 6 meses anteriores a la fecha de la valoración). La recolección y almacenamiento de los datos se hizo de forma sistemática utilizando la plataforma electrónica RedCap 11 del Hospital Universitario San Ignacio.
Para la presentación y análisis de los datos, los hallazgos en piel se dividieron en 4 grupos: a) Condiciones inflamatorias; b) Condiciones infecciosas; c) Condiciones neoplásicas; d) Otros. Para las variables cuantitativas continuas que cumplieron el supuesto de normalidad (prueba de Kolmogorov-Smirnov), se utilizó la media como medida de tendencia central y la desviación estándar como medida de dispersión. Para aquellas variables cuantitativas cuya distribución no fue normal se utilizó la mediana y los valores mínimos y máximos para la presentación de los datos. Las variables categóricas se presentaron en forma de tablas de frecuencias. La variable "conteo de linfocitos CD4 + " se categorizó en 3 grupos, según la clasificación del Centro para el Control y la Prevención de Enfermedades (CDC) de 1993 12. Para el procesamiento de los datos, se utilizó el paquete estadístico SPSS (Statistical Package for Social Sciences) versión 25.
RESULTADOS
De los 168 pacientes incluidos en este estudio, el 99,4% fueron reclutados en el contexto de valoración por dermatología en consulta ambulatoria. Las principales características sociodemográficas se presentan en la tabla 1, en donde cabe resaltar que la población estaba conformada en su mayoría por hombres (88,7%), en la cuarta década de la vida, que tienen sexo con hombres (77,4%), solteros (76,8%), con fototipos del II al IV (97%). El 71,4% de los pacientes reportó tener un título técnico o profesional.
Tabla 1 Características sociodemográficas y clínicas de pacientes VIH positivos
| Variable n (%) | n=168 |
|---|---|
| Sexo masculino, | 149 (88,7) |
| Edad años, media (DE) | 34 (11,2) |
| Orientación sexual a | |
| HSH | 108 (64,3) |
| HSM/MSH | 38 (22,6) |
| Bisexual | 22 (13,1) |
| Fototipo b | |
| I | 1 (0,6) |
| II | 35 (20,8) |
| III | 65 (38,7) |
| IV | 63 (37,5) |
| V | 4 (2,4) |
| Estado civil | |
| Soltero | 129 (76,8) |
| Unión libre | 24 (14,3) |
| Casado | 9 (5,4) |
| Divorciado | 4 (2,4) |
| Viudo | 2 (1,2) |
| Escolaridad a | |
| Ninguno | 1 (0,6) |
| Básica primaria | 8 (4,8) |
| Básica secundaria | 39 (23,2) |
| Técnico | 41 (24,4) |
| Profesional | 61 (36,3) |
| Postgrado | 18 (10,7) |
| Aseguramiento en salud | |
| Régimen contributivo | 164 (97,6) |
| Régimen subsidiado | 4 (2,4) |
| Antecedentes | |
| Consumo de cigarrillo c | 37 (22) |
| Consumo de sustancias psicoactivas c | 21 (12,5) |
| Hipotiroidismo | 5 (3) |
| Diabetes mellitus | 3 (1,8) |
a Referido por el paciente; b A partir de examen físico e interrogatorio por médico especialista en dermatología; c Consumo activo al momento de la valoración. Abreviaturas: DE, desviación estándar. HSH, hombres que tienen sexo con hombres. HSM, hombre que tiene sexo con mujeres. MSH, mujer que tiene sexo con hombres.
Con respecto al motivo por el cual los pacientes realizaron la prueba de VIH que llevó al diagnóstico, el 34,5% reportó haber realizado tamización asintomática y voluntaria, el 14,9% realizó la prueba por alteraciones gastrointestinales, el 13% por alteraciones en la piel, el 10,1% por pérdida de peso involuntaria, el 2% por fiebre sin foco y el 26% por otras causas.
El 94,6% de los pacientes se encontraba tomando terapia antirretroviral al momento de la evaluación, siendo Tenofovir + Emtricitabina + Efavirenz (44 pacientes), Emtricitabina + Tenofovir + Dolutegravir (22 pacientes) y Tenofovir + Emtricitabina + Darunavir + Ritonavir (21 pacientes) los esquemas de medicamentos encontrados con mayor frecuencia. En cuanto a los hallazgos paraclínicos, 77 pacientes (45,8%) tenían una carga viral para VIH indetectable y la mediana del conteo de linfocitos CD4+ fue de 343 (7 - 1949).
El 97,6% de los pacientes evaluados presentó al menos un hallazgo en la piel durante el examen físico dermatológico, con una mediana de 3 y rango de 9, para un total de 461 hallazgos (en 168 pacientes), de los cuales 43,8% fueron condiciones infecciosas, 35,4% condiciones inflamatorias, 4,1% condiciones tumorales y 16,7%, otros. Las diferencias según conteo de linfocitos CD4+ pueden verse en la Figura 1, en la cual se evidencia que las manifestaciones dermatológicas fueron más prevalentes en los pacientes con conteo de linfocitos CD4+, menor de 500. En los 3 grupos predominaron las manifestaciones infecciosas, seguidas de las inflamatorias.
La prevalencia de las diferentes infecciones encontradas según conteo de linfocitos CD4+ se muestra en la Tabla 2, con predominio de los patógenos virales, especialmente en el grupo de pacientes con conteo menor a 200 linfocitos CD4+ por mm3. De estas, las infecciones por virus del papiloma humano, en la presentación de condilomas perianales (25,6%), condilomas genitales (16,7%) y verrugas virales (11,3%), seguidas por los moluscos contagiosos (11,3%) fueron las más frecuentes.
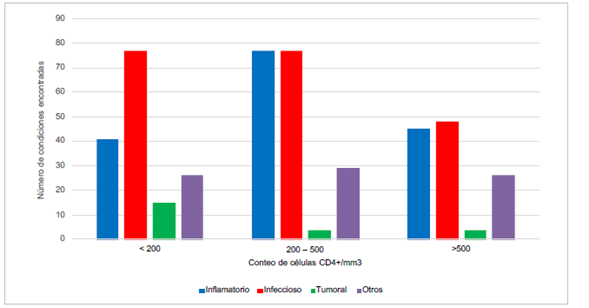
Figura 1 Clasificación de las 461 condiciones cutáneas encontradas en 168 pacientes, según grupos de clasificación del conteo de linfocitos T CD4+ del CDC de 1993 12
Tabla 2 Condiciones cutáneas infecciosas según el conteo de linfocitos CD4+ en pacientes VIH positivos
| Conteo de linfocitos CD4+/mm3 | ||||
|---|---|---|---|---|
| Total | < 200 | 200 - 500 | 500 | |
| Variable, n (%) | n=168 | n=47 | n=77 | n=44 |
| Infecciosas virales a | ||||
| Condilomas perianales | 43 (25,6) | 18 (38,3) | 17 (22,1) | 8 (18,2) |
| Condilomas genitales | 28 (16,7) | 14 (29,8) | 10 (13) | 4 (9,1) |
| Verrugas virales | 19 (11,3) | 5 (10,6) | 9 (11,7) | 5 (11, 4) |
| Moluscos contagiosos | 19 (11,3) | 12 (25,5) | 5 (6,5) | 2 (4,5) |
| Leucoplasia oral vellosa | 10 (6) | 6 (12,8) | 3 (3,9) | 1 (2,3) |
| Herpes Zoster | 2 (1,2) | 2 (4,3) | 0 (0) | 0 (0) |
| Herpes genital | 2 (1,2) | 1 (2,1) | 0 (0) | 1 (2,3) |
| Infecciosas fúngicas | ||||
| Tiña pedis a | 37 (22) | 8 (17) | 18 (23,4) | 11 (25) |
| Tiña ungueum clínica a | 21 (12,5) | 7 (14,9) | 6 (7,8) | 8 (18,2) |
| Pitiriasis versicolor a | 3 (1,8) | 1 (2,1) | 1 (1,3) | 1 (2,3) |
| Candidiasis oral a | 2 (1,2) | 1 (2,1) | 1 (1,3) | 0 (0) |
| Tiña ungueum microbiológica b | 1 (0,6) | 0 (0) | 0 (0) | 1 (2,3) |
| Infecciosas bacterianas | ||||
| Sífilis b | 6 (3,6) | 1 (2,1) | 2 (2,6) | 3 (6,8) |
| Foliculitis bacteriana a | 5 (3) | 0 (0) | 4 (5,2) | 1 (2,3) |
| Queratolisis punctataa | 2 (1,2) | 1 (2,1) | 0 (0) | 1 (2,3) |
| Infecciosas parasitarias | ||||
| Escabiosis a | 2 (1,2) | 0 (0) | 1 (1,3) | 1 (2,3) |
a Diagnóstico clínico a partir de examen físico por médico especialista en dermatología; b Diagnóstico confirmado por microbiología.
La Tabla 3 muestra las condiciones inflamatorias según conteo de linfocitos CD4+, siendo los hallazgos más prevalentes en este grupo dermatitis seborreica (44%) y acné (29,8%). La dermatitis seborreica tuvo una distribución similar en los 3 grupos, según el conteo de linfocitos CD4+, mientras el acné fue encontrado en mayor proporción en los pacientes con conteo de linfocitos CD4+ mayor de 200.
Tabla 3 Condiciones cutáneas inflamatorias según el conteo de linfocitos CD4+ en pacientes VIH positivos
| Conteo de células CD4/mm3 | ||||
|---|---|---|---|---|
| Total | < 200 | 200 - 500 | >500 | |
| Variable, n (%) | n = 168 | n = 47 | n = 77 | n = 44 |
| Dermatitis seborreica a | 74 (44) | 24 (51,1) | 32 (41,6) | 18 (40,9) |
| Acné a | 50 (29,8) | 6 (12,8) | 29 (37,7) | 15 (34,1) |
| Dermatitis de contacto a, b | 14 (8,3) | 4 (8,5) | 5 (6,5) | 5 (11,4) |
| Rosácea a | 4 (2,4) | 3 (6,4) | 1 (1,3) | 0 (0) |
| Prurigo a | 3 (1,8) | 2 (4,3) | 1 (1,3) | 0 (0) |
| Urticaria crónica a | 3 (1,8) | 0 (0) | 2 (2,6) | 1 (2,3) |
| Foliculitis eosinofílica c | 3 (1,8) | 1 (2,1) | 2 (2,6) | 0 (0) |
| Psoriasis c | 2 (1,2) | 1 (2,1) | 1 (1,3) | 0 (0) |
| Alopecia areata a | 2 (1,2) | 0 (0) | 2 (2,6) | 0 (0) |
| Efluvio telógeno a | 2 (1,2) | 0 (0) | 1 (1,3) | 1 (2,3) |
| Eczema dishidrótico a | 2 (1,2) | 0 (0) | 0 (0) | 2 (4,5) |
| Dermatitis periorificial a | 2 (1,2) | 0 (0) | 1 (1,3) | 1 (2,3) |
| Morfea c | 1 (0,6) | 0 (0) | 0 (0) | 1 (2,3) |
| Reacción cutánea adversa a medicamentos e | 1 (0,6) | 0 (0) | 0 (0) | 1 (2,3) |
a Diagnóstico clínico a partir de examen físico por médico especialista en dermatología; b Dermatitis de contacto alérgica o irritativa; c Diagnóstico confirmado por histopatología; d Reacción cutánea adversa a medicamentos leve, sin compromiso sistémico.
En cuanto a las condiciones neoplásicas mostradas en la Tabla 4, el sarcoma de Kaposi fue el tumor maligno más frecuente, presente en el 3% de los pacientes.
Tabla 4 Condiciones cutáneas neoplásicas según el conteo de linfocitos CD4+ en pacientes VIH positivos
| Conteo de células CD4/mm3 | ||||
|---|---|---|---|---|
| < 200 | 200 - 500 | >500 | ||
| Variable, n (%) | n = 168 | n = 47 | n = 77 | n = 44 |
| Neoplasias benignas a | ||||
| Queratosis seborreicas | 3 (1,8) | 0 | 2 (2,6) | 1 (2,3) |
| Acrocordones | 2 (1,2) | 0 | 2 (2,6) | 0 |
| Neoplasias malignas b | ||||
| Sarcoma de Kaposi | 5 (3) | 2 (4,3) | 2 (2,6) | 1 (2,3) |
| Papulosis bowenoide | 3 (1,8) | 2 (4,3) | 0 | 1 (2,3) |
| Carcinoma basocelular | 1 (0,6) | 0 | 0 | 1 (2,3) |
| Melanoma | 1 (0,6) | 0 | 1 (1,3) | 0 |
| Otras neoplasias | ||||
| Queratosis actínicas a | 2 (1,2) | 0 | 0 | 2 (4,5) |
| Nevus displásico b | 2 (1,2) | 2 (4,3) | 0 | 0 |
a Diagnóstico clínico a partir de examen físico por médico especialista en dermatología; b Diagnóstico confirmado por histopatología.
En el 26,8% de los pacientes se encontró xerosis y solo el 6% de pacientes refirieron prurito al momento de la valoración (Tabla 5).
Tabla 5 Otras condiciones cutáneas según el conteo de células CD4
| Conteo de células CD4/mm3 | ||||
|---|---|---|---|---|
| < 200 | 200 - 500 | >500 | ||
| Variable, n (%) | n = 168 | n = 47 | n = 77 | n = 44 |
| Xerosis | 45 (26,8) | 17 (36,2) | 15 (19,5) | 13 (29,5) |
| Queratosis pilaris | 21 (12,5) | 2 (4,3) | 12 (15,6) | 7 (15,9) |
| Prurito | 10 (6) | 5 (10,6) | 2 (2,6) | 3 (6,8) |
| Melasma | 1 (0,6) | 0 | 0 | 1 (2,3) |
Diagnóstico clínico a partir de examen físico por médico especialista en dermatología.
DISCUSIÓN
Este es el primer estudio realizado en la ciudad de Bogotá que describe los hallazgos en piel de pacientes adultos con diagnóstico de infección por VIH, así como sus características clínicas y sociodemográficas, según el conteo de linfocitos CD4+. La población evaluada estuvo conformada en su mayoría por hombres, adultos jóvenes, solteros, que tienen sexo con hombres (de orientación homosexual y bisexual). En Colombia, la población masculina representa el 81,4 % de los casos de VIH 2, lo cual difiere de las estadísticas globales, en donde más de la mitad de todas las personas infectadas en el mundo son mujeres y más del 80% de las infecciones ocurren por transmisión heterosexual 13. Estas estadísticas reflejan la situación en el África subsahariana, que alberga a la mayoría de la población mundial infectada por el VIH y donde la transmisión heterosexual es el principal contribuyente a la epidemia 14.
Más de un tercio de los pacientes realizó la prueba de VIH que llevó al diagnóstico por tamización voluntaria en el contexto asintomático, lo cual probablemente está relacionado con que este grupo de pacientes en su mayoría cuenta con un título técnico o profesional, que les permite tener mejor acceso a información en salud y, por lo tanto, la oportunidad de detectar tempranamente la enfermedad. Cabe resaltar también que alrededor de 1 de cada 10 pacientes evaluados llegaron al diagnóstico de VIH por cambios presentados en la piel, lo que refleja la importancia del estudio cuidadoso de las dermatosis que pueden sugerir una infección por VIH aún no detectada.
Cerca del 95% de los pacientes se encontraba recibiendo manejo con terapia antirretroviral al momento de la valoración, con buen control virológico (carga viral indetectable) en la mitad de los casos, y conteo de linfocitos CD4+ superior a 500 en cerca de un tercio de los pacientes, lo cual se debe probablemente a que se encontraban dentro de un programa de atención integral para pacientes VIH positivos. Esto, a su vez, implica que el perfil de manifestaciones dermatológicas se acerca más a lo encontrado en inmunocompetentes, a diferencia de los primeros estudios similares publicados en la literatura entre los años 1980 y 2000, en los cuales los pacientes no habían iniciado tratamiento o no habían logrado control inmunovirológico 15-17.
En el contexto de la infección por VIH, las enfermedades de la piel pueden ocurrir con manifestaciones clínicas de topografía inusual, mayor gravedad y resistencia terapéutica 7. En estudios previos se han reportado prevalencias de hallazgos en piel en pacientes con diagnóstico de VIH entre 33 y 95% 18,19; en nuestro estudio, la prevalencia fue de 97,4%, lo cual puede ser explicado porque la mayoría de pacientes fueron remitidos a nuestro servicio por alguna manifestación en la piel y menos del 5% estaban asintomáticos.
Encontramos xerosis en cerca de 1 de cada 4 pacientes, similar al 20% de prevalencia reportada en estudios previos 7,20. Se ha sugerido que su patogénesis incluye cambios en la microcirculación, en la producción de sudor, función del estrato córneo 21 y formación del factor humectante natural en la piel 22. En la mayoría de los casos, la xerosis se acompaña de prurito, lo cual puede afectar de forma importante la calidad de vida 23. Sin embargo, nos llama la atención que menos del 10 % de los pacientes de nuestro estudio lo reportaron, siendo inferior a los resultados informados por Xu (20%) 24, Blanes (31%) 25 y Kaushik (45%) 4.
En cuanto a las patologías agrupadas según su origen, las infecciones cutáneas fueron el hallazgos más frecuente, así como se ha reportado en otros estudios realizados en Europa, África y América del Norte 7,15; y de estas, las infecciones virales fueron las más prevalentes. Esto puede ser explicado por la disminución del conteo de linfocitos T CD4+ y por el cambio hacia un perfil de citoquinas Th2 de los pacientes VIH positivos 20. Además, estos pacientes presentan una marcada disminución en el número y función de las células de Langerhans, linfocitos T CD4+, células natural killer, macrófagos y monocitos 26.
La frecuencia de infección por virus del papiloma humano (VPH) clínicamente evidente, específicamente condilomas perianales (25,6%) y genitales (16,7%) fue similar a la reportada en India 27, Estados Unidos 6,28, España 29 y Brasil 30, siendo su prevalencia en el grupo de pacientes con conteo de linfocitos CD4+ menor a 200, cerca de 5 veces la encontrada en los pacientes con más de 500 linfocitos CD4+/mm3. Mientras que en estudios realizados en África, los condilomas no fueron la infección predominante 31.
En la era de terapia antirretroviral, la infección anogenital por el VPH ha tomado importancia por varios motivos: su alta prevalencia en pacientes VIH positivos 32, su presentación clínica de difícil tratamiento 33 y su relación con el carcinoma escamocelular 29. Se han postulado varios mecanismos que explican la relación entre la infección por VPH y el VIH: la atenuación de las respuestas mediadas por células presentadoras de antígenos, la expresión aberrante de citocinas (interleucina 6) que modulan la expresión del gen del VPH, una mayor expresión de factores de crecimiento y efectos directos de Tat de VIH-1, que potencian la expresión de los oncogenes E6 y E7 del VPH 34. Además, la inmunodeficiencia crónica parece proporcionar un entorno óptimo para el desarrollo de displasia anogenital asociada al VPH 35.
Por consiguiente, el hecho de que aproximadamente 1 de cada 4 pacientes evaluados en nuestro estudio presentara condilomas perianales nos invita a implementar tamización de rutina 36,37; incluso, si el paciente refiere conductas sexuales seguras, dado que no es posible establecer que se trate de un contagio reciente, ya que el VIH altera el aclaramiento de la infección por VPH 38-40).
En nuestra población no fue tan frecuente la presentación de otros virus como herpes zoster, citomegalovirus o leucoplasia oral vellosa. Las infecciones fúngicas más frecuentes fueron la tiña peáis y ungueum, sin clara diferencia según los grupos de conteo de linfocitos T CD4+. La severidad y la alta variabilidad en la presentación clínica de la infección por dermatofitos son más comunes en el VIH 41. No se observaron casos de criptococosis o histoplasmosis, y la frecuencia de candidiasis oral fue baja, lo cual se debe muy probablemente a que la mayoría de nuestros pacientes tenían un conteo de linfocitos T CD4+ mayor de 200 y fueron evaluados en el contexto de consulta externa.
Las infecciones bacterianas más frecuentemente encontradas en este grupo de pacientes fueron sífilis y foliculitis, similar a lo reportado en población estadounidense 6,20.
Con respecto a las dermatosis inflamatorias, estas fueron más frecuentes en pacientes con más de 200 linfocitos T CD4+, como lo muestra la Figura 1, lo cual podría estar relacionado con un mejor control inmunológico y, por lo tanto, la posibilidad de hacer una respuesta inflamatoria.
Las patologías inflamatorias encontradas más prevalentemente fueron la dermatitis seborreica y el acné. La dermatitis seborreica se encontró en cerca de la mitad de los pacientes, sin diferencias aparentes por conteo de linfocitos T CD4+, mientras que en la población general se ha reportado su prevalencia en 3% al 10% 42,43. La mayor frecuencia de dermatitis seborreica en pacientes con infección por VIH se ha explicado por alteraciones en el microbioma de la piel 44, específicamente la presencia de mayores cantidades de Malassezia 45, así como la mayor proliferación de queratinocitos y una alteración en su diferenciación 46,47.
La prevalencia de acné en pacientes con más de 500 linfocitos T CD4+ fue de cerca de 3 veces la del grupo con conteos bajos (menor de 200), lo cual podría incluso estar relacionado con la reconstitución inmune posterior al inicio de la terapia antirretroviral, como se ha planteado en estudios previos 48. A diferencia de estudios realizados principalmente en África 7, el prurigo se encontró en nuestro estudio en muy pocos casos.
Como era de esperarse, y en relación con lo descrito en otros estudios, las neoplasias fueron más frecuentes en la población con conteo linfocitos T CD4+ inferior a 200 49.
Conocer las patologías cutáneas que se presentan en pacientes con infección por VIH permite identificar de forma correcta grupos de riesgo específicos para ofrecer una atención pertinente y mejor informada.
El perfil de hallazgos en piel de pacientes VIH positivos en nuestra institución se asemeja a lo reportado en algunas poblaciones norteamericanas, en las cuales se ha logrado buen control inmunovirológico de la enfermedad, lo cual puede ser consecuencia del acceso que tienen algunos pacientes en la capital de nuestro país a un adecuado seguimiento clínico e inicio oportuno de terapia antirretroviral en centros de atención integral.
La alta prevalencia de condilomas anogenitales en la población estudiada nos invita a implementar estrategias de tamización de rutina para VPH, así como de educación en otras infecciones de transmisión sexual en este grupo de pacientes.
Nuestro estudio es la primera aproximación descrita al perfil de manifestaciones cutáneas en la población VIH positiva de Bogotá, con resultados muy similares a los encontrados por Gaviria et ál. en la ciudad de Medellín 50. Una gran fortaleza es la descripción de una población grande (más de 150 pacientes). Consideramos que una gran limitación de nuestros resultados fue el bajo número individual de hallazgos por patología en algunos casos, lo que no permite hacer comparaciones al interior de cada enfermedad. Estudios multicéntricos y prospectivos ayudarán a tener una mejor aproximación del comportamiento de estos pacientes en Colombia y América Latina ♣














