Introducción
En este artículo de revisión se presenta una breve reseña de la historia de moléculas tipo escuaramida (estructura 1 de la figura 1), nombre sistemático es 3.4-diaminociclobut-3-en-1.2-diona, y su aplicación como organocatalizadores en síntesis asimétrica. Estas moléculas son derivados del ácido escuárico (estructura 2 de la figura 1). La síntesis del ácido escuárico fue reportada por primera vez por el grupo de investigación de Cohen 1959 citado por Thorpe, 1968.

Fuente: elaboración propia de los autores.
Figura 1 Escuaramida (compuesto 1) y ácido escuárico (compuesto 2).
En 1968 Thorpe reportó la síntesis de algunos escuaramidas y los espectros de RMN-1H de estas. Desde esa fecha hubo un vacío bibliográfico hasta 1992, con el trabajo de Frauenhoff y colaboradores, el cual informó del uso de este tipo de compuestos como ligantes en química de coordinación.
A lo largo de los años, han surgido numerosas aplicaciones y estudios teóricos, debido a las inusuales propiedades fisicoquímicas de estos derivados (Ian Storer, Aciro y Jones, 2011; Quiñonero, Frontera, Ballesteros y Deyà 2000). Además, en el año 2009, resurgió el interés por este tipo de moléculas en el área de la organocatálisis. Para el mes de noviembre de 2017 se encontraron 75 artículos con la palabra clave escuaramida, siendo China y España los principales países con reportes sobre este tema. (Scopus, 2017). En este artículo de revisión, primero se abordarán los aspectos relacionados con la síntesis de escuaramidas y, luego, en un segundo apartado, se tratará el papel de estos compuestos como organocatalizadores.
Síntesis de escuaramidas
El precursor de la escuaramida como lo conocemos hoy en día es el di-cetociclobuten- diol (3.4-dihidroxiciclobut-3-en-1.2-diona), también conocido como ácido escuárico, (estructura 2 de la figura 1). Este fue preparado por primera vez en 1959 por Cohen, Lacher y Park, mediante la hidrólisis del 3.3-dicloro-1.2.4.4-tetrafluorociclobut-1-eno. (Cohen, Lacher y Park, 1959)
La mayoría de los derivados de las escuaramidas son sintetizados a partir de la 3.4-dihidroxciclobut-3-en-1.2-diona (Ian Storer et al., 2011; Kumar et al., 2012; Muthyala, Subramaniam y Todaro, 2004). A continuación, se muestran algunos ejemplos de reacciones para acceder a las escuaramidas. En 1966, Cohen y colaboradores reportaron por primera vez la síntesis de la escuaramida con rendimientos de 75% y 87% sucesivamente a partir del escuarato de dimetilo (figura 2).
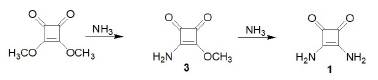
Fuente: modificado de Cohen (1965).
Figura 2 Síntesis de escuaramida a partir del escuarato de dimetilo.
Desde ese año no se había profundizado en las aplicaciones de la escuaramida como tal, ya que inicialmente el énfasis estuvo dirigido a la comprensión estructural y la dinámica molecular del anillo de cuatro miembros de los derivados del ácido escuárico (Cohen y Cohen, 1966) debido a la geometría molecular que presentan este tipo de compuestos.
Posteriormente en el año de 1976, Eggerding y West informaron sobre una serie de derivados de mono-tioescuaratos y los iones de 1.2-ditioescuaratos y sus correspondientes derivados. En uno de los pasos de síntesis se describió la reacción de los compuestos 7a y 7b (representados en la figura 3) con 1 equivalente de dimetilamina que provocó solamente el desplazamiento de los grupos etoxi, lo que proporcionó la serie de 3-dimetilamino-4-alquiltiociclobutenodionas (Eggerding y West, 1976) con un rendimiento de hasta un 70%.
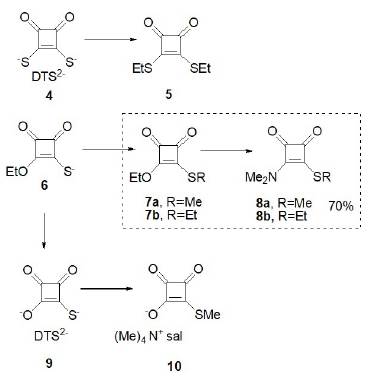
Fuente: modificado de Eggerdin y West (1976).
Figura 3 Síntesis de mono y tioescuaratos y derivados.
La aplicabilidad de las escuaramidas no era tan relevante, puesto que, como se mencionó, tuvieron que pasar alrededor de 20 años para que se realizara un nuevo estudio de este tipo de estructuras. Ya en 1995, Morley, realizó estudios teóricos sobre la estructura electrónica y propiedades no lineales de la escuaramida (Morley, 1995).
Al año siguiente, en 1996, Tomàs et al sintetizaron otra batería de derivados de escuaramida, esto con el fin de estudiar sus propiedades ácido-base y, así, poder corroborar información teórica acerca de su papel en la formación en enlaces por puentes de hidrógeno en la estabilización de complejos (figura 4). Con esto, se dio pauta a muchas aplicaciones con derivados de escuaramidas.
Fue cinco años más tarde, en el 2001, que Prohens et al reportaron la síntesis de derivados de escuaramida con la finalidad de determinar sus parámetros termodinámicos (las estructuras se muestran en la figura 5). A partir de este estudio, los autores concluyeron que la capacidad para la formación de enlaces por puentes de hidrógeno puede modularse en las escuaramidas por la sustitución de grupos hidroxilo por grupos amino, además, que esta propiedad depende del tipo de solvente empleado.
En el 2002, Liu, Lam, Fowler y Lauher trabajaron un derivado de escuaramida (figura 6), que prepararon fácilmente mezclando en proporciones estequiométricas escuarato de dietilo con 4-aminometilpiridina.
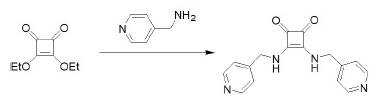
Fuente: modificado de Liu et al. (2002).
Figura 6 Síntesis de un derivado de escuaramida a partir de escuarato de dietilo y 4-aminometilpiridina.
Estos autores encontraron que esta escuaramida tiene características muy peculiares, dado que se puede emplear una estrategia de co-cristalización para la ingeniería de cristalización. En esta, cada molécula posee una funcionalidad de enlace por puente de hidrógeno (figura 7) que conduce a la formación de una red con una distancia repetida.
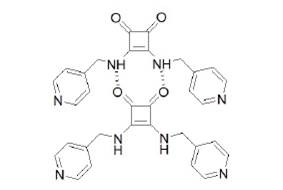
Fuente: modificado de Liu et al. (2002).
Figura 7 Interacciones por puente de hidrógeno que permite la formación de una red cristalina a partir del derivado de escuaramida.
En el 2005, Frontera y colaboradores reportaron una escuaramida para cuya síntesis se emplearon dos etapas. Como primera etapa realizaron la condensación de escuarato de dietilo y 9-(aminometil) antraceno, esto dio como resultado el intermediario el éster de escuaramida. Seguido a ello, llevaron a cabo una condensación con 2-(aminometil)-8-corona-6 (figura 8) para llegar al compuesto deseado con un rendimiento del 52%.
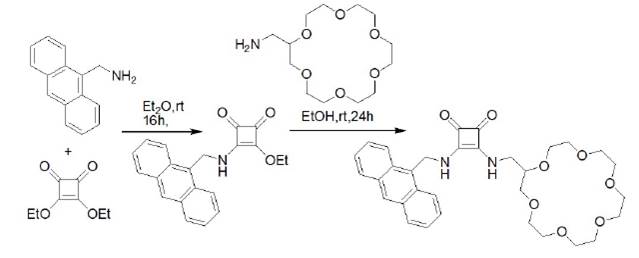
Fuente: modificado de Frontera et al. (2005)
Figura 8 Síntesis de derivado de escuaramida que incluye en su estructura a un sistema de antraceno.
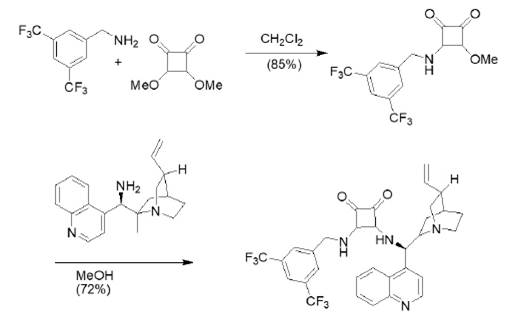
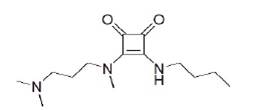
Por otro lado, en el año 2008, Malerich, Hagihara, y Rawal reportaron un derivado de escuaramida bifuncionalizada con sustituyentes quirales (figura 9); ellos realizaron una reacción de sustitución doble para la obtención del catalizador.
Las escuaramidas como organocataliza dores
La síntesis asimétrica consiste en la transformación de un sustrato aquiral en un producto quiral, mediante la generación de uno o más centros estereogénicos con quiralidad definida. Esta área de la química orgánica está presente en los grupos de investigación de hoy en día como una consecuencia de la tragedia de la talidomida, medicamento que fue lanzado en la década de los sesenta para el tratamiento de los síntomas del embarazo, como ansiedad, insomnio y náuseas matutinas. Desafortunadamente, este fue comercializado como una mezcla racémica, pero solo uno de los enantiómeros presentaba la actividad farmacológica deseada, mientras que el otro presentaba efectos teratogénicos. Esto desencadenó el nacimiento de gran número de niños con malformaciones por los efectos nocivos de esta sustancia. A raíz de ello, se enfatizó el desarrollo de procesos de síntesis y separación que llevaran a la obtención de compuestos enantioméricamente puros (Nguyen He y Pham-Huy, 2006).
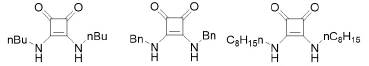
Actualmente, existen diversas estrategias de síntesis que llevan a la obtención de compuestos ópticamente puros. Con este fin, en los últimos años, la organocatálisis asimétrica se ha ido posicionando cada vez más como una alternativa viable. Esto ha provocado que, en la actualidad, las escuaramidas estén siendo reconocidas como agentes potenciales para inducir quiralidad en una reacción química, y por poseer dentro de su estructura (figura 10) tanto sitios donadores como receptores para la formación de enlaces por puentes de hidrógeno ( Alemán, Parra, Jiang, y Jørgensen, 2011; Guo y Wong, 2017; Quiñonero et al, 2000).
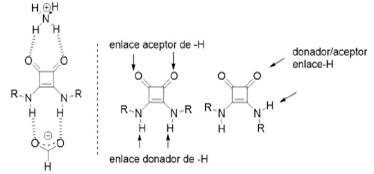
Fuente: Alemán et al. (2011)
Figura 10 Dualidad en la unión bidimensional e hidrogénica de las esquaramidas.
De esta manera, las escuaramidas se comparan en su comportamiento químico con las amidas, ureas y tioureas ya que en todas ellas se encuentran al mismo tiempo sitios moleculares con carácter donador y aceptor de enlaces por puentes de hidrógeno. (Alemán et al., 2011; Quiñonero et al., 2000). Es decir, son capaces de formar cuatro enlaces por puentes de hidrógeno (Ian Storer et al., 2011). Este gran conjunto de catalizadores asimétricos que se caracterizan por la posibilidad de generar puentes de hidrógeno para estabilizar intermediarios de reacción han sido objeto de numerosas aplicaciones, que han crecido de forma explosiva en la última década (Malerich et al, 2008). Aunque en el año de 1977, Wynberg y colaboradores presentaron un aporte importante en el campo de la organocatálisis, vía la formación de enlaces por puentes de hidrógeno (Guo y Wong, 2017; Helder, Arends, Bolt, Hiemstra y Wynberg., 1977).
Un aspecto a considerar en el diseño de nuevos organocatalizadores es el tipo de interacción entre éste y el sustrato, porque la activación mediante puentes de hidrógeno ha despertado el interés de diversos grupos de investigación. Se ha postulado que el papel de este tipo de catalizadores es mediante la activación no covalente que promueven los sitios del catalizador que se comportan como bases de Bröönsted al funcionar como aceptoras de protones en interacciones del tipo del puente de hidrógeno. De manera particular, los organocatalizadores del tipo escuaramida presentan claramente estos tipos de interacciones (Alemán y Cabrera, 2013; Alemán et al, 2011).
En la década pasada, ureas, tioureas, dioles y ácidos fosfóricos quirales dominaban el campo de la inducción mediante la formación de puentes de hidrógeno, (Qian et al, 2010). Sin embargo, hoy en día una serie de catalizadores a base de escuaramida se han desarrollado y aplicado con éxito en varias reacciones asimétricas (Malerich et al, 2008; Qian et al, 2010; Yang y Du, 2010) como: la reacción de Friedel-Crafts (Qian et al, 2010); la α-aminación de compuestos 1.3-dicarbonílicos con nitroalquenos (Konishi, Lam, Malerich y Rawal, 2010) y la adición de Michael enantioselectiva (Malerich et al, 2008; Xu et al, 2010; Zhu et al, 2010).
En 2010, Qian y colaboradores demostraron que las escuaramidas quirales son catalizadores altamente eficaces para la reacción enantioselectiva de Friedel-Crafts de indoles con iminas, Qian reportó excelentes rendimientos (75-96%) y buenos excesos enantioméricos (81-96%).
Tabla 1 Reacción de Friedel-Crafts enantioselectiva de indoles con N-tosiliminas catalizada por escuaramida.
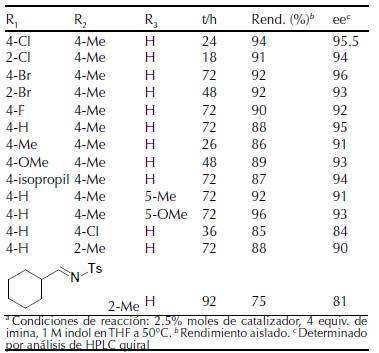
Fuente: Qian et al. (2010).
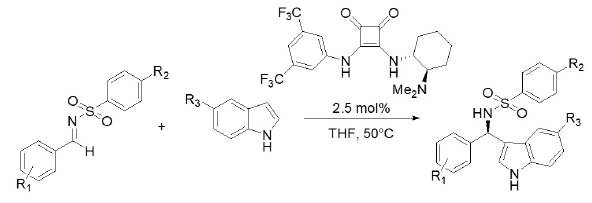
Fuente: modificado de Qian et al. (2010).
Figura 11 Reacción enantioselectiva de Friedel-Crafts de indoles con iminas.
Fuente: modificado de Konishi et al. (2010).
Figura 12 α-aminación enantioselectiva de compuestos 1.3-dicarbonilicos.
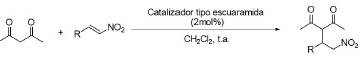
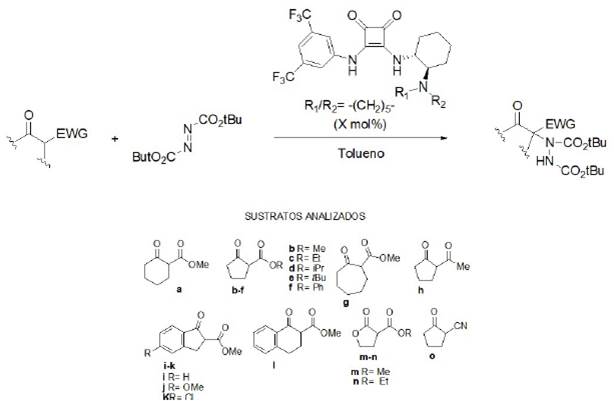
La adición de Michael asimétrica se ha convertido en una potente y eficiente herramienta para la formación de enlaces C-C en síntesis orgánica. En 2012, Kasaplar, Riente, Hartmann y Pericàs llevaron a cabo la reacción asimétrica de adición de Michael de compuestos 1.3-dicarbonílicos a β-nitroestirenos con buenos rendimientos y excelentes enantioselectividades. Utilizaron una escuaramida quiral inmovilizada covalentemente en una resina de poliestireno (tipo Merrifield), esto se muestra la estructura del catalizador en la figura 13, con el que reportaron mejores excesos enantioméricos.
Posteriormente, los autores realizaron la evaluación del alcance de la reacción con β-nitroestirenos diversamente sustituidos, y llevaron a cabo la reacción a temperatura ambiente (figura 13). Los resultados obtenidos con los compuestos probados se resumen en la tabla 2 (Kasaplar et al, 2012).
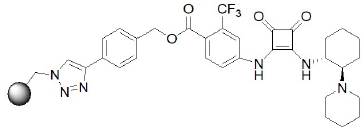
Fuente: modificado de Kasaplar et al. (2012).
Figura 13 Catalizador derivado de escuaramida soportada en resina tipo Merrifield
Tabla 2 Resultados de la adición de sistemas dicarbonílicos a nitroestirenos empleando el catalizador de escuaramida soportado en resina tipo Merrifield.
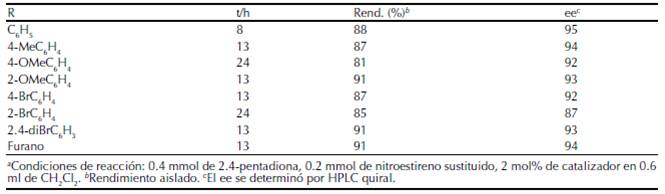
Fuente: modificado de Kasaplar et al. (2012).
En 2015, Chen et al desarrollaron una reacción altamente enantioselectiva de Michael en cascada con un proceso de ciclación empleando 3-hidroxioxindoles/3-aminooxindoles con α,β−fosfonatos de acilo insaturados catalizada por derivados de escuaramida (la figura 15) Desarrollaron una amplia gama de compuestos espirocíclicos con rendimientos, que van de moderados a excelentes y de buenos a excelentes diastereo- y enantioselectividad (tabla 3).
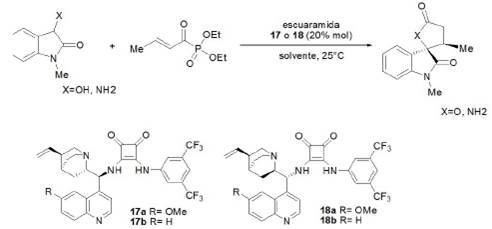
Fuente: modificado de Chen et al. (2015).
Figura 15 Ciclación de 3-hidroxioxindoles y 3-aminooxindoles con α,β-fosfonatos de acilo insaturados catalizada por derivados de escuaramida.
Tabla 3 Condiciones de optimización para la obtención de espirocompuestos a partir de 3-hidroxioxindoles/3-aminooxindoles con α,β-fosfonatos.
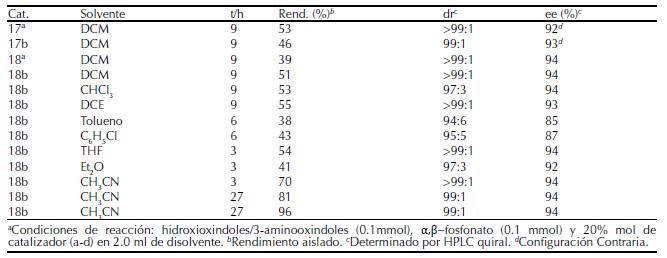
Fuente: Chen et al. (2015).
De igual modo, se ha estudiado el potencial biológico de este tipo de derivados. En 2016, se reportó que tienen propiedades biológicas como antiespasmódicos e inhibidores de micobacterias (Ribeiro et al., 2016; Tantry et al., 2017), también que poseen propiedades antiinflamatorias (Busch-Petersen, 2006). En el año 2014, Olmo y colaboradores sintetizaron un derivado de escuaramida (figura 16), con resultados promisorios para el tratamiento de la enfermedad de Chagas (Olmo et al., 2014).
Fuente: modificado de Olmo et al. (2014)
Figura 16 Derivado de escuaramida con potencial para el tratamiento de la enfermedad de Chagas
En el 2016, Rudd y colaboradores reportaron la síntesis de derivados del éster de escuaramida, que puede utilizarse para reacciones de bioconjugación eficaces para anticuerpos y proteínas (Rudd et al, 2016).
Conclusiones
Inicialmente, las escuaramidas fueron objeto de atención dada sus propiedades estructurales, tal como la rigidez del sistema cíclico, la relativa facilidad de interconversión en su funcionalización y las posibilidades de contar con sitios tanto aceptores como donadores en interacciones del tipo de los puentes de hidrógeno. Posteriormente, se añadieron a esta comprensión básica de un sistema estructuralmente interesante estrategias de aplicación enfocadas al uso de las escuaramidas como agentes de inducción de la quiralidad en secuencias de síntesis asimétrica, en las que se emplea como organocatalizadores quirales. Este es un ejemplo claro de cómo la contribución de un conocimiento básico sobre la estructura molecular permite el desarrollo de aplicaciones exitosas, en campos estratégicos de la ciencia. En la actualidad, se reconoce a la organocatálisis como un campo de acción de vanguardia en la síntesis asimétrica y, dentro de este campo, las escuaramidas han mostrado su eficiencia al aplicarse en nuevas reacciones enantioselectivas. Asimismo, al considerar su papel en la activación de electrófilos por la formación de enlaces tipo puente de hidrógeno.