Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Perspectivas en Nutrición Humana
Print version ISSN 0124-4108
Perspect Nut Hum vol.10 no.2 Medellín July/Dec. 2008
INVESTIGACIÓN
Respuesta inflamatoria en niños con desnutrición aguda grave y anemia
Inflammatory response in children with severe acute malnutrition and anemia
Claudia M. Velásquez Rodríguez1; Carolina Navarro B.2; Ángel Gonzaléz M.3;
1Grupo de Investigación en Alimentación y Nutrición Humana, Escuela de Nutrición y Dietética, Universidad de Antioquia claver@pijaos.udea.edu.co
2Estudiante de Microbiología, Grupo de Hemopatología Molecular
3Grupo de Hemopatología Molecular, Escuela de Microbiología, Universidad de Antioquia
Artículo recibido: 6 de agosto de 2008
Aceptado: 10 de diciembre de 2008
Resumen
Introducción: El manejo de la infección todavía es un reto en el tratamiento del desnutrido grave porque la inmunosupresión y la anemia concomitante comprometen la respuesta inflamatoria. Objetivo: Comparar la respuesta inflamatoria entre niños con desnutrición aguda grave tipo marasmo y kwashiorkor y niños eutróficos con y sin anemia (grupos control), mediante la medición de los niveles de proteína C reactiva (PCR) y de las citocinas pro–inflamatorias IL–8, IL–1β, IL–6, IL–10, TNFα e IL–12. Metodología: Se realizó un estudio de corte transversal, donde se determinaron los niveles de algunos indicadores de la respuesta inflamatoria como proteína C reactiva (PCR), citocinas pro–inflamatorias como IL–8, IL–1β, IL–6, IL–10, TNF–α e IL–12p70, hemoglobina y ferritina en un grupo de 40 niños: 10 con marasmo, 10 con kwashiorkor, 10 eutróficos con anemia y 10 eutróficos sin anemia. Resultados. La PCR fue significativamente mayor en desnutridos que en eutróficos. Las concentraciones de las citocinas pro–inflamatorias fueron mas altas en niños con kwashiorkor seguidos de eutróficos con anemia, marasmáticos y eutróficos sin anemia. La hemoglobina se correlacionó negativamente con los niveles de IL–8 (r=–0,409 p=0,009), IL–6 (r=–0,442 p=0,004) e IL–10 (r=–0,436 p=0,005). Conclusión. Los niños con desnutrición aguda grave producen una respuesta inflamatoria con aumento en los niveles de la PCR y de citocinas pro–inflamatorias que indican infección aun cuando no presenten signos, lo cual apoya la recomendación del protocolo de la OMS de medicarlos con antibioticos. Adicionalmente, estos resultados sugieren que las citocinas pro–inflamatorias podrian participar en la patogenesis de la anemia en pacientes con o sin desnutricion.
Palabras clave: desnutrición proteico–energética, Marasmo, kwashiorkor, citocinas, proteina C–reactiva, hemoglobina, niños.
Abstract
The treatment of the infection is still challenging in children with severe malnutrition and immunosupression. Objective: evaluate and compare inflammatory markers such as C–reactive protein (CRP) and proinflammatory cytokines in children with severe malnutrition and anemia. Methodology: levels of hemoglobin, transferrin, CRP and inflammatory markers such as cytokines IL–8, IL–1β, IL–6, IL–10, TNF–α and IL–12p70 were assessed in a group of 40 children, nutritional status was also evaluated.10 were classified with marasmus, 10 with kwashiorkor, 10 well nourish with anemia and 10 well nourish with no anemia. Results: C–reactive protein was significantly higher in undernourishment children than in well nourish children. Levels of proinflammatory cytokines were higher in children with kwashiorkor along by well nourish children with anemia, children with marasmus and well nourish children with no anemia. Hemoglobin was no correlated with levels of IL–8 (r=–0,409 p=0,009), IL–6 (r=–0,442 p=0,004) and IL–10 (r=–0,436 p=0,005). Conclusion:< malnourished children could develop an inflammatory condition presenting high levels of inflammatory markers such as C–reactive protein (CRP) and proinflammatory cytokines. These results suggest that proinflammatory cytokines may participate in the pathogenesis of anemia in malnourished or well nourished patients.
Key words: protein–energy malnutrition, marasmus, Kwashiorkor, cytokines, C–reactive protein, hemoglobin, children.
INTRODUCCIÓN
La desnutrición y las enfermedades infecciosas coexisten y son ampliamente prevalentes en los países en desarrollo, con interacciones mutuamente adversas que contribuyen al incremento de la morbilidad y mortalidad en los niños menores de cinco años. Entre el 10 y el 20% de los niños del mundo sufren desnutrición proteico–calórica (PEM: protein–energy malnutrition) moderada o grave de acuerdo al indicador de peso para la edad (1). En Colombia se reportó en el año 2005 un leve aumento de 0,8 a 1,2% en la desnutrición aguda con respecto al año 2000, lo que indica que pese a los avances logrados en la prevención y tratamiento de la misma, este es un problema aún no resuelto en nuestro país (2). A pesar de que en la década de los 90s los casos de desnutrición en el mundo disminuyeron de 177 a 147 millones, el 30% de los niños que presentan marasmo y hasta el 50% con kwashiorkor mueren, y una de las principales causas de mortalidad es el inadecuado manejo de la infección durante la enfermedad (3).
Se conoce que la desnutrición deteriora la respuesta inmune y se asocia con atrofia generalizada de los tejidos linfoides. El timo, el bazo, las amígdalas, las placas de Peyer y los ganglios linfáticos están seriamente afectados con evidencia histológica de atrofia significativa en las áreas de los linfocitos T en estos tejidos, lo que conlleva a una deficiencia en la respuesta inmune y a susceptibilidad incrementada a patógenos, reactivación de infecciones virales y desarrollo de infecciones oportunistas (4). También se presenta alteración en las membranas de las mucosas con cambios en la flora bacteriana y deterioro de la función protectora contra infecciones en el tracto respiratorio, gastrointestinal y urinario (5, 6).
En la desnutrición resulta más afectada la respuesta inmune celular (7, 8, 9). Se presenta una reducción significativa en la proliferación de linfocitos T, además de una inversión de la proporción de linfocitos TCD4 colaboradores (Th), TCD8 citotóxicos (Tc), con un radio menor a 0,8 comparable con estados de inmunodeficiencia (10, 11).
En cuanto a los mecanismos inespecíficos de protección del hospedero como la piel, las mucosas, el sistema del complemento y la fagocitosis, se ha descrito una actividad deficiente de estos componentes de la inmunidad natural. Aunque la fagocitosis parece intacta, la destrucción metabólica de las partículas ingeridas por los fagocitos se altera, lo que a su vez se relaciona con alteraciones en la quimiotaxis, la opsonizacióno y los mecanismos bactericidas de estas células fagocíticas (12).
La PEM también afecta la respuesta inflamatoria, en parte por una alteración marcada en la producción y en la actividad de mediadores inflamatorios como las citocinas y proteínas de fase aguda tipo la PCR, que son moléculas fundamentales para señalar en el organismo la presencia de agentes infecciosos y disparar una respuesta inflamatoria que localice y detenga su crecimiento de manera satisfactoria. Los estudios sobre la producción in vitro de citocinas por células de niños con PEM son limitados y en general, muestran una disminución en la capacidad de los fagocitos mononucleares para producir citocinas como la interleucina (IL)–1, IL–6, IL–8 y el factor de necrosis tumoral alpha (TNFα) que median o modulan la respuesta inflamatoria de fase aguda (13, 14, 15, 16). Otro estudio mostró que los niños con desnutrición grave tienen menor capacidad para producir citocinas tipo Th1 como la IL–2 y el interferón gamma (IFNγ) y mayor capacidad de producir IL–4 e IL–10, lo que evidencia una disminución de la relación Th1/Th2 en desnutrición (17).
En contraste con las investigaciones en células de niños desnutridos, algunos estudios muestran resultados controversiales ya que los niveles plasmáticos de citocinas pro–inflamatorias se han encontrado normales o muy poco alterados (13, 16, 18). Esta situación podría indicar que en los niños desnutridos se prioriza la producción de mediadores inflamatorios a expensas de la producción de otras proteínas celulares menos vitales (19, 20, 21, 22).
Los estudios sobre mediadores inflamatorios en niños con desnutrición aguda grave son pocos, y la interpretación de sus resultados debe hacerse con cuidado, entre otros aspectos, porque incluyen en un mismo grupo niños con diferentes tipos (crónica y aguda) y grados (leve, moderada y severa) de desnutrición, condiciones que pueden generar respuestas inmunológicas diferentes (16, 17). La mayoría de estos estudios se realizaron en niños africanos en quienes predomina la desnutrición aguda con menor afección de la talla, situación contraria a lo que ocurre en los niños latinoamericanos, quienes presentan desnutrición aguda generalmente acompañada de desnutrición crónica moderada (22). En Colombia no hay publicaciones sobre este tema y su necesidad es evidente para entender la capacidad de respuesta inflamatoria de los niños y las posibles implicaciones terapéuticas que podrían contribuir al control de la infección, disminuir la mortalidad y mejorar la sobrevida.
En el presente trabajo se comparó la respuesta inflamatoria entre niños con desnutrición aguda grave tipo marasmo y kwashiorkor, y niños eutróficos con y sin anemia (grupos control), mediante la medición de los niveles de proteína C reactiva (PCR) y de las citocinas pro–inflamatorias IL–8, IL–1β, IL–6, IL–10, TNFα e IL–12.
METODOLOGÍA
El estudio es de tipo transversal. Se determinaron y compararon los niveles séricos de varios mediadores inflamatorios entre cuatro grupos de niños. Dos de ellos con desnutrición aguda grave: marasmo y Kwashiorkor, y los otros dos grupos eutróficos: uno con anemia y el otro sin anemia; este último considerado como el grupo control
Sujetos y muestra: el estudio incluyó 40 niños y niñas menores de cinco años de edad y distribuidos en cuatro grupos: 10 con marasmo, 10 con kwashiorkor, 10 eutróficos anémicos y 10 eutróficos sin anemia (control).
La muestra se calculó con el programa Primer (PRIMER OF BIOESTADISTICS: THE PROGRAM By Stanton A. Glantz. Copyrigth 1992 by McGraw–Hill. Inc. Version 3.02) con base en los siguiente criterios: un error alfa de 0.05, un poder de la muestra de 0.90; se definió la IL–6 como variable principal para medir la diferencia esperada entre grupos (desnutridos y eutróficos) por el papel central que tiene esta citocina en la inflamación y por ser una de las que más se altera en desnutrición. Según el estudio de Dulguer y col (18), la diferencia encontrada en la producción sérica de IL–6 entre niños desnutridos agudos graves y eutróficos fue de 11,91 ± 5,56 pg/ml. La aplicación de esta fórmula permitió determinar un número mínimo de 10 niños a estudiar por grupo.
Criterios de inclusión para grupos con desnutrición: se incluyeron niños con desnutrición aguda grave con o sin infección aparente, con o sin anemia y cuyos padres aceptaron la participación en el estudio. Se clasificó la desnutrición según el protocolo de la Organización Mundial de la Salud (OMS) (23): tipo marasmo cuando el niño presentó una relación peso para la talla (P/T) inferior a –3 desviaciones estándar (DS) sin edema y kwashiorkor cuando presentó edema nutricional al menos maleolar bilateral, independiente de la relación P/T.
Criterios de exclusión para grupos con desnutrición: se excluyeron niños con edema secundario a enfermedad grave y niños con deshidratación.
Grupos con niños eutróficos: se conformaron dos grupos con los niños menores de cinco años que asistieron al programa de vacunación del Hospital Francisco Valderrama, se verificó que estuvieran sanos y sin procesos infecciosos mediante un examen médico realizado conforme a la estrategia de Atención Integral de Enfermedades Prevalentes de la Infancia (AIEPI) (24) y la determinación de PCR; también se evaluó que fueran eutróficos con P/T entre –1DS y +1DS y que no consumieran ningún tipo de suplemento de vitaminas y minerales. Adicionalmente, se determinaron los niveles de hemoglobina y ferritina, y según los resultados se separaron en dos grupos: uno eutrófico con anemia y el otro eutrófico sin anemia.
MATERIALES Y MÉTODOS
Ingreso: se realizó Gram de una gota de orina sin centrifugar para detectar infección urinaria, gota gruesa para evaluar la presencia de malaria y radiografía de tórax para verificar infección respiratoria. Se obtuvieron 5 ml de sangre venosa de los cuales 2 mL fueron utilizados para el hemoleucograma y 3 ml se dispensaron en tubo seco para obtener suero por centrifugación a 2.500–3.000 r.p.m durante 15 minutos, con el cual se midieron las concentraciones de ferritina, PCR y citocinas.
Diagnostico de enfermedades asociadas: un médico entrenado en el diagnóstico de enfermedades según la estrategia AIEPI (24) identificó los signos clínicos de infección como fiebre, somnolencia, hipoglucemia, hipotermia y los signos específicos para cada enfermedad infecciosa. También se consideraron como signos de infección una temperatura axilar mayor de 38°C, anormalidades en la placa de rayos X y el Gram de la gota de orina sin centrifugar positivo para bacterias. Adicionalmente, se evaluó la PCR, y el punto de corte que indicó inflamación fue > 8 miligramos por litro (mg/L).
El diagnóstico de anemia se realizó con base en los criterios de la OMS, concentración de hemoglobina <11 gramos por decilitro (g/dl), de igual manera se acogieron los puntos de corte de la OMS para diagnosticar ferropenia por debajo de 12 nanogramos sobre mililitros (ng/ml) en niños sin infección y de 30 ng/ml en desnutridos con infección (25). El diagnóstico de malaria se realizó con el examen de gota gruesa. Todos los niños del estudio, sanos o con desnutrición severa, fueron revisados por el mismo médico.
Medidas antropométricas: el peso de los niños se determinó diariamente con la utilización de una balanza mecánica Health o Meter ®, con sensibilidad de 10 gramos (g); los niños se pesaron sin ropa. Debido a la edad y al estado de salud de los niños, la estatura se midió en decúbito supino en un infantómetro de madera con sensibilidad de un milímetro (1mm). Todos los niños se pesaron y se midieron en el mismo equipo antropométrico y por personal de enfermería estandarizado. Cada medida antropométrica se tomó tres veces, y si la diferencia entre los datos sobrepasaba los 10 gramos en el caso del peso y dos milímetros en el de la longitud, se trabajaba con el promedio de los tres.
Evaluación bioquímica: la hemoglobina se determinó por el método de cianometahemoglobina, la ferritina por inmunoensayo enzimático de micropartículas (MEIA), la PCR se determinó en suero por turbidimetría con el estuche comercial PCR látex (Biosystems) y se siguieron las indicaciones del fabricante.
Evaluacíon inmunológica: la medición sérica de citocinas pro–inflamatorias (IL–8, IL–1β, IL–6, IL–10, TNF–α e IL–12p70), se realizó por citometría de flujo, con el estuche comercial Human Inflammation Kit (BDTM Cytometric Bead Array) según las recomendaciones del fabricante.
Manejo ético de la investigación: la investigación se clasificó como de riesgo mínimo según los criterios establecidos en la Resolución número 008430 de Octubre de 1993, artículo 11, del Ministerio de Salud de Colombia. Los procedimientos que se aplicaron a los niños del estudio son los que sugiere la OMS como ideales para su recuperación, pertenecieran o no a la investigación. Todas las personas relacionadas con la investigación recibieron información clara y detallada de los objetivos, metodología y resultados esperados de la investigación. Los padres o responsables de los niños dieron su consentimiento para participar en la investigación en forma voluntaria y tenían claro que estaban en plena libertad de retirar a los niños del estudio en el momento que lo desearan sin que ello representara perjuicio alguno. El proyecto contó con el aval del Comité Central de Bioética de la Universidad de Antioquia.
Análisis estadístico: se comprobó la normalidad mediante prueba Shapiro Wilk. La comparación entre los cuatro grupos al momento del ingreso se hizo mediante un análisis de varianza (ANOVA) de una vía. La correlación entre las variables se realizó con la prueba de Correlación de Pearson o la Rho de Spearman. Para la comparación entre las variables categóricas se utilizaron las pruebas Chi cuadrado y exacta de Fischer. En todos los casos se consideró significativa una p menor de 0,05. El análisis estadístico se realizó con el programa Statistical Package for the Social Sciences, SPSS® V 14.0.
RESULTADOS
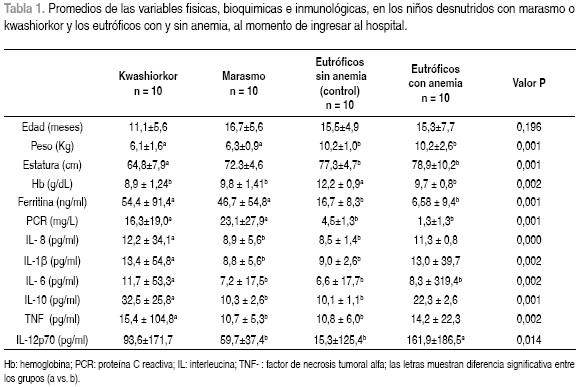
No se encontró diferencia significativa en las variables de edad (p= 0,196), sexo (p= 0,675) y raza, lo que hizo comparables a los cuatro grupos de estudio. Los niños eutróficos, tanto del grupo con anemia como del grupo sin anemia, tuvieron mayor peso y estatura que los desnutridos, no presentaron infección al examen medico y no mostraron respuesta inflamatoria, en todos los casos la PCR fue < 8 mg/L.
Los niños eutróficos, tanto del grupo con anemia como del grupo sin anemia, tuvieron mayor peso y estatura que los desnutridos, no presentaron infección al examen medico y no mostraron respuesta inflamatoria, en todos los casos la PCR fue < 8 mg/L.
La concentración de PCR fue significativamente mayor en los grupos con desnutrición que en los eutróficos, de hecho todos los niños con desnutrición tenían alta la concentración de PCR (> 8 mg/L) lo que indicó un proceso inflamatorio activo (Tabla 1).
50% de los niños con kwashiorkor y 60% de los marasmáticos presentaron signos de infección, sin diferencias significativas entre ellos (p=0,5). El principal signo de infección fue la fiebre. 60% de los niños con kwashiorkor y el 50% de los niños con marasmo presentaron diarrea sin diferencia significativa entre ellos (p=0,5).
El grupo de los niños control (eutrófico sin anemia) presentó una concentración promedio de hemoglobina de 12,2 g/dL, significativamente mayor que la de los otros tres grupos en los cuales la concentración de hemoglobina indicó anemia (Tabla 1). La hemoglobina se correlacionó negativamente con los niveles de IL–8 (r=–0,409 p=0,009), la IL–6 (r= –0,442 p=0,004) y la IL–10 (r= –0,436 p=0,005).
La concentración de ferritina fue significativamente superior en los desnutridos, en contraste, en los eutróficos con anemia indicó ferropenia y en los controles mostró un adecuado estado del hierro. La ferritina se correlacionó positivamente con la PCR (r=0,49 p=0,001).
El grupo con kwashiorkor siempre presentó las concentraciones más altas de las citocinas IL–8, IL–1β, IL–6, IL–10 y TNF (Tabla 1). La IL–6 fue significativamente mayor en niños con kwashiorkor que en los otros tres grupos (p=0,002). Las citocinas IL–1β, IL–8, IL–10 y TNFα, fueron significativamente mayores en el grupo de niños con kwashiorkor que en el grupo de niños con marasmo y el grupo control (p=0,002, p=0,001, p=0,001 y p=0,002, respectivamente), pero no se diferenciaron de los niños eutróficos con anemia. En el caso de la IL–12p70 los niños eutróficos con anemia mostraron los valores más altos, con diferencia significativa frente a los marasmáticos y los controles (p=0,014).
Las citocinas que comandan la respuesta de fase aguda, mostraron fuertes asociaciones entre ellas, la IL–8 se correlacionó positivamente con IL–1β (r= 0,750 p=0,0001), IL–6 (r= 0,601 p=0,0001), IL–10 (r= 0,609 p=0,0001) y TNFa (r= 0,735 p=0,001). A su vez el TNFa presentó una correlación positiva con IL–1β (r= 0,839 p=0,001) e IL–10 (r= 0,646 p=0,001). De otra parte la IL– 6 se correlacionó con la IL–10 (r= 0,617 p=0,001).
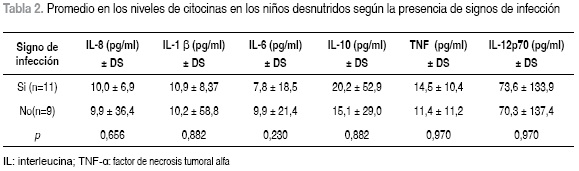
No se encontró diferencia significativa al comparar la concentración de citocinas en los niños desnutridos que presentaron signos evidentes de infección con aquellos que no los manifestaron (Tabla 2).
En resumen los niños del grupo con kwashiorkor fueron los de menor edad y estatura, todos tenian anemia y presentaron una PCR elevada, lo que indica un proceso inflamatorio. La concentración promedio de ferritina en este grupo fue elevada con valores indicativos de una respuesta inflamatoria y presentaron los niveles más altos en todas las citocinas estudiadas; sin embargo, sólo 50% manifestaron signos de infección.
En el grupo con marasmo todos los niños tenian anemia, fue el grupo con los niveles más altos de la PCR y en un valor indicativo de inflamación. Los niveles de ferritina estuvieron elevados en respuesta a un posible proceso inflamatorio y los niveles de citocinas fueron menores que las de los kwashiorkor pero mayores que los del grupo control. De manera similar al grupo anterior, sólo 60% de los marasmáticos reportaron signos de infección.
Los niños eutróficos con anemia presentaron niveles de hemoglobina inferior a 11 g/dL, acompañados de ferropenia (6,6 ng/mL). Todos presentaban crecimiento pondoestatural adecuado y a ninguno se le detectaron signos de infección aparente en el examen médico. Adicionalmente, ninguno de los niños eutróficos con anemia reportó concentraciones de PCR elevadas que indicaran un proceso inflamatorio, pero sorprendentemente, presentaron concentraciones más elevadas de todas las citocinas en comparación con el grupo de niños con marasmo o los eutróficos sanos y sin anemia; y en niveles cercanos a los del grupo con kwashiorkor (Tabla 1).
DISCUSIÓN
La recomendación de la OMS de tratar a todos los niños desnutridos con antibioticos aún cuando no presenten signos de infección ha sido muy controvertida por diferentes investigadores (24). En este estudio encontramos que al ingreso, 60% de los niños desnutridos manifestaron algún signo de infección. Estos resultados son similares a las estadísticas de países africanos y asiáticos y a otros estudios realizados en la Unidad Vida Infantil (23). Sin embargo, en todos los niños desnutridos se encontraron niveles de PCR y de citocinas pro–inflamatorias muy elevados y sin diferencias significativas entre los niños quienes presentaron signos de infección y los que no los presentaron; estos resultados sugieren que todos los niños desnutridos, con o sin manifestacion de signos de infección, fueron capaces de desarrollar una respuesta inflamatoria aguda. Estos resultados apoyan la recomendación de tratar como infectados a todos los niños con desnutrición aguda grave, como lo sugiere el protocolo de la OMS (24).
En el presente estudio, las concentraciones de PCR y ferritina en los grupos de niños con kwashiorkor y marasmo mostraron valores significativamente superiores al compararlas con los niños eutróficos con y sin anemia. En concordancia con estos hallazgos, Manary y col (1998), observaron concentraciones aumentadas de PCR y sin diferencias entre los dos tipos de desnutrición (19). Resultados similares fueron descritos por Amesty–Valbuena y col (2004), quienes observaron altas concentraciones de PCR en niños con marasmo (22). Adicionalmente, los resultados del presente estudio concuerdan con los descritos por Dulger y col (2002), en los cuales se concluyó que la prioridad del desnutrido descompensado, es la de producir mediadores inflamatorios para responder a la infección, aunque se disminuyan las reservas proteicas. Además, en los niños con kwashiorkor, grupo con la mayor producción de citocinas, se observó una disminución mas marcada en las proteínas circulantes y transportadoras, hecho que se asocia con la aparición del edema (18).
Similar a lo observado en este estudio, otros investigadores encontraron que los niños desnutridos graves presentaban niveles de IL–1, IL–6 y TNF, principales mediadores de la respuesta de fase aguda, superiores a las de los controles eutróficos, lo que indica que a pesar del deterioro inmunológico, el niño desnutrido es capaz de producir citocinas que participan en la respuesta de fase aguda (12, 16, 18, 26). En concordancia con los actuales resultados, Sauerwein y col (1997) encontraron que los niños con kwashiorkor presentaban una mayor concentración en todas las citocinas estudiadas que los marasmáticos (13); hallazgos que confirman que los niños desnutridos, a pesar de la inmunosupresión, tienen la capacidad de producir altos niveles de citocinas pro–inflamatorias ante un proceso infeccioso, y que esta respuesta es de mayor magnitud en los niños con kwashiorkor. De manera similar, Abo–Shousa y col (2005), observaron que la IL–8 y la IL–6 en niños con PEM estaban aumentadas en comparación con los controles saludables. Sin embargo, cuando estimularon las celulas de sangre periférica de estos niños con lipopolisacaridos (LPS), la respuesta en la producción de las citocinas fue menor que en los niños eutróficos, lo que sugirió que en estos niños se presenta una dificultad para enfrentar nuevos retos infecciosos (14).
En un niño desnutrido compensado, mientras no tenga un proceso infeccioso, se disminuye la tasa de síntesis y degradación protéica, y en consecuencia el recambio proteico. Con la aparición de una infección, el desnutrido entra en un estado de decompensación, lo que podría acelerar el recambio proteíco para suplir los aminoácidos que se necesitan para construir una respuesta de fase aguda. Esta respuesta estimula una alta producción de citocinas pro–inflamatorias y algunas proteínas de fase aguda, a expensas de la concentración de albúmina, ceruloplasmina y transferrina (27). Lo anterior permite proponer a la infección como el gatillo que dispara la formación del edema en el kwashiorkor. En concordancia con este postulado, este estudio encontró las mayores concentraciones de ferritina y citocinas proinflamatorias en los niños con edema o desnutrición tipo kwashiorkor.
Todos los niños desnutridos presentaron anemia; este hallazgo no es sorprendente debido a que es una de las carencias nutricionales más comunes en Colombia (2); adicionalmente, la presencia de infección en el desnutrido puede contribuir a la anemia. El hierro es un componente esencial en la inmunidad, este elemento promueve el crecimiento e induce la diferenciación de células que participan en la respuesta inmune; sin embargo, bajo condiciones de inflamación, las citocinas pro–inflamatorias y las proteínas de fase aguda orientan el tráfico del hierro desde la circulación hacia los sitios de almacenamiento en el sistema retículo endotelial y estimulan la síntesis de la hormona hepcidina, ambas situaciones inducen hipoferremia (28, 29, 30, 31). A su vez, la hipoferremia condiciona una eritropoyesis restringida en hierro y el desarrollo de anemia con hiperferritinemia. Adicionalmente, las citocinas pro–inflamatorias inhiben la producción de eritropoyetina y con ello la producción de glóbulos rojos en la medula ósea (32, 33). Este mecanismo homeostático busca controlar la infección al limitar la disponibilidad de nutrientes esenciales y factores de crecimiento a los microorganismos, por lo que bloquea su proliferación y fortalece las vías efectoras de la inmunidad mediada por células contra el patógeno invasor (34). En este sentido, se observó una correlación negativa entre las concentraciones de hemoglobina y los niveles de las citocinas IL–8, IL–6 y la IL–10, lo que podría entenderse como una confirmación del anterior mecanismo homeostatico, en donde a mayor producción de citocinas por el proceso infeccioso, la concentración de hemoglobina es menor.
Si bien los anteriores resultados sobre anemia en los grupos de desnutridos se esperaban, fue sorprendente encontrar en los niños eutróficos con anemia (Hb 9,7 ± 0,8 g/dl) y ferropenia (ferritina 6,58 ± 9,4 ng/ml), niveles de citocinas casi tan altos como los presentes en los niños con kwashiorkor, y superiores a los niveles de los marasmáticos y el grupo control. Es de anotar que en este grupo de niños eutróficos con anemia, no se observaron signos de infección, como fuera determinado por el examen médico, y los niveles de la PCR fueron normales en todos los casos (0,95 ± 1,3 mg/L). Estos resultados son inquietantes porque sugieren que en un niño con adecuado crecimiento pondo–estatural, que a juicio del médico está perfectamente saludable y que no manifiesta ningún signo de infección, la presencia de anemia podría predisponer a una elevada concentración de citocinas pro–inflamatorias. En contraste con los actuales resultados, otros estudios evaluaron la producción in vitro de IL–1β, IL–2, IL–6, IL–10 y TNFα por células mononucleares de sangre periférica (PBMC) en 20 pacientes con anemia y los compararon con controles saludables, sin encontrar una diferencia significativa en la producción de estas citocinas entre anémicos y controles (35). Sin embargo, en otro estudio se comparó la producción de citocinas pro–inflamatorias en pacientes con artritis reumatoidea con y sin anemia, y se encontró que los pacientes con anemia presentaban niveles significativamente mayores de las citocinas estudiadas (IL–1β, IL–6 y el TNFα) (36).
En conclusión, según los resultados del presente estudio, los niños con desnutrición aguda grave producen una respuesta inflamatoria con aumento en los niveles de la PCR y de citocinas pro–inflamatorias que indican infección, aun cuando no presenten signos , lo cual apoya la recomendación del protocolo de la OMS de medicarlos con antibioticos. Adicionalmente, estos resultados sugieren que las citocinas pro–inflamatorias podrian participar en la patogenesis de la anemia en pacientes con o sin desnutricion.
Los hallazgos que relacionan la producción de citocinas pro–inflamatorias con anemia en niños eutróficos no infectados de esta investigación, requieren más estudios que permitan esclarecer los mecanismos involucrados y el posible papel que tiene en esta relación, la carencia concomitante de otros micronutrientes inmunomoduladores como la vitamina A y el cinc, cuyas deficiencias en la población cursan a menudo con las carencias de hierro. De otra parte, sería importante evaluar en las diferentes etapas de manejo del niño desnutrido grave, los cambios en las variables bioquímicas e inmunológicas para un mejor entendimiento de la capacidad de respuesta de ellos ante un proceso inflamatorio, a medida que la infección se controla con antibióticos y que el estado nutricional se recupera. Adicionalmente y teniendo en cuenta que la recomendación del protocolo es la suplementación con hierro una vez el niño recupera el apetito, se necesitan más estudios para conocer cual es el mejor momento para ofrecer el hierro y sopesar las implicaciones que tiene prescribir este mineral en pacientes infectados ante la necesidad de tratar la anemia. En general recobra importancia la investigación sobre algunos micronutrientes que hacen parte del protocolo, como la vitamina A y el cinc, y que tienen impacto en la respuesta inmune; por ejemplo conocer los mecanismos moleculares mediante los cuales ejercen su acción, evaluar la eficacia de su uso y las potencialidades que tienen al reforzar la defensa inmune del niño con desnutrición aguda grave.
REFERENCIAS
1. OPS. Estrategia y plan de acción regionales sobre nutrición y desarrollo. 40a sesión del Subcomité de Planificación y Programación del Comité Ejecutivo OPS–OMS. Washington; 2006. OPS/OMS–SPP40/12. [ Links ]
2. Ojeda G, Ordoñez M, Ochoa L, Samper B. Estado nutricional en mujeres y niños menores de 5 años. En: salud sexual y reproductiva en Colombia: resultados de la encuesta nacional de demografía y salud. 2005. Bogotá: Profamilia; 2006. p. 266–73. [ Links ]
3. Collins S, Dent N, Binns P, Bahwere P, Sadler K. Management of severe acute malnutrition in children. Lancet. 2006;368:1992–2000. [ Links ]
4. Savino W. The thymus gland is a target in malnutrition. Eur J Clin Nutr. 2002;56(Supl 3):46–9. [ Links ]
5. Deitch E, Ma W, Ma L, Berg R, Specian R. Protein malnutrition predisposes to inflammatory–induced gut–origin septic states. Ann Surg. 1990;211:560–68. [ Links ]
6. ZieglerT, Evans M, Fernandez–Estivariz C, Jones D. Trophic and cytoprotective nutrition for intestinal adaptation, mucosal repair and barrier function. Annu Rev Nutr. 2003;23:229–61. [ Links ]
7. Cunnigham–Rundles S, Moon A. Mechanisms of nutrient modulation of the immune response. J Allergy Clin Immunol. 2005;115:1119–28. [ Links ]
8. Keusch G. Malnutrition and the thymus gland. In: nutrient modulation of the immune response. New York: Marcel Dekker; 1993. p.283–89. [ Links ]
9. Sánchez–Alvarez V. Inmunocompetencia en la malnutrición proteico–energética. Rev Cubana Aliment Nutr. 1999;13:129–36. [ Links ]
10. Beisel W. Nutrition and immune function: overview. J Nutr. 1996;126(S1):2611–15. [ Links ]
11. Zayas G. Respuesta inmune en niños de 2 años de edad con bajo peso al nacer y su relación con la morbilidad. Rev Cubana Aliment Nutr. 1999;13:24–38. [ Links ]
12. Chandra R. Protein energy malnutrition and immunological responses. J Nutr. 1992;122:597–600. [ Links ]
13. Sauerwein R, Mulder J, Mulder L, Lowe B, Peshu N, Demacker P, et. al. Inflammatory mediators in children with protein–energy malnutrition. Am J Clin Nutr. 1997;65:1534–39. [ Links ]
14. Abo–Shousha S, Hussein M, Rashwan I, Salama M. Production of proinflammatory cytokines: granulocyte–macrophage colony stimulating factor, interleukin–8 and interleukin–6 by peripheral blood mononuclear cells of protein energy malnourished children. Egypt J Immunol. 2005;12:125–31. [ Links ]
15. Giovvambattista A, Spinedi E, Sanjurio A, Chisari A, Rodrigo M, Perez N. Circulating and mitogeninduced en tumor necrosis factor (TNF) in malnourished children. Medicina (B Aires). 2000;60:339–42. [ Links ]
16. Woodward B. The effect of protein–energy malnutrition on immune competent. In: Nutrition, immunity, and infection in infants and children. Nestle Nutr Workshop Ser Pediatr Program. 2001;45:89–120. [ Links ]
17. Rodríguez L, Gonzalez C, Florez L, Jiménez–Zamudio L, Graniel J, Ortiz R. Assessment by flow cytometry of cytokine production in malnourished children. Clin Diagn Lab Immunol. 2005;12:502–7. [ Links ]
18. Dulger H, Arik M, Sekeroglu M, Tarakcioglu M, Novan T, Cesur Y, et al. Pro–inflammatory cytokines in Turkish children with protein–energy malnutrition. Mediators Inflamm. 2002;11:363–5. [ Links ]
19. Manary Mj, Broadhead RL, Yaresheski KE. Whole–body protein kinetics in marasmus and kwashiorkor during acute infection. Am J Clin Nutr. 1998;67:1205–9. [ Links ]
20. Reid M, Badaloo A, Forrester T, Morlese JF, Heird WC, Jahoor F. The acute–phase protein response to infection in edematous and nonedematous protein–energy malnutrition. Am J Clin Nutr. 2002;76:1409–15. [ Links ]
21 Aslan Y, Erduran E, Gedik Y, Mocan H, Okten A, Orem A, et al. Serum interleukin–1 and granulocyte–macrophage colony–stimulating factor levels in protein malnourished patients during acute infection. Cent Afr J Med. 1996;42:179–84. [ Links ]
22. Amesty–Valbuena A, Pereira N, Castillo J, García D, Nuñez J, Cayama N, et al. Mediadores de inflamación (Proteina C Reactiva) en el niño con desnutrición proteico energética y en el niño eutrófico. Invest Clin. 2004;45:53–62. [ Links ]
23. Bernal C, Velásquez C, Alcaraz G, Botero J. Treatment of severe malnutrition in children: experience in implementing the World Health Organization Guidelines in Turbo, Colombia. J Pediatr Gastroenterol Nutr. 2008;46:322–8. [ Links ]
24. WHO. Management of the child with serious infection or severe malnutrition. Guidelines for care at the first–referral level in developing countries. Geneva; 2000. [ Links ]
25. UNICEF, UNU, WHO. Iron deficiency anaemia. Assessment, prevention, and control: a guide for programme managers. Geneva: WHO, 2001. p.33–45. [ Links ]
26. Azevedo Z, Victal L, Fonseca K, Camara F, Haeffner–Cavaillon N, Cavaillon J, e. al. Increased production of tumor necrosis factor–? in whole blood cultures from children whit primary malnutrition. Braz J Med Biol Res. 2005;38:171–83. [ Links ]
27. Golden M, Waterlow J, Picou D. Protein turnover, synthesis and breakdown before and after recovery from protein–energy malnutrition. Clin Sci. 1977;53:473–7. [ Links ]
28. Van de Wiel, A. Anemia in critically ill patients. Eu J Internal Med. 2004;15:481–86. [ Links ]
29. Konijn AM. Iron metabolism in inflammation. Baillieres Clin Haematol. 1994;7(4):829–49. [ Links ]
30. Means R. Hepcidin and anaemia. Blood Rev. 2004;18(4):219–25. [ Links ]
31. Ganz T, Nemeth E. Regulation of iron acquisition and iron distribution in mammals. Biochim Biophys Acta. 2006;1763(7):690–99. [ Links ]
32. Ferrucci L, Guralnik J, Woodman R, Bandinelli S, Lauretani F, Corsi A, et al. Proinflammatory state and circulating erythropoietin in persons with and without anemia. Am J Med. 2005;118:1288–92. [ Links ]
33. Koike M, Ishiyama T, Tomoyasu S, Tsuruoka N. Spontaneous cytokine overproduction by peripheral blood mononuclear cells from patients with myelodysplastic syndromes and aplastic anemia. Leuk Res. 1995;19:639–44. [ Links ]
34. Weiss G. Modification of iron regulation by the inflammatory response. Best Pract Res Clin Haematol. 2005;18:183–01. [ Links ]
35. Bergman M, Bessler H, Salman H, Siomin D, Straussberg R, Djaldetti M. In vitro cytokine production in patients with iron deficiency anemia. Clin Immunol. 2004;113:340–44. [ Links ]
36. Voulgari P, Kolios G, Papadopoulos G, Katsaraki A, Seferiadis K, Drosos A. Role of cytokines in the pathogenesis of anemia of chronic disease in rheumatoid arthritis. Clin Immunol. 1999;92:153–60 [ Links ]