Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Perspectivas en Nutrición Humana
versão impressa ISSN 0124-4108
Perspect Nut Hum v.12 n.2 Medellín jul./dez. 2010
ARTÍCULOS DE INVESTIGACIÓN
Efecto del all-trans ácido retinoico en la producción de citocinas por células mononucleares de sangre periférica (CMSP) en niños con desnutrición aguda
Effects of all-trans retinoic acid on the production of cytokines by peripheral blood mononuclear cells (PBMC) in children with acute malnutrition
Gloria C. Deossa1; Claudia M. Velásquez2; Juliana Orozco2; Ángel González3
1Escuela de Nutrición y Dietética, Universidad de Antioquia. Medellín-Colombia. glory@pijaos.udea.edu.co
2Grupo Investigación Alimentación y Nutrición Humana. Universidad de Antioquia. Medellín-Colombia.
3Grupo de Micología Médica y Experimental. Corporación para Investigaciones Biológicas (CIB). Universidad de Antioquia. Medellín-Colombia.
Artículo recibido: 22 de septiembre de 2010 Aceptado: 19 de noviembre de 2010.
Como citar este artículo: Deossa GC, Velásquez CM, Orozco J, González A. Efecto del all-trans ácido retinoico en la producción de citocinas por células mononucleares de sangre periférica (CMSP) en niños con desnutrición aguda. Perspect Nutr Humana. 2010;12:
Resumen
Objetivo: comparar el efecto del all-trans ácido retinoico en la producción de citocinas por células mononucleares de sangre periférica (CMSP) entre niños con desnutrición aguda moderada (Dn-M), grave (Dn-G) y un grupo control de niños eutróficos (Eu). Metodología: estudio cuasi-experimental in vitro que evaluó el efecto de diferentes dosis de atRA (0, 17, 30 y 50 nM) sobre la concentración de citocinas (L-8, IL-1β, IL-6, IL-10, TNF-α e IL-12p70) en CMSP de 21 niños, distribuidos en 3 grupos: 7 con desnutrición moderada (Dn-M); 7 con desnutrición grave (Dn-G) y 7 eutróficos (Eu). Resultados: aunque 71% de los niños desnutridos (Dn-G y Dn-M) manifestaron signos de infección, presentaron una población de leucocitos y linfocitos más baja que los Eu. En los niños Dn-G se reportaron unos valores de proteína C reactiva (CRP) significativamente mayores que en los otros dos grupos y simultáneamente menor edad, menor estatura (T/E) y menor hemoglobina. Los valores de IL-1β, IL-6, IL-8, TNFα e IL-10 en CMSP fueron mayores en Dn-M que en Dn-G y Eu. En la comparación entre grupos se encontró que con 50 nM de atRA el valor medio de la IL-8 fue significativamente menor y el de IL-10 mayor en Dn-G comparados con los otros grupos; de acuerdo al análisis MANOVA estas diferencias se atribuyeron al hecho de pertenecer al grupo (Dn-G) y no a la dosis de atRA (50 nM). El análisis del efecto de las diferentes dosis de atRA al interior de cada grupo mostró una disminución significativa con 50nM de atRA de IL-8 en Dn-G y de IL-10 en Eu. En Dn-M aumentó la IL-12p70 con dosis de 17 nM. Conclusión: el atRA influye en la producción de citocinas, pero el principal determinante de la concentración es el tipo de desnutrición.
Palabras clave: ácido retinoico, citocinas, desnutrición proteico-calórica, proteína C-reactiva, niños.
Abstract
Objective: To compare the effect of all-trans retinoic acid in the production of cytokines by peripheral blood mononuclear cells (PBMC) among children with moderate malnutrition (Dn-M), severe (Dn-G) and a control group of children eutrophic (Eu). Methodology: Quasi-experimental research in vitro, to assess the effect of different doses of atRA (0, 17, 30 and 50 nM) on the concentration of cytokines (L-8, IL-1β, IL-6, IL-10, TNF-α and IL-12p70) in PBMC of 21 children, divided into three groups: seven with moderate malnutrition (Dn-M), 7 with severe malnutrition (Dn-G) and 7 healthy children (Eu). Results: Although 71% of malnourished children (Dn-G and Dn-M) showed signs of infection, had a population of leukocytes and lymphocytes lower than the Eu. Children Dn-G reported a concentration of C-reactive protein (CRP), significantly higher than the other two groups and simultaneously younger, shorter (T/E) and lower hemoglobin. The concentration of IL-1β, IL-6, IL-8, TNFα and IL-10 in PBMC was higher in Dn-M than in Dn-G and Eu. Comparison between groups was found that 50 nM of atRA concentration of IL-8 was significantly lower and the higher IL-10 in Dn-G compared with the other two groups. MANOVA analyses indicate these differences were attributed to the fact to belonging the group (Dn-G) and not the dose of atRA (50 nM). Analysis of the effect of different doses of atRA in each group showed a significant decrease with 50nM of atRA of IL-8 in Dn-G and IL-10 in Eu. IL-12p70 increased with doses of 17 nM in Dn-M. Conclusion: atRA affects the production of cytokines but the main determinant of concentration is the type of malnutrition.
Key words: tretinoin, cytokines, protein-energy malnutrition, C-reactive protein, children.
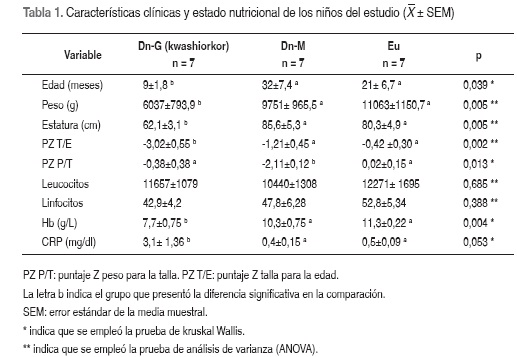
INTRODUCCIÓN Las carencias de nutrientes aumentan el riesgo de enfermedades infecciosas y generan mayor mortalidad (1). En el mundo mueren anualmente cerca de 10 millones de niños, la mitad en países en desarrollo y en relación con la desnutrición (2,3). En niños desnutridos es común encontrar deficiencias concomitantes de micronutrientes, entre ellos de vitamina A, en forma de 9-cis-ácido retinoico y de all-trans ácido retinoico (atRA), este último considerado como el principal metabolito activo y que modula el sistema inmunológico por participar en la respuesta humoral y celular, al unirse a receptores nucleares RAR-RXR(4-8).Una deficiencia de vitamina A altera el balance de citocinas pro-inflamatorias y anti-inflamatorias y el perfil de linfocitos Th1 y Th2, generando una respuesta inflamatoria inadecuada(3-4,9-15). La deficiencia preexistente de vitamina A, al parecer, incrementa las infecciones en los niños menores de cinco años; la suplementación ha demostrado una reducción en el riesgo de muerte de estos niños hasta de 30% (16). En la malnutrición proteico energética (MPE) se afecta la producción y actividad de las citocinas y de la proteína C reactiva (CRP), fundamentales para detectar agentes infecciosos y localizar la respuesta inflamatoria para evitar la sepsis (17). Para tratar la desnutrición aguda grave y prevenir las muertes por esta causa, la Organización Mundial de la Salud (OMS) implementó la estrategia Atención Integrada a las Enfermedades Prevalentes de la Infancia (AIEPI) enfatizando en el manejo de la deficiencia de micronutrientes, para lo que recomienda utilizar suplementos como la vitamina A (18). Al implementar el protocolo se ha logrado disminuir la mortalidad por desnutrición a menos de 5%, pero aún preocupa que la sepsis sea la principal causa de muerte en los niños con desnutrición grave; en consecuencia, se dedican esfuerzos para estudiar el comportamiento de los mediadores inflamatorios y la influencia de los micronutrientes en la respuesta inmunológica de los niños desnutridos (18-19). Se han realizado algunas investigaciones en células de adultos eutróficos y en modelos murinos tanto in vivo como in vitro para entender cómo actúa el atRA en la infección; la mayoría de estudios describen los mecanismos moleculares por los cuales el atRA ejerce sus efectos en condiciones nutricionales adecuadas (20-23), también se dispone de investigaciones sobre la respuesta inflamatoria en niños desnutridos, pero no hay estudios que evalúen el impacto de la suplementación con atRA en la fase aguda de la respuesta, específicamente en niños con desnutrición aguda y su papel en la concentración de citocinas (24-31). Por lo anterior este estudio evaluó el efecto que ejercen diferentes dosis de atRA (0, 17, 30 y 50 nM) en la producción de citocinas por CMSP de niños con desnutrición aguda moderada y grave, comparados con niños eutróficos. MATERIALES Y MÉTODOS Población: niños y niñas menores de 5 años con desnutrición aguda en el municipio de Turbo. Muestra: se calculó con el programa Primer (Primer of biostatistics: the program by Stanton A. Glantz, c1992 McGrawHill Inc. Version 3.02). Criterios: tres grupos a comparar, error alfa 0,05; poder 0,90. Según Dulger (28), 11,91±4,5 pg/ml es la diferencia en la concentración de IL-6 entre niños con desnutrición aguda grave y eutróficos. La fórmula define un mínimo de seis niños por grupo; finalmente se conformó una muestra de 21 niños repartidos en tres grupos: siete con desnutrición grave (Dn-G); siete con desnutrición moderada (Dn-M) y siete niños eutróficos (Eu) sin infección. Tipo de estudio: cuasi-experimental in vitro. Criterios de inclusión y exclusión: los grupos con desnutrición se conformaron con niños y niñas que ingresaron en un periodo de 12 meses a la UVI (Unidad Vida Infantil) de Turbo (Antioquia) y que al momento del ingreso se les diagnosticara Dn-M o Dn-G. La desnutrición se clasificó según el protocolo de la OMS (18), así: Dn-M relación peso para la talla (P/T) entre -2 y -3 DS con respecto a las normas del National Center for Health Statistics (NCHS) (32), Dn-G tipo kwashiorkor con edema nutricional al menos maleolar bilateral, independiente de la relación P/T. Se excluyeron niños con desnutrición secundaria a otras enfermedades, con edema no nutricional, deshidratados, con malaria, infectados con VIH o sida, o que hubiesen recibido transfusión 20 días antes del estudio. Grupo control: a niños y niñas Eu (P/T±1DS) sin infección, seleccionados en el programa de Promoción de la Salud, se verificó que estuvieran sanos y sin signos de infección según examen médico por protocolo de AIEPI18 y por medición de proteína C reactiva (CRP). Estado nutricional: se expresaron los índices antropométricos como puntajes Z de longitud/estatura para la edad, peso para la edad y peso para la longitud/estatura. La población de referencia fue la del NCHS (32). Para las mediciones de peso, estatura y longitud se utilizaron instrumentos precisos y personal estandarizado que siguió las normas internacionales (33). Determinación de hemoglobina, recuento leucocitario y CRP Hemoglobina: por cianometahemoglobina; valor para diagnosticar anemia <11 g/dL (34). Recuento leucocitario: en contador celular Cell Dyn 1200 Abbott laboratorios. Proteína C reactiva (CRP) en suero: por nefelometría. Reactivos de Beckman Coulter (C-Reactive Protein Microparticulate Enhanced Reagent. Ref 474000, Calibrator 5. Ref 465250, Vigil Serology Control Level 2. Ref 450163). Valor de referencia en suero 0,10 a 0,17 mg/dL, punto de corte: inflamación > 0,8 mg/dL (35). Cultivo de CMSP y obtención de sobrenadante (36) Sangrado: por personal experto, la muestra con heparina se guardó a temperatura ambiente e inmediatamente se envió vía aérea a la ciudad de procesamiento. Medio de cultivo: mezcla de RPMI 1640 con antibióticos (penicilina 100 U.I, gentamicina 50 ug/ml, anfotericina 0,25 ug/ml) al 2%. Separación de CMSP: mediante la técnica de Ficoll Hipaque. Se varió la técnica de separación cuando se presentó microeritrocitosis (en niños con anemia), se lisaron los glóbulos rojos y se prolongó el tiempo de centrifugación. Siembra de CMSP: en platos de 24 pozos (Greiner®), a una concentración de 1.000.000 de células por pozo, resuspendidas en 500 µL de medio de cultivo. Estimulación de CMSP con atRA Las CMSP se cultivaron por duplicado en presencia o ausencia de atRA (atRA marca Sigma Prod. No. R 2625. CAS NUMBER: 302-79-4) diluido en dimetil sulfóxido (DMSO) a diferentes concentraciones, así: 17 nM de atRA en DMSO a 0,1%, 30 nM de atRA en DMSO a 0,18% y 50 nM de atRA en DMSO a 0,3%, la incubación se llevó a cabo durante 48 horas a 37oC y 5% de CO2. Posteriormente se recolectaron los sobrenadantes, haciendo un pool de los duplicados y se centrifugaron a 1500 rpm por 10 minutos. Los sobrenadantes se almacenaron en viales de 1,5 mL, a -170°C en nitrógeno líquido, hasta la cuantificación de las citocinas. Medición de citocinas La medición de las citocinas IL-1β, IL-6, IL-8, IL-10, IL-12p70 y TNFα, en los sobrenadantes de CMSP, se hizo mediante la técnica de citometría de flujo, estuche comercial Human Inflammation Kit (BD™ Biosciences Cytometric Bead Array System CBA. Cat. No. 551811). Consideraciones éticas: aprobación por el Comité de Bioética de la Sede de Investigación Universitaria de la Universidad de Antioquia. La persona responsable del menor firmó el consentimiento informado, el cual incluyó los principios éticos para las investigaciones médicas en seres humanos de la Declaración de Helsinki. Los investigadores cumplieron en todos los casos con la Resolución 8430 de 1993 del Ministerio de la Protección Social de Colombia. Análisis estadístico: para el análisis exploratorio se empleó la prueba de Shapiro Wilks, se comprobó homocedasticidad mediante prueba de Levene. Se realizó estadística descriptiva a las variables cuantitativas y a las cualitativas se les realizó tablas de frecuencia y análisis comparativo mediante Chi cuadrado. Para las comparaciones entre los tres grupos se utilizaron ANOVA con pos-test de Tukey o Kruskal Wallis con comparaciones múltiples por U de Mann Whitney. Para las comparaciones según dosis de atRA al interior de cada grupo se emplearon Friedman y Wilcoxon. Las correlaciones se evaluaron con Pearson o Spearman. Con MANOVA con contraste canónico ortogonal, se evaluó la producción de citocinas según las diferentes dosis de atRA, con el fin de contrastar si existía divergencia estadística por la dosis o por el grupo. Se consideró significativa p<0,05. El análisis se realizó con el programa Statistical Package for the Social Sciences, SPSS® V 17.0. RESULTADOS Características clínicas y estado nutricional de los niños del estudio: 57% de los niños pertenecía al género masculino, sin diferencias significativas entre los tres grupos (p=0,280). Los Dn-G presentaron la menor edad (p=0,039), desnutrición crónica grave con un puntaje Z de T/E significativamente menor (-3,02±0,55 SEM) que en los Dn-M (IC 95%: 1,81; 0,63) y que en los Eu (IC 95%: 2,60; 0,63). Los niños con Dn-G presentaron la mayor prevalencia de enfermedad diarreica (4 de 7 niños con Dn-G vs. 2 de 7 con Dn-M), la mayoría de ellas agudas y sin disentería, la anemia se presentó en los dos grupos de niños con desnutrición, pero la concentración de hemoglobina fue significativamente menor en Dn-G que en Dn-M (p=0,030) y Eu (p=0,002). De los 14 niños con desnutrición, 10 (71%) presentaron signos de infección al ingreso, sin diferencia estadísticamente significativa entre ellos (p=0,559) (Tabla 1), los Dn-G presentaron los valores más bajos de linfocitos y cifras de CRP significativamente mayores (p=0,030).
Cultivos de CMSP obtenidas de los niños del estudio
Mediante la técnica de Ficoll se reportan porcentajes de recuperación de CMSP entre 60 y 95% (36-37), en nuestro estudio luego de la incubación de las CMSP durante 48 horas con diferentes dosis de atRA, todos los grupos mostraron una disminución similar en el número de células recuperadas, obteniendo un porcentaje promedio de recuperación cercano al 64%, sin diferencias significativas en la disminución (p=0,393), concluyendo que los cultivos son comparables desde el punto de vista de las CMSP recuperadas.
Comparación en la concentración de citocinas entre los grupos estudiados
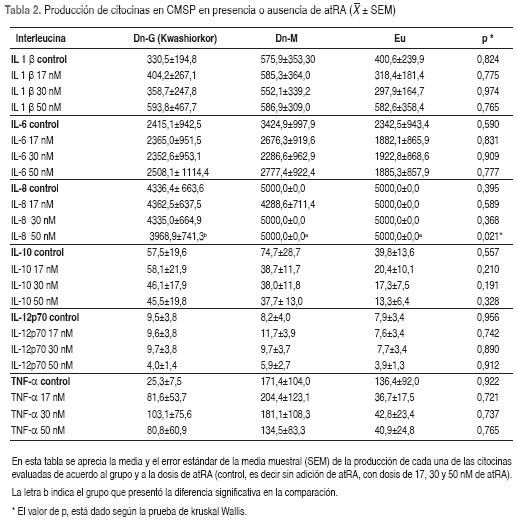
Sin estímulo de atRA (cultivos control) no se encontraron diferencias estadísticamente significativas en los valores promedio de ninguna de las citocinas entre los tres grupos, aunque la concentración de la IL-6, IL-10 e IL-12p70 fue mayor en los niños con desnutrición que en Eu. Entre los dos grupos con desnutrición, los Dn-M presentaron mayores concentraciones de IL-1β, IL-6, IL-8, IL-10 y TNFα que los Dn-G. Cuando se compararon los valores promedio de citocinas con los diferentes estímulos de atRA entre los 3 grupos, se observaron mayores efectos con la dosis de 50 nM, con esta dosis el valor medio de IL-8 en niños con Dn-G fue significativamente menor (p=0,021) en comparación con la de los otros dos grupos (Tabla 2, figura 1A); con 50 nM de atRA, los Dn-G también presentaron valores mayores pero no significativos, de IL-1β e IL-10 que los otros dos grupos. Al estimular las CMSP con las diferentes dosis de atRA el promedio del TNFα mostró una concentración menor en los Eu que en los otros dos grupos pero la diferencia no fue significativa (Tabla 2, figura 1B ).
Al interior de cada grupo se observó que la dosis de 50 nM de atRA produjo el mayor valor promedio de IL-1β (p=0,765) y el menor valor promedio tanto en la IL-10 como en la IL-12p70, sin diferencias significativas entre ellos (p=0,328 y p=0,912 respectivamente), (Tabla 2, figura 1C, D y E).
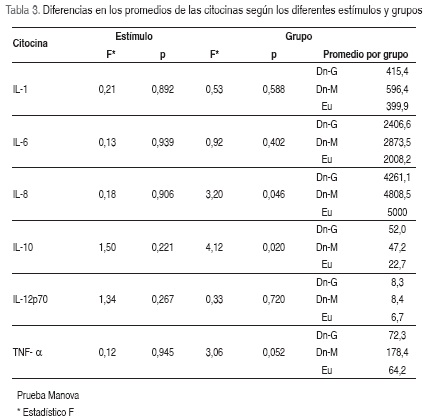
Para comprobar si las diferencias de los promedios de cada una de las citocinas entre los grupos se debían al grado de desnutrición (consecuencia de pertenecer al grupo) o eran efecto del estímulo con atRA independiente del grupo, se utilizó la prueba estadística MANOVA (la cual hace una comparación múltiple de todos los estímulos y de todos los grupos al mismo tiempo), teniendo en cuenta el criterio de Wilk's, encontrando que las diferencias significativas estaban determinadas por el grupo (p=0,000), más no por los estímulos (p=0,436). Mediante el pos hoc de Tukey, se determinó que las diferencias significativas se presentaban entre los Dn-G con el promedio más bajo de IL-8 y más alto de IL-10 comparado con los Eu (Tabla 3).
En los sobrenadantes de las células control (sin estímulo) se halló una correlación positiva y significativa entre las citocinas IL-1β con la IL-6 (r=0,884, p=0,00), con la IL-10 (r=0,927, p=0,00) y con el TNFα (r=0,874, p=0,00). La IL-1β del sobrenadante control también correlacionó positivamente con la IL-6 producida con dosis de atRA de 17, 30 y 50 nM (r=0,839, p=0,00; r=0,897, p= 0,00; r=0,792, p= 0,00 respectivamente), con el TNFα en células estimuladas con dosis de atRA de 17, 30 y 50 nM (r=0,831, p=0,00; r=0,834, p=0,00; r=0,894, p=0,00 respectivamente) y con la IL-10 en sobrenadante estimulado con dosis de atRA de 17, 30 y 50 nM (r=0,642, p=0,00; r=0,638, p=0,00; r=0,741, p=0,00 respectivamente). Con dosis de 50 nM de atRA se encontró una correlación positiva entre la IL-8 y la IL-1β (r=0,595, p=0,00) y entre la IL-8 con la IL-6 (r=0,605, p=0,00).
Cambio al interior de cada grupo en la producción de citocinas según las diferentes dosis de atRA
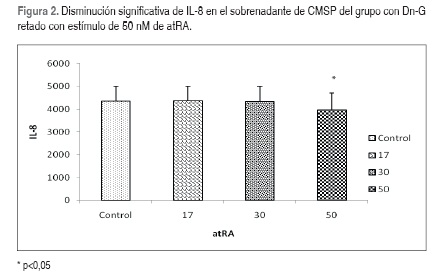
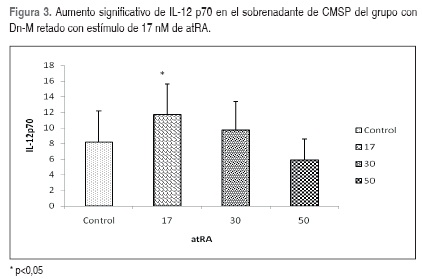
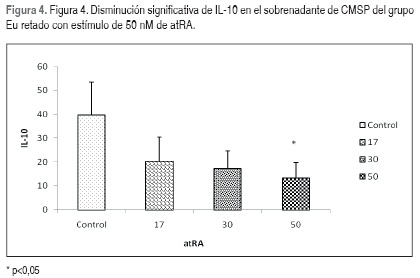
Se midieron en un mismo momento los valores promedios de las citocinas en los sobrenadantes de CMSP al interior de cada grupo de niños y se encontró una disminución significativa en la producción de IL-8 con el estímulo de 50 nM de atRA (Figura 2, Tabla 2). En los sobrenadantes de CMSP de niños con Dn-M se observó un aumento significativo en los promedios de IL-12p70(Figura 3, Tabla 2). En el grupo de niños Eu se observó una disminución significativa de la IL-10 (Figura 4, Tabla 2).
El mayor cambio en la concentración de IL-1β, aunque sin significancia estadística, se observó con dosis de 50 nM, con la cual aumentaron las concentraciones de esta citocina en los sobrenadantes de CMSP en los tres grupos de niños estudiados: Dn-G, Dn-M y Eu (tabla 2). La dosis de 50 nM de atRA en comparación con el control (sin atRA) indujo un aumento en los valores de IL-6 en sobrenadantes de CMSP de niños con Dn G y contrariamente, una disminución de dicha citocina en los sobrenadantes de CMSP de niños con Dn-M y Eu, sin diferencias significativas (Tabla 2, figura 1F). Las diferentes dosis de atRA incrementaron la producción de TNFα en niños con Dn-G y la disminuyeron en niños Eu, aunque tampoco se presentó significancia estadística.
DISCUSIÓN
La desnutrición y la deficiencia de micronutrientes impiden una adecuada respuesta inflamatoria al disminuir la producción de reactantes de fase aguda como la CRP y alterar la respuesta inmune mediada por células Th1 y Th2, en la cual intervienen las citocinas, siendo la respuesta Th2 la que más se afecta (37).
En la primera fase del estudio se analizaron las características clínicas y el estado nutricional de los niños con el fin de tener mayores elementos de análisis al estimular sus CMSP con atRA, encontrando que el 71% de los Dn-G presentaron procesos infecciosos, lo cual se correlacionó con un valor significativamente mayor de CRP. En concordancia la mayoría de investigaciones han demostrado que en malnutrición hay aumento de proteínas de fase aguda, pese al desgaste proteico (28,30,38-39) . Amesty-Valbuena y colaboradores (17) demostraron que había una concentración de CRP significativamente mayor en niños infectados que en sanos, pero una magnitud de respuesta superior en niños con estado nutricional adecuado que en los desnutridos graves; en la MPE aunque se carece de suficientes sustratos para la síntesis de nuevas proteínas, se incrementa el recambio proteico para producir las de fase aguda, pero en menor magnitud, por lo que hay mayor ocurrencia de sepsis.
La atrofia generalizada de tejidos linfoides y escasez de nutrientes como la vitamina A alteran la proliferación de linfocitos T; en nuestro estudio los niños con desnutrición e infección presentaron valores bajos de linfocitos. La célula dendrítica presentadora de antígenos (CPA) aporta atRA e IL-2 a la célula T, durante la sinapsis inmunológica y estimula la expresión de ciclina D3, por medio de receptores nucleares RAR, para activar la maquinaria celular, promoviendo el paso de los linfocitos T (LT) de la fase G1 a la fase S y estimulando su proliferación; la IL-2 disminuye la apoptosis y aumenta la vida media del LT humano activado; ante una deficiencia de vitamina A la población celular disminuye (4-7). Las citocinas IL-1, IL-6 y el TNFα también promueven la proliferación de LT, los valores de estas tres citocinas fueron mayores en los Dn-M, quienes presentaron además una mayor cantidad de linfocitos, en comparación con los Dn-G.
La anemia afecta el sistema inmunológico, por alterar la función de los LT, la producción de citocinas y la actividad de los neutrófilos, generando mayor dificultad para combatir las infecciones (40-43). Entre el hierro y las citocinas pro-inflamatorias existe una relación recíproca, dicho mineral regula su producción, en particular la IL-1β, al tiempo que las citocinas permiten el mantenimiento del balance de hierro intracelular (40); en el presente estudio los Dn-G mostraron valores significativamente más bajos de hemoglobina y concentraciones más bajas de citocinas pro-inflamatorias; un estudio previo reportó concentraciones bajas de hemoglobina en niños con kwashiorkor (8.9±1.24 g/L) y en niños con marasmo (9.8±1.41 g/L)(30). La concentración baja de IL-1β e IL-8 en niños con Dn-G, se relacionan con bajas concentraciones de hemoglobina en este grupo; Bergman y colaboradores (41) demostraron que las CMSP de pacientes con anemia por deficiencia de hierro secretaban menos IL-2 que las células de sujetos sanos, citocina esencial para la proliferación y diferenciación de LT; Jason y colaboradores (42) también reportaron disminución de IL-8 como en el presente estudio, además de incremento de la IL-6 en niños con deficiencia crónica de hierro.
Los promedios de las citocinas se midieron antes de estimular las CMSP con atRA (control), encontrando concentraciones mayores en niños desnutridos que en los Eu, y entre los desnutridos eran mayores en Dn-M que en Dn-G. Diversas investigaciones reportan concentraciones mayores de citocinas proinflamatorias en CMSP en niños desnutridos que en eutróficos (28-29,44-45). Otros autores han reportado menor producción de IL-1β en CMSP de niños con desnutrición grave (kwashiorkor), lo que se relaciona con la incapacidad de manifestar fiebre y la dificultad para el diagnóstico de sepsis (46-47). En el presente estudio el grupo de niños con Dn-G fue el más afectado en peso y talla, el más anémico, con los valores de CRP más elevados, más bajos de linfocitos y con menor capacidad para producir citocinas, evidenciando así que entre mayor es el grado de desnutrición, mayor es el compromiso en la respuesta inmune.
Los niños con Dn-G tipo kwashiorkor presentan comprometida la reserva y disponibilidad de micronutrientes y aminoácidos, lo que les impide realizar un adecuado recambio proteico y responder a las demandas de la infección (39). En el presente estudio se observaron diferencias en la producción de citocinas según el grado de desnutrición, lo que podría explicarse por las carencias múltiples de sustratos para aumentar sus concentraciones (14). Azevedo y colaboradores (29) demostraron que las células sanguíneas de los niños con desnutrición no eran deficientes en la producción de TNFα, y sugirieron que sus células aumentaban de manera primordial la cantidad de esta citocina; Muñoz y colaboradores (48) reportaron disminución del TNFα en niños con marasmo; Velásquez y colaboradores (30) encontraron valores significativamente mayores de IL-8, IL-1β, IL-6, TNFα e IL-10 en el suero de niños con kwashiorkor comparados con los de niños con marasmo; aunque se conoce que las concentraciones de citocinas pro-inflamatorias, son más bajas en las células que en el plasma de los niños desnutridos.
La disminución del TNFα puede provocar diseminación de la infección y sepsis (49), principal causa de muerte en los niños con Dn-G(19). En este estudio se encontró una fuerte correlación entre la IL-1, IL-6 y el TNFα, las dos primeras contribuyen a la síntesis de proteínas de fase aguda (50-51). Adicionalmente estas tres citocinas correlacionaron con el valor medio de IL-10, lo que podría sugerir que la IL-10 (reguladora) aumenta para atenuar la respuesta pro-inflamatoria.
Al adicionar atRA a los cultivos de CMSP de niños con Dn-G se evidenció una tendencia no significativa al aumento de IL-1β y TNFα y a la disminución de IL-12p70 e IL-10, lo que podría sugerir que se favorece la focalización de la inflamación y se evita la sepsis; sin embargo este efecto se contradice con el hallazgo más relevante en este grupo que fue la disminución significativa en la IL-8 con dosis de atRA de 50 nM, potente factor quimiotáctico de neutrófilos, que amplifica la respuesta inflamatoria local; los neutrófilos expuestos a IL-8 junto con el TNFα se activan para producir explosión respiratoria y contribuir a la defensa del hospedero(48), por tal motivo la disminución de la IL-8 en los niños con Dn-G, quienes presentan procesos infecciosos y requieren localizar la respuesta inflamatoria, podría considerarse como un efecto poco benéfico del atRA a dosis altas (50 nM), debido a que al no localizar la inflamación, el proceso infeccioso se podría diseminar aumentando la producción de TNFα por otros tejidos, con efectos deletéreos para la salud y podría generar un alto grado de mortalidad por sepsis (51).
La adición de atRA a cultivos en Dn-M evidenció un aumento significativo de la IL-12p70 (pro-inflamatoria) con dosis de 17 nM; ésta se produce rápidamente cuando hay una infección y aumenta la producción de INF? para activar las células fagocíticas, favoreciendo la respuesta de linfocitos Th1 e inhibiendo Th2; sin embargo con la dosis de 50 nM la IL-12p70 presentó una tendencia a disminuir en los tres grupos estudiados, lo que podría corroborar el efecto del atRA en favor de la respuesta Th2, como lo demuestran investigaciones previas que reportan que el atRA a través del ligando RAR/RXR inhibe la trascripción de genes de respuesta (22, 52-54).
Varios estudios reportan aumento de la IL-10 como un mecanismo de autorregulación (la IL-12p70 induce la producción de IL-10, para bloquear la acción de la IL-12p70 (22,55-56). Los resultados indicaron que la IL-10 presentó una tendencia a la disminución en los tres grupos de niños, pero permaneció más elevada en niños con Dn-G en comparación a los niños con Dn-M, similar a lo reportado en otros estudios, que evidencian efecto estimulador o ningún efecto de los retinoides en la síntesis de IL-10 (20), por lo que el retardo leve en la expresión de la IL-10, comparada con la IL-12p70 y con otras citocinas pro-inflamatorias tanto in vivo como in vitro, evidencia una respuesta particularmente efectiva de regulación (56) y posiblemente para poder evidenciar el efecto en la disminución de IL-12p70 y el aumento en la IL-10, se requieran dosis más altas de atRA o un mayor lapso de tiempo; no obstante Dawson y colaboradores (20) reportaron en un estudio la disminución en IFN?, IL-2, IL-12p70 y TNFα en CMSP de individuos sanos, dependiente de la dosis de atRA y evidente a las 12 horas post estímulo.
En los niños Eu se encontró una disminución significativa en la concentración de IL-10 con dosis de 50 nM de atRA, su disminución con dosis altas de atRA podría comprometer la capacidad de regulación de la respuesta inflamatoria en niños con adecuado estado nutricional (49).
Una limitante de esta investigación es que no permite sacar una conclusión en cuanto a la inducción de los linfocitos T hacia un perfil Th1 o Th2; tampoco se pudieron homogenizar el tipo de infección (que determina repuesta Th1 o Th2), el tiempo de evolución del proceso infeccioso, la depleción de nutrientes requeridos para el funcionamiento del sistema inmunológico, entre otros (43,57-58).
Prospectiva: continuar investigando las repercusiones de la suplementación con vitamina A en la disminución de la IL-8 en los niños con Dn-G, la cual es clave para la quimioatracción, localización de la infección y evitar la sepsis, debido a que pudiera ser más un riesgo que un beneficio su disminución en una fase inicial de la infección.
Quedan interrogantes: ¿la inducción que hace el atRA en la producción de citocinas requiere del apoyo de otros nutrientes o de un tiempo de estímulo mayor?, ¿la respuesta inmunológica de un niño con desnutrición depende del tipo de desnutrición que presente?, ¿el tratamiento de recuperación nutricional y en especial la suplementación con micronutrientes, debería ser diferente según la modulación que se quiera lograr en el sistema inmunitario o dependerá además del tipo de infección y del estado nutricional?
AGRADECIMIENTOS
A la bióloga Ruth Beatriz Peña por el acompañamiento en las técnicas de laboratorio. A la Vicerrectoría de Investigación, a la Escuela de Nutrición y Dietética y al Grupo de Investigación en Alimentación y Nutrición Humana de la Universidad de Antioquia por el apoyo económico.
Conflicto de Intereses: no existen.
Origen del apoyo económico. Los recursos para realizar la investigación se obtuvieron de la Universidad de Antioquia por Vicerrectoría de Investigación mediante la estrategia de sostenibilidad a grupos 2009-2010 y de la Escuela de Nutrición y Dietética.
REFERENCIAS
1. Quintero M. En los últimos 5 años el país ha mejorado sus indicadores en mortalidad infantil. Bogotá: UNICEF; 2007 [citado julio de 2009]. Disponible en: http://www.unicef.org/colombia/newsletter/septiembre-07/pop-news-septiembre-07-04.htm. [ Links ]
2. Programa de las Naciones Unidas para el Desarrollo. Objetivos de desarrollo del Milenio (ODM). Nueva York; 2009. [citado julio de 2009]. Disponible en: http://www.undp.org/spanish/mdg/basics.shtml. [ Links ]
3. Cunningham-Rundles S, McNeeley D, Moon A. Mechanism of nutrient modulation of the immune response. J Allergy Clin Immunol. 2005;115:1119-28. [ Links ]
4. Iwata M. Retinoic acid production by intestinal dendritic cells and its role in T-cell trafficking. Seminars Immunol. 2009;21:8-13. [ Links ]
5. Chen Q, Ross AC. Retinoic acid regulates cell cycle progression and cell differentiation in human monocytic THP-1 cells. Exp Cell Res. 2004;297:68-81. [ Links ]
6. Engedal N, Ertesvag A, Blomhoff HK. Survival of activated human T lymphocytes is promoted by retinoic acid via induction of IL-2. Int Immunol. 2004;16:443-53. [ Links ]
7. Balmer JE, Blomhoff R. Gene expression regulation by retinoic acid. J Lipid Res. 2002;43:1773-808. [ Links ]
8. Wang X, Allen Ch, Ballow M. Retinoic acid enhances the production of IL-10 while reducing the synthesis of IL-12 and TNF-a from LPS-Stimulated Monocytes/Macrophages. J Clin Immunol. 2007;27:193-200. [ Links ]
9. Grimble R. Basics in clinical nutrition: main cytokines and their effect during injury and sepsis. e-SPEN: Eur J Clin Nutr Metabol. 2008;3:289-92. [ Links ]
10. Lin E, Kotani J, Lowry S. Nutritional modulation of immunity and the inflammatory response. Nutrition. 1998;14:545-50. [ Links ]
11. Ross AC, Chen Q, Mab Y. Augmentation of antibody responses by retinoic acid and costimulatory molecules. Seminars Immunol. 2009;21:42-50. [ Links ]
12. Mataix VJ, Ochoa HJ. Vitaminas. En: nutrición y alimentación humana. Barcelona: Océano Ergon; 2005. vol. 1, p. 175-84. [ Links ]
13. Ross AC. Vitamin A and carotenoids. En: Modern nutrition in health and disease. 10 ed. Philadelphia: Lippincott Williams & Wilkins; 2006. p. 351-75. [ Links ]
14. Sánchez-Álvarez V. Inmunocompetencia en la malnutrición proteico energética. Rev Cubana Aliment Nutr. 1999;13:129-36. [ Links ]
15. Beisel W. Nutrition and immune function: overview. J Nutr. 1996;126:2611-5. [ Links ]
16. WHO. Global prevalence of vitamin A deficiency in populations at risk: 1995-2005. Geneva; 2009 [citado julio de 2009]. Disponible en: http://www.who.int/vmnis/vitamina/en/. [ Links ]
17. Amesty-Valbuena A, Pereira N, Castillo J, Garcia D, Nuñez J, Cayama N, et al. Mediadores de inflamación (Proteina C Reactiva) en el niño con desnutrición proteica energética y en el niño eutrófico. Invest Clin. 2004;45:53-62. [ Links ]
18. Ashworth A, Khanum S, Jackson A, Hfield C. Directrices para el tratamiento hospitalario de los niños con malnutrición grave. Ginebra: OMS; 2005. [citado junio de 2009]. Disponible en: http://publications.paho.org/product.php?productid=826cat=0page=1. [ Links ]
19. Bernal C, Velásquez C, Alcaraz G, Botero J. Treatment of severe malnutrition in children: experience in implementing the World Health Organization Guidelines in Turbo, Colombia. J Pediatr Gastroenterol Nutr. 2008;46:322-8. [ Links ]
20. Dawson HD, Collins G, Pyle R, Key M, Weeraratna A, Deep-Dixit V, et al. Direct and indirect effects of retinoic acid on human Th2 cytokine and chemokine expression by human T lymphocytes. BMC Immunol. 2006;7:27. [ Links ]
21. Stephensen CB, Jiang X, Freytag T. Vitamin A deficiency increases the in vivo development of IL-10-positive Th2 cells and decreases development of Th1 cells in mice. J Nutr. 2004;134:2660-6. [ Links ]
22. Iwata M, Eshima Y, Kagechika H. Retinoic acids exert direct effects on T cells to suppress Th1 development and enhance Th2 development via retinoic acid receptors. Int Immunol. 2003;15:1017-25. [ Links ]
23. Hoag KA, Nashold FE, Goverman J, Hayes CE. Retinoic acid enhances the T helper 2 cell development that is essential for robust antibody responses through its action on antigen-presenting cells. J Nutr. 2002;132:3736-9. [ Links ]
24. Sauerwein R, Mulder J, Mulder L, Lowe B, Peshu N, Demacker P, et al. Inflammatory mediators in children with protein-energy malnutrition. Am J Clin Nutr. 1997;65:1534-9. [ Links ]
25. Abo-Shousha S, Hussein M, Rashwan I, Salama M. Production of proinflammatory cytokines: granulocyte-macrophage colony stimulating factor, interleukin-8 and interleukin-6 by peripheral blood mononuclear cells of protein energy malnourished children. Egypt J Immunol. 2005;12:125-31. [ Links ]
26. Giovvambattista A, Spinedi E, Sanjurio A, Chisari A, Rodrigo M, Perez N. Circulating and mitogeninduced en tumor necrosis factor (TNF) in malnourished children. Medicina (B Aires). 2000;60:339-42. [ Links ]
27. Rodríguez L, González C, Flórez L, Jiménez-Zamudio L, Graniel J, Ortiz R. Assessment by flow cytometry of cytokine production in malnourished children. Clin Diagn Lab Immunol. 2005;12:502-7. [ Links ]
28. Dulger H, Arik M, Sekeroglu M, Tarakcioglu M, Novan T, Cesur Y, et al. Pro-inflammatory cytokines in Turkish children with protein-energy malnutrition. Mediators Inflamm. 2002;11:363-5. [ Links ]
29. Azevedo Z, Victal L, Fonseca K, Camara F, Haeffner-Cavaillon N, et al. Increased production of tumor necrosis factor-a in whole blood cultures from children whit primary malnutrition. Braz J Med Biol Res. 2005;38:171-83. [ Links ]
30. Velásquez C, Navarro C, González A. Respuesta inflamatoria en niños con desnutrición aguda grave y anemia. Perspect Nutr Humana. 2008;10:131-41. [ Links ]
31. Thompson C, Powrie F. Regulatory T cells. Curr Opinion Pharmacol. 2004;4:408-14. [ Links ]
32. Hamil PVV, Drizid TA, Johnson CL, Reed RB, Roche AF, Moore WM. Physical growth: National Center for Health Statistics percentiles. Am J Clin Nutr. 1979;32:607-29. [ Links ]
33. Gordo CC, Cameron W, Roche A. Stature, recumbent length, and weight. In: Lohman T, Roche A, Martorell R. Anthropometric standarization reference manual. Champaign: Human Kinetics Book; 1988. p. 3-8. [ Links ]
34. UNICEF, UNU, WHO. Methods of assessing iron status. In: Iron deficiency anaemia. Assessment, prevention, and control. A guide for programme managers. Washington: WHO; 2001. p. 33-45. [ Links ]
35. Ángel Mejía, G. Diccionario de laboratorio aplicado a la clínica. 2 ed. Bogotá: Editorial Médica Panamericana; 2000. [ Links ]
36. Strober W. Immunologic studies in humans. Isolation of whole mononuclear cells from peripheral blood and cord blood. In: Current protocols. New York: Wiley and Sons; 2006. [ Links ]
37. Lofty OA, Saleh WA, el-Barbari M. A study of some changes of cell-mediated immunity in protein energy malnutrition. J Egypt Soc Parasitol. 1998;28:413-28 [ Links ]
38. Reid M, Badaloo A, Forrester T, Morlese JF, Heird WC, Jahoor F. The acute-phase protein response to infection in edematous and nonedematous protein-energy malnutrition. Am J Clin Nutr. 2002;76:1409-15. [ Links ]
39. Manary MJ, Broadhead, RL, Yarasheski KE. Whole-body protein kinetics in marasmus and kwashiorkor during acute infection. Am J Clin Nutr. 1998;67:1205-9. [ Links ]
40. O'Brien-Ladner AR, Nelson SR, Murphy WJ, Blumer BM, Wesselius LJ. Iron is a regulatory component of human IL-1β production. Support for regional variability in the lung. Am J Respir Cell Mol Biol. 2000;23:112-9. [ Links ]
41. Bergman M, Bessler H, Salmana H, Siomin D, Straussberg R, Djaldetti M. In vitro cytokine production in patients with iron deficiency anemia. Clin Immunol. 2004;113:340-4. [ Links ]
42. Jason J, Archibald LK, Nwanyahwu OC, Jensen RJ, Gunter E, Buchanan I, et al. The effect of iron deficiency on lymphocyte cytokine production and activation: preservation of hepatic iron but not at all cost. Clin Exp Immunol. 2001;126:466-73. [ Links ]
43. Walter T, Olivares M, Pizarro F, Muñoz C. Iron, anemia, and infection. Nutr Rev. 1997;55:111-24. [ Links ]
44. Chandra R. Protein energy malnutrition and immunological responses. J Nutr. 1992;122:597-600. [ Links ]
45. Woodward B. The effect of protein-energy malnutrition on immune competente. In: Nutrition, immunity, and infection in infants and children. Nestle Nutr Workshop Ser Pediatr Program. 2001;45:89-120. [ Links ]
46. Bhaskaram P, Swakumar B. Interleukin 1 in malnutrition. Arch Dis Child. 1986;61:182-5. [ Links ]
47. Aslan Y, Erduran E, Gedik Y, Mocan H, Okten A, Orem A, et al. FERUM: interleukin-1 and granulocyte-macrophage colony-stimulating factor levels in protein malnourished patients during acute infection. Cent Afr J Med. 1996;42:179-84. [ Links ]
48. Muñoz C, Arévalo, M, López M, Schlesinger L. Impaired interleukin 1 and tumor necrosis factor production in protein caloric malnutrition?. Nutr Res. 1994;14:347-52. [ Links ]
49. Murphy K, Travers P, Walport Mark. Inmunobiología de Janeway. 7 ed. México: Mc Graw Hill; 2009. [ Links ]
50. Marik P, Varon J. Sepsis: state of the art. Dis Month. 2001;47:463-532. [ Links ]
51. Rodríguez JM, Sanguineti AC y Vergara G, Citoquinas y piel (Parte I): inmunodermatología. Folia Dermatol Peruana. 1995 [citado marzo de 2010];6:3. Disponible en: http://sisbib.unmsm.edu.pe/BVrevistas/folia/Vol6_N3/citoquinas.htm . [ Links ]
52. Shimizu T, Esaki L, Mizuno H, Takeda K. Granulocyte macrophage colony stimulating factor enhances retinoic acid-induced gene expression. J Leukoc Biol. 2006;80:889-96. [ Links ]
53. McGrane M. Vitamin A regulation of gene expression: molecular mechanism of a prototype gene. J Nutr Biochem. 2007;18:497-508. [ Links ]
54. Velásquez C. Modulación de la expresión génica por vitaminas liposolubles. Perspect Nutr Humana. 2006;16:44-52. [ Links ]
55. Dawson HD, Collins G, Pyle R, Key M, Taub D. The retinoic acid receptor-a mediates human T-cell activation and Th2 cytokine and chemokine production. BMC Immunol. 2008;9:16. [ Links ]
56. Trinchieri G. Cytokines acting on or secreted by macrophages during intracellular infection (IL-10, IL-12, IFN-?). Curr Opinion Immunol. 1997;9:17-93. [ Links ]
57. Chandra RK, Nutrition and the immune system: an introduction. Am J Clin Nutr. 1997;66:460S-3S. [ Links ]
58. Scrimshaw NS, SanGiovanni JP. Synergism of nutrition, infection, and immunity: an overview. Am J Clin Nutr. 1997;66:464-77S. [ Links ]